Farmakologická skupina
Teriparatid (ATC kód H05AA02) je v současné době jediným dostupným představitelem skupiny stimulátorů kostní novotvorby [1].
Chemické a fyzikální vlastnosti
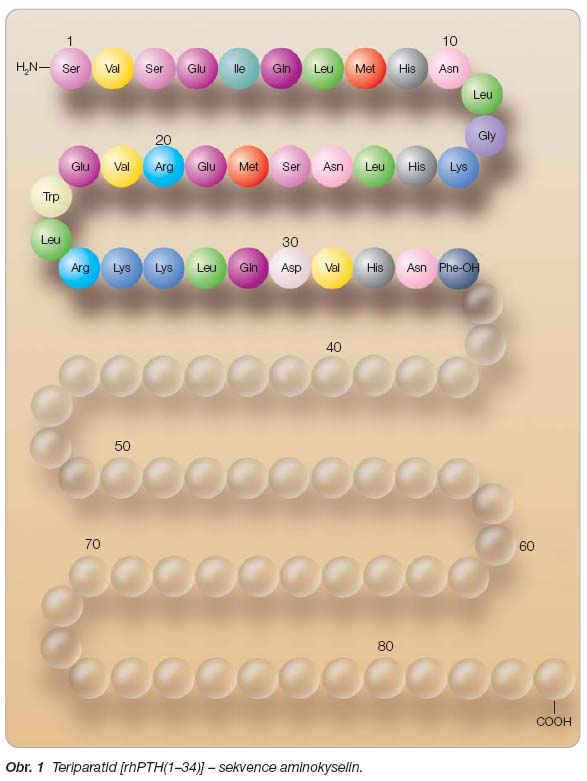
Teriparatid (TPTD) je pojem označující aminoterminální sekvenci 34 aminokyselin lidského parathormonu, která zodpovídá za biologickou účinnost celé molekuly parathormonu čítající 84 aminokyselin [hPTH(1–84)]. TPTD je získáván rekombinantní technologií za použití kmene
Escherichia coli
[rhPTH(1–34)]. Sekvence aminokyselin TPTD je zobrazena na
obr. 1
.
Sumární vzorec: C
181
H
291
N
55
O
51
S
2
Molekulová hmotnost: 4117,8
Mechanismus účinku
Endogenní parathormon [hPTH(1–84), PTH] je primárním regulátorem metabolismu vápníku a fosforu v kosti a ledvinách. PTH reguluje metabolismus kosti a stimuluje renální tubulární reabsorpci vápníku a fosfátů i absorpci vápníku ve střevě. Biologické účinky PTH i TPTD jsou zprostředkovány specifickými receptory na povrchu buněk. Celá molekula TPTD vykazuje po vazbě na specifický receptor na buňkách linie osteoblastů a v ledvinách obdobné biologické účinky jako 34 N-terminálních aminokyselin PTH. Skeletální účinky TPTD však závisí na charakteru systémové expozice. Základ diametrálně odlišného vlivu kontinuální hypersekrece PTH a intermitentní denní aplikace TPTD na kost spočívá v odlišné regulaci genové exprese. Genetické subsety regulované intermitentní a kontinuální aplikací PTH se podstatně liší; z celkového počtu 1075 genů regulovaných jednou nebo druhou aplikační formou je jich při obou typech aplikace regulováno pouze 158 [2].
Efekt PTH na skelet je zprostředkován
lokální produkcí růstových faktorů. Inter
mitentní aplikace PTH stimuluje lokální uvol
ňování IGF-I, proteinu stimulujícího syntézu
kolagenu. Ta je naopak kontinuální hypersekrecí PTH utlumena. PTH ovlivňuje i systém OPG-RANKL-RANK. Kontinuální infuze lidského PTH(1–38) u potkanů zvyšuje expresi RANKL a snižuje expresi OPG a genů spojených s kostní novotvorbou (např. osteoblastický specifický transkričpní faktor, osteokalcin, kostní sialoprotein, kolagen typu I). Naproti tomu jednorázová aplikace PTH(1–38) vede k rychlému, ale přechodnému vzestupu exprese RANKL a k poklesu exprese OPG. Tento efekt je však omezen pouze na první hodinu, od druhé hodiny po aplikaci dochází k soustavnému vzestupu koncentrace OPG a k poklesu RANKL; tento stav pak přetrvává po dobu 24 hodin – v klinické praxi tedy do aplikace další dávky TPTD [3].
Ultrakrátká expozice TPTD po intermitentní aplikaci vede k nárůstu kostní hmoty prostřednictvím stimulace diferen
ciace osteoblastů [4], zatímco kontinuál
ní aplikace PTH (jako model hyperpara
tyreózy) vede k úbytku kostní hmoty sti
mulací kostní remodelace s převahou kostní resorpce.
Už v roce 1929 dosáhl Bauer intermitentní aplikací extraktu z příštítných tělísek u experimentálních potkanů a psů zvýšení počtu kostních trámců [5].
O tři roky později Selye prokázal, že aplikace velmi malých dávek extraktu z příštítných tělísek stimuluje u potkanů formaci osteoblastů a zvyšuje apozici kosti [6].
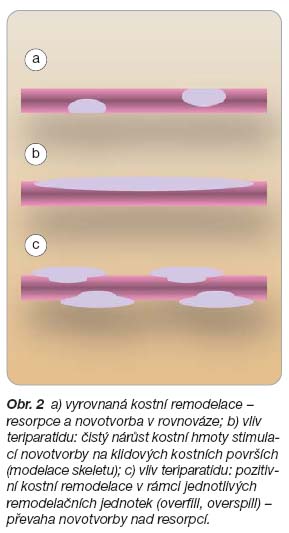
Anabolického efektu, tedy čistého přírůstku kostní hmoty, je v trámčité a endokortikální kosti dosaženo zvýšenou stimulací osteoblastů vedoucí k vzestupu novotvorby kosti během klasického cyklu kostní remodelace na úrovni kostní mnohobuněčné (remodelační) jednotky, ale rovněž novotvorby kosti na klidových površích, tedy modelací skeletu (
obr. 2
) [4, 7].
Farmakokinetické vlastnosti
TPTD je po subkutánní injekci výborně absorbován; absolutní biologická dostupnost je vysoká. Vysoká je i rychlost absorpce a eliminace. TPTD dosahuje vrcholu sérové koncentrace po 30 minutách po
podkožní aplikaci 20
m
g dávky. Sérové kon
centrace klesají k neměřitelným hod
notám po 3 hodinách. V klinických studi
ích dochází rychle k překročení horní hranice normálního rozmezí sérových hodnot endogenního PTH dvoj- až čtyřnásobně.
K perifernímu metabolismu TPTD nespe
cifickými enzymatickými mechanismy dochází v játrech a kosti [8], k eliminaci TPTD včetně jeho amino- a karboxyterminálního fragmentu dochází v ledvinách. TPTD se neakumuluje v kostech ani v jiných tkáních.
Interindividuální variabilita systémové clearance a distribučního objemu je 25–50 %. Plazmatický poločas teriparatidu je 5 minut po i.v. aplikaci a cca 1 hodina po podkožní aplikaci. Delší poločas po subkutánní aplikaci odráží dobu nezbytnou k absorpci z místa vpichu. Základní
farmakokinetické parametry TPTD jsou shr
nuty v
tab. 1
.

Farmakodynamika
Přibližně 2 hodiny po aplikaci 20
m
g TPTD s.c. je zaznamenatelný vzestup hladin sérového vápníku, vrcholu je dosaženo mezi 4. a 6. hodinou. K poklesu dochází od šesté hodiny po aplikaci a k vstupním hodnotám se hladina vápníku vrací 16–24 hodin po podání každé dávky.
V klinické studii s postmenopauzálními ženami s osteoporózou činila průměrná hladina sérového vápníku 4–6 hodin po aplikaci 20
m
g TPTD 2,42 mmol/l. Vrcholové sérové koncentrace vápníku nedosáhly hodnoty 2,76 mmol/l (jako hranice hyperkalcémie) u více než 99 % žen. Setrvalá hyperkalcémie nebyla pozorována.
Rozdíly v kalciurii při aplikaci 20
m
g TPTD ve srovnání s placebem byly minimální (+0,76 mmol/d po 6 měsících, resp. +0,30 mmol/d po 12 měsících léčby). Výskyt hyperkalciurie (> 7,5 mmol/d) byl shodný v léčené a placebové skupině.
Hypofosfatémie (< 0,74 mmol/l) nebyla v klinických studiích s TPTD pozorována.
V souladu s účinky endogenního PTH došlo i v klinických studiích s TPTD k vze
stupu koncentrací aktivních metabolitů vita
minu D. Průměrné zvýšení sérových
koncentrací 1,25-dihydroxyvitaminu D po
12měsíční léčbě činilo ve srovnání se vstup
ními hodnotami 19 % u žen a 14 % u mužů (v placebové skupině změny činily -2 % u žen a +5 % u mužů) [9].
Klinické zkušenosti
Postmenopauzální osteoporóza
Po zahájení léčby TPTD dochází
k rychlému a výraznému vzestupu hladiny aminoterminálního propeptidu prokolagenu typu
I (PINP), markeru kostní novotvorby (po 1
měsíci o 113 % nad vstupní úroveň), vrcholu je dosaženo po 6 měsících léčby
(251 % nad úrovní vstupních hodnot). Vze
stup markeru kostní resorpce (NTx) je podstatně menší (o 58 % nad úroveň
vstupních hodnot, významný pouze po 3
měsících léčby) a opožděný za vzestupem markeru kostní novotvorby [10].
Ve srovnání s placebem zvyšuje TPTD v dávce 20
m
g denně denzitu kostního minerálu (BMD) bederní páteře o 9 % a krčku femuru o 3 % po tříleté léčbě, zvýšen je i celotělový obsah kostního minerálu [11]. V přímém srovnání s alendronátem vedlo podávání dávky TPTD 40
m
g denně k významnějšímu vzestupu BMD bederní páteře (12,2 % vs. 5,6 %), obdobný vývoj byl pozorován i na krčku femuru [12].
Vývoj BMD při léčbě TPTD podhodnocuje jeho skutečný anabolický vliv na kostní hmotu, neboť stupeň mineralizace rychle tvořené nové kosti je relativně nižší [13]. Pro posouzení účinnosti TPTD na úrovni kostní tkáně je vhodnější přímá histomorfometrická analýza vzorků kostní hmoty
získaných biopsií (
obr. 3
). V roce 1980
Meunier a Reeve publikovali výsledky prv
ní klinické studie s TPTD. Jedenadvacet pacientů s osteoporózou bylo léčeno 100
m
g TPTD v jedné podkožní injekci denně po dobu 6–24 měsíců. Histomorfometrické vyšetření vzorků získaných biopsií z lopaty kosti kyčelní prokázalo vzestup objemu trámčité kosti o 70 % ve srovnání se vstupními hodnotami. Nově tvořená kost
byla histologicky normální [14]. Osmnác
timěsíční léčba TPTD významně zvyšuje objem trámčité kosti (TPTD +14 %; placebo -24 %; p = 0,001), denzitu konektivity trámců (TPTD +19 %; placebo -14 %; p = 0,034) a tloušťku kortikální kosti (TPTD +22 %; placebo +3 %; p = 0,012). TPTD příznivě ovlivňuje index strukturálního modelu (SMI), popisující biomechanické charakteristiky průřezu kostních trámců (TPTD -12 %; placebo +7 %; p = 0,012) [15].

Teriparatid zvyšuje tloušťku kortikální kosti krčku femuru, zlepšuje geometrické parametry jeho pevnosti a zvyšuje jeho stabilitu [16].
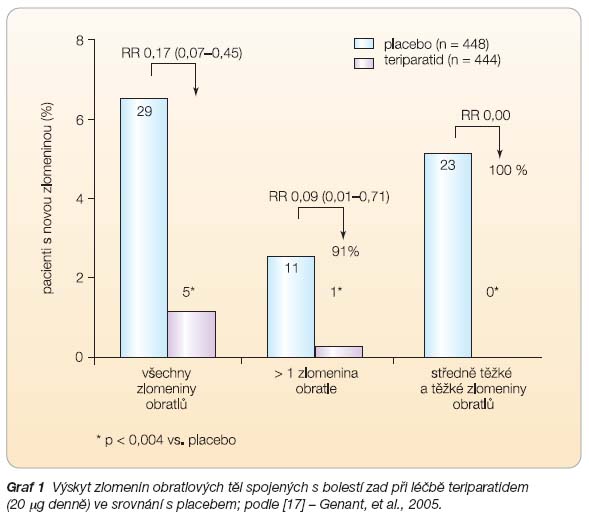
Vliv TPTD na výskyt zlomenin byl zkoumán u 1637 postmenopauzálních žen s prodělanou zlomeninou obratle v rámci studie Fracture Prevention Trial
(FPT). Průměrná doba sledování byla 21
měsíců. Výskyt nových zlomenin obratlů byl 14 % v placebové skupině a 5 % ve skupině užívající 20
m
g TPTD denně; relativní riziko bylo při léčbě sníženo o 65 % (RR 0,35; 95% CI 0,22–0,55). Výskyt mnohočetných
(> 1) zlomenin obratlových těl byl při podá
vání 20
m
g TPTD denně snížen o 77 % (p ≤ 0,001 ve srovnání s placebem) [11]. Výskyt symptomatických zlomenin obratlových těl při léčbě TPTD byl ve srovnání s placebem nižší o 83 % (RR 0,17; 95% CI 0,07–0,45), výskyt vícečetných symptomatických zlomenin obratlových těl byl nižší o 91 % (RR 0,09; 95% CI 0,01–0,71). Symptomatické středně těžké a těžké zlomeniny obratlů byly při léčbě TPTD eliminovány úplně (v placebové skupině výskyt 5,1 %), viz
graf 1
[17].
I přes nízký výskyt osteoporotických nevertebrálních zlomenin (6 % v placebové skupině) bylo při léčbě TPTD 20
m
g denně riziko tohoto typu fraktur sníženo o 53 % (RR 0,47; 95% CI 0,25–0,88). Výskyt zlomenin proximálního femuru byl příliš nízký (4 ve skupině s placebem, 1 ve skupině s TPTD 20
m
g), aby mohlo být dosaženo statistické významnosti [11].
V přímém srovnání byla incidence nevertebrálních zlomenin významně snížena při užívání TPTD (4,1 %) i ve srovnání s alendronátem (13,7 %; p = 0,042) [12].
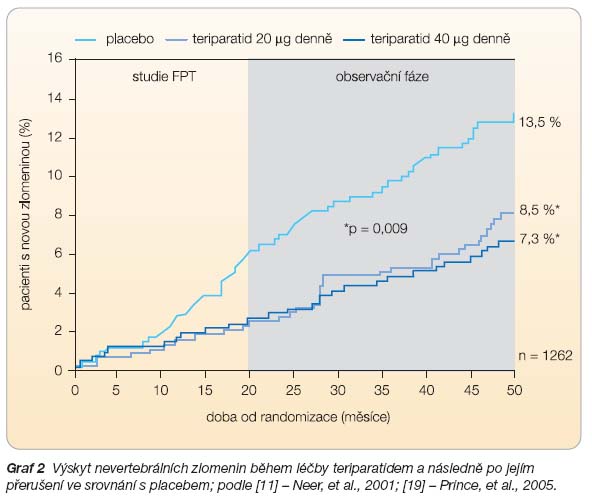
Po ukončení studie FPT byly pacientky dále sledovány v rámci observační studie. Během 18 měsíců tohoto sledování bylo pozorováno významné snížení výskytu zlomenin obratlových těl u pacientek původně léčených TPTD v dávce 20
m
g denně nežli u pacientek z původní placebové skupiny (RR 0,59; 95% CI 0,42–0,85) [18]. Vliv na snížení výskytu nevertebrálních zlomenin přetrvával až 30 měsíců po ukončení léčby. Riziko nevertebrální zlomeniny u pacientek randomizovaných k léčbě 20
m
g TPTD denně bylo po 50 měsících sledování (20 měsíců léčba, 30 měsíců obser
vační fáze) významně sníženo (RR 0,62;
95%
CI 0,41–0,93; p = 0,022) [19], viz
graf 2
.
V průběhu léčby TPTD bylo pozorováno progresivní snižování výskytu nevertebrálních zlomenin, tj. v průběhu léčby dochází k postupnému snižování relativního rizika fraktur [20].
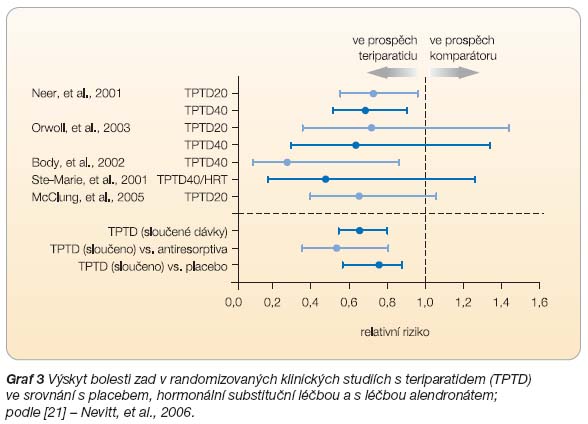
Metaanalýzou bylo prokázáno, že pacientky užívající TPTD mají ve srovnání s placebem, alendronátem či hormonální substituční léčbou nižší výskyt nové nebo zhoršené bolesti zad (RR 0,66; 95% CI 0,55–0,80), včetně středně těžké a těžké bolesti zad (RR 0,60; 95% CI 0,48–0,75), resp. těžké bolesti zad (RR 0,44; 95% CI 0,28–0,68), viz
graf 3
[21].
V klinické praxi je léčba TPTD spojena se vzestupem kvality života a snížením spotřeby analgetik [22].
Účinnost TPTD není ovlivněna hloub
kou poklesu BMD, počtem a tíží prevalentních zlomenin ani věkem [23]. Aplikace TPTD pacientkám ve vysokém riziku zlomenin snižuje riziko na úroveň rizika pacientek s relativně lehčími formami osteoporózy.
Mužská osteoporóza
Studie srovnávající vliv jedenáctiměsíční léčby TPTD (20
m
g a 40
m
g) s placebem randomizovala 437 mužů s BMD (T skóre) bederní páteře nebo proximálního femuru < -2 SD. Při léčbě 20
m
g TPTD denně byly zjištěny významné vzestupy BMD bederní páteře od 3 měsíců po zahájení léčby. Po skončení léčby došlo ve skupině léčené 20
m
g TPTD denně k vzestupu BMD o 5,9 % (p < 0,001 vs. placebo). BMD krčku femuru byla v téže skupině na konci sledování zvýšena o 1,5 % (p = 0,029), celotělový obsah minerálu o 0,6 % (p = 0,021) [24].
Po dobu 30 měsíců navazující observační fáze bez léčby byl u 355 mužů pozorován postupný pokles BMD, ale hodnoty BMD bederní páteře i celkové oblasti proximálního femuru zůstaly na konci sledování významně vyšší než před zahájením léčby (p ≤ 0,001). Případná navazující antiresorpční léčba dokázala zabránit pozorovanému poklesu BMD a vedla k trendu vzestupu BMD. U 279 mužů bylo možno zhodnotit laterální radiogramy páteře pořízené na počátku léčby a 18 měsíců po jejím přerušení. Výskyt zlomenin obratlových těl byl následující: 11,7 % u mužů užívajících placebo, 5,4 % u mužů, kterým byl podáván TPTD v dávce 20
m
g denně,
a 6,0 % u těch, kteří byli léčeni 40
m
g TPTD denně. V kombinovaných teriparatidových skupinách byl zjištěn trend ke snížení výskytu vertebrálních zlomenin o 51 % (p = 0,07). Incidence středně těžkých a těžkých zlomenin obratlů byla při léčbě TPTD snížena významně, o 83 % (p = 0,01) [25].
Glukokortikoidy indukovaná osteoporóza
Hlavní mechanismus účinku glukokortikoidů na kost spočívá v narušení homeo
stázy osteoblastů, v indukci apoptózy
osteoblastů a osteoklastů s následným
potlačením novotvorby kostní hmoty [26]. Kauzálním opatřením prevence a léčby glukokortikoidy indukované osteoporózy jsou opatření spočívající v preferenční stimulaci funkce osteoblastů a ve zvýšení kostní novotvorby. Aplikace TPTD, který tímto mechanismem prokazatelně zvyšuje objem
[14] a zlepšuje kvalitativní parametry kost
ní hmoty, předpoklad kauzální léčby splňuje.
K dispozici jsou výsledky primární
18měsíční fáze klinické studie fáze III, která byla
multicentrickou, randomizovanou, dvojitě
slepou aktivně kontrolovanou klinickou studií u pacientů s glukokortikoidy indukovanou osteoporózou (užívání prednisonu ≥ 5 mg denně) ve zvýšeném riziku zlomenin [27]. Studie srovnávala účinnost TPTD v dávce 20
m
g denně (s.c.) s účinností alendronátu v dávce 10 mg denně (p.o.). Všichni pacienti užívali kalcium (1000 mg/den) a vitamin D (800 IU/den). Primárním cílem této studie bylo stanovení, zda vzestup BMD indukovaný TPTD převýšil statisticky významně vzestup BMD indukovaný alendronátem. TPTD i alendronát významně zvýšily hodnotu BMD v oblasti bederní páteře, krčku femuru a celkové oblasti proximálního femuru (Total Hip), přičemž vzestupy BMD zjištěné u pacientů užívajících TPTD byly významně vyšší než u pacientů užívajících alendronát (bederní páteř, p < 0,001; krček femuru, p < 0,05; Total Hip, p < 0,01). Mezi sekundárními cíli bylo i sta
novení vlivu na výskyt zlomenin. Ve skupi
ně
s alendronátem utrpělo novou morfome
tric
kou zlomeninu obratlového těla 10 paci
entů; ve skupině s TPTD utrpěl zlomeninu obratle pouze 1 pacient, což znamenalo statisticky významný rozdíl (p = 0,004). Aplikace TPTD tedy prokázala superioritu nad alendronátem jak ve smyslu vlivu na BMD, tak v ovlivnění výskytu zlomenin obratlových těl. Tento výsledek je zcela výjimečný, dosud žádná z aktivně kontrolovaných klinických studií non-inferiority designu neprokázala superioritu ve smyslu snížení rizika zlomenin obratlových těl.
Užití teriparatidu v kontextu předchozí, současné a navazující léčby osteoporózy
Předchozí léčba alendronátem oddaluje anabolickou odpověď skeletu na aplikaci TPTD [28]. Pro klinickou praxi je podstatné, že u pacientů předléčených bisfosfonáty, především těmi s dlouhodobou retencí ve skeletu, lze při navazující léčbě TPTD očekávat méně výrazné vzestupy BMD. Současná aplikace alendronátu a TPTD má menší vliv na plošnou i volumetrickou BMD než samostatná aplikace TPTD [29, 30]. Současná léčba TPTD a bisfosfonáty proto není doporučována. Přidání raloxifenu k TPTD potlačí vzestup kostní resorpce, zatímco kostní novotvorba není ovlivněna [31]. Antiresorpční léčba navazující bezprostředně na ukončení kúry TPTD dokáže zabránit poklesu BMD, k němuž po ukončení léčby TPTD jinak dochází [18]. Tento přístup je všeobecně doporučován i pro klinickou praxi.
Zařazení do současné palety léčiv
Všeobecně je léčba TPTD považována za indikovanou
– �u pacientek s postmenopauzální osteoporózou ve vysokém riziku zlomenin. To zahrnuje ženy s anamnézou osteoporotické zlomeniny, ženy s kumulací rizikových faktorů zlomenin nebo pacientky, které netolerují jinou léčbu osteoporózy či u nichž byla předchozí léčba osteoporózy neúčinná;
– �u mužů s primární nebo hypogonadální osteoporózou ve vysokém riziku zlomenin. Toto vymezení zahrnuje muže s anamnézou osteoporotické zlomeniny, muže s kumulací rizikových faktorů zlomenin nebo muže, kteří netolerují jinou léčbu osteoporózy či u nichž byla předchozí léčba osteoporózy neúčinná;
– �u mužů i žen s osteoporózou, která se vyvinula v souvislosti se systémovou léčbou kortikosteroidy a kteří jsou ve vysokém riziku zlomeniny.
Indikace
V České republice může být TPTD předepsán v definovaných centrech po schválení Indikační komisí Společnosti pro metabolická onemocnění skeletu (SMOS) a pojišťoven na základě stávajících kritérií platných pro postmenopauzální osteoporózu:
1. �u pacientů s vícečetnými (≥ 2) zlomeninami obratlových těl a zároveň s hodnotou BMD (T skóre) krčku femuru nebo celkového proximálního femuru (Total Hip) ≤ -3,0 SD;
2. �po selhání minimálně dvouleté antiresorpční léčby u pacientů s BMD (T skóre) krčku femuru nebo celkového proximálního femuru ≤ -2,8 SD.
(Selhání léčby je definováno jako pokles BMD o ≥ 7 % v oblastech Total Hip nebo krčku femuru nebo ≥ 5 % na bederní páteři nebo jako vznik nové zlomeniny obratlového těla. [1]).
Kontraindikace
V preklinických studiích, v jejichž rámci byly vysoké dávky TPTD podávány potkanům, byl pozorován zvýšený výskyt kost
ních nádorů, včetně maligního osteosar
komu. Jejich výskyt byl závislý na dávce a byl pozorován u těch pokusných zvířat, která byla léčena prakticky celoživotně. Podle rozhodnutí panelu odborníků nejsou tato zjištění pro metabolismus kosti u člověka relevantní.
Nicméně u následujících kategorií pacientů, u nichž hrozí zvýšené riziko osteosarkomu, je užití TPTD kontraindikováno [10].
• �Pacienti s Pagetovou chorobou kostí.
Nejasné zvýšení hodnot alkalické fosfatá
zy může ukazovat na přítomnost Pagetovy choroby.
• �Děti. TPTD nebyl studován v dětské
populaci a neměl by být aplikován pedi
atrickým pacientům a mladým dospělým s otevřenými epifyzárními štěrbinami.
•
�Pacienti po předchozí radioterapii skeletu.
• �Pacienti s kostními metastázami a s anamnézou malignit skeletu.
• �Pacienti s jinými metabolickými chorobami kostí.
TPTD nebyl studován u pacientů s preexistující hyperkalcémií. Tito pacienti by
neměli být léčeni TPTD pro možnost zhor
šení hyperkalcémie. K dalším kontraindika
cím
užití TPTD patří hypersenzitivita, těhotenství a kojení, těžké postižení funkce ledvin.
Nežádoucí účinky
V rámci studie FPT se celkový výskyt nežádoucích příhod nelišil mezi skupinami užívajícími placebo a TPTD v dávce 20
m
g. Výskyt nežádoucích příhod vyžadujících léčbu byl ve skupině užívající TPTD významně nižší (p = 0,047) než ve skupině placebové. Ve skupině s TPTD byl ve srovnání s placebem významně vyšší výskyt závratí (9 % vs. 6 %) a bolestí dolních končetin (3 % vs. 1 %). Přerušení z důvodů nežádoucích účinků se nelišilo ve skupině užívající TPTD (6,5 %) a ve skupině dostávající placebo (5,9 %).
Ve skupině TPTD mělo 11,1 % pacientek nejméně 1 hodnotu sérového vápníku vyšší, než je horní hranice normy (2,64
mmol/l), ve srovnání s 1,5 % žen užívají
cích placebo. Pokud se stanovení sérového kalcia provádělo 4–6 hodin po aplikaci léčiva, ve skupině léčené byla hyperkalcémie přítomna u 3,0 % pacientek (0,2 % v placebové skupině). U takových pacientek by měla být snížena suplementace preparáty s vápníkem [11].
Výskyt nežádoucích účinků u mužů byl obdobný v placebové skupině a ve skupině užívající 20
m
g TPTD denně [24].
Lékové interakce
Současné podání 25 mg hydrochlorothiazidu denně neovlivnilo kalcemickou odpověď na aplikaci TPTD v dávce 40
m
g. 24hodinová kalciurie byla snížena klinicky nevýznamně (o 15 %). Efekt léčby vyššími dávkami hydrochlorothiazidu nebyl studován.
Ve studii s pacienty s lehkou až těžkou nedostatečností ledvin (clearance kreatininu 13–72 ml/min) vedla současná aplikace furosemidu (20–100 mg/den) a TPTD (40
m
g/den) k mírným vzestupům sérové
hladiny kalcia (+2 %) a 24hodinové kalciu
rie (+37 %), které patrně nejsou klinicky významné [10].
Dávkování a doba podávání
Léčivo se aplikuje jednou denně do kůže břicha či stehna. Dávka k subkutánní aplikaci obsahuje 20
m
g TPTD; roztok obsažený v jednom injektoru spolehlivě postačuje na 28 dní léčby. Trvání léčby je pevně stanoveno na 18 měsíců. Možnost případného opakování kúry dosud není dořešena.
Monitorování účinnosti léčby
Stejně jako pro antikatabolickou léčbu osteoporózy můžeme i v případě léčby anabolické v praxi monitorovat odpověď na léčbu prostřednictvím detekce změn BMD nebo markerů kostní remodelace. Vzhledem k preferenční stimulaci kostní
novotorby se jako nejvhodnější varianta j
eví marker kostní novotvorby. Pozitivní odezva PINP definovaná jako vzestup o více než 10
m
g/l byla detekována téměř u 80 % pacientů po roční léčbě TPTD, zatímco ve skupině dostávající placebo byl takový vzestup zaznamenán pouze u 5,9–7,6 % pacientů [32].
Balení
Lékovou formou je sterilní, bezbarvý, čirý izotonický roztok ve skleněné patroně, která je zabudována v injektoru (peru) určeném k subkutánní aplikaci tenkou jehlou. Předplněný injektor obsahuje 3,3 ml roztoku, z čehož lze aplikovat 3 ml. Koncentrace účinné látky je 250
m
g/ml. 1 ml roztoku dále obsahuje 0,41 mg ledové kyseliny octové, 0,10 mg octanu sodného, 45,4 mg mannitolu a 3,0 mg metakresolu. K dosažení pH 4 je přidáván 10% roztok kyseliny chlorovodíkové a/nebo 10% roztok hydroxidu sodného. Charakteristiky léčivého přípravku s obsahem TPTD shrnuje
tab. 2
.