Farmakologická skupina
Topotekan patří mezi deriváty kamptotecinu – alkaloidu izolovaného z asijského stromu
Camptotheca acuminata
. Kamptotecin inhibuje topoizomerázu I, která je ve zvýšené míře exprimována u většiny nádorových buněk. Kamptotecin však způsoboval kromě hematologické toxicity také
těžké hemoragické cystitidy a měl poměr
ně závažnou gastrointestinální toxicitu. Semisyntetické deriváty kamptotecinu – topo
tekan a irinotekan – mají velmi dobrou protinádorovou účinnost, jsou chemicky sta
bilní, rozpouštějí se při nižším pH a nezpůsobují hemoragickou cystitidu.
Topotekan řadíme do farmakoterapeutické skupiny jiná cytostatika, ATC kód: L01XX17.
Chemické a fyzikální vlastnosti
Topotekan je chemicky (S)-10-[(dime-
thylamino)methyl]-4-ethyl-4,9-dihydroxy-
1H-pyrano[3,4:6,7]indolizino[1,2-b]chi-
nolin-3,14-(4H,12H)-dion hydrochlorid
(
obr. 1
).
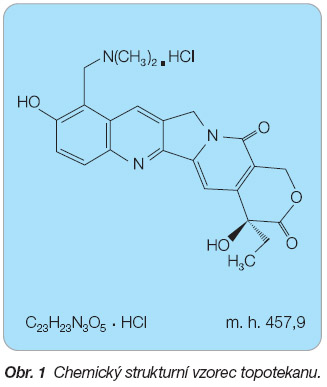
Sumární vzorec: C
23
H
23
N
3
O
5
. HCl
Molekulová hmotnost: 457,9
Topotekan je světle žlutý až zelenožlutý prášek rozpustný ve vodě.
Mechanismus účinku, farmakodynamika
Cytostatická aktivita topotekanu spo-čívá v inhibici enzymu topoizomerázy I
v S fázi buněčného cyklu. Topoizomeráza
I hraje důležitou roli při procesu replikace tím, že uvolňuje torzní napětí molekuly DNA před místem větvení – a to tak, že přeruší 1 vlákno, zlomem protáhne smyčku druhého vlákna, zacelí zlom a odvine dvoušroubovici o 1 závit.
Topotekan inhibuje topoizomerázu I stabilizací kovalentního komplexu mezi enzymem a štěpeným vláknem DNA, což je mezistupeň katalytického procesu. Inhibice topoizomerázy I topotekanem vede v buňce k indukci jednovláknových zlomů DNA, a tím k buněčné smrti [1], viz
obr.
2
.
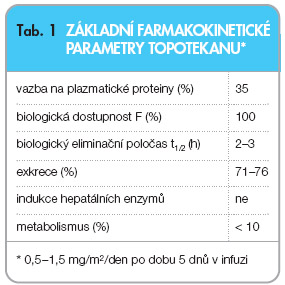
Farmakokinetické vlastnosti
Distribuce
Po intravenózním podání topotekanu v denních dávkách 0,5–1,5 mg/m2 ve formě třicetiminutové infuze po dobu 5 dnů je jeho plazmatická clearance (62 l/hod) vysoká, odpovídá zhruba 2/3 jaterního
krevního průtoku [2, 3]. Topotekan má vel
ký distribuční objem (okolo 132 l) a relativně krátký biologický poločas (2 až 3 hodiny). Farmakokinetika se nemění během opakované aplikace po dobu 5 dnů. Plocha pod křivkou (AUC) roste proporcionálně se
zvyšující se dávkou léku. Vazba topoteka
nu na plazmatické bílkoviny je nízká (35 %), distribuce mezi plazmou a krevními elementy je homogenní a topotekan se dobře dostává do tkání. Topotekan dobře pro
chází hematoencefalickou bariérou, asi 30
% plazmatické koncentrace můžeme najít v mozkomíšním moku. Intratekální aplikace ale není běžně doporučována.
Metabolismus
Metabolismus topotekanu v játrech není důležitý. Zahrnuje N-dealkylaci, kdy vzniká N-demethyltopotekan, a glukuronidaci. Metabolismus představuje méně než
10 % eliminace topotekanu. N-demethylo
vaný metabolit, který má podobnou akti
vitu jako mateřská látka, ale o něco nižší, byl
nalezen v moči, plazmě a ve stolici. Meta
bolit vznikající O-glukuronidací topotekanu byl též nalezen v moči. Topotekan je metabolizován převážně hydrolýzou laktonového kruhu za vzniku karboxylátu s otevřeným kruhem.
Exkrece
Po intravenózní aplikaci je topotekan vylučován v nezměněné formě močí. Průměrně 40 % z celkové dávky se objeví v moči během 24 hodin od začátku třicetiminutové infuze a přibližně 18 % je vyloučeno stolicí. Močí se vylučuje karboxylová forma, pokud se pH moči pohybuje kolem 6,9. Je-li pH nižší, objevuje se v moči laktonová forma. I když se topotekan vylučuje přednostně močí a objevuje se v moči ve vysoké koncentraci, nemá renální toxicitu, protože je vysoce rozpustný ve vodě. Vzhledem k vylučování močí je ale nutné snižovat dávku při poškození ledvin. Dávka by se měla redukovat o třetinu, pohybuje-li se clearance kreatininu v rozmezí 40–60 ml/min, a o polovinu, je-li clearance kreatininu 20–40 ml/min, abychom zabránili těžké myelosupresi. Pokud je clearance kreatininu nižší než 20 ml/min, topotekan by neměl být vůbec podán. Naproti tomu dávka topotekanu nemusí být redukována při alteraci jaterních funkcí. Topotekan se dá hemodialyzovat. Farmakokinetické parametry shrnuje
tab. 1
.
Klinické zkušenosti
Ovariální karcinom
Topotekan je možné používat od druhé poloviny devadesátých let při léčbě recidivujícího nebo progredujícího karcinomu ovaria. Používání topotekanu v léčbě pacientek s touto diagnózou bylo schváleno na základě výsledků jedné srovnávací a tří nesrovnávacích studií [4–6]. Pacientky zařazené do této studie byly z více než 70 %
definovány jako tzv. platina-rezistentní
(rezistentní k léčbě platinou). Iniciální dávka topotekanu byla 1,5 mg/m2 v třicetiminutové intravenózní infuzi po dobu 5 následujících dní, cykly byly podávány v 21denním intervalu. Ten Bokkel Huinink a kol. [4] srovnávali topotekan s paklitaxelem ve velké multicentrické prospektivní randomizované studii. Jednalo se o pacientky s recidivujícím karcinomem ovaria, které již byly léčeny chemoterapií s platinovým derivátem a na tuto chemoterapii neodpověděly. Žádná z pacientek nedostávala předtím paklitaxel. Objektivní odpověď na léčbu byla 20,5 % (topotekan) versus 14 % (paklitaxel). Stabilní onemocnění bylo zaznamenáno u 20 % žen s topotekanem versus 33 % s paklitaxelem. Ženy, kterým nebyla podávána platina déle než 6 měsíců, měly vyšší odpověď v obou skupinách. Byly publikovány dvě velké nesrovnávací studie [5, 7]. Do první z nich byly zařazeny pacientky, u nichž selhala terapie první linie s platinou (bez taxolu), a do druhé studie byly zařazeny pacientky, u nichž selhala chemoterapie s platinovým derivátem a paklitaxelem v první nebo ve druhé linii. Odpověď na léčbu topotekanem byla 16,3 % a 13,7 %. Kudelka a kol. hodnotili též odpověď na topotekan u žen rezistentních k léčbě platinou, odpověď byla 13 %. Studie GOG (Gynecology and Oncology Group) hodnotila odpověď na léčbu topotekanem u žen, které měly tzv. platina-free interval delší než 6 měsíců. V této „příznivé skupině" zaznamenali u dvou žen (ze 46) kompletní a u 13 částečnou odpověď, tzn. že odpověď na léčbu představovala celkem 32,6 %. Stabilní onemocnění
bylo zaznamenáno u 22 ze 46 žen (47,8 %).
Topotekan je všeobecně dobře tolerován.
Dávku limitující toxicita je hematolo
gická,
ale reverzibilní a nekumulativní. Neu
trope
nie (stupeň 4) byla zaznamenána u 60 % pa
cientek během prvního cyklu chemoterapie
a ve 40 % v dalších cyklech chemoterapie.
Trvala průměrně 7 dní. Trombocy
topenie
(stupeň 4) se vyskytovala u 27 % pacientek a v 9 % cyklů chemoterapie. Průměrná doba trvání trombocytopenie byla 5 dnů. Transfuzi erytrocytů a trombocytů vyžado
valo 22 % pacientek ve 4 % cyklů. Proto
že topotekan nezpůsobuje kumulativní toxi
citu, ve většině případů stačilo snížit dáv
ku nebo mírně oddálit chemoterapii a nebylo nutné užít stimulační faktory (růstový faktor granulopoezy G-CSF). Nehematologická toxicita, která byla zaznamenána, byla obvykle pouze lehká. Nejčastější toxicita byla gastrointestinální – nauzea, zvracení a průjem. V těchto studiích s topotekanem nebyla profylakticky užívána antiemetika.
Pro některé pacientky nebylo akceptovatelné trvání chemoterapie po dobu pěti dnů.
Ovariální karcinom si postupně vyvíjí rezistenci na různá cytostatika, a tím i rezistenci na léčbu. Topotekan je cytostatikum, které nemá zkříženou rezistenci s žádným
cytostatikem užívaným v první linii chemo
te
rapie, tím dává eventuální šanci na odpo
věď pacientkám s časnými recidivami anebo je možné podáváním topotekanu prodloužit interval bez podávání platiny.
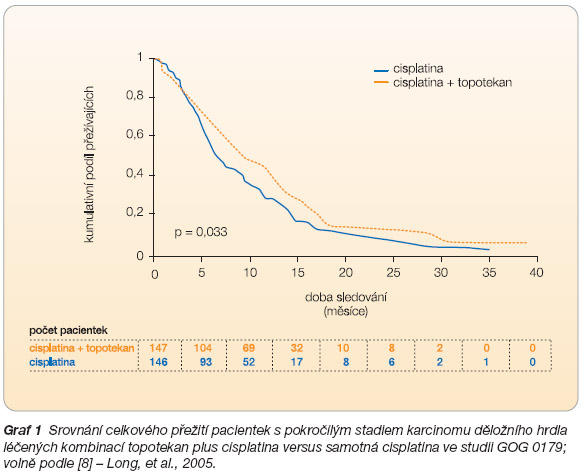
Karcinom děložního hrdla
Prognóza pokročilých stadií karcinomu děložního hrdla není dobrá a u recidiv navíc máme minimum léčebných modalit. Topotekan byl schválen pro léčbu karcinomu
děložního hrdla ve Spojených státech
v roce 2006 (a následně i v Evropě) na základě randomizované studie GOG 0179 [8]. Pacientky s perzistujícím a recidivují
cím karcinomem děložního hrdla byly ran
domizovány do tří ramen: cisplatina 50 mg/m2 v monoterapii v 21denním intervalu versus kombinace cisplatina 50 mg/m2 1. den + topotekan 0,75 mg/m2 1., 2. a 3. den v intervalu 21 dnů versus methotrexát, vinblastin, doxorubicin a cisplatina (MVAC). MVAC rameno muselo být uzavřeno kvůli 4 úmrtím v souvislosti s chemoterapií, a nebylo proto v této studii hodnoceno. Ženy, které dostaly kombinovanou terapii, měly celkové přežití 9,4 měsíce, zatímco ženy léčené monoterapií přežívaly 6,5 měsíce (p = 0,017). Doba přežívání bez progrese (progression-free survival, PFS) byla 4,6 měsíce v případě kombinované léčby versus 2,9 měsíce v případě monoterapie (p = 0,014). U monoterapie bylo dosaženo kompletní remise u 4 pacientek, 14 pacientek dosáhlo částečné
remise. V případě kombinace topotekanu
a cisplatiny bylo 14 celkových remisí a 22 částečných remisí.
Hematologická toxicita byla vyšší při kombinované chemoterapii. Neutropenie (stupeň 4) se vyskytovala ve 48 % versus 1 % a trombocytopenie (stupeň 4) ve 2 % versus 0 %.
Závěry této studie ukazují, že kombinace topotekanu a cisplatiny významně prodlužuje život pacientkám s karcinomem děložního hrdla. Srovnání celkového přežití při podávání kombinace versus monoterapie ve studii GOG 0179 znázorňuje
graf 1
.
Malobuněčný karcinom plic
Malobuněčný karcinom plic je velmi agresivní zhoubný nádor, který má vysokou odpověď na primární terapii, ale recidivy jsou typické. Recidivující malobuněčný karcinom plic má špatnou prognózu a obvykle velmi špatně odpovídá na jakoukoliv léčbu. Topotekan byl schválen pro léčbu malobuněčného karcinomu plic v roce 2006 na základě hodnocení pěti studií [9–13]. Léčebná odpověď je 15 %, ale je vyšší u chemosenzitivního onemocnění (19 %), zatímco u chemorezistentního onemocnění pouze 4 %. Stabilní onemocnění bylo zaznamenáno ve 20 % (u chemosenzitivních nádorů 22 % versus 16 % u nádorů chemorezistentních). Nejčastější
byla hematologická toxicita. Neutropenie stupně 3 a 4
se vyskytovala až u 90 % pacientů a trombocytopenie
stupně 3 a 4
byla diagnostikována až u 55 % pacientů. Ostatní toxicita byla pouze lehká. Léčba topotekanem může paliativně ovlivnit i symptomy onemocnění jako dyspnoe, kašel, bolest na hrudi, anorexii, nespavost. Topotekan je cennou možností terapie pře
devším proto, že nezpůsobuje kumulativ
ní toxicitu a subjektivně je pacienty velmi dobře tolerován, čímž může zvyšovat kvalitu života.
Zařazení do současné palety léčiv
Topotekan je v současné době společ
ně s pegylovaným lipozomálním doxoru
bi
cinem lékem volby u ovariálních karcino
mů
rezistentních na platinu. Obě léčiva mají
rozdílný profil toxicity a tolerability. V terapii karcinomu děložního hrdla patří topotekan
do standardní léčby v kombinaci s cispla
ti
nou.
U karcinomu plic, kde se v první linii
po
užívají cytostatika, jež se vyznačují poměr
ně velkou kumulativní toxicitou, je topotekan, prostý kumulativní toxicity
, výhodný. Topotekan je v druhé linii chemoterapie alternativou etoposidu v monoterapii a CAV (cyklofosfamid, doxorubicin, vinkristin). Léčba topotekanem v monoterapii u pacientů s malobuněčným karcinomem plic bude ještě výhodnější v situaci, kdy bude dostupná jeho perorální forma [14]. Pozn.
Ke dni 8.
1. 2009 nebyl perorální topotekan v ČR dostupný, probíhá správní řízení o stanovení maximální ceny a o stanovení výše a podmínek úhrady.
Indikace
Topotekan je v monoterapii indikován:
– �u pacientek s metastazujícím karcinomem ovarií v případě selhání léků první volby nebo následné terapie,
– �u nemocných s relapsem malobuněč
ného
karcinomu plic, u nichž není opa
ko
vaná léčba režimem první volby považována za vhodnou,
– �v kombinaci s cisplatinou u pacientek s karcinomem děložního hrdla rekurentním po radioterapii a u žen s onemocněním ve stadiu IVB. U pacientek, které již cisplatinou byly léčeny, je vyžadován dostatečně dlouhý interval k tomu, aby bylo možno považovat podání této kombinace cytostatik za odůvodněné.
Kontraindikace
Topotekan je kontraindikován u kojících žen, dále u nemocných, kteří:
– �mají v anamnéze výskyt hypersenzitivních reakcí na léčivou látku nebo na kteroukoliv pomocnou látku obsaženou v přípravku,
– �mají před zahájením prvního cyklu chemoterapie těžký útlum kostní dřeně vyjádřený výchozím počtem neutrofilů nižším než 1,5 x 109/l nebo počtem trombocytů nižším než 100 x 109/l.
Nežádoucí účinky
Nejčastějším nežádoucím účinkem topotekanu je hematotoxicita – neutropenie
a febrilní neutropenie, trombocytopenie,
anémie a leukopenie. Při podávání v mono
terapii se vyskytuje těžká neutropenie stupně 3 a 4 až v 77 % případů a febrilní neutropenie až u 16 % léčených. Neutropenie se objevuje většinou mezi 9. a 10. dnem od
prvního
dne chemoterapie. Riziko těžké trom
bo
cyto
penie (< 25 x 109/l) je 25 %. Transfu
ze trombocytární masy je nutná až u 4 % léčených monoterapií. Anémie nebývá tak závažná, transfuze krve je nutná asi u 50 % nemocných. Anémie s hodnotami hemo
globinu < 8,0 g/dl byla pozoro
vána u 37 % léčených [15, 16]. Nejčastější nehematologické nežádoucí účinky jsou: nauzea (52 %), zvracení (32 %), průjem (18 %), obstipace (9 %) a mukozitida (15 %). Může se vyskytnout i tzv. neutropenická kolitida při neutropenii, která může vést i ke smrti nemocného. Mírná bolest břicha při chemoterapii topotekanem bývá popisována asi v 5 %. Zvýšená únava je uváděna asi v 25 %, ale ve většině případů zároveň nacházíme i anémii. Významnou alopecii
způsobuje topotekan asi ve 30 % přípa
dů.
Mohou se objevovat hyper
senzitivní reak
ce
s exantémem a svědě
ním. Při extravazál
ní aplikaci dochází pouze k mírné reakci, která nevyžaduje léčbu.
Lékové a jiné interakce
Nebyly prováděny
in vivo
studie týkající se interakce topotekanu s jinými léčivy. V populační studii nebylo prokázáno, že současné podávání blokátorů receptorů 5HT
3
(ondansetron, granisetron), opiátových analgetik nebo kortikosteroidů by mělo vliv na farmakokinetiku topotekanu. Při kombinované léčbě s jinými cytostatiky je často nutná redukce dávek jednotlivých cytostatik pro zlepšení snášenlivosti. Při podávání platinových derivátů první den léčby společně s topotekanem je nutné redukovat vzhledem ke snášenlivosti jejich dávku, zatímco pokud je podáváme až pátý den, dávku většinou redukovat nemusíme. Při podávání topotekanu v dávce 75 mg/m2 5 dnů po sobě a cisplatiny v dávce 60 mg/m2 první den u ovariálního karcinomu bylo zaznamenáno mírné zvýšení AUC topotekanu.
Těhotenství a kojení
V preklinických studiích bylo prokázáno, že topotekan má embryotoxické a fetotoxické účinky. Podobně jako ostatní cytostatika může topotekan způsobit poškození plodu. Pokud je topotekan užíván v těhotenství nebo ženy otěhotní v průběhu léčby, musí být upozorněny na rizika pro plod. Během kojení je podávání topotekanu kon
traindikováno, i když není prokázán pře
stup topotekanu do mléka. Ve studiích na zvířatech nebylo prokázáno ovlivnění fertility, nicméně jako ostatní cytostatika je topotekan genotoxický a ovlivnění lidské fertility nemůže být vyloučeno.
Dávkování
Topotekan lze používat pouze na pracovištích specializovaných na podávání cytostatik a smí být podáván pouze pod dohledem lékaře se zkušenostmi s používáním chemoterapie.
Před podáním prvního cyklu topoteka
nu musí mít pacienti výchozí počet neutrofilů
vyšší než 1,5 x 109/l a počet trombocytů
musí převyšovat 10 x 109/l. Topotekan
musí
být před aplikací rozpuštěn a dále
naředěn.
Ovariální karcinom a malobuněčný karcinom plic
Počáteční dávkování
Doporučená dávka je 1,5 mg/m2 tělesného povrchu a den. Podává se denně formou 30minutové nitrožilní infuze, a to
5 po sobě následujících dní. Interval mezi jednotlivými cykly by měl být 21 dní. V léčbě je možné pokračovat, je-li dobře tolerována, až do progrese základního onemocnění.
Následující dávkování
Topotekan nesmí být znovu aplikován,
pokud není počet neutrofilů vyšší než
1,0 x 109/l, počet trombocytů musí být více
než 100 x 109/l a hodnoty hemoglobinu vyšší než 9 g/dl. Pacientům s výskytem těžké
neutropenie (počet neutrofilů < 0,5
x 109/l) trvající 7 nebo více dní nebo
pacientům, kteří mají febrilní neutropenii,
se
podává redukovaná dávka 1,25 mg/m2/den
(pokud je to nezbytné, pouze 1 mg/m2/den) nebo se k udržení intenzity dávkování i v opakovaných cyklech profylakticky podává G-CSF od šestého dne léčebného cyklu (tj. následný den po ukončení cyklu) [17,
18]. Pokud nedojde ke zmírnění neutro
penie po podávání G-CSF, je nutné přistoupit k redukci dávky topotekanu. Dávku topotekanu je rovněž třeba snížit, pokud počet trombocytů poklesne pod 25 x 109/l. V klinických studiích byla léčba topotekanem přerušena, pokud redukce dávky topotekanu na 1,0 mg/m2 nedostačovala.
Karcinom děložního hrdla
Počáteční dávkování
Doporučené dávkování topotekanu je 0,75 mg/m2 podávaných 1., 2. a 3. den léčby v intravenózní infuzi trvající 30 minut. Cisplatina se podává v dávce 50 mg/m2 1. den následně po podání topotekanu. Toto léčebné schéma se opakuje každých 21 dnů 6 cyklů nebo do progrese onemocnění.
Následující dávkování
Topotekan nesmí být znovu aplikován, pokud není počet neutrofilů vyšší než 1,5 x 109/l, počet trombocytů vyšší než 100 x 109/l a pokud hodnoty hemoglobinu
nepřevyšují 9 g/dl. U pacientek s výsky
tem febrilní neutropenie (je-li počet neutrofilů < 1 x 109/l a teplota vyšší než 38 °C) se doporučuje snížit dávku o 20 % na 0,60 mg/m2 v následujících cyklech. Jako alternativu ke snížení dávky je možné podávat G-CSF počínaje 4. dnem cyklu (nejméně 24 hodin po ukončení infuze s topotekanem). Pokud se febrilní neutropenie objeví i přes použití G-CSF, doporučuje se snížit dávku topotekanu o dalších 20 %, na 0,45 mg/m2 v následujících cyklech. Pacientkám, u kterých dojde ke snížení hladiny trombocytů pod 10 x 109/l, se
doporučuje podávat dávky snížené o 20
%, na 0,60 mg/m2.
Dávkování při renální insuficienci
V monoterapii (ovariální a malobuněčný plicní karcinom): U pacientů s clearance kreatininu nižší než 20 ml/min nejsou k dispozici dostatečná data pro stanovení doporučené dávky. V monoterapii pa
cientů se středně těžkou renální insufici
encí s clearance kreatininu 20–39 ml/min je doporučeno podávat 0,75 mg/m2 topotekanu denně po dobu 5 po sobě následujících dní.
Při kombinované léčbě (karcinom děložního hrdla) je třeba se řídit doporučeními pro snížení dávky cisplatiny.
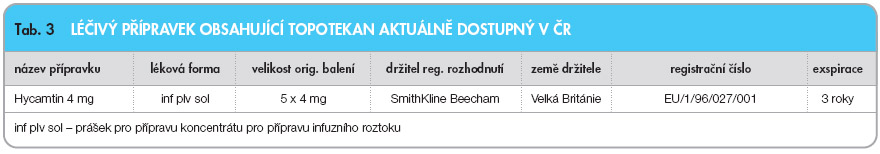
Balení
Viz
tab. 3
.