Ulipristal acetát
Podávání selektivních modulátorů progesteronových receptorů (SPRM) pacientkám s děložními myomy představuje nadějný terapeutický směr, který by mohl znamenat průlom v dosud nepříliš efektivní farmakologické léčbě tohoto velmi častého onemocnění premenopauzálních žen. Z této poněkud nesourodé skupiny bylo dosud nejlepších klinických výsledků dosaženo používáním ulipristal acetátu (UPA). Vzhledem k dosud neúplným znalostem o SPRM je jejich současné využití omezeno na předoperační léčbu symptomatických děložních myomů a pro nouzovou postkoitální kontracepci. Podávání UPA indukuje v buňkách myomů apoptózu, což může přispívat k žádoucímu klinickému účinku – zmenšení myomů a zástavě děložního krvácení. Dlouhodobější využití UPA nejen v předoperační léčbě děložních myomů je předmětem intenzivního zkoumání.
Farmakologická skupina
Ulipristal acetát (UPA) patří mezi tzv. selektivní modulátory progesteronových receptorů (SPRM). Tato skupina léčiv nepůsobí jednoznačně ani progestagenně, ani antagonisticky vůči progesteronu, nýbrž (v závislosti na orgánu, resp. tkáních, kde působí) různým způsobem moduluje progesteronové receptory. UPA je řazen mezi SPRM II. generace. ATC kód UPA je G03AD02.
Chemické a fyzikální vlastnosti
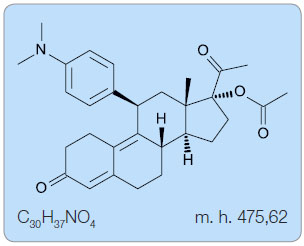 UPA patří do kategorie steroidů. Struktura je odvozena od 19-norprogesteronu. Chemicky se jedná o (8S,11S,13S,14R,17R)-17-acetoxy-11-[4-(dimethylamino)fenyl]
UPA patří do kategorie steroidů. Struktura je odvozena od 19-norprogesteronu. Chemicky se jedná o (8S,11S,13S,14R,17R)-17-acetoxy-11-[4-(dimethylamino)fenyl]
-19-norpregna-4,9-dien-3,20-dion [1], obr. 1.
UPA je bělo-žlutavý krystalický prášek volně rozpustný v methylenchloridu, rozpustný v methanolu, acetonu a ethanolu a nerozpustný ve vodě.
Sumární vzorec: C30H37NO4
Molekulová hmotnost: 475,62
Mechanismus účinku, farmakodynamika
UPA je perorálně aktivní syntetický SPRM charakterizovaný částečným tkáňově specifickým progestagenním účinkem, a zároveň antagonistickou aktivitou na progesteronových receptorech (podobně jako starší antiprogestiny mifepriston či lilopriston). V důsledku této interakce dojde k inhibici či opoždění ovulace [2]. Ulipristal se současně váže i ke glukokortikoidním receptorům, avšak antagonizace na této úrovni nebyla v klinických studiích pozorována. Minimální afinitu má k androgenním a žádnou k lidským estrogenovým či mineralokortikoidním receptorům.
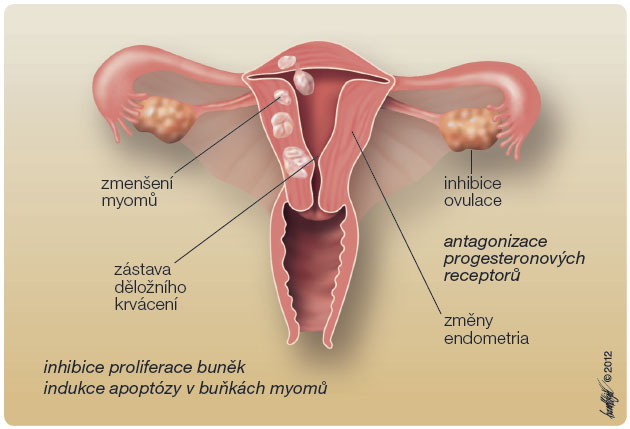 Hlavním mechanismem účinku UPA je tedy inhibice nebo zpoždění ovulace a zmenšení objemu myomů inhibicí buněčné proliferace s indukcí apoptózy [3], obr. 2. K jeho účinnosti mohou přispívat rovněž změny endometria. Zatímco mifepriston (SPRM I. generace) kromě snížení menstruačního krvácení a objemové redukce dělohy a myomů (o 26–32 % po tříměsíčním užívání) způsobuje také hyperplazii endometria, UPA se svým modifikovaným parciálně agonistickým i antagonistickým účinkem na progesteronové receptory tento nežádoucí efekt nemá [4].
Hlavním mechanismem účinku UPA je tedy inhibice nebo zpoždění ovulace a zmenšení objemu myomů inhibicí buněčné proliferace s indukcí apoptózy [3], obr. 2. K jeho účinnosti mohou přispívat rovněž změny endometria. Zatímco mifepriston (SPRM I. generace) kromě snížení menstruačního krvácení a objemové redukce dělohy a myomů (o 26–32 % po tříměsíčním užívání) způsobuje také hyperplazii endometria, UPA se svým modifikovaným parciálně agonistickým i antagonistickým účinkem na progesteronové receptory tento nežádoucí efekt nemá [4].
Vliv na endometrium
UPA působí skrze progesteronové receptory endometria. Denní dávka 5 mg vede k rychlému navození amenorey, a to již během prvních 10 dnů léčby. Pravidelný menstruační cyklus je obnoven v průměru do 4 týdnů od ukončení léčby. Výsledkem přímého účinku na endometrium jsou skupinově specifické histologické změny označované jako změny endometria související s modulátorem progesteronového receptoru (Progesterone receptor modulators Associated Endometrial Changes – PAEC). Obvyklým histologickým nálezem jsou neaktivní a slabě proliferující epitelové buňky spojené s asymetrií růstu stromální a epitelové složky s cysticky dilatovanými žlázkami s kombinací estrogenových (mitotických) a progestinových (sekrečních) epiteliálních účinků. Takový obraz byl pozorován přibližně u 60 % pacientek léčených UPA po dobu 3 měsíců. Tyto změny jsou benigní, plně reverzibilní po ukončení léčby a neměly by být zaměňovány za hyperplazii endometria [5].
Pokud zesílení endometria přetrvává i po 3 měsících od ukončení léčby a obnovení menstruačního cyklu, je nutné pacientku vyšetřit v souladu s obvyklou klinickou praxí k vyloučení prekancerózy či malignity endometria.
Působení na myomy
UPA působí přímo na děložní myomy a zmenšuje jejich velikost inhibicí buněčné proliferace a indukcí apoptózy.
V kultivovaných buňkách leiomyomu, tedy v laboratorních podmínkách, vedou SPRM ke snížení životaschopnosti buněk, potlačení exprese růstových faktorů a ke vzniku indukované apoptózy prostřednictvím aktivace mitochondriálního a s tumor nekrotizujícím faktorem souvisejícího ligandu, který indukuje apoptózu (TRAIL) [6]. Za klíčový protein v inhibici apoptózy je považován Bcl-2. Bylo prokázáno, že promotér Bcl-2 interaguje prostřednictvím progesteronového receptoru s progesteronem, z čehož lze usuzovat, jakým dalším mechanismem mohou SPRM indukovat apoptózu [7]. Proapoptotický efekt SPRM však donedávna nebyl verifikován ve tkáních leiomyomů odstraněných po léčbě SPRM od živých pacientek, tedy in vivo (viz níže).
Vliv na hypofýzu
Denní dávka UPA 5 mg způsobuje u většiny pacientek inhibici ovulace. Průměrná hladina progesteronu je přibližně 0,3 ng/ml a vede k částečnému potlačení hladiny folikuly stimulujícího hormonu (FSH). Hladiny estradiolu zůstávají u většiny pacientek ve středním folikulárním rozmezí, a jsou tedy srovnatelné s koncentracemi u žen užívajících placebo [8]. UPA nemá během 3 měsíců léčby vliv na hladiny thyreotropinu (TSH), kortikotropinu (ACTH) nebo prolaktinu v séru [9].
Farmakokinetické vlastnosti
Absorpce
U PA se po perorálním podání rychle vstřebává a velmi rychle se transformuje na farmakologicky aktivní metabolit [9], základní farmakokinetické parametry jsou shrnuty v tab. 1.
PA se po perorálním podání rychle vstřebává a velmi rychle se transformuje na farmakologicky aktivní metabolit [9], základní farmakokinetické parametry jsou shrnuty v tab. 1.
Podání tablety spolu s jídlem ovlivňuje dosažení maximální plazmatické koncentrace cmax – podání 30mg tablety UPA se snídaní s vysokým obsahem tuků mělo za následek přibližně o 45 % nižší střední hodnotu cmax, prodloužení času potřebného k dosažení maximální plazmatické koncentrace (tmax) od mediánu 0,75 hodiny až na 3 hodiny a o 25 % vyšší střední hodnotu plochy pod křivkou koncentrace léčiva v krvi (AUC) ve srovnání s podáním na lačno. Tyto rozdíly v absorpci nejsou klinicky významné, proto lze UPA užívat s jídlem i bez něj [10, 11].
Při vyšším pH v žaludku (bez ohledu na příčinu) může být jeho absorpce snížena. Při podávání UPA (10mg tablety) společně s inhibitorem protonové pumpy esomeprazolem (20 mg denně po dobu 6 dní) došlo ke snížení střední hodnoty cmax přibližně o 65 %, prodloužení tmax ze střední hodnoty 0,75 h na 1,0 h a zvýšení střední hodnoty AUC o 13 % [9], ale tento účinek preparátů zvyšujících žaludeční pH by neměl mít zásadní klinický význam pro denní podávání tablet s obsahem UPA.
Distribuce
UPA se silně váže na plazmatické bílkoviny (> 98 %), včetně albuminu, ?1-ky-
selého glykoproteinu a lipoproteinu s vysokou a nízkou hustotou. Účinky UPA u pacientů se změněnými plazmatickými hladinami proteinů nejsou známé [12].
Biotransformace a eliminace z organismu
UPA je snadno metabolizován na své mono-N-demetylované a dále na di-N-demetylované metabolity. Mono-N-demetylovaný metabolit je farmakologicky aktivní na rozdíl od neaktivního di-N-demetylovaného metabolitu. Dle studií in vitro je tento metabolismus zprostředkováván převážně izoformou cytochromu P450 3A4 (CYP3A4) a v menší míře také pomocí CYP1A2 a CYP2D6 [9].
Data ze studií in vitro dále ukazují, že UPA a jeho aktivní metabolit neinhibují CYP1A2, 2A6, 2C9, 2C19, 2D6, 2E1 a 3A4, ani neindukují CYP1A2. Podávání UPA tak pravděpodobně nemění clearance léčivých přípravků, které jsou těmito enzymy metabolizovány. UPA a jeho aktivní metabolit nejsou substráty P-glykoproteinu (ABCB1).
Hlavní cestu eliminace představuje stolice. Méně než 10 % je vyloučeno močí. Ženy s těžkou poruchou funkce jater nebo ledvin by neměly dostávat tento lék z důvodu nedostatku údajů o bezpečnosti a účinnosti u této skupiny pacientek [9].
Klinické zkušenosti
Klinická bezpečnost a účinnost UPA byly hodnoceny v následujících pěti zásadních studiích.
•Prospektivní, multicentrická, otevřená studie byla provedena na 45 klinikách plánovaného rodičovství v USA se snahou posoudit účinnost UPA. Jedna 30mg tableta byla podávána 48 až 120 hodin po nechráněném pohlavním styku. Do studie byly zařazeny ženy starší 18 let, které měly pravidelný menstruační cyklus (mezi 24 a 35 ± 5 dny), neužívaly hormonální antikoncepci a byly ochotné používat bariérovou metodu antikoncepce do dokončení studie. Ze studie byly vyloučeny těhotné, kojící ženy, ženy s nitroděložním tělískem (IUD), ženy po sterilizaci a ženy, jejichž partner podstoupil vazektomii.
Na začátku studie byl proveden těhotenský test z moči a krve s cílem vyloučit již existující těhotenství. Po celou dobu studie si pacientky vedly diáře a zaznamenávaly pohlavní styk, užívání antikoncepce, současné podávání léků, intermenstruační krvácení nebo špinění a jiné nežádoucí účinky (nevolnost, zvracení, bolest).
Odběr moči na průkaz těhotenství byl proveden při zápisu, pět až sedm dní po předpokládaném začátku menstruace a 12 až 14 dní po očekávaném nástupu menstruace, pokud k menstruaci dosud nedošlo. Při pozitivním výsledku testu bylo těhotenství ověřeno kontrolou sérového ß-hCG.
U žen, jejichž výsledek testu byl negativní a které začaly menstruovat, byla ukončena jejich účast ve studii. U žen, jejichž výsledek testu byl negativní a u kterých nezačala menstruace, pokračovaly těhotenské testy každý týden až do menstruace. Ženy, jejichž výsledek testu byl negativní po 60 dnech, byly hodnoceny jako sekundární amenorea.
Primárním cílovým parametrem byl těhotenský index definovaný jako počet těhotenství po podání UPA a dělený počtem léčených pacientů. Hlavním sekundárním cílovým parametrem bylo porovnat horní limit 95% intervalu spolehlivosti (CI) pozorovaného těhotenství s klinickou bezvýznamností prahu, definovanou jako 4 %.
V populaci pozorovaná frekvence těhotenství činila 1,9 % (95% CI: 1,3–2,8 %), oproti očekávané frekvenci 5,7 %. Celkově zabránilo použití UPA 62,3 % těhotenství (95% CI: 41,9–75,6 %). Účinnost se nesnižuje v průběhu času – pozorovaná frekvence gravidit byla 2,3 %, 2,1 % a 1,3 % (statisticky nesignifikantní rozdíly; p = 0,44) při podání léku za 48–72 hodin, 72–96 hodin a 96–120 hodin po nechráněném pohlavním styku [13].
Nejčastěji hlášenými nežádoucí účinky byly bolesti hlavy (9,3 %), nauzea (9,2 %) a bolesti břicha (6,8 %), přičemž většina z těchto nežádoucích účinků byla mírné až středně závažné povahy.
Dalším vedlejším účinkem byl delší menstruační cyklus. Více než 90 % žen uvedlo opoždění menstruace o 7 a více dnů po podání UPA a 7 % žen o 15 a více dnů. Intermenstruační krvácení bylo hlášeno u 134 žen (8,7 %) po léčbě; 91,8 % krvácivých příhod bylo popsáno jako špinění. Závěr studie byl takový, že 30mg dávka UPA představuje účinnou urgentní kontracepci (ES), pokud je podána během 48 až 120 hodin po nechráněném pohlavním styku [14].
• Další studie porovnávala bezpečnost a účinnost UPA s levonorgestrelem (LNG) pro účely ES. Jednalo se o randomizovanou, multicentrickou, mezinárodní, jednoduše zaslepenou studii uskutečněnou na 35 klinikách pro plánování rodičovství ve Velké Británii, Irsku a USA. Do studie byly zařazeny ženy, které žádaly o antikoncepci do 120 hodin po nechráněném styku a které byly starší 16 let (v případě Velké Británie a Irska), resp. 18 let věku (v USA). Ze studie byly vyloučeny ženy těhotné, kojící, ženy s IUD nebo hormonální antikoncepcí a ženy, které podstoupily sterilizaci, nebo ženy s partnerem po vazektomii. Při vstupu do studie byla odebrána moč a krev na těhotenský test.
Elektronický systém byl použit k rozřazení 2221 žen do skupiny s jednorázovou dávkou 1,5 mg LNG nebo 30 mg UPA. Pacientky byly povinny si vést denní záznamy o každé mimořádné události (pohlavní styk, užívání antikoncepce, vaginální krvácení, současné užívání jiných léků). Hodnocení bylo plánováno 5 až 7 dní po očekávaném nástupu menstruace. Během této doby byl proveden další těhotenský test. Pokud byl výsledek negativní a žena začala menstruovat, byla její účast ve studii považována za skončenou. Při negativním výsledku, avšak pokud žena nezačala menstruovat, byly provedeny další navazující těhotenské testy až do menstruace. Ženy, jejichž výsledek testu byl negativní po 60 dnech, byly hodnoceny jako sekundární amenorea. Primárním cílovým parametrem byla frekvence těhotenství u žen, kterým byl lék podán do 72 hodin po nechráněném styku. Sekundárním cílovým parametrem byla frekvence gravidit u žen, které byly léčeny do 120 hodin po nechráněném styku.
Ve studii bylo zaznamenáno 50 gravidit: u 20 žen z celkem 1104 žen užívajících UPA a u 30 žen z celkem 1117 žen ve skupině s LNG. U 2018 žen, které byly léčeny do 72 hodin po styku, bylo zaznamenáno 37 těhotenství: u 22 z 852 žen (2,6 %) po užití LNG (95% CI: 0–9,3) a u 15 z 844 žen (1,8 %) po užití UPA (95% CI: 1,0–3,0). Tento rozdíl mezi skupinami nebyl statisticky významný (odds ratio 0,68 při 95% CI: 0,35–1,31).
V podskupině 203 žen léčených 72 až 120 hodin po nechráněném styku byla zaznamenána 3 těhotenství, všechna ve skupině žen užívajících LNG. U obou podskupin byla četnost těhotenství po UPA (1,8 %) významně nižší než očekávaná četnost gravidit (5,5 %; p = 0,001). Četnost gravidit po LNG byla 2,6 % při očekávané četnosti 5,4 % (p = 0,001).
Nežádoucí účinky byly zaznamenány u 597 žen (54 %) užívajících UPA a u 626 žen (56 %), které dostávaly LNG. Jednalo se o bolesti podbřišku mírné až střední intenzity, bolesti hlavy, dysmenoreu a nevolnost. Z vážnějších nežádoucích příhod byly zaznamenány závratě po podání UPA a molární těhotenství u jedné ženy užívající LNG. K menstruaci došlo v průměru o 2,1 dne později (směrodatná odchylka – SD 8,2) u žen užívajících UPA a o 1,2 dne (SD 7,9) dříve u žen užívajících LNG (p = 0,001) [15].
•V červnu 2010 byly v Evropě dokončeny 2 klinické studie fáze III: PEARL I a PEARL II (PGL4001 Efficacy Assessment in Reduction of symptoms due to uterine Leiomyomata), tedy hodnocení účinnosti UPA (PGL 4001) ke snížení příznaků děložních myomů. Byly získány údaje od 498 žen ve věku od 18 do 50 let se symptomatickými myomy a indikací k hysterektomii či myomektomii.
Do studií byly přijímány pacientky s myomem o velikosti alespoň 3 cm, s typickými krvácivými obtížemi (nadměrné či prodloužené děložní krvácení s PBAC /Pictorial Bleeding Assessment Chart/ se skóre vyšším než 100 za 1.–8. den menses) a s výraznou sekundární anémií (hemoglobin ? 102 g/l a hematokrit ? 30 %). Do studie nebyly zařazeny ženy, u nichž celková velikost myomatózní dělohy přesahovala 16. týden gravidity, ženy s anamnézou operačního výkonu na děloze, ženy užívající v posledním měsíci před nástupem do studie preparáty obsahující estrogeny či progestiny, ženy s pozitivním těhotenským testem, ženy s BMI < 18 či s BMI > 40, ženy s hemoglobinopatií, atypickou hyperplazií nebo karcinomem endometria, s karcinomem hrdla děložního, ovaria nebo prsu, s děložním polypem o velikosti > 2 cm, s ovariální cystou > 4 cm nebo s kovovými implantáty.
PEARL I, dvojitě zaslepená, randomizovaná multicentrická studie kontrolovaná placebem, prokázala významně lepší účinnost UPA (jak v podskupině s denní perorální dávkou 5 mg, tak v podskupině s denní dávkou 10 mg). Ve srovnání s placebem došlo ke snížení excesivního děložního krvácení a bolestí podbřišku, korekci anémie, zvýšení kvality života a redukci objemu myomů (o 23 % v době ukončení tříměsíční léčby 5 mg UPA denně oproti výchozímu stavu), resp. redukci objemu celé myomatózní dělohy [16].
PEARL II, dvojitě zaslepená, randomizovaná multicentrická studie, porovnávala perorální UPA s injekčním přípravkem obsahujícím leuprolid acetát ze skupiny analog gonadoliberinu (GnRHa). Studie prokázala srovnatelnou účinnost UPA a leuprolidu při snížení excesivního děložního krvácení, korekci anémie a zmenšení objemu 3 dominantních myomů (dle magnetické rezonance). Na rozdíl od léčby leuprolidem však u pacientek užívajících po 3 měsíce 5 mg či 10 mg UPA denně přetrvávala signifikantní redukce objemu těchto 3 myomů i 25 týdnů po skončení léčby. Dalším výrazným rozdílem byl fakt, že děložní krvácení bylo u více než 90 % žen užívajících UPA pod kontrolou již během 7 dnů od započetí léčby oproti 30 dnům v případě podávání leuprolidu. Konečně studie prokázala signifikantně lepší profil bezpečnosti a snášenlivosti a odpovídající vyšší skóre hodnocení kvality života ve skupině s UPA vzhledem k podstatně nižší frekvenci klimakterických vazomotorických příznaků v této skupině. Tomu odpovídaly nezměněné (střední folikulární) hladiny sérového estradiolu u žen užívajících UPA. Nejčastějšími nežádoucími účinky UPA v obou studiích byly citlivost prsou, bolesti hlavy a návaly horka [17].
•Jiná recentní multicentrická studie se zaměřila na případný vliv UPA na indukci programované buněčné smrti neboli apoptózy v buňkách leiomyomů u pacientek plánovaných k chirurgické léčbě pro symptomatické děložní myomy [18]. Tento efekt byl dosud popsán u jiných preparátů ze skupiny SPRM pouze ve studiích in vitro.
Jedné skupině žen byl po dobu 12 týdnů před operací podáván UPA (ženy ze studie PEARL I užívající 5 mg či 10 mg UPA denně). Jako skupiny určené k porovnání byly zvoleny ženy léčené 3 měsíce před operací GnRHa (triptorelin v dávce 3 mg intramuskulárně celkem 3krát v intervalu 28 dnů) a pacientky, které před provedením hysterektomie či myomektomie neabsolvovaly žádnou hormonální předoperační léčbu. Ve studii byly hodnoceny pouze ženy, u nichž histologické vyšetření exstirpovaného tumoru dělohy nebo celé dělohy prokázalo vitální, tedy laboratorně hodnotitelný leiomyom.
Apoptóza byla přítomna v signifikantně vyšším počtu buněk leiomyomů u pacientek léčených UPA ve srovnání se ženami léčenými triptorelinem (p = 0,01) a s kontrolní skupinou bez hormonální předléčby (p = 0,01). Mezi podskupinami s 5 mg a 10 mg UPA nebyl pozorován významný statistický rozdíl v hodnotách apoptotického indexu. Apoptóza indukovaná 3měsíčním podáváním UPA se tak může podílet na prolongovaném klinickém efektu pozorovaném ve studii PEARL II [18].
•Brzy bude publikována práce o léčbě UPA, v níž autoři použili data ze dvou studií fáze III, jejichž parametry byly sloučeny k vytvoření analýzy u větší populace (celkem 2183 žen). Práce se zabývá účinností UPA po nechráněném styku a vlivem jiných faktorů na výskyt těhotenství [19].
Přes použití UPA otěhotnělo celkem 41 žen (1,9 %). Frekvence těhotenství byla vyšší u žen s opakovaně nechráněným stykem v jednom cyklu a u obézních. Ta se pohybovala od 1,3 % (0,9–2,0 %) u neobézních žen, které neměly opakovaný nechráněný styk (n = 1704), do 8,3 % (0,2–38,5 %) u obézních, které opakovaný nechráněný pohlavní styk měly (n = 12). UPA se tak ukázal jako účinný a bezpečný při prevenci otěhotnění po nechráněném pohlavním styku. Jeho účinnost je však nižší u žen s opakovaným nechráněným stykem a u obézních [19].
Zařazení do současné palety léčiv
Nouzová antikoncepce
I přesto, že počet žen, které běžně užívají antikoncepci, za poslední roky významně stoupl, má nouzová antikoncepce zcela jasně definovanou pozici. Ještě nedávno byl za zlatý standard považován LNG, ale na základě posledních výzkumů se zřetelně ukazují výhody UPA, který postupně nachází stále významnější místo jako nouzová antikoncepce pro použití během 120 hodin (5 dnů) od nechráněného pohlavního styku nebo po selhání použité metody antikoncepce a také u žen, které nevědí o dostupnosti nouzové antikoncepce, nebo které vyhledají lékařskou pomoc se zpožděním [20].
Jeho nespornou výhodou oproti LNG je bezpečnost, lepší efekt a nižší výskyt nežádoucích účinků [21]. UPA může zabránit otěhotnění, pokud je podán v pokročilé folikulární fázi cyklu, i když hladina luteinizačního hormonu již začala stoupat, což je doba, kdy LNG už v potlačení ovulace nebývá účinný [1].
Léčba myomů
V léčbě myomů dosud dominuje chirurgické řešení, nejčastěji je prováděna myomektomie nebo hysterektomie v závislosti na věku a reprodukčních cílech pacientky. Farmaka jsou i dnes používána spíše jako symptomatická léčba méně pokročilých nálezů. Zejména u nálezů mnohočetných, recidivujících či nepříznivě lokalizovaných myomů, nevhodných k technicky standardní myomektomii, je však vhodné uvažovat o nových léčebných postupech, jako např. o některých modalitách léčby radiologické nebo o moderní farmakoterapii.
Ambici stát se kauzální léčbou myomů měly některé hormonální preparáty. V této indikaci se již používala řada lékových skupin: progestiny (včetně jejich nitroděložní aplikace), danazol, agonisté i antagonisté gonadoliberinu, selektivní modulátory estrogenových receptorů (SERM), inhibitory aromatázy nebo antiprogestiny. Žádný z nich však dosud v léčbě myomů neznamenal výrazný průlom.
Dosud nejvíce byly používány a studovány GnRHa. Způsobují hypoestrinismus, který při několikaměsíčním užívání vede k mírné objemové regresi myomů. Podávání GnRHa s sebou bohužel nese řadu nevýhod, pro které se jejich využívání v léčbě myomů omezilo na tříměsíční předléčbu selektovaných pacientek před myomektomií či hysterektomií. Jsou to především výrazné klimakterické účinky, dočasnost efektu léčby vázaná na dobu podávání (a rychlý návrat myomů k původní velikosti po vysazení léčby) nebo selhání objemového efektu na myomy u některých pacientek. Po „boomu“ využívání GnRHa v léčbě myomů v devadesátých letech tak lze v poslední době naopak pozorovat mírný odklon od jejich užívání v této indikaci.
Další, dnes mírně obsolentní alternativou léčby myomů jsou systémově podávané gestageny (perorální či injekční, depotní formy), které ale mají nulový efekt na zmenšení myomů a výrazně nižší účinek na zástavu krvácení. V protikrvácivých účincích (zejména jako nouzová, akutní zástava krvácení namísto kyretáže) může být účinný norethisteron, zřejmě pro svůj parciální estrogenní efekt na endometrium. Dlouhodobější spokojenost u menších intramurálních myomů, které signifikantně nedeformují děložní dutinu, přináší také lokálně působící intrauterinní systém s LNG (LNG-IUS) [22].
Jinou alternativou je antigonadotropin danazol, syntetický derivát chemicky příbuzný 17-ethinyltestosteronu, který je špatně tolerován pro nežádoucí účinky a parciální androgenní efekt [23]. Danazol snižuje objem myomů na základě snížení koncentrace estrogenů. In vitro také inhibuje steroidogenezi ve varlatech, ovariích a nadledvinách. Jeho působení vede k atrofii endometria.
Jen některé medikamenty mají naději zasáhnout kauzálně do progrese růstu myomů. K nejperspektivnějším lékům z této kategorie řadíme SPRM, které jsou v posledních letech předmětem intenzivního zkoumání [24]. Jejich klasickým představitelem je asoprisnil (J867), který ve tkáňových kulturách selektivně indukuje apoptózu v buňkách leiomyomů, aniž by způsoboval proliferaci nebo apoptózu v buňkách normálního myometria [25]. V roce 2005 byly přerušeny fáze III studií zabývajících se asoprisnilem, a to kvůli hyperplastickým změnám endometria po užívání tohoto přípravku.
Dalším SPRM s výrazně antigestagenním účinkem je mifepriston (RU486), syntetická steroidní látka. Dlouhodobé studie zaměřené na vyhodnocení karcinogenního potenciálu mifepristonu nebyly provedeny. Výsledky ze studií prováděných in vitro a na zvířatech neukázaly genotoxický potenciál mifepristonu [26]. Kromě snížení menstruačního krvácení a objemové redukce dělohy a myomů (o 26–32 % během tříměsíčního užívání) způsobuje také hyperplazii endometria. UPA se svým modifikovaným agonistickým i antagonistickým účinkem na progesteronové receptory tento nežádoucí efekt nemá [4].
Lze shrnout, že obecně mají SPRM ve srovnání s GnRHa přibližně stejný účinek na zmenšení myomů, ale při jistějším a rychlejším nástupu kontroly krvácení. Hlavní výhodou SPRM je absence klimakterických projevů. Navíc při podávání SPRM není nutná injekční aplikace. Nadějí pro budoucnost je delší užívání SPRM (nově plánovaná studie PEARL IV, kdy je v plánu užívat lék s přestávkami po dobu 12 měsíců), což u GnRHa nelze, mj. pro vysoké riziko vývoje osteoporózy.
Indikace
UPA patří mezi léčiva užívaná k předoperační terapii („pretreatment“) děložní myomatózy a k urgentní postkoitální kontracepci.
Předoperační léčba výrazně symptomatických děložních myomů (děložní krvácení, tlakové symptomy) u dospělých žen v reprodukčním věku: pacientky s myomy (nehledě na jejich velikost a uložení) mohou očekávat do cca 7 dnů zástavu krvácení (s pravděpodobností přesahující 90 %) a s tím související úpravu těžké anémie a nižší riziko nutnosti podání transfuze v perioperačním období. Kromě ústupu krvácivých obtíží obvykle dochází i ke zmírnění tlaku v podbřišku a samozřejmě i k vymizení dysmenorey (menstruační bolesti). Z výsledků dosavadních klinických studií navíc vyplývá, že vlivem UPA lze očekávat i objemové zmenšení myomu a celé myomatózní dělohy [27].
Nouzová antikoncepce: vhodná pro použití během 120 hodin (5 dnů) od nechráněného pohlavního styku nebo po selhání použité metody antikoncepce.
V obou indikacích jde o bezpečný, velmi dobře tolerovaný přípravek s minimem vedlejších nežádoucích účinků (viz níže).
Kontraindikace
Kontraindikacemi podávání UPA jsou: hypersenzitivita na jednotlivé složky léku, těhotenství a kojení, genitální krvácení neznámého původu, rakovina těla děložního, děložního hrdla, vaječníku nebo prsu.Vzhledem k nedostatku údajů vztahujících se k bezpečnosti při dlouhodobém užívání by alespoň prozatím neměla doba trvání léčby přesáhnout 3 měsíce.
Nežádoucí účinky
UPA j e obecně velmi dobře snášen. Nejčastějším vedlejším účinkem byla při klinických zkouškách amenorea (82,2 %), což však bylo u léčených žen považováno za žádoucí výsledek [28]. Nejčastěji pozorovaným skutečným nežádoucím účinkem byly návaly horka. Velká většina nežádoucích účinků měla mírný nebo středně těžký průběh (94,9 %), nevedla k přerušení užívání léčivého přípravku (99,3 %) a odezněla spontánně.
e obecně velmi dobře snášen. Nejčastějším vedlejším účinkem byla při klinických zkouškách amenorea (82,2 %), což však bylo u léčených žen považováno za žádoucí výsledek [28]. Nejčastěji pozorovaným skutečným nežádoucím účinkem byly návaly horka. Velká většina nežádoucích účinků měla mírný nebo středně těžký průběh (94,9 %), nevedla k přerušení užívání léčivého přípravku (99,3 %) a odezněla spontánně.
Bezpečnost UPA byla hodnocena v rámci klinického vývojového programu u 4718 žen. Nežádoucí účinky hlášené ve studii fáze III hodnocené u 2637 žen jsou uvedeny v tab. 2, dále jsou zmíněny vybrané nežádoucí účinky [9].
Zesílení endometria
U 10–15 % pacientek bylo na konci léčby při užívání UPA pozorováno zesílení endometria nad 16 mm (dle ultrazvuku nebo magnetické rezonance). Tyto změny jsou reverzibilní – po ukončení léčby a obnovení menstruačního krvácení dochází k obnovení původního stavu. Změny endometria vlivem podávání UPA (PAEC) se liší od hyperplazie endometria. Při odesílání vzorků po hysterektomii nebo biopsii endometria k histologickému vyšetření by měl být patolog informován o tom, že pacientka užívala UPA [29].
Návaly horka
Ve studii kontrolované aktivním komparátorem (GnRHa) se středně závažné až závažné návaly vyskytovaly u 11,3 %, resp. 9,7 % pacientek léčených UPA (v dávce 5 mg UPA, resp. 10 mg UPA denně), zatímco u žen léčených leuprorelinem se vyskytovaly v 39,6 % [17]. Ve studii kontrolované placebem nebyly tyto vegetativní klimakterické symptomy po podání UPA popisovány vůbec [16].
Bolesti hlavy
Mírná nebo středně silná bolest hlavy byla pozorována u 6,4 % pacientek.
Ovariální cysty
Funkční ovariální cysty byly pozorovány během léčby a po ní u 1,5 % pacientek a ve většině případů spontánně vymizely po několika týdnech.
Děložní krvácení
Pacientky se silným menstruačním krvácením v důsledku děložních myomů jsou ohroženy nadměrným krvácením, které může vyžadovat chirurgický zásah. V průběhu léčby UPA, resp. 2–3 měsíce po ukončení léčby, byly tyto obtíže pozorovány jen ojediněle.
Předávkování
Možné předávkování UPA bylo hodnoceno pouze u omezeného počtu subjektů. Po podání jednotlivé dávky až do výše 200 mg a denní dávky 50 mg po 10 po sobě následujících dní nebyly hlášeny žádné těžké ani závažné nežádoucí účinky.
Lékové interakce
Následující přehled představuje možné účinky jiných léčivých přípravků naUPA [9].
Hormonální antikoncepce
UPA řadíme mezi SPRM s převážně inhibičním účinkem na progesteronový receptor. Z tohoto důvodu mohou hormonální antikoncepce a progestiny snížit účinek UPA kompetitivním působením na progesteronový receptor. Nedoporučuje se proto současné podávání léčivých přípravků s obsahem progestinu
Inhibitory CYP3A4
U pacientek, kterým jsou podávány současně s UPA slabé inhibitory CYP3A4, není nutná žádná úprava dávkování. Podání středně silných či silných inhibitorů cytochromu CYP3A4 (např. ketokonazol, ritonavir, nefazodon) může vést k velmi výrazným změnám koncentrací UPA v plazmě a z toho důvodu se jejich současné užívání nedoporučuje.
Induktory CYP3A4
Pacientky, které současně užívají induktory CYP3A4, mohou mít snížené koncentrace UPA v plazmě. Současné užívání UPA a silných induktorů CYP3A4 (rifampicin, karbamazepin, fenytoin) se proto nedoporučuje.
Léčivé přípravky ovlivňující hodnotu pH v žaludku
Jak bylo popsáno výše, změny pH v žaludku mohou ovlivnit vstřebávání UPA. Pacienti by se měli vyvarovat současného podávání léků zvyšujících pH v žaludku, jako jsou inhibitory protonové pumpy, histaminových receptorů 2. typu (H2) a antacid [30]. Pro denní podávání tablet s obsahem UPA by ale tato interakce neměla mít klinický význam [9].
Účinnost UPA může být snížena, pokud je podáván současně s barbituráty. Naopak jeho použití ve spojení s jakýmkoli léčivem, které má tendenci inhibovat CYP3A4, jako je itrakonazol nebo ketokonazol, může vést ke zvýšení jeho plazmatických koncentrací.
Dále jsou uvedeny možné účinky UPA na jiné léčivé přípravky.
Hormonální antikoncepce
UPA svým modulujícím účinkem na receptory progesteronu může zasahovat do působení hormonálních antikoncepčních přípravků s obsahem gestagenu (včetně nitroděložních tělísek s obsahem LNG) i do působení gestagenů podávaných z jiných důvodů. Proto se nedoporučuje současné podávání těchto léčivých přípravků. Léčivé přípravky obsahující progestagen by neměly být užívány po dobu 12 dní po ukončení léčby UPA.
Substráty P-glykoproteinu
Studie in vitro naznačují, že UPA může být inhibitorem P-glykoproteinu (P-gp) při klinicky významných koncentracích ve stěně GIT během absorpce. Současné podávání UPA může zvýšit koncentrace v plazmě současně podávaných léčivých přípravků, které jsou substráty P-gp (dabigatran etexilát, digoxin). Proto se jejich společné podávání nedoporučuje [30].
Těhotenství a laktace
Těhotenství
Pokud jde o zdraví plodu/novorozence v případě vystavení matky účinkům UPA v těhotenství, jsou k dispozici velmi omezené údaje. Ačkoli nebyl pozorován žádný teratogenní potenciál, údaje ze studií na zvířatech nejsou s ohledem na reprodukční toxicitu dostačující.
K dispozici nejsou žádné nebo jsou jen omezené údaje týkající se užívání UPA v těhotenství. Podávání UPA je během těhotenství kontraindikováno.
Kojení
Dostupné toxikologické údaje ze studií na zvířatech ukazují na vylučování UPA do mléka. Není známo, zda je UPA vylučován do mateřského mléka u lidí, a riziko u novorozenců či kojenců nelze vyloučit. Po podání UPA se nedoporučuje kojení po dobu nejméně 36 hodin. Léčba UPA je během kojení kontraindikována.
Ovlivnění pozornosti
UPA může mít nepatrný vliv na schopnost řídit a obsluhovat stroje, protože po užití UPA byla pozorována mírná až střední závrať. Méně časté jsou ospalost a rozmazané vidění, vzácně byla hlášena porucha pozornosti.
Dávkování
Léčba myomů
K předoperační léčbě středně závažných až závažných symptomů onemocnění děložními myomy u dospělých žen v reprodukčním věku jsou indikovány 5mg tablety. Doba trvání léčby je omezena na 3 měsíce. Léčba spočívá v podávání jedné 5mg tablety perorálně jedenkrát denně po dobu maximálně 3 měsíců. Tablety je možné užít společně s jídlem nebo bez jídla. Léčba by měla být zahájena v průběhu prvního týdne menstruačního cyklu.
K dispozici nejsou žádné údaje pro léčbu trvající déle než 3 měsíce nebo pro opakovanou léčbu. Proto by léčba neměla překročit dobu 3 měsíců. Pokud pacientka vynechá dávku, měla by užít UPA co nejdříve. Pokud by byla doba vynechání delší než 12 hodin, neměla by pacientka vynechanou dávku užívat a dále by měla jednoduše pokračovat podle obvyklého plánu užívání následující dávkou [9, 16, 17].
Specifické populace
U pacientek s mírnou nebo středně závažnou poruchou funkce ledvin se úprava dávkování nedoporučuje. Podávat UPA pacientkám se závažnou poruchou funkce ledvin se vzhledem k absenci specifických studií nedoporučuje, pokud nejsou pečlivě sledovány.
U pacientek s mírnou poruchou funkce jater není úprava dávkování nutná, ale vzhledem k absenci specifických studií se podávání UPA pacientkám se středně závažnou nebo závažnou poruchou funkce jater nedoporučuje.
Neexistuje žádné relevantní použití UPA u pediatrické populace, jeho bezpečnost a účinnost byla stanovena jen u žen starších 18 let [9].
Nouzová antikoncepce
Pro použití během 120 hodin (5 dnů) od nechráněného pohlavního styku nebo po selhání použité metody antikoncepce jsou indikovány 30mg tablety.
Léčba se skládá z jedné tablety podané perorálně co nejdříve, ale ne později než za 120 hodin (5 dní) po nechráněném pohlavním styku nebo po selhání použité metody antikoncepce.
Tabletu je možno užít společně s jídlem nebo bez jídla. Pokud do 3 hodin po užití přípravku dojde ke zvracení, je třeba užít další tabletu. Přípravek může být užit kdykoli během menstruačního cyklu. Před podáním přípravku je třeba vyloučit těhotenství.
UPA není určen pro použití jako běžná metoda hormonální antikoncepce, nechrání proti pohlavně přenosným onemocněním nebo přenosu infekce HIV. Nouzová antikoncepce je metoda určená pro příležitostné použití a rozhodně nesmí nahradit některou metodu pravidelné antikoncepce. V každém případě je ženám třeba doporučit, aby si zvolily některou z běžných metod antikoncepce.
Přestože použití přípravku nevylučuje pokračování v užívání pravidelné hormonální antikoncepce, může přípravek snížit její antikoncepční účinek. Po použití nouzové antikoncepce se proto doporučuje použít pro následující pohlavní styky až do začátku další menstruace ochranu spolehlivou bariérovou metodou.
Opakované podání přípravku v průběhu jednoho menstruačního cyklu se nedoporučuje, jelikož bezpečnost a účinnost přípravku po opakovaném podání v jednom menstruačním cyklu nebyla zkoumána. Nedoporučuje se ani souběžné podávání s nouzovým kontraceptivem obsahujícím LNG.
Pokud dojde po užití přípravku k otěhotnění, je třeba, stejně jako u všech těhotenství, posoudit možnost mimoděložního těhotenství. Mimoděložní těhotenství může trvat i přesto, že došlo k děložnímu krvácení.
Po podání přípravku se může menstruační krvácení objevit o několik dní dříve nebo později, než bylo očekáváno [1, 3].
Specifické populace
U pacientek s poškozením ledvin nebo jater nelze vzhledem k neexistenci specifických studií uvést žádná zvláštní doporučení týkající se dávkování. Použití přípravku u pacientek se závažným poškozením jater se vzhledem k neexistenci specifických studií nedoporučuje.
Do klinické studie přípravku byl začleněn omezený počet žen ve věku do 18 let. S podáním přípravku mladistvým nejsou tedy dostatečné klinické zkušenosti a jeho užívání se zde nedoporučuje.
Nedoporučuje se použití u žen s těžkým astmatem nedostatečně kontrolovaným perorálními glukokortikoidy.
Seznam použité literatury
- [1] Jadav SP, Parmar DM. Ulipristal acetate, a progesterone receptor modulator for emergency contraception. J Pharmacol Pharmacother 2012; 3: 109–111.
- [2] Kim A, Bridgeman MB. Ulipristal Acetate (ella): A Selective Progesterone Receptor Modulator For Emergency Contraception. P T. 2011; 36: 325–331.
- [3] McKeage K, Croxtall JD. Ulipristal acetate: a review of its use in emergency contraception. Drugs 2011; 71: 935–945.
- [4] Bagaria M, Suneja A, Vaid NB, et al. Low-dose mifepristone in treatment of uterine leiomyoma: a randomised double-blind placebo-controlled clinical trial. Aust N Z J Obstet Gynaecol 2009; 49: 77–83.
- [5] Brache V, Sitruk-Ware R, Williams A, et al. Effects of a novel estrogen-free, progesterone receptor modulator contraceptive vaginal ring on inhibition of ovulation, bleeding patterns and endometrium in normal women. Contraception 2012; 85: 480–488.
- [6] Maruo T, Ohara N, Yoshida S, et al. Translational research with progesterone receptor modulator motivated by the use of levonorgestrel-releasing intrauterine system. Contraception 2010; 82: 435–441.
- [7] Yin P, Lin Z, Cheng YH, et al. Progesterone receptor regulates Bcl-2 gene expression through direct binding to its promoter region in uterine leiomyoma cells. J Clin Endocrinol Metab 2007; 92: 4459–4466.
- [8] Brache V, Cochon L, Jesam C, et al. Immediate pre-ovulatory administration of 30 mg ulipristal acetate significantly delays follicular rupture. Hum Reprod 2010; 25: 2256–2263.
- [9] Esmya 5mg: Summary of Product Characteristics (SPC) – available at http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002041/WC500124085.pdf (accessed 26 October 2012).
- [10] EllaOne: Summary of Product Characteristics (SPC) – available at http://www.emea.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/001027/WC500023670.pdf (accessed 26 October 2012).
- [11] Nallasamy S, Kim J, Sitruk-Ware R, et al. Ulipristal Blocks Ovulation by Inhibiting Progesterone Receptor-Dependent Pathways Intrinsic to the Ovary. Reprod Sci 2012 Sep 25 [Epub ahead of print].
- [12] Gemzell-Danielsson K, Meng C. Emergency contraception: Potential role of ulipristal acetate. Int J Womens Health 2010; 4: 53–61.
- [13] Richardson AR, Maltz FN. Ulipristal acetate: review of the efficacy and safety of a newly approved agent for emergency contraception. Clin Ther 2012; 34: 24–36.
- [14] Fine P, Mathe H, Ginde A, et al. Ulipristal acetate taken 48–120 hours after intercourse for emergency contraception. Obstet Gynecol 2010; 115: 257–263.
- [15] Glasier AF, Cameron ST, Fine PM, et al. Ulipristal acetate versus levonorgestrel for emergency contraception: A randomised non-inferiority trial and meta-analysis. Lancet 2010; 375: 555–5562.
- [16] Donnez J, Tatarchuk TF, Bouchard P, et al. PEARL I Study Group. Ulipristal acetate versus placebo for fibroid treatment before surgery. N Engl J Med 2012; 366: 409–420.
- [17] Donnez J, Tomaszewski J, Vázquez F, et al.PEARL II Study Group. Ulipristal acetate versus leuprolide acetate for uterine fibroids. N Engl J Med 2012; 366: 421–432.
- [18] Horák P, Mára M, Dundr P, et al. Effect of selective progesterone receptor modulator on induction of apoptosis in uterine fibroids in vivo. Int J Endocrinol 2012; 436174.
- [19] Moreau C, Trussell J. Results from pooled Phase III studies of ulipristal acetate for emergency contraception. Contraception 2012 Jul 6 [Epub ahead of print].
- [20] Duffy K, Gold MA. Adolescents and emergency contraception: update 2011. Curr Opin Obstet Gynecol 2011; 23: 328–333.
- [21] Sarkar NN. The state-of-the-art of emergency contraception with the cutting edge drug. Ger Med Sci 2011; 9: Doc16.
- [22] Kriplani A, Awasthi D, Kulshrestha V, Agarwal N. Efficacy of the levonorgestrel-releasing intrauterine system in uterine leiomyoma. Int J Gynaecol Obstet 2012; 116: 35–38.
- [23] Koskas M, Chabbert-Buffet N, Douvier S, et al. Role of medical treatment for symptomatic leiomyoma management in premenopausal women. Gynecol Obstet Biol Reprod (Paris) 2011; 40: 858–874.
- [24] Yoshida S, Ohara N, Xu Q, et al. Cell-type specific actions of progesterone receptor modulators in the regulation of uterine leiomyoma growth. Semin Reprod Med 2010; 28: 260–273.
- [25] Chen W, Ohara N, Wang J, et al. A novel selective progesterone receptor modulator asoprisnil (J867) inhibits proliferation and induces apoptosis in cultured human uterine leiomyoma cells in the absence of comparable effects on myometrial cells. J Clin Endocrinol Metab 2006; 91: 1296–1304.
- [26] Murphy A, Morales A, Kettel M, et al. Regression of uterine leiomyomata to anti-progesteron RU486: dose response effect. Fertil Steril 1995; 64: 187.
- [27] Nieman LK, Blocker W, Nansel T, et al. Efficacy and tolerability of CDB-2914 treatment for symptomatic uterine fibroids: a randomized, double-blind, placebo-controlled, phase IIb study. Fertil Steril 2011; 95: 767–772.
- [28] Bouchard P. Current and future medical treatments for menometrorrhagia during the premenopause. Gynecol Endocrinol 2011; 27: 1120–1125.
- [29] Williams AR, Bergeron C, Barlow DH, et al. Endometrial Morphology After Treatment of Uterine Fibroids With the Selective Progesterone Receptor Modulator, Ulipristal Acetate. Int J Gynecol Pathol 2012 Sep 26 [Epub ahead of print].
- [30] Ella: a new emergency contraceptive. Med Lett Drugs Ther 2011; 53: 3–4. [No authors listed].