Ursodeoxycholová kyselina
Souhrn:
Ursodeoxycholová kyselina (UDCA) je minoritní žlučová kyselina, článek shrnuje základní vlastnosti této látky. Detailněji jsou osvětleny mechanismy působení UDCA zahrnující protizánětlivé, antiapoptotické, imunomodulační účinky i schopnost UDCA inhibovat nekrózu, a dále mechanismy vedoucí ke snížení intracelulární koncentrace žlučových kyselin. Řada těchto mechanismů je zprostředkována nepřímo, tedy interakcí UDCA s jadernými receptory. Dále jsou zmíněny schválené indikace, farmakokinetické parametry UDCA, její farmakokinetické interakce, nežádoucí účinky a toxicita.
Key words: ursodeoxycholic acid – pharmacology – cholestasis – primary biliary cirrhosis – primary sclerosing cholangitis – gallstones.
Summary:
Ursodeoxycholic acid (UDCA) is minority bile acid, the basic pharmacological characteristics of which are presented in this review. Its mechanisms of action are explained in detail. These mechanisms include anti‑inflammatory, antiapoptotic, immunomodulatory effects, inhibition of necrosis and mechanisms decreasing the content of intracellular bile acids. Many of these mechanisms are mediated via interaction of UDCA with nuclear receptors. Moreover, approved indications, pharmacokinetic parameters, pharmacokinetic interactions of UDCA are reviewed, as well as adverse effects and toxicity.
Farmakologická skupina
Léčiva k terapii onemocnění jater a žlučových cest, přípravky obsahující žlučové kyseliny, ATC A05AA02.
Chemické a fyzikální vlastnosti
Ursodeoxycholová kyselina (CAS 128 13 2), systematickým názvem kyselina 3a, 7β dihydroxy 5β cholan 24 ová, je bílý nebo téměř bílý prášek, je velmi těžce rozpustná ve vodě, snadno rozpustná v 96% lihu, těžce rozpustná v acetonu a v dichlormethanu, taje při cca 202 °C. Molekulová hmotnost ursodeoxycholové kyseliny je 392,58.
Úvod
Ursodeoxycholová kyselina (UDCA) byla objevena přibližně před devadesáti lety jako hlavní složka sušené žluči čínského čern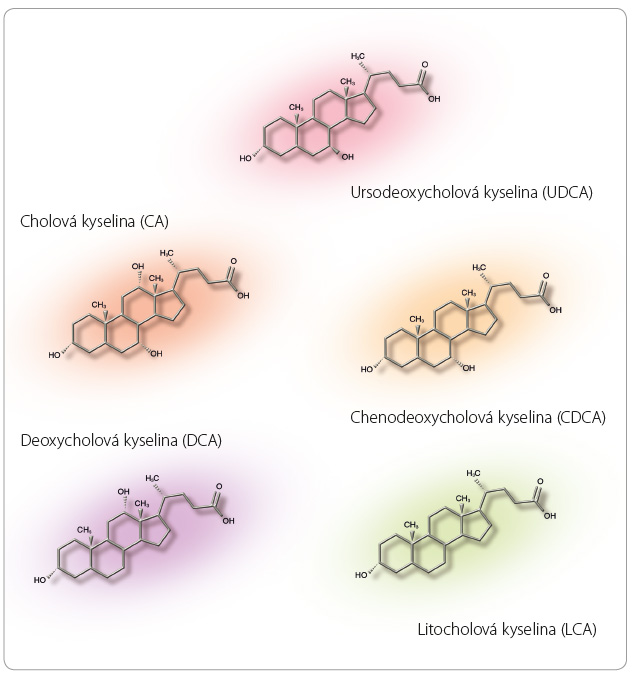 ého medvěda, která byla používána v tradiční čínské medicíně již v dynastii Tang (618–907 n. l.) [1,2]. Na základě medicíny založené na důkazech (evidence based medicine, EBM) se UDCA používá asi třicet let. Látka je hydrofilní žlučová kyselina fyziologicky přítomná v malém množství i v lidské žluči, tvoří její asi 4 % [3] (obr. 1). Žlučové kyseliny a oxysteroly jsou endogenními ligandy jaderných receptorů a některých membránových receptorů a podílejí se na regulaci metabolismu lipidů, sacharidů a na homeostáze [4]. Ursodeoxycholová kyselina je 7 epimer chenodeoxycholové kyseliny (CDCA), je hydrofilnější, a proto v takové míře nepoškozuje biomembrány. Další rozdíly spočívají v rozdílné schopnosti regulovat apoptózu, zánět, transport a metabolismus žlučových kyselin, na molekulární úrovni mechanismů působení je to pak odlišná schopnost vazby a ovlivnění jaderných i membránových receptorů.
ého medvěda, která byla používána v tradiční čínské medicíně již v dynastii Tang (618–907 n. l.) [1,2]. Na základě medicíny založené na důkazech (evidence based medicine, EBM) se UDCA používá asi třicet let. Látka je hydrofilní žlučová kyselina fyziologicky přítomná v malém množství i v lidské žluči, tvoří její asi 4 % [3] (obr. 1). Žlučové kyseliny a oxysteroly jsou endogenními ligandy jaderných receptorů a některých membránových receptorů a podílejí se na regulaci metabolismu lipidů, sacharidů a na homeostáze [4]. Ursodeoxycholová kyselina je 7 epimer chenodeoxycholové kyseliny (CDCA), je hydrofilnější, a proto v takové míře nepoškozuje biomembrány. Další rozdíly spočívají v rozdílné schopnosti regulovat apoptózu, zánět, transport a metabolismus žlučových kyselin, na molekulární úrovni mechanismů působení je to pak odlišná schopnost vazby a ovlivnění jaderných i membránových receptorů.
Mechanismus účinku‚ farmakodynamika
Ursodeoxycholová kyselina vykazuje celé spektrum účinků a nahlížení na její působení se za poslední desetiletí radikálně změnilo. Je tu patrný posun ve vnímání UDCA jako pouhé hydrofilní žlučové kyseliny „nařeďující“ toxičtější žlučové kyseliny (ŽK) směrem k využití jejích imunoregulačních účinků a účinků na apoptózu, daných specifickým působením UDCA na jaderné a membránové receptory.
Změna hydrofilního indexu žluči
Při podávání UDCA dochází k relativnímu zvýšení zastoupení z původních přibližně 4 % až na 19–64 % z celkového obsahu ŽK [5]. Tímto způsobem se zvyšuje hydrofilita žluči vlivem „naředění“ primárních lipofilních a toxických ŽK (chenodeoxycholová kyselina [CDCA], cholová kyselina [CA], deoxycholová kyselina [DCA]). Uvedená změna přitom není provázena změnou v celkovém obsahu žlučových kyselin v séru.
Inhibice apoptózy a nekrózy![Obr. 2 Aktivace apoptózy žlučových kyselin a inhibice apoptózy ursodeoxycholové kyseliny (UDCA); podle [3] – Roma, et al., 2011 (se svolením autora). 1 – vnitřní cesta; 2 – zevní cesta; 3 – cesta stresu na úrovni endoplazmatického retikula; Akt – serin/threoninová kináza; APAF – apoptotic protease‑activating factor, transkripční faktor aktivující apoptózu; Bad, Bax, Bak, Bid – proapoptotické proteiny; Bcl – rodina proapoptotických proteinů; Ca – vápník; DISC – death inducing signaling complex, signalizační komplex spouštějící buněčnou smrt; EGFR – epidermal growth factor receptor, receptor pro epidermální růstový faktor; FADD – Fas‑associated protein with death domain, doména smrti asociovaná s proteinem FAS; MPTP – mitochondrial permeability transition pore, mitochondriální pór přechodné propustnosti; NADPH – nikotinamidadenindinukleotidfosfát; PI3K – fosfatidylinositol‑3‑kináza; ROS – reactive oxygen species, reaktivní kyslíkové radikály; TCF, SRT – transkripční faktory antiapoptotické dráhy ERK; TRAILR – proapoptotický membránový receptor pro ligand podobný TNF; UDCA – ursodeoxycholová kyselina](https://www.remedia.cz/photo-a-30914---.jpg)
Cytotoxické primární žlučové kyseliny indukují v závislosti na stupni cholestázy apoptózu a nekrózu. Žlučové kyseliny indukují apoptózu spouštěnou tzv. vnitřní mitochondriální cestou i zevní cestou [3]. Ursodeoxycholová kyselina inhibuje několika mechanismy zevní i vnitřní cestu spouštění apoptózy a tvorbu protoonkogenu Bcl 2 i přechodně propustných pórů v membráně mitochondrií (mitochondrial permeability transition pore, MPTP) (obr. 2).
Modulace exprese jaterních transportérů a enzymů zapojených do syntézy žlučových kyselin
Terapeutické účinky UDCA jsou mj. založeny na snížení obsahu nebo toxicity ŽK cestou inhibice jejich syntézy nebo stimulace jejich exkrece (obr. 3): a) inhibice transportu ŽK do hepatocytů (organic![Obr. 3 Zjednodušené schéma transportu žlučových kyselin hepatocyty; volně podle [3,10] – Roma, et al., 2011; Ferenci, et al., 2002. ABCB4 – gen rodiny ABC (ATP binding cassette), transkriptem je MDR3 (multidrug resistance protein 3); ASBT – apical sodium‑dependent bile acid transporter, apikální transportér pro žlučové kyseliny závislý na sodíku; BSEP – bile salt export pump; MRP – multidrug resistance‑associated protein, efl uxní transportní protein; Na – sodík; NTCP – Na/ taurocholate cotransporting polypeptide; membránový transportér pro sodík a taurocholovou kyselinu; OA – organický anion; OATP1B1 – organic anion transporting polypeptide 1B1; OC – organický kation; OST – organic solute transporter; Pgp – P‑glykoprotein, produkt genu MDR1 (multidrug resistance, též ABCB1); UDCA – ursodeoxycholová kyselina; ŽK – žlučová kyselina](https://www.remedia.cz/photo-a-30915---.jpg) anion transporting polypeptide 1, OATP1) [3,6]; b) up regulace efluxních transportérů MRP3 a MRP4 (multidrug resistance associated protein) na bazolaterální straně [7,8]; c) up regulace hepatocelulárních kanalikulárních transportérů BSEP (bile salt export pump) a MRP2 [3,6,9]; d) změna exprese transportérů v ledvinách (obr. 4) – UDCA zvyšuje expresi efluxních transportérů
anion transporting polypeptide 1, OATP1) [3,6]; b) up regulace efluxních transportérů MRP3 a MRP4 (multidrug resistance associated protein) na bazolaterální straně [7,8]; c) up regulace hepatocelulárních kanalikulárních transportérů BSEP (bile salt export pump) a MRP2 [3,6,9]; d) změna exprese transportérů v ledvinách (obr. 4) – UDCA zvyšuje expresi efluxních transportérů![Obr. 4 Transport žlučových kyselin v proximálním tubulu; volně podle [3,7] – Roma, et al., 2011; Zollner, et al., 2006. ASBT – apical sodium‑dependent bile acid transporter, apikální transportér pro žlučové kyseliny závislý na sodíku; BilD – konjugovaný bilirubin; MRP – multidrug resistance‑associated protein, efl uxní transportní protein; OAT3 – organic anion transporter 3; OST – organic solute transporter; UDCA – ursodeoxycholová kyselina; ŽK – žlučová kyselina](https://www.remedia.cz/photo-a-30916---.jpg) MRP2 a MRP4 a zároveň snižuje expresi ASBT (apical sodium dependent bile acid transporter); celkově tak dochází ke zvýšení koncentrace sérových ŽK a ke zvýšení renální exkrece ŽK [3,7]; e) inhibice syntézy ŽK, podpora jejich hydroxylace – UDCA snižuje expresi CYP7A1, tedy limitující krok v syntéze ŽK, a navíc zvyšuje expresi CYP3A11, CYP2B10 a CYP3A4 – enzymů katalyzujících hydroxylace primárních ŽK na hydrofilnější (méně toxické) ŽK [3,11].
MRP2 a MRP4 a zároveň snižuje expresi ASBT (apical sodium dependent bile acid transporter); celkově tak dochází ke zvýšení koncentrace sérových ŽK a ke zvýšení renální exkrece ŽK [3,7]; e) inhibice syntézy ŽK, podpora jejich hydroxylace – UDCA snižuje expresi CYP7A1, tedy limitující krok v syntéze ŽK, a navíc zvyšuje expresi CYP3A11, CYP2B10 a CYP3A4 – enzymů katalyzujících hydroxylace primárních ŽK na hydrofilnější (méně toxické) ŽK [3,11].
„Bikarbonátový deštník“ a zlepšení transportu žlučových kyselin v cholangiocytech
Ursodeoxycholová kyselina stimuluje sekreci bikarbonátu jednak zvýšením exprese, jednak také posttranskripční stimulací transportéru AE2 (anion exchanger 2). Bikarbonát, secernovaný do lumen žlučovodu, udržuje alkaličtější pH, což udržuje ŽK v deprotonované formě, která neprostupuje zpět z lumen do hepatocytu [12] (obr. 5).
Protizánětlivé a imunoregulační účinky ursodeoxycholové kyseliny
Cholestatická onemocnění, primární biliární cirhóza i primární sklerotizující cholangoitida, bývají označována za autoimunitní, kdy dochází k tvorbě antimitochondriálních protilátek (AMA) a autoprotilátek proti jaderným strukturám [15]. Obě onemocnění jsou také dávána ![Obr. 5 Ursodeoxycholová kyselina a ovlivnění sekrece bikarbonátu; volně podle [3,13,14] – Roma, et al., 2011; Beuers, et al., 2010; Jones, et al., 2015. ADP – adenosindifosfát; AE2 – anion exchanger 2, transportér aniontů; ALP – alkalická fosfatáza (pod stimulací HCO3 katalyzuje štěpení ATP); AMP – adenosinmonofosfát; ATP – adenosintrifosfát; CFTR – chloridový kanál (cystic fi brosis transmembrane conductance regulator); GR – glukokortikoidní receptor; PKC – proteinkináza C; P2YR – purinergní receptor P2Y](https://www.remedia.cz/photo-a-30917---.jpg) do souvislosti s přítomností mutací v genech antigenů HLA B8, DR3, DR4, které jsou ovšem nespecificky spojovány i s řadou jiných autoimunitních chorob [15]. Ursodeoxycholová kyselina má imunomodulační účinky jednak na úrovni exprese antigenů hlavního histokompatibilního komplexu (major histocompatibility complex, MHC) („imunosupresivní účinek“) a adhezních molekul ICAM 1 a LFA 1 (intercellular adhesion molecule 1, lymphocyte function-associated antigen 1), jednak také snižuje produkci prozánětlivých cytokinů TGFβ1, TNFα [16] a Fas ligandu [17], uvolňování cytokinů IL 2, IL 4 a IFNγ mononukleáry a rovněž zánětlivého proteinu makrofágů (macrophage inflammatory protein, MIP) [18]. Tyto prozánětlivé cytokiny se podílejí na apoptóze cholangiocytů i hepatocytů nejen u cholestatických onemocnění, ale i u polékového poškození jater, hepatitidy a alkoholické i nealkoholické steatohepatitidy [3]. Protizánětlivé účinky UDCA mohou být též spouštěny aktivací receptoru pro vitamin D
do souvislosti s přítomností mutací v genech antigenů HLA B8, DR3, DR4, které jsou ovšem nespecificky spojovány i s řadou jiných autoimunitních chorob [15]. Ursodeoxycholová kyselina má imunomodulační účinky jednak na úrovni exprese antigenů hlavního histokompatibilního komplexu (major histocompatibility complex, MHC) („imunosupresivní účinek“) a adhezních molekul ICAM 1 a LFA 1 (intercellular adhesion molecule 1, lymphocyte function-associated antigen 1), jednak také snižuje produkci prozánětlivých cytokinů TGFβ1, TNFα [16] a Fas ligandu [17], uvolňování cytokinů IL 2, IL 4 a IFNγ mononukleáry a rovněž zánětlivého proteinu makrofágů (macrophage inflammatory protein, MIP) [18]. Tyto prozánětlivé cytokiny se podílejí na apoptóze cholangiocytů i hepatocytů nejen u cholestatických onemocnění, ale i u polékového poškození jater, hepatitidy a alkoholické i nealkoholické steatohepatitidy [3]. Protizánětlivé účinky UDCA mohou být též spouštěny aktivací receptoru pro vitamin D
v cholangiocytech [18].
Farmakokinetické vlastnosti
Po podání UDCA per os je biologická dostupnost přibližně 90 % [19] při hodnotě tmax (čas dosažení maximální plazmatické koncentrace) v rozmezí 30–50 minut [1,20], poté podléhá účinku prvního průchodu játry (cca 50 %). Množství UDCA extrahované játry s mírou poškození jater klesá, a tak mají pacienti s cholestatickým onemocněním jater vyšší koncentrace UDCA v séru a nižší koncentrace ve žluči [1,19]. Přesto při doporučeném dávkování tvoří UDCA zhruba 30–50 % obsahu žluči [19]. Nekonjugovaná UDCA se váže asi ze 70 % na proteiny plazmy [19]. Eliminace probíhá převážně cestou konjugace s glycinem a taurinem a podléhá enterohepatální cirkulaci [1]. Působením střevních bakterií dochází k 7 dehydroxylaci na kyselinu litocholovou. Ursodeoxycholová kyselina je vylučována převážně stolicí; i zde dochází u pacientů ke snížené exkreci a k vylučování játry a žlučí do stolice, proto se u nemocných s cholestatickým poškozením jater zvýšeně vylučuje UDCA močí [1,21]. Eliminační poločas je z důvodu účinné recirkulace poměrně dlouhý – 4–6 dní [19].
Klinické zkušenosti
Ursodeoxycholová kyselina je v současnosti jediným léčivem schváleným americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) pro terapii primární biliární cirhózy [3]. Evropská asociace pro studium jater (European Association for the Study of the Liver, EASL) doporučuje UDCA v léčbě primární biliární cirhózy v dávce 13–15 mg/kg jako dlouhodobou terapii první volby [19]. Včasná léčba poskytuje lepší prognózu a léčebný výsledek [15]. Látka prodlužuje dobu progrese onemocnění do finálního stadia (jaterní transplantace), prodlužuje přežití a je dobře tolerována [15], zlepšuje i sekundární léčebné cíle ve většině studií, její účinek je výraznější u pacientů v počátečních stadiích onemocnění (nižší koncentrace bilirubinu, GGT, AST). Terapie UDCA snižuje hodnoty sérových transferáz (ALT, AST), gamaglutamyltranspeptidázy (GGT), bilirubinu a alkalické fosfatázy (ALP) [15].
Oproti primární biliární cirhóze nejsou pro prospěšnost UDCA v indikaci primární sklerotizující cholangoitidy tak silné důkazy na základě EBM. Přesto se UDCA v této indikaci podává, protože zlepšuje biochemické parametry onemocnění a zmírňuje jeho zánětlivou složku. Celkové přežití, jaterní histologii ani čas do transplantace však UDCA podávaná v množství 10–15 mg/kg/den nejspíše neovlivňuje [15,22] – příčinou může být její nízká dávka v dosud provedených studiích.
Při disoluci nekalcifikovaných žlučových kamenů ≤ 20 mm (≤ 15 mm dle SPC) [23] se UDCA uplatňuje tam, kde je kontraindikován chirurgický přístup. Podmínkou úspěšnosti léčby je funkční žlučník a přítomnost čistých radiotransparentních cholesterolových kamenů. Ursodeoxycholová kyselina ve výsledku zvyšuje saturační index pro cholesterol [24,25]. Úspěšnost léčby v této indikaci dosahuje 40–90 %, v závislosti na typu kamenů, na dávce UDCA, na délce léčby a na compliance pacienta [24]. Dle doporučení EASL podání UDCA předchází vzniku cholesterolových žlučových kamenů u obézních pacientů po bariatrické operaci nebo u pacientů podstupujících redukční dietu; navíc je tato forma prevence ekonomicky výhodná [24]. Léčba UDCA může být zvážena jako prevence žlučových kamenů při léčbě somatostatinem nebo jeho analogy [23].
Zařazení do současné palety léčiv
V terapii primární biliární cirhózy i rozpouštění žlučových kamenů je UDCA léčivem první volby, v ostatních indikacích je spíše doplňkovou léčbou nebo léčivem druhé volby v případě neúčinnosti jiných léčiv. Bezpečnost UDCA je ve srovnání s ostatními alternativami léčby primární sklerotizující cholangoitidy nebo hepatitidy s cholestázou velmi dobrá, stejně jako u off label indikací.
Indikace
Schválenými indikacemi použití UDCA v České republice jsou disoluce nekalcifikovaných žlučových kamenů, primární biliární cirhóza I. a II. stadia (PBC), primární sklerotizující cholangoitida (PSC), hepatitida různé etiologie s cholestatickým syndromem, reaktivní gastritida při duodenogastrickém refluxu a poruchy jater a žlučových cest u cystické fibrózy u dětí ve věku od 6 do 18 let [23].
Kontraindikace
Mezi kontraindikace UDCA patří hypersenzitivita, intolerance UDCA nebo obecně žlučových kyselin, akutní zánět žlučníku a žlučových cest, obstrukce vývodných žlučových cest (ductus choledochus, ductus cysticus), rentgenologicky nekontrastní žlučník, kalcifikované žlučové konkrementy, porušená kontraktilita žlučníku, časté biliární koliky, pokročilé stadium primární biliární cirhózy – vzhledem k možnosti nedostatečného terapeutického účinku – a závažné poruchy ledvinných a jaterních funkcí [19,23].
Nežádoucí účinky a toxicita
Bezpečnost UDCA se v terapeutickém dávkování (do 25 mg/kg/den) jeví jako velmi dobrá a v klinických studiích se neobjevují případy závažných nežádoucích účinků, nebo jsou vzácné.
Ursodeoxycholová kyselina je považována za hepatoprotektivní látku, na rozdíl od hepatotoxické CDCA, která byla používána v minulosti. Nejčastějším nežádoucím účinkem je řidší stolice, u pacientů se žlučovými kameny se vyskytovala s frekvencí 2–9 % [1,26]. Tento nežádoucí účinek mnohdy záhy spontánně ustupuje. Mezi další nežádoucí účinky patří nauzea, flatulence a bolest v pravém nadbřišku. Vzestup aktivity transamináz po podání UDCA je nevýznamný. Vzácně byly hlášeny případy kalcifikace žlučových kamenů, dekompenzace jaterní cirhózy, nicméně kauzalita není jasná [1].
V preklinickém pokusu UDCA v dietě stimulovala proliferaci hepatocytů a růst nádorů u transgenních myší s genem HBV, nicméně přímé důkazy o mutagenním nebo kancerogenním účinku UDCA u lidí nejsou známy. U pacientů s primární sklerotizující cholangoitidou a současně s ulcerózní kolitidou, kteří jsou ohroženi obecně vyšším rizikem rozvoje karcinomu tlustého střeva, může naopak UDCA – zvláště v nižší dávce – snížit riziko vzniku neoplazie, dysplazie nebo nádoru [1,27].
Lékové interakce
Ursodeoxycholová kyselina ovlivňuje expresi hlavních biotransformačních enzymů – cytochromů P450. V zásadě se jedná o indukční vliv na enzymy podrodiny CYP3A [28]. Především indukcí CYP3A4 jsou vysvětlovány interakce se substráty CYP3A4, kdy podáním UDCA jsou jejich koncentrace v plazmě sníženy [29,30], ovšem děje se tak pravděpodobně spíše na úrovni střevního CYP3A4 a P glykoproteinu (prostřednictvím aktivace jaderných receptorů PXR) než na úrovni jaterních enzymů [11]. Byla publikována i práce dokumentující snížení dávky cyklosporinu A při kombinaci s UDCA; plocha pod křivkou koncentrace léčiva v krvi (area under curve, AUC) se údajně zvýšila 2× [31].
Řada léčiv může naopak snížit biologickou dostupnost UDCA – jedná se především o antacida obsahující hydroxid hlinitý, popř. diosmektit, a proto se mají podávat s dostatečným časovým odstupem. Vcelku logická a očekávatelná je i interakce s hypolipidemiky (cholestyramin, colestipol) [1]; fibráty by teoreticky mohly snižovat účinek UDCA [19], nicméně některé studie naopak hovoří o potenciaci účinku fibráty jakožto agonisty jaderných receptorů PPARα (peroxisome proliferator activated receptor alpha) [32–34]. Estrogeny a estrogenní kontraceptiva mohou rovněž zapříčinit pokles účinnosti UDCA svým vlivem na zvýšení sekrece cholesterolu [19].
Těhotenství a kojení
Ursodeoxycholová kyselina se off label používá v terapii intrahepatální cholestázy u těhotných, nicméně pouze ve II. a III. trimestru gravidity po pečlivém zvážení rizika pro plod. Podání UDCA v této indikaci je při dodržení dávkování 10–20 mg/kg bezpečné [1,23,35]. Z pohledu embryotoxicity je klasifikována stupněm B. Látku se nedoporučuje užívat během kojení, nicméně plazmatické koncentrace jsou poměrně nízké a v mateřském mléce nebyla UDCA detekována [1,36]. Data o reprodukční toxicitě nejsou známa.
Ovlivnění pozornosti
Ursodeoxycholová kyselina neovlivňuje pozornost ani schopnost řídit motorová vozidla.
Dávkování
Při rozpouštění cholesterolových žlučových kamenů u dospělých je doporučená dávka 10 mg/kg/den. Celá dávka má být podána najednou, večer před spaním. V případě primární biliární cirhózy I. a II. stadia a jiných stavů spojených s intrahepatální cholestázou se podává 10–15 mg/kg/den rozdělených do 2–3 dávek. V indikaci reaktivní gastritida při duodenogastrickém refluxu je doporučená dávka 250 mg večer před spaním. Doporučená délka léčby je 10–14 dní.Dávkování u dětí ve věku od 2 let je individuální, obvyklá dávka je 10–20 mg/kg/den. Pro děti s cystickou fibrózou ve věku od 6 do 18 let je doporučeno podání 20 mg/kg denně rozdělených do 2–3 dávek, s následným zvýšením dávky na 30 mg/kg/den, pokud je to nezbytné.
Závěr
Ursodeoxycholová kyselina je minoritní žlučová kyselina používaná v klinické praxi již několik dekád. V poslední době dochází k posunu jejího vnímání. Tento posun je zčásti zapříčiněn novými objevy na poli jejích mechanismů účinku na molekulární úrovni, a její chápání se tak posouvá od pouhé hydrofilní „nařeďující“ žlučové kyseliny k zajímavé imunomodulační látce a vpravdě signální molekule ovlivňující mnohé jaderné receptory. Evidence její účinnosti u řady cholestatických onemocnění a při rozpouštění žlučových kamenů je vcelku přesvědčivá. Zajímavé jsou závěry studií zaměřených na možné protektivní působení UDCA u poškození jater (ať už polékového, při hepatitidě nebo jiného) a také závěry (pilotních) studií dokládající chemopreventivní působení i protektivní účinek před venookluzivním poškozením po transplantaci krvetvorných buněk. Čas a dobře uspořádané randomizované klinické studie ukáží, zda UDCA tato očekávání naplní.
Tento článek vznikl za podpory projektu „Experimentální farmakologický vývoj v neuropsychiatrii a onkologii“ MUNI/A/1284/2015 financovaného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2016.
Seznam použité literatury
- [1] Hempfling W, Dilger K, Beuers U. Ursodeoxycholic acid – adverse effects and drug interactions. Aliment Pharmacol Ther 2003; 18: 963–972.
- [2] Beuers U, Trauner M, Jansen P, Poupon R. New paradigms in the treatment of hepatic cholestasis: From UDCA to FXR, PXR and beyond. J Hepatol 2015; 62 (1 Suppl): S25–S37.
- [3] Roma M, Toledo F, Boaglio A, et al. Ursodeoxycholic acid in cholestasis: linking action mechanisms to therapeutic applications. Clin Sci 2011; 121: 523–544.
- [4] Chiang JY. Bile acids: regulation of synthesis. J Lipid Res 2009; 50: 1955–1966.
- [5] Lazaridis KN, Gores GJ, Lindor KD. Ursodeoxycholic acid mechanisms of action and clinical use in hepatobiliary disorders. J Hepatol 2001; 35: 134–146.
- [6] Fickert P, Zollner G, Fuchsbichler A, et al. Effects of ursodeoxycholic and cholic acid feeding on hepatocellular transporter expression in mouse liver. Gastroenterology 2001; 121: 170–183.
- [7] Zollner G, Wagner M, Moustafa T, et al. Coordinated induction of bile acid detoxification and alternative elimination in mice: role of FXR‑regulated organic solute transporter‑alpha/beta in the adaptive response to bile acids. Am J Physiol Gastrointest Liver Physiol 2006; 290(5): G923–932.
- [8] Zollner G, Wagner M, Trauner M. Nuclear receptors as drug targets in cholestasis and drug‑induced hepatotoxicity. Pharmacol Ther 2010; 126: 228–243.
- [9] Micheline D, Emmanuel J, Serge E. Effect of ursodeoxycholic acid on the expression of the hepatocellular bile acid transporters (Ntcp and bsep) in rats with estrogen‑induced cholestasis. J Pediatr Gastroenterol Nutr 2002; 35: 185–191.
- [10] Ferenci P, Zollner G, Trauner M. Hepatic transport systems. J Gastroenterol Hepatol 2002; 17 (Suppl): S105–S112.
- [11] Schuetz E, Strom S, Yasuda K, et al. Disrupted bile acid homeostasis reveals an unexpected interaction among nuclear hormone receptors, transporters, and cytochrome p450. J Biol Chem 2001; 276: 39411–39418.
- [12] Concepcion AR, Lopez M, Ardura‑Fabregat A, Medina JF. Role of AE2 for pH(i) regulation in biliary epithelial cells. Front Physiol 2014: 4: 413. doi: 10.3389/fphys.2013.00413
- [13] Beuers U, Hohenester S, de Buy Wenniger LJ. The binary HCO3‑umbrella: A unifying hypothesis on pathogenetic and therapeutic aspects of fibrosing cholangiopathies. Hepatology 2010; 52: 1489–1496.
- [14] Jones H, Alpini G, Francis H. Bile acid signaling and biliary functions. Acta Pharm Sin B 2015; 5: 123–128.
- [15] ČHs: PBC a PSC – Doporučený postup ČHS JEP. In Guideline edn; 2010: 1–19.
- [16] Buryova H, Chalupsky K, Zbodakova O, et al. Liver protective effect of ursodeoxycholic acid includes regulation of ADAM17 activity. BMC Gastroenterol 2013: 13: 155. doi: 10.1186/1471‑230X‑13‑155
- [17] Azzaroli F, Mehal W, Soroka CJ, et al. Ursodeoxycholic acid diminishes Fas‑ligand‑induced apoptosis in mouse hepatocytes. Hepatology 2002; 36: 49–54.
- [18] Poupon R. Ursodeoxycholic acid and bile‑acid mimetics as therapeutic agents for cholestatic liver diseases: An overview of their mechanisms of action. Clin Res Hepatol Gastroenterol 2012; 36 (Suppl 1): S3–S12.
- [19] Dynamed: Codeine. In Edited by American Society of Health System Pharmacists EIS, 2016 Feb 182016 Feb 23 edn: EBSCO; 2016.
- [20] Crosignani A, Setchell K, Invernizzi P, et al. Clinical pharmacokinetics of therapeutic bile acids. Clin Pharmacokinet 1996; 30: 333–358.
- [21] Stiehl A, Rudolph G, Sauer P, Theilmann L. Biliary‑secretion of bile‑acids and lipids in primary sclerosing cholangitis – influence of cholestasis and effest of ursodeoxycholic acid treatment. J Hepatol 1995; 23: 283–289.
- [22] European Assoc Study L. EASL Clinical Practice Guidelines: Management of cholestatic liver diseases. J Hepatol 2009; 51: 237–267.
- [23] SÚKL: SmPC: Ursosan. In Edited by léčiv Súpk; 2016: 1–6.
- [24] Nunes D. Dissolution therapy for the treatment of gallstones. In Edited by Chopra S: Wolters Kluwer; 2016: 1–9.
- [25] Guarino M, Cocca S, Altomare A, et al. Ursodeoxycholic acid therapy in gallbladder disease, a story not yet completed. World J Gastroenterol 2013; 19: 5029–5034.
- [26] Sackmann M, Pauletzki J, Aydemir U, et al. Efficacy and safety of ursodeoxycholic acid for dissolution of gallstone fragments – comparison with the combination of ursodeoxycholic acid and chenodeoxycholic acid. Hepatology 1991; 14: 1136–1141.
- [27] Singh S, Khanna S, Pardi D, et al. Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta‑analysis. Inflamm Bowel Dis 2013; 19: 1631–1638.
- [28] Schuetz JD, Beach DL, Guzelian PS. Selective expression of cytochrome P450 CYP3A mRNAs in embryonic and adult human liver. Pharmacogenetics 1994; 4: 11–20.
- [29] Becquemont L, Glaeser H, Drescher S, et al. Effects of ursodeoxycholic acid on P‑glycoprotein and cytochrome P450 3A4‑dependent pharmacokinetics in humans. Clin Pharmacol Ther 2006; 79: 449–460.
- [30] Uchida S, Tanaka S, Namiki N. Simultaneous and comprehensive in vivo analysis of cytochrome P450 activity by using a cocktail approach in rats. Biopharm Drug Dispos 2014; 35: 228–236.
- [31] Gutzler F, Zimmermann R, Ring G, et al. Ursodeoxycholic acid enhances the absorption of cyclosporine in a heart‑transplant patient with short bowel syndrome. Transplant Proc 1992; 24: 2620–2621.
- [32] Iwasaki S, Ohira H, Nishiguchi S, et al. The efficacy of ursodeoxycholic acid and bezafibrate combination therapy for primary biliary cirrhosis: A prospective, multicenter study. Hepatol Res 2008; 38: 557–564.
- [33] Zhu G, Huang S, Huang G, et al. Optimal drug regimens for primary biliary cirrhosis: a systematic review and network meta‑analysis. Oncotarget 2015; 6: 24533–24549.
- [34] Kanda T, Yokosuka O, Imazeki F, Saisho H. Bezafibrate treatment: a new medical approach for PBC patients? J Gastroenterol 2003; 38: 573–578.
- [35] Gabzdyl E, Schlaeger J. Intrahepatic cholestasis of pregnancy: a critical clinical review. J Perinat Neonatal Nurs 2015; 29: 41–50.
- [36] Rudi J, Schonig T, Stremmel W. Therapy with ursodeoxycholic acid in primary biliary cirrhosis during pregnancy. Z Gastroenterol 1996; 34: 188–191.