Léčba niraparibem prodloužila přežití bez progrese – studie PRIME
Klinická studie fáze III PRIME prokázala prodloužení doby přežití bez progrese u pacientek s nově diagnostikovaným karcinomem ovaria, které byly léčeny individualizovanou počáteční dávkou niraparibu v rámci udržovací terapie v porovnání s placebovou skupinou. Výsledky studie podpořily monoterapii niraparibem v udržovací léčbě po prvoliniové chemoterapii na bázi platiny bez ohledu na status biomarkerů.
Klinická
studie fáze III PRIME prokázala prodloužení doby přežití bez
progrese u pacientek s nově diagnostikovaným karcinomem
ovaria, které byly léčeny individualizovanou počáteční dávkou
niraparibu v rámci udržovací terapie v porovnání
s placebovou skupinou. Výsledky studie podpořily monoterapii
niraparibem v udržovací léčbě
po prvoliniové chemoterapii na bázi platiny bez ohledu
na status biomarkerů.
Uspořádání studie a charakteristika pacientů
Do randomizované, dvojitě
zaslepené, placebem kontrolované studie fáze III PRIME bylo
randomizováno celkem 384 pacientek v poměru 2 : 1
k podávání niraparibu (n = 255), nebo placeba
(n = 129) po dobu 36 měsíců nebo do progrese
onemocnění, úmrtí či nepřijatelné toxicity [1]. Pacientkami
vhodnými pro léčbu byly ženy s karcinomem ovaria stadia III
nebo IV podle kritérií FIGO (International Federation of
Gynecology and Obstetrics), s high grade serózním nebo
endometroidním epiteliálním ovariálním karcinomem, s předchozí
primární nebo intervalovou cytoredukční operací bez ohledu
na status pooperační reziduální choroby a s kompletní
nebo částečnou odpovědí na prvoliniovou chemoterapii
na bázi platiny.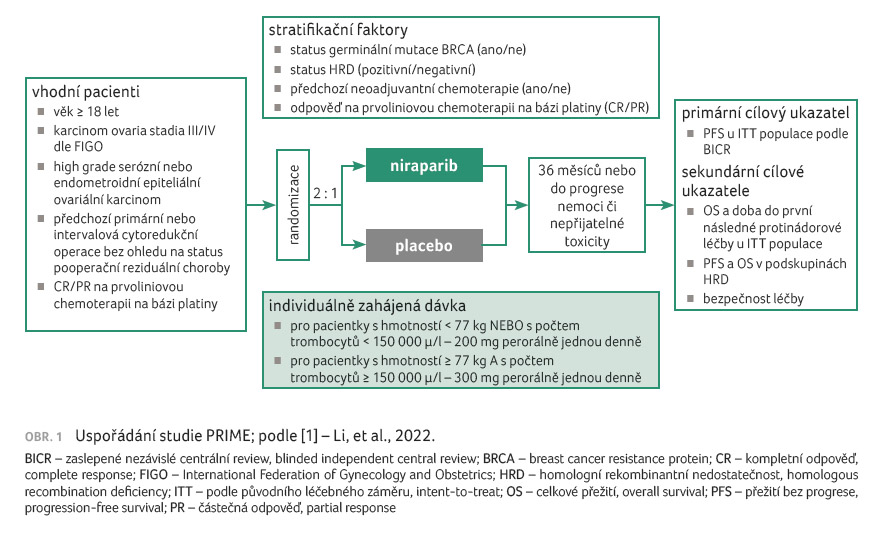
Stratifikační faktory zahrnovaly přítomnost/nepřítomnost germinální mutace BRCA, přítomnost/nepřítomnost poruchy homologní rekombinace (homologous recombination deficiency, HRD), předchozí neoadjuvantní chemoterapii nebo její absenci a částečnou či kompletní odpověď na prvoliniovou chemoterapii na bázi platiny. Primárním cílem bylo přežití bez progrese (progression free survival, PFS) hodnocené pomocí zaslepeného nezávislého centrálního hodnocení (blinded independent central review, BICR) u ITT populace (populace podle původního léčebného záměru, intent to treat). Klíčovými sekundárními cíli byly celkové přežití (overall survival, OS), doba do první následné protinádorové léčby u ITT skupiny, PFS a OS v podskupině s HRD a bezpečnost léčby (obr. 1).
V době tzv. cut off (rozhodovací mez) bylo v niraparibové skupině stále léčeno 102 pacientek, v placebové skupině 29 osob. Medián follow up v době analýzy byl 27,5 měsíce.
U pacientek zahrnutých do studie
byl medián věku 53,0 let ve skupině s niraparibem
oproti 54,0 let ve skupině s placebem, medián tělesné
hmotnosti 59 kg u osob léčených niraparibem oproti 57 kg
u osob s placebem. Onemocnění stadia III dle FIGO
mělo ve skupině s niraparibem 71,4 % pacientek
oproti 72,9 % pacientek ve skupině s placebem,
onemocnění stadia IV dle FIGO mělo ve skupině s niraparibem
28,6 % pacientek, ve skupině s placebem
27,1 % pacientek (tab. 1).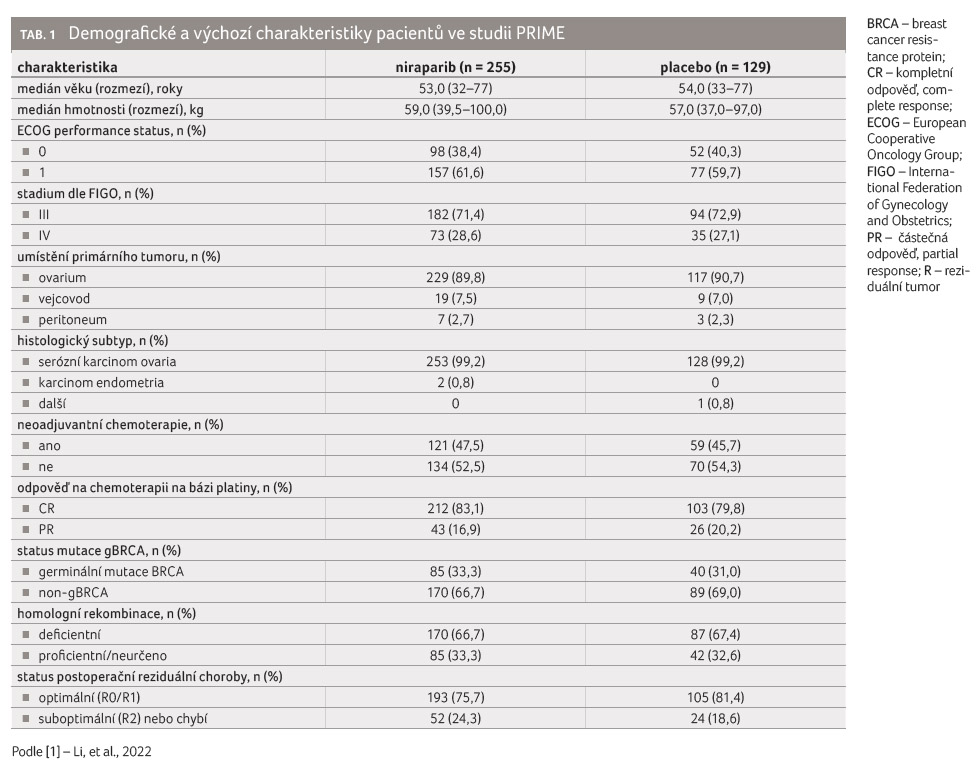
Kompletní odpověď (complete response, CR) na předchozí chemoterapii na bázi platiny byla zaznamenána u 83,1 % pacientek léčených niraparibem a u 79,8 % pacientek léčených chemoterapií. Částečná odpověď na předchozí chemoterapii platinou (partial response, PR) byla 16,9 % v niraparibové skupině a 20,2 % pro placebo. Celkem 33,3 % pacientek v niraparibové skupině a 31,0 % v placebové skupině mělo germinální mutaci BRCA. BRCA status bez germinálních mutací (non gBRCA) byl zjištěn u 66,7 % osob léčených niraparibem a u 69,0 % osob s placebem.
Výsledky sledování
Medián doby PFS činil ve studii
PRIME u ITT populace 24,8 měsíce – poměr rizik (HR)
0,45; 95% interval spolehlivosti (CI) 19,2–neodhadnuto (NE) – pro
niraparib a 8,3 měsíce (95% CI 7,3–11,1) pro placebo
(HR 0,45; 95% CI 0,34–0,60; p < 0,001), graf 1.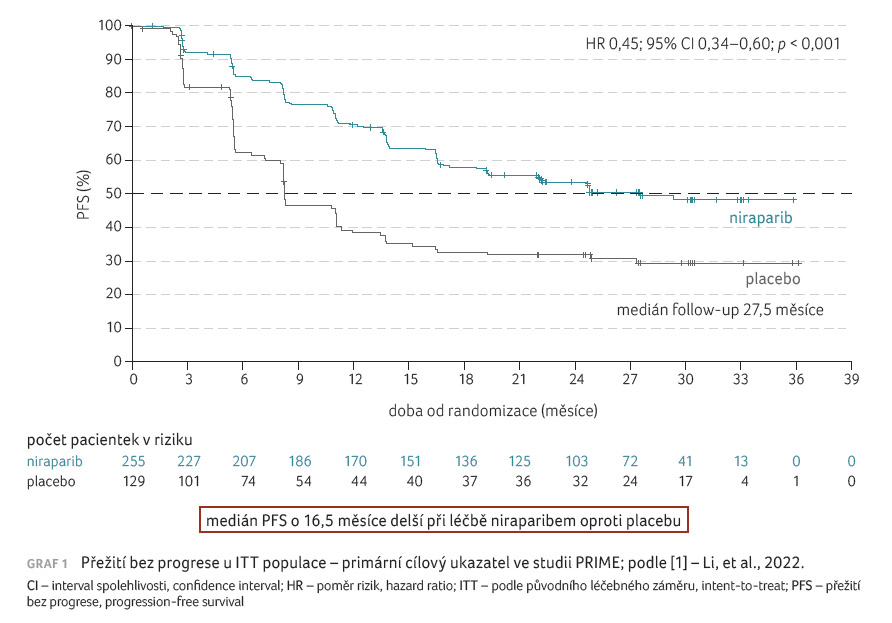
V podskupině pacientek s HRD nebylo zatím mediánu PFS dosaženo ve větvi s niraparibem (95% CI 22,3–NE). Medián PFS u placebového ramene byl 11 měsíců (95% CI 8,3–13,88 – HR 0,48; 95% CI 0,34–0,68; p < 0,001).
U pacientek s germinální mutací genu BRCA nebylo mediánu PFS v niraparibové skupině zatím dosaženo (95% CI 22,3–NE) oproti mediánu PFS 10,8 měsíce (95% CI 8,3–19,3) v placebové skupině (HR 0,40; 95% CI 0,23–0,68; p < 0,001).
V případě pacientek non-gBRCA
byl zaznamenán medián PFS 19,3 měsíce (95% CI 13,8–NE) oproti
8,3 měsíce (95% CI 5,6–11,2) v niraparibové, resp.
placebové skupině (HR 0,48; 95% CI 0,34–0,67; p < 0,001),
graf 2.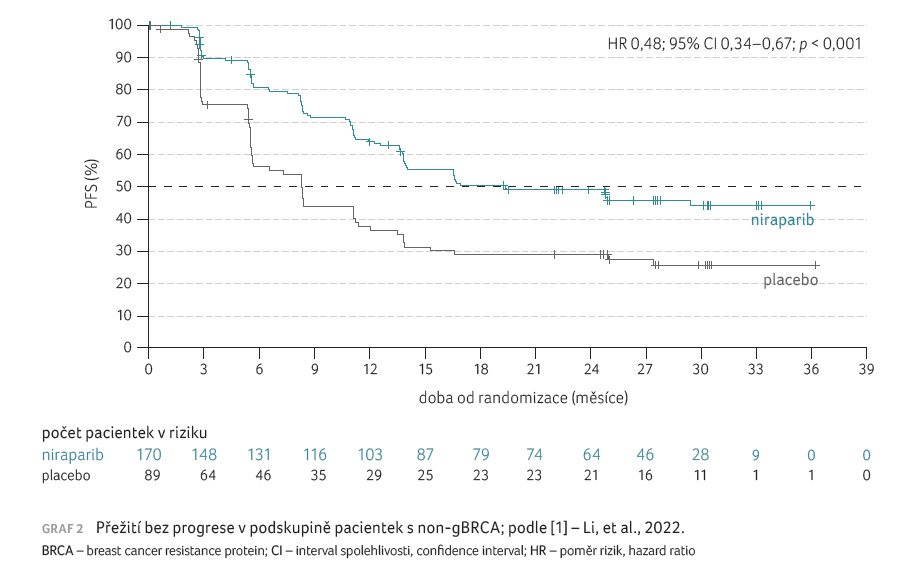
V podskupině s non gBRCA u HRD pacientek byl medián PFS 24,8 měsíce (95% CI 14,0–NE) versus 11,1 měsíce (95% CI 8,3–13,8) v niraparibové, resp. placebové skupině (HR 0,58; 95% CI 0,36–0,93; p = 0,022).
U pacientek s non-gBRCA bez deficitu homologní rekombinace byl medián PFS 14,0 měsíce (95% CI 11,9–NE) oproti 5,5 měsíce (95% CI 2,9–7,3) v niraparibové, resp. placebové skupině (HR 0,41; 95% CI 0,25–0,65; p < 0,001).
Ve 24 měsících bylo v ITT skupině 52,6 % pacientek léčených niraparibem stále bez progrese onemocnění. V HRD podskupině bylo po 24 měsících stále bez progrese nebo úmrtí 57,4 % osob léčených niraparibem. Data OS jsou zatím nezralá (OS pro ITT: HR 0,63; 95% CI 0,38–1,03; p = 0,061), je však viditelný trend ve prospěch niraparibu. Medián doby do první následné protinádorové léčby byl 29,2 měsíce (95% CI 22,4–NE) u pacientek léčených niraparibem a 11,9 měsíce (95% CI 8,8–14,8) pro placebo.
Bezpečnost terapie
Nežádoucí účinky vyplývající z léčby stupně 3 a vyššího, které se objevily u více než 20 % pacientek v niraparibové i placebové kohortě, zahrnovaly neutropenii (17,3 % vs. 1,6 %), leukopenii (6,7 % vs. 0,8 %), anémii (18,0 % vs. 1,6 %), trombocytopenii (14,1 % vs. 0,8 %) a zvýšenou aktivitu glutamyltransferázy (5,1 % vs. 2,3 %).
Nežádoucí účinky vyplývající z léčby, které vedly k dočasnému přerušení terapie niraparibem, byly zaznamenány u 62,7 % pacientek, ke snížení dávky niraparibu došlo u 40 % pacientek.
Míra trvalého ukončení léčby niraparibem kvůli nežádoucím účinkům byla nízká (6,7 % u niraparibu ve srovnání s 5,4 % u placeba). red
Komentář: Léčba niraparibem
prodloužila přežití bez progrese – studie PRIME
MUDr. Dagmar Brančíková, Ph.D.
Interní hematologická a onkologická klinika FN Brno
Dvojitě zaslepená randomizovaná studie fáze III PRIME potvrdila data z předchozích studií ohledně účinnosti niraparibu u pacientek s nádorem ovaria ve stadiu III a IV úspěšně předléčených platinovým režimem (s efektem parciální nebo kompletní remise) a ohledně výhodnosti individualizovaného dávkování niraparibu a jeho vlivu na toxicitu léčby.
Studie prospektivně sledovala účinnost a bezpečnost udržovací léčby niraparibem s individualizovanou počáteční dávkou u pacientek s nově diagnostikovaným ovariálním karcinomem (histologicky high grade serózním či endometroidním epiteliálním karcinomem vaječníku, vejcovodu nebo primárně peritoneálním karcinomem), které odpovídaly na první linii platinové chemoterapie nezávisle na stavu biomarkerů a nezávisle na přítomnosti rezidua po chirurgickém zákroku. Do sledování byly zařazeny nejen pacientky s reziduem, ale i pacientky ve stadiu III bez viditelného rezidua po primárním debulkingu, což rozšířilo spektrum nemocných vhodných k léčbě. V celém souboru byl prokázán o 16,5 měsíce delší medián přežití bez progrese (progression free survival, PFS) pro niraparib v porovnání s placebem (poměr rizik [HR] 0,45; 95% interval spolehlivosti [CI] 0,34–0,60; p < 0,001).
Ve studii PRIME pacientka, která vážila méně než 77 kg anebo měla méně než 150 000/µl trombocytů, začínala dávkou 200 mg, ostatní nemocné dávkou niraparibu 300 mg 1× denně. Klinické hodnocení potvrdilo výhodu podání individualizované počáteční dávky, a to nízkým podílem trvalého vysazení léčby – 6,7 %. Frekvence trvalého vysazení léčby kvůli nežádoucím účinkům byla srovnatelná s placebem – 5,4 %.
Pro udržovací léčbu v první linii vysoce rizikového ovariálního karcinomu s uvedenou histologií je niraparib dle výsledků této studie velmi dobrou volbou, a to i v případě, kdy nemáme k dispozici výsledek testu mutace BRCA (nebo je tento negativní) a ani výsledek homologní rekombinace, neboť niraparib je vhodný jak pro pacientky s mutací BRCA, tak pro pacientky bez této mutace a lze jej podat také nezávisle na stavu homologní rekombinace. Prakticky žádná z analyzovaných podskupin neprokázala jiný než významný přínos niraparibu pro PFS. Toxicita léčby je předvídatelná, závažné příhody se objevily ve skupině léčené niraparibem ve 14,8 %, nejčastěji v podobě neutropenie, anémie a trombocytopenie. Tyto nežádoucí účinky byly spjaty s úmrtím ve 0,4 %, takže léčbu lze považovat za relativně bezpečnou a pro uvedenou skupinu pacientek vhodnou. I když na výsledky v celkovém přežití ještě budeme muset nějakou dobu počkat, nemáme kromě skupiny pacientek s potvrzeným deficitem homologní rekombinace definovaným buď mutací BRCA1, BRCA2, a/nebo genomovou nestabilitou jinou vhodnou léčebnou alternativu. Niraparib lze podat pacientkám jak s deficitem, tak bez deficitu homologní rekombinace.
Seznam použité literatury
- [1] Li N, Zhu J, Yin R, et al. Efficacy and safety of niraparib as maintenance treatment in patients with newly diagnosed advanced ovarian cancer using an individualized starting dose (PRIME Study): a randomized, double‑blind, placebo‑controlled, phase 3 trial. Presented at: 2022 SGO Annual Meeting on Women’s Cancer; March 18–21, 2022; Phoenix, Arizona.