Masterclass RS
Edukační webinář Masterclass RS pořádaný společností Teva se konal ve druhé polovině dubna 2023. Primářka Marta Vachová přednesla z praktického pohledu neurologa prezentaci o vlivu glatiramer acetátu na B lymfocyty. Profesor Jan Krejsek upozornil na zajímavý a často opomíjený mechanismus působení glatiramer acetátu na B lymfocyty i na jeho vliv na remyelinizaci. Velmi přínosnému a praktickému tématu infekcí u imunokompromitovaných pacientů se ve svém příspěvku věnovala primářka Hana Roháčová. Moderátorem webináře byl profesor MUDr. Jan Mareš, Ph.D., MBA, (Neurologická klinika LF UP a FN Olomouc).
Role B buněk v procesu neurodegenerace u roztroušené sklerózy a jejich možné ovlivnění
Primářka MUDr. Marta Vachová (Neurologické oddělení s RS centrem Nemocnice Teplice) představila význam B lymfocytů v rozvoji autoimunitního zánětu CNS z pohledu neuroložky. Historicky byl kladen důraz na T lymfocyty při rozvoji roztroušené sklerózy (RS), přestože oligoklonální pásy, jejichž podkladem jsou imunoglobuliny produkované plazmatickými buňkami, patří k diagnostickým průkazům RS (diseminace v čase). Autoreaktivní B lymfocyty jsou přítomny v periferní krvi již v časných fázích RS a perzistence B lymfocytárních folikulů je charakteristická pro sekundárně progresivní formu RS (SP‑RS). Význam B lymfocytů u tohoto onemocnění byl prokázán v klinických studiích ověřujících léčivé přípravky s anti‑B lymfocytárními účinky [1].
B lymfocyty produkují autoprotilátky proti nervové tkáni pomocí mediace Toll‑like receptorem, a to bez přítomnosti T lymfocytů, čímž se podílejí na aktivaci komplementu. Astrocyty produkují B lymfocyty aktivující faktor (B cell activating factor, BAFF), který umožňuje delší přežití paměťových B lymfocytů, včetně autoagresivních. B lymfocyty fungují jako antigen prezentující buňky (antigen presenting cell, APC), a navíc mohou produkovat prozánětlivé cytokiny (interferon gama, IFNγ; interleukin 6, IL‑6; tumor nekrotizující faktor alfa, TNFα ad.), které udržují prozánětlivé prostředí, stimulují astrocyty k produkci BAFF, což vede k astroglióze. B lymfocyty v meningeálních infiltrátech u SP‑RS jsou zodpovědné za setrvalou produkci prozánětlivých působků za hematoencefalickou bariérou. B lymfocyty však mohou produkovat i protizánětlivé cytokiny. K tomu potřebují podporu regulačních B lymfocytů [1].
V současnosti se již považuje za prokázané, že vznik RS je úzce spjat s infekcí virem Epsteina–Barrové (EBV). Výše titru IgG protilátek proti antigenu EBNA‑1 může predikovat aktivitu RS. V klidovém stadiu přežívá EBV v B lymfocytech za kontroly CD8+ T lymfocytů. Infikované B lymfocyty jsou přítomny v ektopických folikulech v meningách a při selhání (EBV) specifických CD8+ T lymfocytů dochází k poruše regulace imunitních funkcí [2].
Léčivých přípravků, které ovlivňují B lymfocytární řadu, máme k dispozici již několik: anti‑CD20 a anti‑CD52 monoklonální protilátky, kladribin, fingolimod a dimetylfumarát. Patří k nim i glatiramer acetát (GA) [1].
Mechanismus působení glatiramer acetátu
Glatiramer acetát snižuje schopnost prezentace antigenu B lymfocyty, snižuje počet cirkulujících B lymfocytů a produkci prozánětlivých cytokinů (TNFα) a podporuje produkci protizánětlivých cytokinů (IL‑10). Navíc zvyšuje schopnost kooperace s regulačními T lymfocyty. Měření aktivity autoagresivních B lymfocytů v periferní krvi predikuje odpověď na léčbu RS GA a dalšími přípravky [3,4].
K dalším pozitivním účinkům GA patří vliv na chronickou infekci EBV: obnovuje aktivitu CD8+ dozorujících T lymfocytů, reguluje infikované autoreaktivní B lymfocyty, a tím moduluje antivirovou odpověď proti EBV; zvyšuje odpověď na virový antigen, a naopak snižuje počet T lymfocytů se znaky vyčerpání a senescence [2].
Příklady z praxe
Účinky GA pak primářka Vachová doložila dvěma kazuistikami. V první kazuistice přednášející představila pacientku (nar. 1986), která pracuje na plný úvazek jako lékárnice. V roce 2010 byl u ženy zaznamenán klinicky izolovaný syndrom (clinically isolated syndrome, CIS), podle oftalmologického nálezu šlo o retrobulbární neuritidu vpravo. Vyšetření mozku a krční míchy na MR prokázalo tři nespecifická ložiska, v likvoru bylo nalezeno devět oligoklonálních pásů. Nemocná byla zaléčena intravenózním metylprednisolonem (3 g). Vbrzku byla zahájena léčba GA, která byla přerušena do současnosti dvěma úspěšnými graviditami. Po druhém porodu kojila pacientka při léčbě GA šest měsíců. Poslední kontrola byla provedena 3. 11. 2022: EDSS 2,0; T25FW 3,35–3,27 (průměr 3,31) sekundy, což téměř odpovídá hodnotám u zdravého jedince. U této pacientky byl GA nasazen ve stadiu CIS a do současnosti (13 let) je nemocná bez druhé ataky.
V druhé kazuistice šlo o ženu (nar. 1970) s mnoha komorbiditami. Pacientka trpí diabetes mellitus 1. typu, chronickým renálním selháním, osteopenií a má pozitivní rodinnou anamnézu. První ataka (v roce 2000) proběhla bez povšimnutí pro možnou souvislost s úrazem. Druhá ataka (v dubnu 2005) měla kmenové příznaky (alternující paréza levé horní a pravé dolní končetiny, internukleární oftalmoplegie). Jako terapie byl zvolen azathioprin, pro diabetes nebyl použit kortikoid. Další ataky následovaly v lednu a srpnu 2007; hodnota na škále EDSS (Expanded Disability Status Scale) dosahovala 3,0 (porucha chůze). Z dalších vyšetření vyplynuly diabetická retinopatie, oboustranný chronický glaukom, autoimunitní tyreoiditida a nodózní struma. Od listopadu 2007 je pacientka léčena GA, který toleruje, nežádoucí účinky nejsou pozorovány. Vyšetření magnetickou rezonancí (MR) z roku 2009 svědčí pro rozvinutou RS s lézemi supra‑ i infratentoriálně. Při dlouhodobé léčbě GA (16 let) proběhly pouze tři ataky (v roce 2011, 2015 a 2021) a skóre EDSS se zvýšilo na 5,5.
V současnosti pacientka aplikuje subkutánně GA v dávce 40 µg 3× týdně, denně inzuliny (Toujeo 100 IU 0‑0‑0‑20, Humalog 16‑9‑13 UI), do očí betaxolol (Betoptic gtt. 2× denně), perorálně užívá escitalopram (Cipralex tbl. 10 mg 1‑0‑0), levotyroxin (Euthyrox tbl. 50 μg 1‑0‑0), kalcium a vitamin D3 (Caltrate 400 IU/600 mg 1‑0‑0), vitamin D3 (Vigantol 30 gtt. 1× týdně), solifenacin (Vesicare tbl. 10 mg 1‑0‑0), pregabalin (Lyrica tbl. 1‑0‑1).
Při poslední kontrole (20. 1. 2023) bylo skóre EDSS 5,5; test chůze na 25 stop (T25FW) 6,5–6,81 (průměr 6,65) sekundy, tj. na horní hranici normy, ale taktéž v důsledku diabetické polyneuropatie. Při porovnání MR z roku 2009 a 2023 byla pacientka takřka stabilní (1 zvětšená a 1 nová léze, bez výraznější atrofie mozku). U této polymorbidní pacientky s limitovanou možností výběru léčivého přípravku vykázal GA dobrou účinnost i při původním signifikantním nálezu na MR (bez progrese).
Závěrem primářka Marta Vachová shrnula, že GA představuje léčbu první linie. Ovlivňuje základní patogenezi i infekci EBV při minimálním výskytu nežádoucích účinků. Umožňuje dlouhodobou terapii i s ohledem na plánovanou graviditu.
Role B lymfocytů v procesu neurodegenerace u RS a jejich možné ovlivnění glatiramer acetátem
Profesor RNDr. Jan Krejsek, CSc., (Ústav klinické imunologie a alergologie, FN Hradec Králové) připomněl, že u RS nelze oddělit zánětlivé a demyelinizační procesy od neurodegenerativních, a to od samého počátku onemocnění. Dendritické buňky jsou schopny identifikovat signály poškození, zpracovat je a předložit T lymfocytům, které klonálně expandují a funkčně polarizují. „V minulosti jsme vycházeli z předpokladu, že RS je mediována především T lymfocyty funkčně polarizovanými do subsetu Th1 a Th17 a ztrátou regulačních T lymfocytů. Do centrální nervové soustavy má však imunitní systém přístup kvůli kontrole infekcí a také pro regeneraci nervové tkáně. Kolem roku 2010 se ukázalo, že původní koncept je dobrý, ale neúplný. Zjistilo se, že významnou roli hrají i B lymfocyty,“ komentoval profesor Krejsek [5].
Individualizace léčby
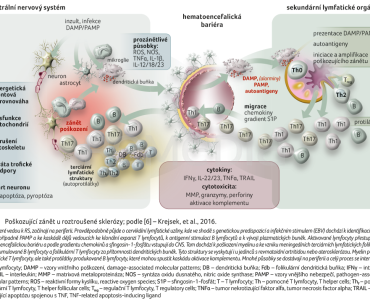 V posledních desetiletích se významně rozšířilo portfolio léčebných možností, které mají zcela odlišné mechanismy působení, míru imunosuprese, potenciál omezit neurodegeneraci a zesílit neuroreparaci. S tím souvisí potřeba individualizace léčebných zásahů s ohledem na perspektivu dlouhodobé (celoživotní) léčby, aktivitu onemocnění a odhad dlouhodobého vývoje nemoci, a to při neexistenci kvalitních imunologických biomarkerů. S ohledem na dlouhodobost léčby je nutné mít na zřeteli, že obranný zánět je nenahraditelný, a to nejen v ochraně, udržování a obnově struktur CNS, ale celého organismu. V průběhu života jedince dochází k fyziologické ontogenetické proměně imunitního systému (imunosenescence), přičemž může jít také o patofyziologickou ontogenetickou proměnu směrem k prozánětlivým procesům (inflamm‑aging) i vzhledem ke komorbiditám. Poškozující zánět v RS je znázorněn na obrázku 1 [6].
V posledních desetiletích se významně rozšířilo portfolio léčebných možností, které mají zcela odlišné mechanismy působení, míru imunosuprese, potenciál omezit neurodegeneraci a zesílit neuroreparaci. S tím souvisí potřeba individualizace léčebných zásahů s ohledem na perspektivu dlouhodobé (celoživotní) léčby, aktivitu onemocnění a odhad dlouhodobého vývoje nemoci, a to při neexistenci kvalitních imunologických biomarkerů. S ohledem na dlouhodobost léčby je nutné mít na zřeteli, že obranný zánět je nenahraditelný, a to nejen v ochraně, udržování a obnově struktur CNS, ale celého organismu. V průběhu života jedince dochází k fyziologické ontogenetické proměně imunitního systému (imunosenescence), přičemž může jít také o patofyziologickou ontogenetickou proměnu směrem k prozánětlivým procesům (inflamm‑aging) i vzhledem ke komorbiditám. Poškozující zánět v RS je znázorněn na obrázku 1 [6].
Glatiramer acetát se svým unikátním mechanismem účinku
Profesor Krejsek představil GA jako unikátní směs syntetických peptidů ze čtyř aminokyselin (L‑glutamové kyseliny, L‑lysinu, L‑alaninu a L‑tyrozinu), kterou nelze analyticky plně definovat. Obsahuje peptidy, jejichž určité části jsou podobné encefalitogenním epitopům (autoantigenům): myelinovému bazickému proteinu (MBP), myelinovému oligodendrocytárnímu glykoproteinu (MOG) a protein‑lipid peptidu (PLP). Díky těmto epitopům má GA imunomodulační účinky – působí na složky vrozené imunity (dendritické buňky, makrofágy a granulocyty) i na specifickou imunitu (T a B lymfocyty, včetně GA stimulovaných T lymfocytů), čímž mírní poškozující zánět. Navíc stimuluje oligodendrocyty a pozitivně ovlivňuje remyelinizaci [3].
Jak fungují jednotliví hráči mechanismu RS pod vlivem GA
Makrofágy osídlující tkáně mají sebeobnovný potenciál bez souvislosti s hematopoezou. Nezralé makrofágy jsou bohatě vybaveny receptory rozpoznávajícími vzory (pattern recognition receptors, PRR), které identifikují vzory vnitřního poškození (damage‑associated molecular patterns, DAMP)/vnějšího nebezpečí (pathogen‑associated molecular patterns, PAMP) a následně se funkčně polarizují. Působením GA je zablokována polarizace směrem k prozánětlivému M1 makrofágu s produkcí prozánětlivých cytokinů, a naopak posílena je polarizace a diferenciace k M2c (regulačním) makrofágům, které tvoří protizánětlivé a homeostatické cytokiny.
Dendritické buňky umějí zpracovat a prezentovat antigen T lymfocytům. Pod vlivem působení GA na dendritickou buňku je zablokována funkční polarizace lymfocytů Th0 na prozánětlivé Th1 a Th17, ale je stimulována diferenciace na protizánětlivé Th2 a regulační T lymfocyty. Glatiramer acetát funguje jako kompetitor na receptorech autoreaktivních T lymfocytů, a tím brání jejich aktivaci. Chová se též jako pozměněný ligand a působí anergii až apoptózu autoreaktivních T lymfocytů.
Proti EBV. Glatiramer acetát vstupuje i do ochrany proti infekci EBV – zvyšuje počet cytotoxických CD8 T lymfocytů specifických pro EBV, snižuje počet nefunkčních cytotoxických CD8 T lymfocytů specifických pro EBV exprimujících znaky vyčerpání (receptor programované buněčné smrti 1, PD‑1) nebo senescence [2].
B lymfocyty prezentují GA jako antigen lymfocytům Th0, čímž je blokována jejich diferenciace k prozánětlivé kaskádě a stimulována protizánětlivá odpověď. Glatiramer acetát přímo stimuluje B lymfocyty k produkci protilátek proti GA, které neinterferují s terapeutickými účinky, ale naopak je posilují [1].
Lze shrnout, že GA působí:
- snížení počtu B lymfocytů v krvi,
- snížení počtu „tranzičních“ B lymfocytů a plazmablastů v krvi,
- snížení počtu paměťových B lymfocytů (trvale infikovaných EBV),
- snížení exprese aktivačních znaků CD69, CD25 na B lymfocytech,
- snížení funkce B lymfocytů jako buněk prezentujících antigen,
- snížení citlivosti B lymfocytů na cytokiny (BAFF, APRIL, TACI),
- preferenční polarizaci k Breg lymfocytům [7].
Neuroregenerace
Glatiramer acetát specifické T lymfocyty produkují neurotrofiny, které stimulují oligodendrocytární a neuronální progenitory, což vede k neuroprotekci, k remyelinizaci a k axonálnímu růstu.
Závěrem profesor Krejsek shrnul, že GA má účinnost ověřenou klinickými studiemi a dlouholetými zkušenostmi. Mechanismy účinku GA jsou dlouhodobě zkoumány – látka moduluje poškozující zánět a vykazuje neuroprotektivní účinky [8].
Infekční onemocnění pacientů léčených DMT – diagnostika, prevence, terapie
Primářka MUDr. Hana Roháčová, Ph.D., (Klinika infekčních nemocí FN Bulovka) vysvětlila, že u imunokompromitovaných jedinců mohou infekční onemocnění probíhat jinak než u zdravé populace. „Nemocem je lépe předcházet, než je léčit. Ne vždy to jde, a ne vždy se to podaří,“ předeslala primářka Roháčová úvodem.
V čase se mění nejen samotné spektrum infekcí, ale především chování etiologických agens v reakci na zevní vlivy – antibiotika (rezistence), antivirotika (virus lidské imunodeficience [HIV], covid‑19), očkování (replacement), imunomodulátory (biologická léčba – monoklonální protilátky apod.).
U pacientů léčených chorobu modifikující terapií (disease‑modyfing therapy, DMT) je zapotřebí brát v úvahu především:
- viry – HIV, cytomegalovirus (CMV), EBV, virus hepatitidy B (HBV), virus hepatitidy C (HCV), John Cunningham virus (JCV), herpetické viry, morbilli, rubeola, covid‑19, chřipka;
- bakterie – pneumokoky, meningokoky, listerie, legionely, mykobakteria TBC, ehrlichie;
- parazity – Toxoplasma gondii, Babesia microti, kryptosporidie, mikrosporidie;
- mykózy – aspergily, Pneumocystis jirovecii, Cryptococcus neoformans, kandidy.
Za rizika lze považovat primoinfekce, reaktivace (TBC; HBV; virus varicella zoster, VZV ad.) a zhoršení chronického onemocnění (HBV, HCV, HIV). Před zavedením DMT je nutné znát stav infekcí HBV, HCV, HIV, CMV, VZV, Quantiferonového testu, sérologie morbill, rubeoly. Naopak výtěry viru hepatitidy A (HAV), viru hepatitidy E (HEV), EBV, viru herpes simplex (HSV) a toxoplazmózy postrádají klinickou relevanci.
Preventivně je vhodné před zahájením DMT ovlivnit očkováním invazivní meningokoková onemocnění (IMO), invazivní pneumokoková onemocnění (IPO), VZV, covid‑19 a léčebně HCV, HBV, TBC a HIV.
Indikace k úhradě očkování proti IMO, IPO, Haemophilus influenzae typu b (Hib), chřipce u imunokompromitovaných osob má oporu v zákoně (novela zákona 48/1997 Sb., k 1. 1. 2018). Navíc existuje několik českých a mezinárodních doporučených postupů, v nichž jsou zakotveny principy prevence infekcí u pacientů léčených DMT [9–11].
Herpetické neuroinfekce mohou být vyvolány osmi typy herpetických virů (HHV 1, HHV 2, EBV, CMV, VZV, HHV 6–8). Až 95 % primoinfekcí proběhne inaparentně s následným trvalým přežíváním v organismu. U imunokompromitovaných osob může primoinfekce i reaktivace HSV 1 proběhnout jako hemoragicko‑nekrotizující encefalitida/meningoencefalitida s náhlým začátkem, psychotickými stavy či poruchou vědomí, křečemi a ložiskovou symptomatologií. U HSV 2 bývá průběh neuroinfekce daleko mírnější. Diagnostickými metodami jsou PCR, sérologie, zobrazovací metody (MR 3. den, výpočetní tomografie [CT] 5. den). V léčbě se doporučují virostatika (aciklovir, valaciklovir). Prevence se obecně nepoužívá; některé studie uvádějí u imunosuprimovaných osob příznivý efekt podávání 2× 200 mg acikloviru po dobu terapie (alemtuzumabem, kladribinem, natalizumabem, fingolimodem).
Virus Epsteina–Barrové inaparentně promořuje takřka celou populaci. Vakcína není k dispozici, možnosti terapie jsou omezené na symptomatickou léčbu. Při akutní primoinfekci mohou mít virostatika lytický efekt (aciklovir inhibuje virovou DNA polymerázu). Latentní infekci, která se u pacientů s RS předpokládá, nelze ovlivnit virostatiky, protože virová DNA se chová jako součást jádra buňky.
Cytomegalovirus není v populaci tolik rozšířen jako EBV, infekce probíhá inaparentně, ale může také vyvolat syndrom infekční mononukleózy. Jsou známy případy CMV hepatitid; reaktivace u imunosuprimovaných osob může vyvolat intersticiální pneumonii, myokarditidu, retinitidu, kolitidu, encefalitidu, generalizovanou CMV infekci. Infekci CMV lze léčit, proto je nutná včasná sérologická diagnostika a zjištění virové nálože (PCR). V pozitivním případě lze dlouhodobou terapií (ganciklovir, foskarnet, cidofovir) infekci zvládnout. U těžkých imunodeficitů bývá nutná i celoživotní profylaxe. Zejména u nemocných léčených alemtuzumabem, fingolimodem, rituximabem je nutné myslet na infekci CMV a na to, jak (i profylakticky) zasáhnout.
Virus varicella zoster se při primoinfekci projeví jako plané neštovice, při reaktivaci jako pásový opar. U imunosuprimovaných osob (primoinfekce i reaktivace) mívá závažnější průběh, četnější komplikace a může dojít ke generalizaci infekce s až 8% letálním zakončením (bez léčby). Diagnostika je podle klinických symptomů, je možné provést PCR z eflorescencí. Léčbou je podávání acikloviru či valacikloviru. Prevence je možná pasivní imunizací – podáním imunoglobulinu. U imunosuprimovaných jedinců nepodáváme živé vakcíny (Zostavax). Neživou očkovací látku (Shingrix) je doporučeno podat před zahájením terapie fingolimodem, siponimodem, ponesimodem, natalizumabem a alemtuzumabem.
Morbilli v současnosti v ČR nejsou problémem, ale před několika lety proběhla i Evropou epidemie, je tedy nutné na ně myslet. Mladší generace by měla být proočkovaná. Vakcíny jsou živé, proto by případné očkování mělo proběhnout před zahájením DMT. Je možná pasivní imunizace [12].
John Cunnigham virus promořuje 80 % populace, u zdravých osob jde o inaparentní infekci. U imunosuprimovaných jedinců (a léčených natalizumabem) vyvolává JCV progresivní multifokální leukoencefalopatii (PML) s vysoce nepříznivou prognózou. Natalizumab zvyšuje prevalenci onemocnění na 4 : 1 000 [10]. Diagnóza se určí na základě vyšetření CT, MR, likvoru, ev. biopsií. U léčených natalizumabem se provádí stanovení protilátek proti JCV každých šest měsíců, MR každé 3–4 měsíce.
Virus lidské imunodeficience je v současné době velmi dobře ovlivnitelný léčbou, nepředpokládá se jeho vysoký výskyt u pacientů s RS. Míra imunodeficience je rozdílná, za vysoce rizikové pacienty se považují nemocní s počtem CD4+ T lymfocytů < 200 v mm3, terapie je zahajována při počtu CD4 > 200 v mm3.
V případě HBV je vyžadováno ověření stavu sérologií před zahájením léčby (popř. HBV DNA), i nosičství může vést při léčbě imunosuprese k reaktivaci HBV a k rychle progredující fibrotické cholestatické hepatitidě s vysokou smrtností. V případě pozitivity zavádíme léčbu bez ohledu na virovou nálož (lamivudin) po celou dobu terapie. U pacientů po prodělané HBV může být HBsAg (povrchový antigen HBV) negativní, ale DNA HBV se nachází v hepatocytech a při imunosupresi se může replikovat. Nutné je sledování markerů HBV jednou za dva měsíce.
Virová hepatitida C patří k infekcím, jejichž výskyt kvůli absenci vakcinace neklesá. Sérologické vyšetření provádíme před zahájením DMT (virovou nálož stanovujeme vždy, může být pozitivní i u séronegativních pacientů). Snažíme se o léčbu před zahájením DMT, současná virostatická terapie vede k vyléčení u více než 90–98 % pacientů.
Tuberkulóza má v ČR nízkou incidenci (4/100 000 obyvatel), ale není znám počet případů latentní tuberkulózy (LTBC), podle odhadů jde o jednotky procent. Pozitivita Quantiferonového testu se považuje za známku LTBC s vysokou pravděpodobností, ale není jasné, jestli a kdy dojde k aktivaci LTBC, imunosuprese však představuje rizikový faktor. Quantiferonový test je nevýtěžný při počtu CD4+ T lymfocytů < 100 mm3. Při pozitivitě se podává isoniazid po dobu šesti měsíců nebo rifampicin po dobu čtyř měsíců. Chorobu modifikující terapii (teriflunomidem, fingolimodem, alemtuzumabem, natalizumabem) zahajujeme po dvou měsících po ukončení léčby (latentní) TBC. Je třeba dát pozor na výsledek při léčbě dimetylfumarátem, kdy může být Quantiferonový test negativní vzhledem k dysfunkci lymfocytů.
Listerióza je charakteristická zoonóza postihující především osoby imunodeficitní, ale mohou onemocnět i lidé zdraví, nebezpečná je pro gravidní ženy. Udává se, že až 0,1 % pacientů léčených alemtuzumabem postihne listerióza. Přenáší se alimentárně (uzeniny, sýry, tepelně nezpracované mléčné výrobky) nebo kontaktem se zvířaty.
Diagnostika spočívá v sérologii, kultivačním nálezu a v rozboru likvoru, případně v PCR.
Při podezření na listeriovou neuroinfekci se podávají aminopeniciliny, kotrimoxazol a cefalosporiny třetí generace.
Legionelóza je nebezpečné onemocnění. Podezření by měly vzbudit atypické plicní záněty. Smrtnost u imunosuprimovaných pacientů je 30–50 %, u zdravých osob 10 %. K nákaze dochází především inhalací kontaminovaného aerosolu. Přenáší se vzduchotechnikou, nebulizátory, vodovodními sítěmi, ale i vodotrysky apod. Ve zdravotnických zařízeních se proto provádí kontrola vody; rizikové jsou hotely, lázně, vřídla. K diagnóze vede sérologie, kultivace, PCR nebo legionelový antigen v moči. Léčí se makrolidy, chinolony.
Pneumokok kolonizuje horní cesty dýchací. Je přítomen zhruba u 5–10 % zdravých dospělých, nález ve výtěru proto nemá klinický význam. Očkování je doporučeno, a to zejména u imunosuprimovaných jedinců.
Meningokok se nevyskytuje tak často jako pneumokok. Rozlišujeme 13 séroskupin, nejčastějšími jsou A, B, C, Y, W (X). Meningokok vyvolává invazivní meningokoková onemocnění, tj. zánět mozkových blan a sepse IMO. Před léčbou ekulizumabem (inhibice komplementu) je nutné očkovat (Nimenrix – ACWY; Bexsero, Trumenba – B).
V případě toxoplazmózy jde většinou o reaktivaci latentní infekce Toxoplasma gondii. Zhruba 30 % populace je inaparentně promořeno. Toxoplazmóza se může projevit jako uzlinový syndrom, syndrom infekční mononukleózy, má také oční formy. Toxoplazmóza může proběhnout pod obrazem encefalitidy, hepatitidy, myokarditidy, pneumonie. Diagnostika je sérologická a prostřednictvím PCR. Toxoplazmóza se léčí pyrimetaminem, sulfadiazinem, kotrimoxazolem.
Pneumocystóza je onemocnění, které je vyvoláno parazitickou houbou a postihuje pouze imunosuprimované osoby (nejčastější oportunní infekce u HIV pozitivních). Pneumocystis jirovecii vyvolává intersticiální pneumonie s 20% letalitou u léčených. Diagnostika spočívá v mikroskopickém průkazu trofozoitů ve sputu. V terapii se používají megadávky kotrimoxazolu a pentamidin.
Vakcinace
Živé očkovací látky jsou u imunosuprimovaných osob kontraindikovány. Pokud je nutné je použít, pak minimálně čtyři týdny před zahájením léčby, ne později než dva týdny před zahájením léčby (morbilli, rubeola, žlutá zimnice). Neživé očkovací látky je doporučeno podat; v úvahu je nutné vzít míru imunosuprese, která má vliv na vytvoření protilátek. Je doporučeno očkovat členy domácnosti.
Pasivní imunizace imunoglobuliny
Důležitá (rozhodující) doba je podání do 48 hodin po expozici. Rozhodujeme se zejména u vážných onemocnění – morbilli (Igamplia), u vztekliny jde o vitální indikaci (100% letalita) – provádí se aktivní i pasivní imunizace (Berirab). U tetanu (s 50% letalitou) z vitální indikace při absenci (nedostatečném) očkování se provádí pasivní imunizace hyperimunním globulinem (Tegabulin). V rámci pasivní imunizace lze při kontaktu imunosuprimovaných pacientů s VZV podat sérum (Varitect).
Literatura
[1] Kuerten S, Jackson LJ, Kaye J, Vollmer TL. Impact of Glatiramer Acetate on B cell‑Mediated Pathogenesis of Multiple Sclerosis. CNS Drugs 2018; 32: 1039–1051.
[2] Guerrera G, Ruggieri S, Picozza M, et al. EBV‑specific CD8 T lymphocytes and B cells during glatiramer acetate therapy in patients with MS. Neurol Neuroimmunol Neuroinflamm 2020; 7: e876.
[3] Häusler D, Hajiyeva Z, Traub JW, et al. Glatiramer acetate immune modulates B‑cell antigen presentation in treatment of MS. Neurol Neuroimmunol Neuroinflamm 2020; 7: e698.
[4] Tacke S, Braune S, Rovituso DM, et al. B cell aktivity predicts Response to GA and IF in RR Multiple Sclerosis. Neurol Neuroimmunol Neuroinflamm 2021; 8: e980.
[5] Mirabella M, Annovazzi P, Brownlee W, et al. Treatment challenges in multiple sclerosis – a continued role for glatiramer acetate? Front Neurol 2022; 13: 844873.
[6] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016.
[7] Amrouche K, Pers J‑O, Jamin C. Glatiramer acetate stimulates regulatory B cell functions. J Immunol 2019; 202: 1970–1980.
[8] Kasindi A, Fuchs D‑T, Koronyo Y, et al. Glatiramer acetate immunomodulation: evidence of neuroprotection and cognitive preservation. Cells 2022; 11: 1578.
[9] Kubala Havrdová E, et al. Klinický doporučený postup pro diagnostiku a léčbu roztroušené sklerózy a neuromyelitis optica a onemocnění jejího širšího spektra. KKNEU 0031, březen 2020. Dostupné na: https://www.czech‑neuro.cz/content/uploads/2020/04/rs_odborna‑2.0_final_pub_web‑2.pdf
[10] Moiola L, Barcella V, Benatti S, et al. The risk of infection in patients with multiple sclerosis treated with disease‑modifying therapies: A Delphi consensus statement. Mult Scler J 2021; 27: 331–346.
[11] Papeix C, Donze C, Lebrun‑Frénay C, et al. Infection and multiple sclerosis: Recommendation from the French Multiple Sclerosis Society. Rev Neurol (Paris) 2021; 177: 980–994.
[12] Sharma K, Chaudhary D, Beard K, et al. A comprehensive review of varicella‑zoster virus, herpes simplex virus and cryptococcal infections associated with sphingosine‑1‑phosphate receptor modulators in multiple sclerosis patients. Mult Scler Relat Disord 2022; 59: 103675.