Pacient s roztroušenou sklerózou vhodný pro léčbu ofatumumabem
Souhrn:
Halúsková S, Vališ M. Pacient s roztroušenou sklerózou vhodný pro léčbu ofatumumabem. Remedia 2022; 32: 347–353.
Roztroušená skleróza (RS) je chronické zánětlivé demyelinizační a neurodegenerativní onemocnění centrálního nervového systému, které postihuje zejména mladé dospělé. Terapeutické možnosti u RS se v posledních dvaceti letech posunuly výrazně kupředu. V popředí zájmu je v současnosti biologická léčba na bázi monoklonálních protilátek namířených proti CD20, povrchovému antigenu B lymfocytů. Jejich účinnost v léčbě RS byla prokázána v klinických studiích. Ofatumumab je plně humánní anti‑CD20 monoklonální protilátka schválená pro léčbu dospělých pacientů s aktivní relabující‑remitující RS (RR‑RS) definovanou klinicky nebo zobrazovacími metodami. Jedná se o první B buněčnou terapii určenou k domácí subkutánní aplikaci jednou měsíčně. Výzkumy potvrzují, že časné nasazení vysoce účinné léčby (high efficacy therapy, HET) zpomaluje progresi disability a zlepšuje dlouhodobou prognózu zejména u mladších pacientů s aktivním onemocněním RR‑RS. V České republice je ofatumumab po okrelizumabu teprve druhým lékem ze skupiny HET, který získal úhradu z prostředků veřejného zdravotního pojištění v rámci první linie léčby RR‑RS.
Summary:
Haluskova S, Valis M. Multiple sclerosis patient suitable for the treatment with ofatumumab. Remedia 2022; 32: 347–353.
Multiple sclerosis (MS) is a chronic inflammatory demyelinating and neurodegenerative disease of the central nervous system affecting most commonly young adults. Treatment options for MS have increased considerably in the last 20 years. Currently, monoclonal antibody‑based therapy directed against the CD20 antigen found on the surface of B‑lymphocytes is in the spotlight. Its efficacy in the treatment of MS has been confirmed in clinical trials. Ofatumumab is a fully human anti‑CD20 monoclonal antibody approved for treating adult patients with active relapsing‑remitting MS (RR‑MS) defined by clinical or imaging features. It is the first self‑administered B‑cell therapy given monthly via subcutaneous injection at home. Research confirms that the early commencement of high efficacy therapy (HET) slows the disability accumulation and improves the long‑term outcome, especially in younger RR‑MS patients with active disease. In the Czech Republic, after ocrelizumab, ofatumumab is only the second drug from the HET group to receive reimbursement from public health insurance funds as part of the first‑line RR‑MS treatment.
Key words: multiple sclerosis, monoclonal antibodies, ofatumumab, high efficacy therapy.
Úvod
Roztroušená skleróza (RS) představuje chronické autoimunitní demyelinizační a neurodegenerativní onemocnění centrálního nervového systému (CNS), které je asociováno se značnou klinickou a socioekonomickou zátěží jak pro pacienty, tak pro systémy zdravotní péče. Roztroušená skleróza začíná u přibližně 85 % nově diagnostikovaných případů relabujícím remitujícím stadiem (RR RS) charakterizovaným střídáním epizod nových či rekurentních symptomů (relapsů) s různě dlouhými obdobími relativního klidu (remise). První příznaky RS se sice objevují typicky u mladých dospělých mezi 20.–40. rokem života, onemocnění se však může manifestovat i v dětství a adolescenci a existují též případy výskytu nemoci u pacientů starších 55 let. Podle současných odhadů žije v České republice přes 20 000 pacientů s RS a jejich počet konstantně narůstá – ročně přibude přibližně 700 nových pacientů, což v přepočtu znamená 58 nově diagnostikovaných měsíčně [1].
I přes fakt, že první zmínky o nemoci, která by svými příznaky mohla připomínat RS, sahají do 14. století, až do příchodu prvních biologických léčiv (disease modifying drugs, DMDs) v devadesátých letech minulého století prakticky nebyla k dispozici specifická léčba k ovlivnění dlouhodobého průběhu nemoci [2]. Díky intenzivnímu výzkumu se však terapeutické možnosti zejména RR RS posunuly v posledních dvaceti letech výrazně kupředu. Od roku 1995, kdy na evropský trh vstoupily interferony beta, rozšířilo paletu DMDs dalších deset přípravků, z nichž osm je určeno pro léčbu pacientů s RR RS, jeden (okrelizumab) lze použít v indikaci RR RS i časné primárně progresivní RS (PP RS) a jeden (siponimod) je schválen pro sekundárně progresivní RS (SP RS). Efektivita léčebných postupů, které směřují k měřitelnému snížení počtu B lymfocytů v periferní krvi s následným potlačením zánětlivé aktivity RR RS a zpomalením progrese disability u PP RS, poskytla vědcům přesvědčivé důkazy o komplexním zapojení B lymfocytů do patogeneze RS. Bylo experimentálně doloženo a klíčovými výsledky klinických studií potvrzeno, že B lymfocyty jsou integrální součástí imunopatogeneze RS – jejich role je značně různorodá, a staly se tak terapeuticky velmi atraktivními při vývoji nových molekul [3,4]. Podle některých názorů bude budoucnost léčby RS patřit právě terapii spočívající v depleci určitých subpopulací B lymfocytů. V popředí zájmu je nyní biologická léčba na bázi monoklonálních protilátek namířených proti CD20, povrchovému antigenu B lymfocytů. Transmembránová molekula CD20 je v současnosti jedním z nejvíce prozkoumaných antigenů z hlediska interakce s možným léčebným účinkem protilátky. Zatím nejnovějším přírůstkem v rodině anti CD20 monoklonálních protilátek využívaných v terapii pacientů s RR RS je ofatumumab.
Subkutánní aplikace monoklonálních protilátek
Monoklonální protilátky představují revoluční způsob léčby řady nemocí, jejich kvalita a poměr účinnost/tolerabilita se neustále zvyšují. První vyrobené – myší ( omab) – protilátky byly vysoce imunogenní s rizikem vzniku anafylaktické reakce při opakovaném podání. Významné pokroky v technologiích genového inženýrství umožnily postupně připravit chimérické ( ximab), humanizované ( zumab) až plně lidské ( umab) monoklonální protilátky. Imunogenicita, tedy schopnost látky vyvolat po vpravení do organismu imunitní odpověď, je už u chimérických monoklonálních protilátek značně redukována a tento trend pokračuje až k plně humánním [5].
Vzhledem k tomu, že monoklonální protilátky jsou tvořeny makromolekulou bílkoviny, je aplikace nutná zpravidla parenterálně. Zpočátku bylo používáno pouze intravenózní podání, ale z praktických a logistických důvodů bylo snahou tento proces co nejvíce zjednodušit a zefektivnit – preference méně invazivního a šetrnějšího způsobu aplikace, snížení výskytu nežádoucích účinků, vyšší dostupnost terapie, lepší adherence pacientů k léčbě, úspora času, nižší náklady na spotřební materiál, uvolnění kapacit zdravotnických zařízení či racionálnější využití středního personálu (nutnost opakovaného zajišťování žilního vstupu a nezbytného monitorování pacienta v případě infuzní terapie atd.). Do klinické praxe proto vstoupily formy subkutánní. Subkutánní aplikace monoklonálních protilátek má své výhody jak pro pacienta, tak pro zdravotníky. Stala se standardem v mnoha oborech medicíny a v některých z nich postupem času jednoznačně převládla. Tato cesta administrace umožňuje podání řady léčiv peptidové a proteinové povahy díky nízké proteolytické aktivitě podkožní tkáně. Kromě výše zmiňovaných výhod je z pohledu pacienta největším přínosem schůdnost domácí autoaplikace, která je po řádném zaškolení a s pomocí předplněných aplikátorů rychlá, snadná a komfortní. Za určité negativum subkutánní aplikace lze považovat bolestivost a vyšší podíl možných reakcí v místě vpichu [6,7]. Ofatumumab představuje první monoklonální protilátku zaměřenou proti CD20+ B lymfocytům aplikovanou formou subkutánní injekce v atraktivním dávkovacím schématu 1× měsíčně samotným pacientem, v domácím prostředí a bez nutnosti premedikace [8]. Nízká frekvence aplikace ve srovnání s prvoliniovými injekčními přípravky navíc zvyšuje úroveň adherence pacientů k léčbě, což je prvním a základním předpokladem úspěšné terapie.
Ofatumumab
Ofatumumab je čistě humánní
anti CD20 monoklonální protilátka třídy IgG1
schválená Evropskou lékovou agenturou (EMA) v březnu 2021
pro léčbu dospělých pacientů s aktivní RR RS
definovanou klinicky nebo zobrazovacími metodami. V indikaci
RR RS je ofatumumab aktuálně schválen v 69 zemích [9].
Na rozdíl od chimérické protilátky rituximabu
a humanizované protilátky okrelizumabu, které mají prakticky
identickou vazbu na velkou extracelulární kličku molekuly
CD20, se ofatumumab váže na malou i velkou extracelulární
smyčku, díky čemuž získává nové možnosti účinku (obr. 1)
[10,11]. Podobně jako několik dalších DMDs dnes používaných
v terapii RS je i ofatumumab lék původem
hematoonkologický. Jeho účinnost byla hodnocena v terapii B
lymfoproliferativních onemocnění, jako je folikulární lymfom,
difuzní velkobuněčný B lymfom či Waldenströmova
makroglobulinemie, a stal se první anti CD20 monoklonální
protilátkou registrovanou pro léčbu chronické lymfocytární
leukemie refrakterní na podávání fludarabinu a alemtuzumabu
[12,13]. Ofatumumab v této indikaci ale již není na evropském
trhu dostupný.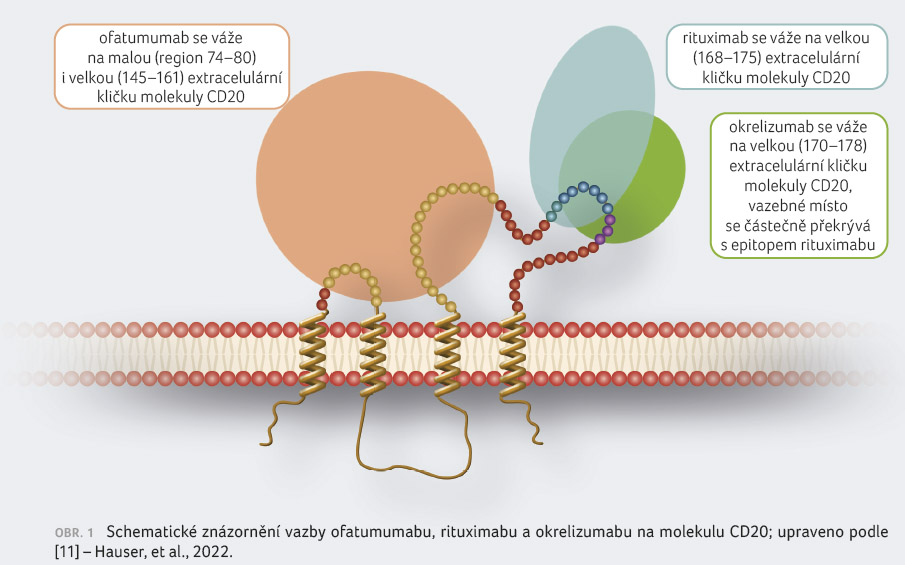
Vysoká účinnost a příznivý
bezpečnostní profil ofatumumabu byly prokázány ve dvou
randomizovaných multicentrických, dvojitě zaslepených studiích
fáze III (ASCLEPIOS I a II), v jejichž rámci
bylo léčivo srovnáváno s aktivním komparátorem –
perorálním teriflunomidem (zařazení pacienti též dostávali
placebo odpovídající druhému léčebnému rameni, aby bylo
zajištěno dvojité zaslepení). Do studií bylo po splnění
vstupních kritérií zařazeno celkem 1 882 pacientů s RR RS
ze 37 zemí a medián sledování činil 20 měsíců, poté
následovala extenze studie a otevřený follow up.
Ve studii ASCLEPIOS I byla roční míra relapsů
(annualized relapse rate, ARR) redukována o 50,5 %
v komparaci s teriflunomidem, ve studii ASCLEPIOS II
o 58,5 % (jeden relaps za 10 let; v obou případech
p < 0,001). Metaanalýza kombinovaných údajů
ukázala, že ofatumumab v porovnání s teriflunomidem
signifikantně snížil riziko dosažení tříměsíční potvrzené
progrese disability (confirmed disability progression, CDP) o 34,4 %
a šestiměsíční CDP o 32,5 %. U pacientů
léčených ofatumumabem došlo rovněž k významnému poklesu
výskytu T1 gadolinium enhancujících lézí na magnetické
rezonanci (MR) – o 97,5 % ve studii ASCLEPIOS
I a o 93,8 % ve studii ASCLEPIOS II. V kritériu
počtu nových nebo zvětšujících se T2 lézí vykázal ofatumumab
81,9% a 84,5% redukci oproti teriflunomidu [14]. Dalším
důležitým analyzovaným parametrem byl podíl pacientů
s dosažením stavu NEDA 3 (no evidence of disease
activity), který zahrnuje tři kritéria, a to nepřítomnost
klinických relapsů, absenci nárůstu disability podle Kurtzkeho
stupnice postižení (Expanded Disability Status Scale, EDSS) a žádné
aktivní a/nebo nové či zvětšující se T2 hyperintenzní léze
na provedené MR mozku [15,16]. Ve druhém roce léčby
ofatumumabem bylo téměř devět z deseti pacientů bez
měřitelné aktivity nemoci (NEDA 3) [17]. V pivotních
studiích byl pozorován podobný výskyt nežádoucích příhod –
83,6 % u ofatumumabu a 84,2 % u teriflunomidu.
U pacientů užívajících ofatumumab byly nejčastěji
reportovány reakce v souvislosti s injekcí; těchto
reakcí ale v čase ubývalo a zmírňovaly se. Z dalších
nežádoucích účinků byl oproti teriflunomidu zaznamenán
častější pokles koncentrace imunoglobulinu M (IgM) pod
hodnotu 0,34 g/l – u 14,3 % pacientů ve skupině
s ofatumumabem versus u 4,5 % ve větvi
s teriflunomidem, avšak bez klinického korelátu (úbytek IgM
nebyl spojen s frekventnějším výskytem
jednotlivých infekcí) [14].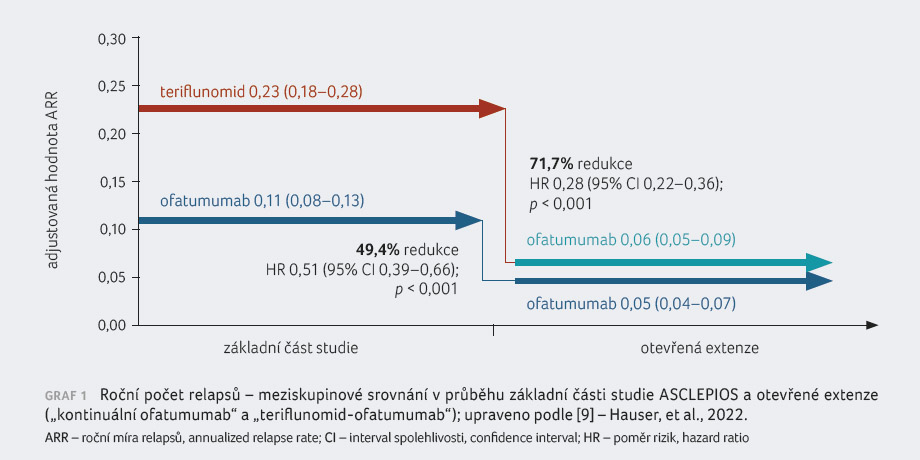
Dlouhodobá účinnost ofatumumabu (4
roky) byla dále sledována v otevřené extenzi studie
ALITHIOS, do níž vstoupilo 1 367 z 1 882 (72,6 %)
pacientů randomizovaných ve studiích ASCLEPIOS I a II.
Kromě vyhodnocení dlouhodobé účinnosti léku bylo cílem analýz
posouzení, resp. srovnání efektu časného versus pozdního
zahájení terapie ofatumumabem. Pacienti léčení ofatumumabem
v základní části studie pokračovali v zavedené
terapii („kontinuální ofatumumab“) a pacienti, kteří
původně dostávali teriflunomid, byli v extenzi převedeni
na ofatumumab („teriflunomid ofatumumab“), graf 1–3.
Data ozřejmila, že delší setrvání v terapii
ofatumumabem bylo asociováno se sníženou hodnotou ARR, s redukcí
tříměsíční a šestiměsíční CDP i s potlačením
aktivity na MR v porovnání s pacienty, kteří byli
nejdříve léčeni teriflunomidem a až v otevřené fázi
studie eskalováni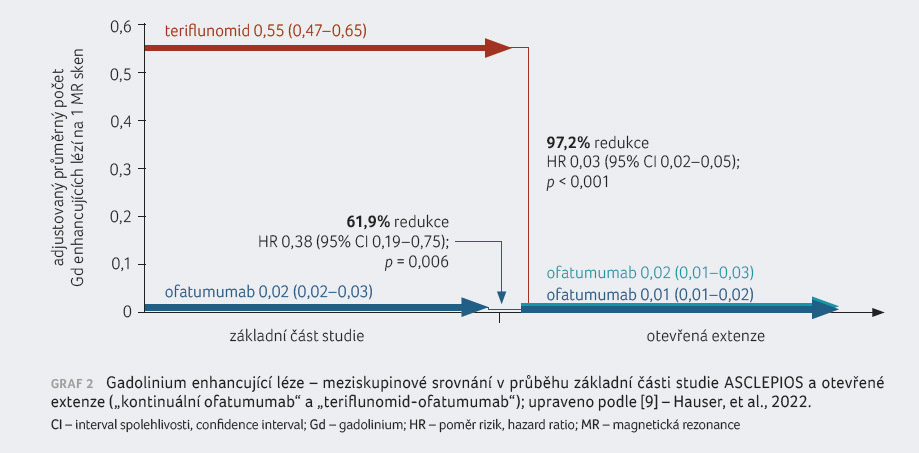 na ofatumumab. Hodnota ARR ve skupině
pacientů s dřívějším zahájením a pokračující
terapií ofatumumabem zůstala na nízké úrovni po dobu
až čtyř let od nasazení léčby, což poukazuje
na významně nižší výskyt relapsů (v přepočtu jeden
relaps za 20 let) [9]. Sledované rozdíly v účinnosti
pozorované ve skupině pacientů kontinuálně užívajících
ofatumumab a ve skupině, která na léčbu
ofatumumabem přešla až v extenzi klinického hodnocení,
zdůrazňují přínos včasné iniciace HET. Potvrdilo se, že
nasazení HET, tj. monoklonální protilátky u pacientů
s RR RS hned v úvodu terapie, zlepšuje dlouhodobé
výsledky ve srovnání s nemocnými, u nichž byla
zahájena léčba méně účinným DMD s následnou eskalací.
Data z otevřené extenze studie ALITHIOS rovněž prokázala,
že dlouhodobá léčba ofatumumabem nesnižuje obranyschopnost
organismu a expozice léku 3,5 roku byla u pacientů
s RR RS zhodnocena jako bezpečná. Nebyla shledána žádná
nová bezpečnostní rizika, nevyskytl se případ progresivní
multifokální
na ofatumumab. Hodnota ARR ve skupině
pacientů s dřívějším zahájením a pokračující
terapií ofatumumabem zůstala na nízké úrovni po dobu
až čtyř let od nasazení léčby, což poukazuje
na významně nižší výskyt relapsů (v přepočtu jeden
relaps za 20 let) [9]. Sledované rozdíly v účinnosti
pozorované ve skupině pacientů kontinuálně užívajících
ofatumumab a ve skupině, která na léčbu
ofatumumabem přešla až v extenzi klinického hodnocení,
zdůrazňují přínos včasné iniciace HET. Potvrdilo se, že
nasazení HET, tj. monoklonální protilátky u pacientů
s RR RS hned v úvodu terapie, zlepšuje dlouhodobé
výsledky ve srovnání s nemocnými, u nichž byla
zahájena léčba méně účinným DMD s následnou eskalací.
Data z otevřené extenze studie ALITHIOS rovněž prokázala,
že dlouhodobá léčba ofatumumabem nesnižuje obranyschopnost
organismu a expozice léku 3,5 roku byla u pacientů
s RR RS zhodnocena jako bezpečná. Nebyla shledána žádná
nová bezpečnostní rizika, nevyskytl se případ progresivní
multifokální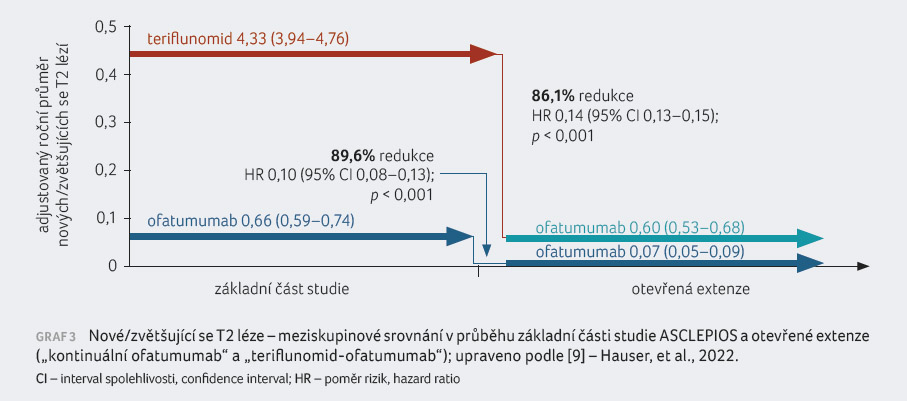 encefalopatie (PML) ani jiné oportunní infekce
a riziko vzniku malignit bylo nízké [11]. Podkožní forma
aplikace, řádově nižší dávka léčiva (20 mg v 0,4 ml)
ve srovnání s anti CD20 biologiky aplikovanými
intravenózně a plně humánní struktura protilátky velmi
pravděpodobně snižují jak závažnost, tak frekvenci nežádoucích
účinků, a proto před podáním ofatumumabu není nutná
premedikace [18,19].
encefalopatie (PML) ani jiné oportunní infekce
a riziko vzniku malignit bylo nízké [11]. Podkožní forma
aplikace, řádově nižší dávka léčiva (20 mg v 0,4 ml)
ve srovnání s anti CD20 biologiky aplikovanými
intravenózně a plně humánní struktura protilátky velmi
pravděpodobně snižují jak závažnost, tak frekvenci nežádoucích
účinků, a proto před podáním ofatumumabu není nutná
premedikace [18,19].
Během registračních studií ASCLEPIOS byly monitorovány čtyři těhotné ženy ve skupině léčené ofatumumabem, aktuálně máme k dispozici rozšířený soubor 32 exponovaných gravidit, přičemž výsledek je znám u 23 těhotenství – šest spontánních potratů, šest umělých přerušení těhotenství a 11 živě narozených dětí. U těchto dětí nebyly hlášeny žádné vrozené vady či malformace plodu, hematologické abnormality, deplece B lymfocytů nebo závažné infekce [8,20].
Pacient vhodný pro léčbu ofatumumabem
Paradigma léčby RS se mění. Skutečnost, že včasná terapeutická intervence hraje ve vývoji nemoci a v její dlouhodobé prognóze zásadní roli, je dnes již dobře známá a není nejmenších pochyb o tom, že v případě RS představuje jediný správný postup, jak zabránit ireverzibilnímu poškození CNS a oddálit nástup invalidity i o několik let [21,22]. Složitá otázka volby optimální strategie léčby RR RS je v posledních letech stále více diskutovaným tématem na domácích i zahraničních odborných fórech. Až donedávna zcela jednoznačně převládal tzv. eskalační přístup, jehož principem je zahájení terapie bezpečnějšími DMDs, avšak s nižší účinností a následnou ideálně rychlou eskalací do vyšší linie při jejich nedostatečném efektu. V reálné praxi to znamenalo, že vzhledem ke stanoveným úhradovým kritériím čekali někteří pacienti na HET několik let i navzdory tomu, že již v době stanovení diagnózy vykazovali známky nepříznivé prognózy nemoci. Pokud se u nich léky základní linie neosvědčily (vyjádřeno alespoň jedním středně těžkým relapsem), bylo možné přejít na léčbu účinnější, ale také finančně nákladnější [23]. Druhou variantu představuje imunorekonstituční terapie (dříve nazývaná indukční), která spočívá v nasazení HET již v začátku onemocnění, i s vědomím případného rizika výskytu závažných nežádoucích účinků [24,25]. Rychle přibývající důkazy z klinických studií, ale i samotné praxe jasně favorizují alternativu s iniciálním razantním potlačením zánětlivé aktivity nemoci a navozením dlouhodobé remise prostřednictvím HET [9,26,27].
O tomto konceptu se hovoří jako o „převrácení pyramidy“, jež odpovídá uplatnění HET v první linii léčby [28]. Literatura uvádí, že až u 60 % pacientů dochází při eskalačním přístupu před eskalací terapie k akumulaci disability [29], a naopak dokládá o 29 % nižší riziko progrese disability u nemocných léčených HET již po stanovení diagnózy [30]. Dle recentních dat z finského registru byla pravděpodobnost šestiměsíční CDP po pěti letech od zahájení léčby ve skupině HET 28,4 % oproti 47,0 % u DMD se střední účinností (p = 0,013) [31]. Z dalších dat vyplývá, že při časnějším zahájení HET je z dlouhodobého hlediska u RR RS menší riziko konverze do SP RS [32]. Používání HET v první léčebné linii bránily v mnoha evropských zemích včetně ČR vysoká cena léků a registrační podmínky. Přitom bylo prokázáno, že z ekonomického hlediska je mnohem výhodnější léčit pacienta co nejefektivněji ihned a nečekat na nárůst invalidity, která se pojí s omezenou soběstačností a poklesem pracovní schopnosti nemocného. Celkové náklady na léčbu totiž stoupají úměrně s progresí postižení. Dlouho očekávané změny v úhradovém systému českých zdravotních pojišťoven dovolují nyní nasadit HET i u nově diagnostikovaných pacientů s RR RS, tj. již po první atace nemoci. Jde o významný a z medicínského hlediska zcela jistě správný krok vpřed. Nicméně HET není automaticky indikována u všech. Na základě přesně stanovených kritérií je rezervována jen pro vybranou skupinu pacientů, kteří z ní budou mít co největší prospěch.
Ofatumumab je od 1. dubna 2022 v ČR hrazen:
- U pacientů s RR RS s invaliditou nepřesahující skóre 5,5 na stupnici EDSS (je možná chůze bez opory a bez zastavení ≥ 100 metrů) se známkami nepříznivé prognózy onemocnění, u kterých došlo navzdory léčbě nejméně jedním DMD první linie k rozvoji alespoň jednoho středně těžkého nebo těžkého relapsu.
- Nově také v první léčebné volbě u pacientů s aktivní formou RR RS (jeden dokumentovaný a léčený relaps v předchozím roce nebo dva dokumentované a léčené relapsy v předchozích dvou letech) a zároveň s významným nálezem na MR mozku (přítomnost T1 gadolinium enhancující léze a/nebo infratentoriální léze a/nebo spinální léze).
- Zobrazení pomocí MR hraje v souvislosti s RS nezastupitelnou roli jak v diagnostice, tak při sledování účinnosti zavedené terapie i odhadu prognózy nemoci. V současnosti představuje jediný validovaný biomarker stabilizace či progrese onemocnění. Mezi prediktivní zámky nepříznivé prognózy řadíme: přítomnost T1 gadolinium enhancujících lézí, přítomnost infratentoriálních a spinálních lézí [33–37].
Terapie ofatumumabem není dále hrazena, pokud pacient neodpovídá na léčbu např. při dvou těžkých relapsech za rok nebo při trvalé progresi podle EDSS (zvýšení skóre EDSS během 12 měsíců mimo ataku o jeden bod) či při ztrátě schopnosti chůze (tj. dosažení hodnoty EDSS > 6,5).
Před zahájením terapie ofatumumabem se doporučuje, podobně jako u jiných anti CD20 monoklonálních protilátek, realizovat: screening virových hepatitid B a C, sérologické vyšetření HIV 1, 2 (lidského viru imunodeficience), VZV (viru varicella zoster), sérologické stanovení koncentrací protilátek proti tetanovému toxoidu, kvantiferonový test na tuberkulózu, krevní obraz včetně diferenciálního rozpočtu a základní biochemii. Pokud pacient potřebuje podstoupit vakcinaci živou nebo živou atenuovanou očkovací látkou, je třeba tuto vakcinaci provést nejméně čtyři týdny před první aplikací ofatumumabu. V případě inaktivovaných vakcín je nutné dodržet časový odstup nejméně dva týdny. Lék je kontraindikován u pacientů se závažnou aktivní infekcí, u pacientů v těžce imunokompromitovaném stavu a také u nemocných se známou aktivní malignitou.
Vzhledem k tomu, že RS postihuje s přibližně dvoutřetinovou převahou mladé ženy v reprodukčním věku, otázka plánování gravidity pro ně představuje jedno z nejpodstatnějších témat [38,39]. Pacientky ve fertilním věku mají během léčby ofatumumabem a po dobu šesti měsíců po jeho posledním podání používat účinnou antikoncepci (metody, které vedou k méně než 1 % těhotenství). Není známo, zda se ofatumumab vylučuje do mateřského mléka [8].
Závěr
Příchodem na trh v roce 2021 ofatumumab rozšířil portfolio léků s vysokou účinností. Jedná se o první přípravek svého druhu přinášející pacientům unikátní možnost HET v domácím prostředí a po okrelizumabu teprve o druhý lék ze skupiny HET, který získal úhradu z prostředků veřejného zdravotního pojištění v rámci první linie léčby RR RS. Jde o průlom v dosavadních léčebných algoritmech, který reflektuje nejnovější vědecké poznatky. Dnes již existuje dostatek relevantních důkazů, které potvrzují, že časné nasazení HET zpomaluje progresi disability a zlepšuje dlouhodobou prognózu zejména u mladších pacientů trpících RR RS s jasně vyjádřenou klinickou i radiologickou aktivitou onemocnění. HET v první linii představuje naději právě pro tuto skupinu nemocných, u nichž bychom vzhledem ke známkám nepříznivého vývoje neměli ztrácet čas. Čas nelze vrátit zpět a v případě RS to platí dvojnásob. S každým relapsem a každou novou lézí na MR totiž dochází ke snižování rezerv CNS a spolu s nimi k poklesu schopnosti kompenzovat poškození nervů a ztrátu mozkové tkáně. Roztroušenou sklerózu stále neumíme vyléčit, lze ji však léčit a s pomocí moderních léků, sofistikovaných postupů a správně využitého tzv. okna příležitostí dostat pod kontrolu. Věříme, že s dostupností včasné HET se podaří velkou část vhodně indikovaných pacientů bez neurodeficitu či s minimálním funkčním postižením na určitou dobu plně stabilizovat.
Práce byla částečně podpořena grantem FN HK 00179906 a výzkumným programem Univerzity Karlovy COOPERATIO, vědní oblast NEUR.
Seznam použité literatury
- [1] Atlas of MS 3rd edition, 2020. Dostupné na: https://www.atlasofms.org/fact‑sheet/czech‑republic.
- [2] Murray TJ. The history of multiple sclerosis: the changing frame of the disease over the centuries. J Neurol Sci 2009; 277(Suppl 1): S3–S8.
- [3] Gelfand JM, Cree BAC, Hauser SL. Ocrelizumab and other CD20+ B‑cell‑depleting therapies in multiple sclerosis. Neurotherapeutics 2017; 14: 835–841.
- [4] Sospedra M. B cells in multiple sclerosis. Curr Opin Neurol 2018; 31: 256–262.
- [5] Bayer V. An overview of monoclonal antibodies. Semin Oncol Nurs 2019; 35: 150927.
- [6] Hamuro L, Kijanka G, Kinderman F, et al. Perspectives on subcutaneous route of administration as an immunogenicity risk factor for therapeutic proteins. J Pharm Sci 2017; 106: 2946–2954.
- [7] Viola M, Sequeira J, Seiça R, et al. Subcutaneous delivery of monoclonal antibodies: How do we get there? J Control Release 2018; 286: 301–314.
- [8] Souhrn údajů o přípravku Kesimpta. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/kesimpta‑epar‑product‑information_cs.pdf
- [9] Hauser SL, Fox E, Aungst A, et al. Long‑term efficacy of ofatumumab in patients with relapsing multiple sclerosis. P5.004, presented at the AAN 2022.
- [10] Teeling JL, Mackus WJ, Wiegman LJ, et al. The biological activity of human CD20 monoclonal antibodies is linked to unique epitopes on CD20. J Immunol 2006; 177: 362–371.
- [11] Hauser SL, Cross AH, Winthrop K, et al. Safety experience with continued exposure to ofatumumab in patients with relapsing forms of multiple sclerosis for up to 3.5 years. Mult Scler 2022; 28: 1576–1590.
- [12] Gupta IV, Jewell RC. Ofatumumab, the first human anti‑CD20 monoclonal antibody for the treatment of B cell hematologic malignancies. Ann N Y Acad Sci 2012; 1263: 43–56.
- [13] Gravanis I, Ersbøll J, Skovlund E, et al. The European Medicines Agency review of ofatumumab (Arzerra®) for the treatment of chronic lymphocytic leukemia in patients refractory to fludarabine and alemtuzumab: summary of the scientific assessment of the European medicines agency committee for medicinal products for human use. Oncologist 2010; 15: 1335–1343.
- [14] Hauser SL, Bar‑Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in multiple sclerosis. N Engl J Med 2020; 383: 546–557.
- [15] Pandit L. No Evidence of Disease Activity (NEDA) in multiple sclerosis – shifting the goal posts. Ann Indian Acad Neurol 2019; 22: 261–263.
- [16] Lu G, Beadnall HN, Barton J, et al. The evolution of “No Evidence of Disease Activity” in multiple sclerosis. Mult Scler Relat Disord 2018; 20: 231–238.
- [17] Hauser S, Bar‑Or A, Cohen J, et al. Ofatumumab versus Teriflunomide in relapsing multiple sclerosis: analysis of No Evidence of Disease Activity (NEDA‑3) from ASCLEPIOS I and II trials. Eur J Neurol 2020; 27 (S1).
- [18] Bar‑Or A, Grove RA, Austin DJ, et al. Subcutaneous ofatumumab in patients with relapsing‑remitting multiple sclerosis: The MIRROR study. Neurology 2018; 90: e1805–e1814.
- [19] Du FH, Mills EA, Mao‑Draayer Y. Next‑generation anti‑CD20 monoclonal antibodies in autoimmune disease treatment. Auto Immun Highlights 2017; 8: 12.
- [20] Hellwig K, Yamout B, Bove R, et al. Pregnancy outcomes in patients with multiple sclerosis following exposure to ofatumumab. P4.007, presented at the AAN 2022.
- [21] Giovannoni G, Butzkueven H, Dhib‑Jalbut S, et al. Brain health: time matters in multiple sclerosis. Mult Scler Relat Disord 2016; 9(Suppl 1): S5–S48.
- [22] Kavaliunas A, Manouchehrinia A, Stawiarz L, et al. Importance of early treatment initiation in the clinical course of multiple sclerosis. Mult Scler 2017; 23: 1233–1240.
- [23] Schmierer K, Sørensen PS, Baker D. Highly effective disease‑modifying treatment as initial MS therapy. Curr Opin Neurol 2021; 34: 286–294.
- [24] Cree BAC, Mares J, Hartung HP. Current therapeutic landscape in multiple sclerosis: an evolving treatment paradigm. Curr Opin Neurol 2019; 32: 365–377.
- [25] Ontaneda D, Tallantyre E, Kalincik T, et al. Early highly effective versus escalation treatment approaches in relapsing multiple sclerosis. Lancet Neurol 2019; 18: 973–980.
- [26] Buron MD, Chalmer TA, Sellebjerg F, et al. Initial high‑efficacy disease‑modifying therapy in multiple sclerosis: A nationwide cohort study. Neurology 2020; 95: e1041–e1051.
- [27] He A, Merkel B, Brown JWL, et al. Timing of high‑efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol 2020; 19: 307–316.
- [28] Giovannoni G. Disease‑modifying treatments for early and advanced multiple sclerosis: a new treatment paradigm. Curr Opin Neurol 2018; 31: 233–243.
- [29] Harding K, Williams O, Willis M, et al. Clinical outcomes of escalation vs early intensive disease‑modifying therapy in patients with multiple sclerosis. JAMA Neurol 2019; 76: 536–541.
- [30] Spelman T, Magyari M, Piehl F, et al. Treatment escalation vs immediate initiation of highly effective treatment for patients with relapsing‑remitting multiple sclerosis: data from 2 different national strategies. JAMA Neurol 2021; 78: 1197–1204.
- [31] Hänninen K, Viitala M, Atula S, et al. Initial treatment strategy and clinical outcomes in Finnish MS patients: a propensity‑matched study. J Neurol 2022; 269: 913–922.
- [32] Brown JWL, Coles A, Horakova D, et al. Association of initial disease‑modifying therapy with later conversion to secondary progressive multiple sclerosis. JAMA 2019; 321: 175–187.
- [33] Brownlee WJ, Altmann DR, Prados F, et al. Early imaging predictors of long‑term outcomes in relapse‑onset multiple sclerosis. Brain 2019; 142: 2276–2287.
- [34] Minneboo A, Barkhof F, Polman CH, et al. Infratentorial lesions predict long‑term disability in patients with initial findings suggestive of multiple sclerosis. Arch Neurol 2004; 61: 217–221.
- [35] Tintoré M, Rovira A, Arrambide G, et al. Brainstem lesions in clinically isolated syndromes. Neurology 2010; 75: 1933–1938.
- [36] Sombekke MH, Wattjes MP, Balk LJ, et al. Spinal cord lesions in patients with clinically isolated syndrome: a powerful tool in diagnosis and prognosis. Neurology 2013; 80: 69–75.
- [37] Dekker I, Sombekke MH, Balk LJ, et al. Infratentorial and spinal cord lesions: cumulative predictors of long‑term disability? Mult Scler 2020; 26: 1381–1391.
- [38] Krysko KM, Bove R, Dobson R, et al. Treatment of women with multiple sclerosis planning pregnancy. Curr Treat Options Neurol 2021; 23: 11.
- [39] Koch‑Henriksen N, Thygesen LC, Stenager E, et al. Incidence of MS has increased markedly over six decades in Denmark particularly with late onset and in women. Neurology 2018; 90: e1954–e1963.