Antitusika v běhu času
Souhrn
Slíva J. Antitusika v běhu času. Remedia 2025; 35: 398–402.
Kašel je přirozený obranný reflex, jehož tlumení má v medicíně dlouhou historii – od přírodních látek ve starověku až po moderní farmaka. V 19. století se začaly používat opioidní látky jako morfin a kodein, později byly vyvinuty bezpečnější neopioidní alternativy, např. butamirát, dextrometorfan aj. Předložený text shrnuje základní aspekty spojené s jejich klinickým využitím s reflexí aktuální situace v České republice a nesmělým výhledem do budoucna.
Klíčová slova: kašel – antitusika – léčba – kombinace – expektorancia.
Summary
Sliva J. Antitussives in the course of time. Remedia 2025; 35: 398–402.
Cough is a natural defensive reflex, the suppression of which has a long history in medicine – from natural substances in ancient times to modern pharmaceuticals. In the 19th century, opioid substances such as morphine and codeine began to be used, and later safer non‑opioid alternatives, such as butamirate, dextromethorphan etc., were developed. The presented text summarizes the basic aspects associated with their clinical use with a reflection of the current situation in the Czech Republic and a timid outlook for the future.
Key words: cough – antitussives – treatment – combination – expectorants.
Historie antitusik v medicíně
Kašel jako obranný reflex dýchacích cest byl popsán již ve starověkých lékařských spisech, přičemž jeho potlačení bylo cílem léčby zejména tehdy, když se stal chronickým, bolestivým nebo neproduktivním. První zmínky o látkách s antitusickým účinkem pocházejí z tradiční čínské, indické a arabské medicíny, kde byly využívány přírodní extrakty jako opium, med, tymián nebo lékořice.
S rozvojem moderní farmakologie v 19. století se začaly objevovat první izolované účinné látky. Morfin, izolovaný z opia, byl jedním z prvních účinných centrálně působících antitusik a jeho deriváty, jako je kodein, se staly standardem léčby suchého kašle. Kodein byl poprvé syntetizován v roce 1832 a jeho antitusický účinek byl systematicky studován v průběhu 20. století.
Na konci 19. století se heroin neobjevil jako nebezpečná pouliční droga, kterou známe dnes, ale jako oslavovaný lékařský průlom. V roce 1895 německý chemik Felix Hoffmann, pracující pro farmaceutickou společnost Bayer, syntetizoval diacetylmorfin – brzy byl uveden na trh pod obchodním názvem „Heroin“. Společnost Bayer jej představila veřejnosti v roce 1898 a propagovala jako nenávykovou alternativu morfia a silný lék na respirační onemocnění.
V té době byly tuberkulóza a zápal plic rozšířenými a často smrtelnými onemocněními a hlavním příznakem byl vytrvalý kašel. Heroin se svou silnou schopností potlačovat kašlací reflex byl oslavován jako zázračný lék. Prodával se v různých formách – sirupy, pastilky a tablety – a lékaři ho hojně předepisovali. Samotný název „heroin“ byl odvozen z německého slova „heroisch“, s významem „hrdinský“ nebo „silný“, což odráží vnímanou sílu a účinnost drogy. Počáteční optimismus však neměl dlouhého trvání. Lékaři si brzy začali všímat, že pacienti si vyvinuli toleranci na heroin a k dosažení stejných účinků potřebovali vyšší dávky. Na počátku 20. století již byla návyková povaha heroinu nepopiratelná. V reakci na rostoucí obavy začaly vlády regulovat jeho používání. Ve Spojených státech amerických zákon o heroinu z roku 1924 jej zcela postavil mimo zákon, a to i pro lékařské účely. To znamenalo konec jeho krátké, ale působivé kariéry jakožto legálního léčiva k potlačení kašle.
Ve 20. století došlo k významnému rozvoji v oblasti vývoje neopioidních antitusik, jako je dextrometorfan, který byl zaveden do klinické praxe v 50. letech. Tato látka působí na centrální nervový systém (CNS), ale bez výrazného rizika závislosti, což z něj činí bezpečnější alternativu k opioidním antitusikům.
V posledních desetiletích se výzkum zaměřuje na periferně působící antitusika a na pochopení neurofyziologie kašlacího reflexu. Byly identifikovány různé typy senzorických receptorů v dýchacích cestách, jako jsou RAR (rychle se adaptující receptory) a C‑vlákna, které hrají klíčovou roli v iniciaci kašle. Tento pokrok umožnil vývoj cílenějších léčiv s menším počtem nežádoucích účinků.
Klasifikace antitusik
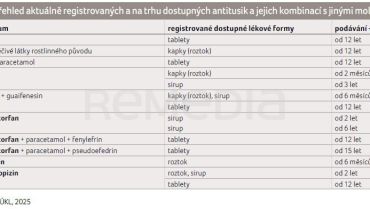 Antitusika se dělí podle místa účinku na centrálně a periferně působící, přičemž každá skupina zahrnuje více účinných látek s různými farmakologickými profily (následující přehled představuje z autorova pohledu nejvýznamnější zástupce) [1]. Přehled účinných látek a jejich kombinací určených na léčbu suchého kašle obsažených v léčivých přípravcích, které jsou aktuálně registrované a dostupné na trhu v České republice, ukazuje tabulka 1 [2].
Antitusika se dělí podle místa účinku na centrálně a periferně působící, přičemž každá skupina zahrnuje více účinných látek s různými farmakologickými profily (následující přehled představuje z autorova pohledu nejvýznamnější zástupce) [1]. Přehled účinných látek a jejich kombinací určených na léčbu suchého kašle obsažených v léčivých přípravcích, které jsou aktuálně registrované a dostupné na trhu v České republice, ukazuje tabulka 1 [2].
Třebaže v klinické praxi se relativně běžně setkáváme i s využitím jiných lékových skupin v léčbě kašle (zejména H1 antihistaminika – dimetinden, prometazin aj.; rostlinné extrakty – Plantago lanceolata, Tussilago farfara, Sambucus nigra, Pelargonium sidoides aj.), tyto jsou pro přehlednost textu primárně pojednávajícího o antitusikách (ATC kód: R05D) a jejich kombinacích s jinými molekulami cíleně opominuty.
- Centrálně působící antitusika
Působí na kašlací centrum v prodloužené míše a tlumí kašlací reflex.
a) Opioidní antitusika
- Dihydrokodein – podobný kodeinu, s mírně delším účinkem. V České republice t. č. dostupný pouze v léčivých přípravcích určených k tlumení středně těžké až těžké bolesti. Jako antitusikum u nás není registrován.
- Folkodin – silnější antitusický účinek než kodein, bez analgetického účinku, nižší riziko závislosti, vhodnější pro děti. V ČR t. č. není registrován.
- Hydrokodon – silnější než kodein, ale s vyšším rizikem závislosti. V ČR t. č. není registrován.
- Kodein – metylderivát morfinu, má antitusický, analgetický a sedativní účinek. Je indikován pro léčbu dráždivého neproduktivního kašle různého původu. Obecně se v praxi používá v případě silného (bolestivého) kašle nebo když jiná antitusika nezabírají. Mezi jeho nejčastější nežádoucí účinky patří zácpa, nauzea, zvracení, útlum dechového centra, retence moči či palpitace. Kodein je obsažen i v kombinovaných přípravcích s expektorancii rostlinného původu, jako jsou tymiánový extrakt či saponiny, které mají slabé antitusické, antiseptické a expektorační účinky. Při užívání kodeinu je z pohledu lékových interakcí třeba pamatovat na zvýšené riziko zácpy při kombinaci s jinými potenciálně obstipačně působícími látkami (anticholinergika, diuretika, hydroxid hlinitý, opioidy, verapamil aj.), útlum CNS při komedikaci látek s centrálně tlumivým účinkem či možné zesílení jeho účinků při kombinaci s inhibitory monoaminooxidázy (IMAO). Přípravky s obsahem kodeinu je možné u dětí podávat až od věku 12 let.
b) Neopioidní antitusika
- Butamirát – působí tlumivě na centrum kašle v prodloužené míše, avšak, na rozdíl od opioidních antitusik, bez možného rizika rozvoje respirační deprese. Zároveň na periferní úrovni blokuje receptory kašle a snižuje jejich dráždivost, má anticholinergní a bronchodilatační účinky. Jeho nežádoucí účinky jsou minimální a jako jedno z mála antitusik je ho možno podávat i u kojenců ve věku od dvou měsíců ve formě sirupu či kapek. Obvyklé dávkování je při obsahu 5 mg účinné látky v 1 ml perorálního roztoku následující: děti od 2 měsíců do 1 roku: 10 gtts 4× denně; 1–3 roky: 15 gtts 4× denně, děti od 3 let: 25 gtts 4× denně.
- Dextrometorfan – nekompetitivní antagonista NMDA (N‑metyl‑D‑aspartát) receptorů. Z pohledu interakcí je třeba pamatovat vedle rizikové (kontraindikované!) kombinace s IMAO a centrálně tlumivě působícími látkami rovněž na konkomitantní užívání inhibitorů cytochromu P450 2D6, které mohou zpomalovat jeho biotransformaci, a tak zvyšovat riziko jeho toxicity. Dextrometorfan byl v posledních letech předmětem zneužívání pro svůj halucinogenní účinek mezi mladistvými. Některé z přípravků s jeho obsahem byly proto nedávno převedeny z režimu volného prodeje na výdej na předpis. Dextrometorfan je antitusikum, které je obecně dobře tolerováno a lze je také užít u menších dětí ve věku již od dvou let (2–6 let: 3,75 mg à 4 h; 6–12 let: 7,5 mg à 4 h).
- Pentoxyverin – centrálně působící, snižuje dráždivost kašlacího centra, má i mírný spasmolytický účinek. V ČR t. č. není registrován.
- Periferně působící antitusika
Působí na receptory v dýchacích cestách, snižují citlivost aferentních nervových zakončení.
- Dropropizin – působí spíše na periferii, kde blokuje senzitivní percepční místa v laryngotracheální oblasti, čímž se snižuje jejich dráždivost a tlumí kašel. Přídatný antihistaminový účinek navíc tlumí kašel alergického původu. Tato látka netlumí dechové centrum a ve srovnání s kodeinovými deriváty nehrozí ani riziko rozvoje závislosti. Jeho výhodou je dobrá tolerance a také možnost podávání u kojenců od šesti měsíců. Obvyklé dávkování u dětí je při obsahu 22 mg účinné látky v 1 ml perorálního roztoku následující: ve věku 6–12 měsíců 6 gtts 3–4× denně, ve věku 1–3 roky 13 gtts 3–4× denně, ve věku 3–13 let 26 gtts 3–4× denně.
- Levodropropizin – levotočivý izomer dropropizinu, navíc s antialergickým a antibronchospastickým účinkem, vhodný i jako premedikace před bronchoskopií. obvyklá antitusicky účinná dávka pro dospělé je 60 mg 3× denně. Lze jej využít i u dětí starších dvou let s adekvátní úpravou dávkování.
- Prenoxdiazin – působí na periferní receptory, snižuje citlivost sliznice dýchacích cest, používá se zejména v Německu a některých dalších zemích. V ČR t. č. není registrován.
Poznámky ke klinickému využití antitusik
Přestože se v minulosti objevovaly pochybnosti o účinnosti některých volně prodejných přípravků na kašel, moderní farmakologie nabízí široké spektrum antitusik, která mají různé mechanismy účinku, jsou dobře snášena a dostupná bez lékařského předpisu. Na druhé straně máme pro jiné případy k dispozici přípravky vázané na lékařský předpis, jež mají v praxi též své místo.
Tato rozmanitost umožňuje zvolit vhodný přípravek podle typu a intenzity kašle, a to v některých případech i bez nutnosti návštěvy lékaře. Důležité je také zmínit, že antitusika nejsou určena k léčbě příčiny onemocnění, ale k úlevě od nepříjemných příznaků, což může významně přispět ke zlepšení kvality života během nemoci. Obecně řečeno, při správném výběru a dodržení doporučeného dávkování jsou volně prodejná antitusika bezpečnou a efektivní volbou pro úlevu od suchého kašle.
U dětí a starších pacientů se preferují neopioidní a periferně působící látky kvůli nižšímu riziku nežádoucích účinků (riziko závislosti, útlum dechového centra, zácpa aj.). Obvykle doporučovaná maximální délka léčby bez porady s lékařem je sedm dní. Vždy se přitom má užívat nejnižší účinná dávka po co nejkratší dobu nutnou ke zmírnění příznaků.
Kombinace antitusik s expektorancii je obecně nevhodná, protože mají opačný účinek – antitusika tlumí kašel, zatímco expektorancia podporují vykašlávání. I přesto se s jejich kombinací (v dílčích léčivých přípravcích nebo jako fixní léková kombinace) v běžné klinické praxi opakovaně setkáváme.
Možná poptávka po takovémto přístupu plyne z přirozené evoluce kašle, jenž kupř. při infekci velmi často přechází od suchého k vlhkému a jako dráždivý může po prodělané infekci i několik dní či týdnů přetrvávat. V iniciálních fázích nemoci může být přitom změna charakteru kašle velmi dynamická. Současně bohužel mnohdy ani samotný pacient není schopen při konzultaci v lékárně přesně popsat, jaký kašel jej aktuálně trápí.
Na obhajobu možné kombinace antitusik s expektorancii (např. guaifenesinem aj.) zmiňme ještě relativně časté doporučení stran preference expektorancia přes den a navečer volbu antitusika s cílem dosažení klidnějšího spánku. Ke zmíněnému guaifenesinu pro zajímavost uveďme, že i tato látka dle některých studií vykazuje vlastní antitusické účinky, třebaže ji primárně vnímáme jako expektorans. U pacientů s infekcí horních cest dýchacích bylo prokázáno, že guaifenesin snižuje citlivost kašlacího reflexu [3,4].
V kontextu výše uvedeného je však třeba léčbu kašle volit vždy dle aktuálního stavu nemocného s přihlédnutím k případným komorbiditám a komedikacím.
Pohled do budoucna
Globální trh s léky na potlačení kašle je připraven na významný růst v příštím desetiletí. Odhaduje se, že v roce 2025 dosáhne trh 28 898,8 milionu dolarů, přičemž projekce naznačují nárůst na 54 260,1 milionu dolarů do roku 2035. Tato expanze je dána složenou roční mírou růstu (CAGR) ve výši 6,5 %, což odráží rostoucí poptávku po lécích proti kašli po celém světě. K tomuto nárůstu trhu přispívá rostoucí prevalence respiračních infekcí, chronický kašel vyvolaný životním stylem a inovace ve farmaceutických přípravcích [5,6].
Stran zmíněných inovací namátkou uveďme alespoň několik příkladů, respektive horkých kandidátů na vstup do klinické praxe. Jednou z nejslibnějších inovací v léčbě suchého kašle je látka s prozatímním označením EX937, která představuje změnu paradigmatu v tom, jak se přistupuje k chronickému a refrakternímu suchému kašli – primárně se zaměřuje na neurologický základ kašlacího reflexu. EX937 navozuje inhibici enzymu FAAH (amidhydroláza mastných kyselin). FAAH metabolizuje anandamid, přirozeně se vyskytující endokanabinoid, jenž se mj. podílí na modulaci bolesti a smyslovém zpracování. Inhibicí FAAH tedy vzrůstá koncentrace anandamidu, což pomáhá desenzibilizovat nadměrně aktivní neurony v dýchacích cestách [5].
Zajímavý cíl představuje modulace receptorů P2XR (látky BLU‑5937, gefapixant aj.). Kupříkladu BLU‑5937 je malá molekula, jež působí jako silný, selektivní a nekompetitivní antagonista homotrimerního receptoru P2X3. Receptory P2X3 jsou adenosintrifosfátem (ATP) řízené iontové kanály umístěné na primárních aferentních neuronech. ATP uvolňovaný z poškozených nebo zanícených tkání v dýchacích cestách působí na P2X3 receptory primárních aferentních neuronů, vyvolává depolarizaci a akční potenciály, které jsou přenášeny centrálně a interpretovány jako nutkání ke kašli. Existují silné preklinické a klinické důkazy podporující roli P2X3 receptorů v hypersenzibilizaci kašlacího reflexu vedoucí k chronickému kašli. Inhibicí receptorů P2X3 na primárních senzorických neuronech by BLU‑5937 inhibovala hypersenzibilizaci kašlacího reflexu a tím i přehnaný kašel. Bohužel často uváděným problémem spojeným s podáváním antagonistů P2XR bývá výrazná dysgeuzie [7–9].
Velmi horkou novinku představuje NOC‑110 (taplucainium), působící jako blokátor sodíkových kanálů určený k inhalačnímu podání. Selektivně umlčuje hyperaktivní nervová zakončení v dýchacích cestách, aniž by současně jakkoliv významně ovlivňoval jiné nervové funkce [6,10].
Bez zajímavosti jistě nejsou ani pokroky v modulaci opioidních receptorů. Látky s duálně působícím mechanismem agonismu kappa receptoru a antagonismu mí receptoru mohou být účinné při léčbě chronického kašle bez možnosti zneužití [11]. Pravděpodobně nejlépe si v této oblasti aktuálně stojí nalbufin [6,12].
Paralelně s uvedeným vzrůstá poptávka spotřebitelů po rostlinné a bylinné léčbě kašle, která nezřídka vychází z obav z možných nežádoucích účinků a z přesvědčení, že vše přírodní je nejlepší. Stále častěji se tak již dnes setkáváme s přípravky na bázi medu, extraktu z listů břečťanu (Hedera helix) či tymiánu (Thymus vulgaris), kořene proskurníku (Althaea officinalis) a mnoha dalších, přičemž i zde jsme svědky stále probíhajícího základního i aplikovaného výzkumu směřujícího k objasnění jejich možných klinických benefitů.
Patrné jsou jistě i technologické inovace. Jde například o sirupy s postupným uvolňováním účinné látky, tablety dispergovatelné v ústech či pastilky, které poskytují dlouhodobější úlevu a lepší spolupráci pacienta. Tyto přípravky mají za cíl snížit frekvenci dávkování a zlepšit pohodlí, zejména při nočním kašli.
Konečně budoucí léčba může zahrnovat genetické profilování a profilování biomarkerů k identifikaci pacientů, kteří budou mít větší pravděpodobnost prospěchu ze specifické antitusické terapie. To by ostatně mohlo být užitečné zejména při rozlišování mezi kašlem klinicky podobným, avšak etiologicky heterogenním, a tedy pro volbu optimální léčby.
Článek vznikl ve spolupráci se společnosti Teva Pharmaceuticals CR, s.r.o.
Literatura
[1] Morice A, Kardos P. Comprehensive evidence‑based review on European antitussives. BMJ Open Respir Res 2016; 3: e000137.
[2] https://sukl.gov.cz [navštíveno 18. 7. 2025]
[3] Dicpinigaitis PV, Gayle YE. Effect of guaifenesin on cough reflex sensitivity. Chest 2003; 124: 2178–2181.
[4] Dicpinigaitis PV, Gayle YE, Solomon G, Gilbert RD. Inhibition of cough‑reflex sensitivity by benzonatate and guaifenesin in acute viral cough. Respir Med 2009; 103: 902–906.
[5] FMI. Cough Suppressant Market. Dostupné na: https://www.futuremarketinsights.com/reports/cough‑suppressant‑market [navštíveno 17. 6. 2025]
[6] Chronic Refractory Cough Drug Pipeline Analysis Report 2025. Dostupné na: https://www.expertmarketresearch.com/clinical‑trials/chronic‑refractory‑cough‑drug‑pipeline‑insight [navštíveno 17. 6. 2025]
[7] Garceau D, Chauret N. BLU‑5937: A selective P2X3 antagonist with potent anti‑tussive effect and no taste alteration. Pulm Pharmacol Ther 2019; 56: 56–62.
[8] Kum E, Patel M, Diab N, et al. Efficacy and Tolerability of Gefapixant for Treatment of Refractory or Unexplained Chronic Cough: A Systematic Review and Dose‑Response Meta‑Analysis. JAMA 2023; 330: 1359–1369.
[9] Dicpinigaitis PV, McGarvey LP, Canning BJ. P2X3‑Receptor Antagonists as Potential Antitussives: Summary of Current Clinical Trials in Chronic Cough. Lung 2020; 198: 609–616.
[10] EU Clinical Trials. Study on the Effectiveness and Safety of Taplucainium Inhalation Powder (NOC‑110) for Adults with Refractory or Unexplained Chronic Cough. Dostupné na: https://clinicaltrials.eu/trial/study‑on‑the‑effectiveness‑and‑safety‑of‑taplucainium‑inhalation‑powder‑noc‑110‑for‑adults‑with‑refractory‑or‑unexplained‑chronic‑cough [navštíveno 18. 6. 2025]
[11] Birring SS, Dicpinigaitis PV, Maher TM, et al. Kappa and Mu Opioid Receptors in Chronic Cough: Current Evidence and Future Treatment. Lung 2025; 203: 62.
[12] Maher TM, Avram C, Bortey E, et al. Nalbuphine Tablets for Cough in Patients with Idiopathic Pulmonary Fibrosis. NEJM Evid 2023; Aug; 2: EVIDoa2300083.