Ekulizumab a ravulizumab – inhibitory C5 složky komplementu v léčbě generalizované formy myasthenia gravis
Souhrn
Týblová M. Ekulizumab a ravulizumab – inhibitory C5 složky komplementu v léčbě generalizované formy myasthenia gravis. Remedia 2024; 34: 302–308.
U těžších forem generalizované myasthenia gravis, s prokázanými protilátkami proti acetylcholinovému receptoru, může již být v indikovaných případech zvážena nová léčba inhibitory C5 složky komplementu. Tímto zásahem do komplementové kaskády zabrání nové léky formování membrány atakujícího komplexu, což významně sníží destrukci nervosvalové ploténky. Jejich efekt je prokázán studiemi fáze III kontrolovanými placebem. Vedle jasného setrvalého efektu léčby na průběh choroby mají tato léčiva i dobrý bezpečnostní profil a výrazně rychlejší nástup účinku oproti standardní imunosupresivní terapii. Jen je při této léčbě zvýšeno riziko infekce způsobené Neisseria meningitidis, a proto je očkování proti tomuto agens povinné.
Klíčová slova: ravulizumab – ekulizumab – inhibitory komplementu – myasthenia gravis.
Summary
Tyblova M. Eculizumab and ravulizumab – C5 complement inhibitors in the treatment of generalized myasthenia gravis. Remedia 2024; 34: 302–308.
In more active forms of generalized myasthenia gravis with positive antibodies against the acetylcholine receptor, a novel treatment with C5 complement inhibitors can already be considered in indicated cases. By interfering with the complement cascade, the novel drugs prevent the formation of the membrane attacking complex, thus significantly reducing the destruction of the neuromuscular plate. Their effect is proven by placebo‑controlled phase 3 studies. In addition to the clear persistent effect on the course of disease, the treatment also has a good safety profile and significantly faster onset of action compared to standard immunosuppressive treatment. The only “drawback” consists of mandatory vaccination against Neisseria meningitidis since the risk of infection with this agent is increased during the above mentioned therapy.
Key words: ravulizumab – eculizumab – complement inhibitors – myasthenia gravis.
Úvod
Myasthenia gravis (MG) je vzácné autoimunitní onemocnění, při němž dochází k blokádě nervosvalové ploténky v oblasti receptoru a jeho okolí. Dosud byla terapie postavena na symptomatickém podávání inhibitorů cholinesterázy a nespecifickém ovlivnění imunopatogeneze glukokortikoidy, intravenózními imunoglobuliny (IVIG), aferetickými metodami a nesteroidními imunosupresivy. Nové dvě lékové skupiny již zasahují specificky do imunopatogeneze. Ve srovnání s původní léčbou mají výrazně rychlejší efekt i dobrý bezpečnostní profil [1].
Blokáda neonatálního Fc receptoru vede ke snížení sérové koncentrace imunoglobulinu G (IgG) včetně patologických autoprotilátek a lze očekávat efekt téměř u všech myastenických pacientů. Mechanismus účinku je tedy podobný jako u plazmaferézy/imunoadsorpce a IVIG. Inhibitory C5 složky komplementu nelze použít u pacientů s pozitivitou protilátek proti tyrozinkináze (muscle specific tyrosinkinase antibodies, MuSK Ab). MuSK protilátky jsou zejména podtřídy IgG4, a tak u nich po navázání na cílový epitop nedochází k aktivaci komplementové kaskády. U MG s protilátkami proti acetylcholinovému receptoru (AChR Ab, séropozitivních) k aktivaci komplementu dochází. Lze očekávat podobný mechanismus účinku i u pacientů s pozitivními protilátkami proti receptoru lipoproteinu 4 (LRP4) [2,3] a rovněž u séronegativních [4], u těchto skupin však zatím chybějí dostatečná data z farmakologických studií, která by tento předpoklad potvrdila.
Komplementový systém
Komplementový systém hraje důležitou roli jak u vrozené, tak u protilátkami zprostředkované imunity [5]. Hlavním cílem komplementu je zničení a odstranění antigenu, účastní se ale i samotné zánětlivé reakce a působí imunomodulačně [6]. Jeho součástí je asi 40 bílkovinných složek a dalších kofaktorů či regulačních molekul vyskytujících se v séru a na povrchu buněk. Prekurzory komplementu C1–9 jsou inaktivované a až za určitých podmínek dojde k jejich kaskádové aktivaci [7], kdy se štěpí na část menší (většinou označována jako a) a větší (většinou označována jako b) [6]. Menší část má různé úlohy jako mediátor zánětu, větší má vazebné místo a enzymatickou aktivitu.
Existují tři dráhy (klasická, lektinová a alternativní), které se liší způsobem aktivace a zapojení složek komplementu C1–5 do celé kaskády (obr. 1) [8].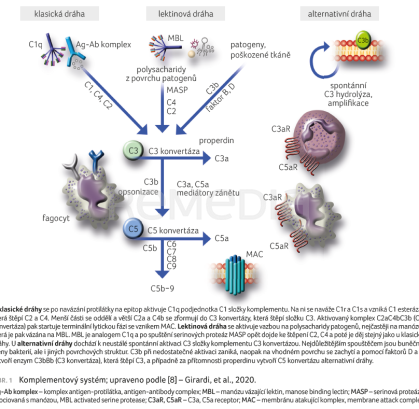
Klasická dráha začíná aktivací C1q podjednotky C1 složky komplementu po navázání protilátky na cílový epitop. Lektinová je spuštěna polysacharidovými složkami povrchu mikroorganismů, které se naváží na lektin vázající manózu (manose binding lectin, MBL). C1q a MBL se chovají podobně a s jejich pomocí je aktivována C2 a C4 složka komplementu za vzniku C3 konvertázy. Alternativní dráha se může aktivovat spontánně, kdy se C3 složka komplementu samovolně štěpí. Spouštěčem alternativní dráhy mohou být buněčné stěny bakterií, ale i jiné povrchové struktury. Vzniklé C3b při nedostatečné aktivaci zaniká, a naopak na vhodném povrchu se zachytí a pomocí faktorů D a B se vytvoří enzym C3 konvertáza (C3bBb). Ta štěpí C3 protein a poté za přítomnosti properdinu vytvoří C5 konvertázu (C3bBbP) alternativní dráhy. Z normálních podmínek je spontánní aktivace regulována různými proteiny tak, aby nedošlo k poškození vlastních zdravých buněk, a přitom byla aktivace efektivní proti patogenu.
U klasické a lektinové dráhy po zahájení úvodní kaskády (obr. 1) dochází k formování C3 konvertázy (C4bC2a) [6] a k rozštěpení C3 složky komplementu na C3a a C3b. C3b se podílí na formování C5 konvertázy (C3bC4bC2a), která rozštěpí C5 složku komplementu na C5a a C5b. Stejně jako C3a i C5a je menší fragment, který má specifické prozánětlivé funkce včetně opsonizace a chemotaxe [9]. Oproti tomu C5b je vázán membránově a kaskádovou aktivací s účastí složek C6–9 komplementu vzniká terminální produkt komplementové kaskády – membránu atakující komplex (membrane attack complex, MAC). MAC pak v membráně buněk působí jako pór umožňující vstup iontů kalcia do buněk a dochází také k poruše osmotické rovnováhy, což vede k destrukci buněk [10].
Inhibitory komplementu u myasthenia gravis
Komplement se podílí na patogenezi onemocnění u AChR Ab pozitivních. Tyto autoprotilátky podtřídy IgG1 a IgG3 po vazbě na receptor aktivují klasickou komplementovou kaskádu. Inhibitory blokují aktivaci terminálního komplementu, a přitom zachovávají funkční iniciální komponenty aktivace komplementu, které jsou nezbytné pro opsonizaci mikroorganismů a clearance (odstraňování) imunokomplexů. Vazbou inhibitoru na protein komplementu C5 je tedy zablokováno rozštěpení na C5a a C5b, navázání C5b na C6 a následná postupná aktivace komplementového systému C6–9. Tím nedojde ke zformování MAC, který se pak podílí na strukturálních změnách nervosvalové ploténky [11]. Jak je patrné na obrázku 1, komplementová kaskáda je komplexnější děj a u MG nedochází jen k aktivaci klasické dráhy, ale určitou roli v síle aktivace C3 konvertázy hraje alternativní dráha [12].
V současné době jsou schváleny tři léčivé přípravky s podobným mechanismem účinku – ekulizumab, ravulizumab a zilukoplan [13]. Inhibitory C5 složky komplementu nejen brání destrukci nervosvalové ploténky tím, že se nevytvoří MAC, ale redukují také lokální zánět způsobený složkou C5a. První dva se liší od zilukoplanu místem, kde se na C5 složku komplementu vážou, a způsobem aplikace. Ravulizumab a ekulizumab jsou v současné době aplikovány intravenózně (i.v.). Zilukoplan je podáván subkutánně a na rozdíl od výše zmíněných navíc blokuje navázání C5b na C6. Na odlišné vazebné místo u zilukoplanu je zatím poukazováno hlavně z důvodu vzácné C5 mutace u 3,5 % japonské populace, která je ohrožena rizikem farmakorezistence na ekulizumab [14].
Všechny léky mají relativně dobrý bezpečnostní profil, ale mohou svým mechanismem účinku zvýšit riziko rozvoje meningokokových infekcí způsobených Neisseria meningitidis, a proto je povinné očkování pokrývající různé sérotypy [15]. Vakcinace a případná revakcinace probíhá dle platných národních pokynů. V České republice se pro kmeny A, C, W‑135 a Y nejčastěji podává vakcína Nimenrix a pro kmeny B vakcína Bexsero [16]. Očkování musí proběhnout nejméně dva týdny před zahájením léčby; jestliže k tomu nedojde, pak je nutné podávat preventivně antibiotika penicilinové řady (nejčastěji amoxicilin/klavulanát) až do dvou týdnů po ukončeném očkování. Zvýšené riziko výskytu infekcí platí i pro další druhy bakterií rodu Neisseria, tedy i pro gonokokové infekce.
Studie zaměřená na inhibitory složky komplementu probíhá ještě s kombinací cemdisiranu a pozelimabu. Pozelimab je monoklonální protilátka proti C5 složce komplementu. Cemdisiran je N‑acetylgalaktosamin konjugovaný s RNAi (i = interference), který reguluje transkripci a vnitrobuněčnou expresi genu. Vyřazením tohoto genu dochází k útlumu produkce komplementu hepatocyty [17]. Probíhá také klinické zkoušení subkutánní formy inhibitoru C5 složky komplementu (gefurulimab, fáze III) [18].
Ekulizumab
Ekulizumab je humanizovaná monoklonální protilátka, která se specificky a s vysokou afinitou váže na protein komplementu C5, čímž brání jeho štěpení na C5a a C5b a tvorbě terminálního komplexu komplementu C5b–9. V České republice byl schválen pro léčbu MG v roce 2017 na podkladě výsledků studie REGAIN. Zkušenosti s tímto lékem jsou ale již více než patnáctileté, protože od roku 2007 je schválen Evropskou lékovou agenturou (EMA) pro léčbu paroxysmální noční hemoglobinurie [19]. Je také používán pro léčbu atypického hemolyticko‑uremického syndromu [20] a pro pacienty s neuromyelitis optica s pozitivitou protilátek proti akvaporinu 4 [21]. V případě MG je ekulizumab indikován pro refrakterní generalizovanou formu (gMG) u pacientů ve věku šest let a starších, u nichž jsou přítomny protilátky proti acetylcholinovému receptoru.
Do dvojitě zaslepené, placebem kontrolované studie fáze III REGAIN bylo zařazeno celkem 125 AChR Ab pozitivních farmakorezistentních pacientů se skóre MG‑ADL (Activities of Daily Living) ≥ 6 bodů a MGFA (Myasthenia Gravis Foundation of America) II–IV. Farmakorezistence byla definována tak, že pacient není buď dostatečně kompenzován na dvou nebo více imunosupresivech, nebo byla u pacienta při první léčbě imunosupresivy nutná čtyřikrát v jednom roce aplikace IVIG nebo plazmaferézy, a to akutně nebo v chronickém režimu. Do studie nebyli zařazeni pacienti po recentním zaléčení relapsu v posledních čtyřech týdnech, s tymomem a po tymektomii provedené v roce screeningu, a také byli vyloučeni nemocní v myastenické krizi (MGFA V). [9]. Jako významný efekt byl pro ekulizumab určen pokles o tři body na škále MG‑ADL [22] a o pět bodů ve skóre QMG (Quantitative Myasthenia Gravis) [23].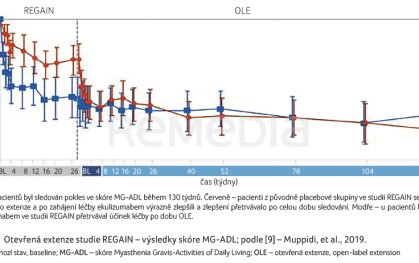
Primárním cílovým ukazatelem studie REGAIN byla změna v celkové hodnotě MG‑ADL po 26 týdnech léčby. Tato analýza proběhla prostřednictvím nejhorší hodnoty testu ANCOVA při porovnání hodnot u pacientů léčených ekulizumabem a placebem a její výsledky nebyly statisticky signifikantní (p = 0,0698). Výsledky analýzy hodnot MG‑ADL při opakovaných měřeních po 26 týdnech léčby již signifikantní byly. Došlo sice k poklesu skóre MG‑ADL u obou skupin, ale u léčených ekulizumabem bylo snížení výraznější (–4,2) oproti placebové větvi (–2,3), p = 0,0058. Také ve všech dalších sledovaných sekundárních cílových parametrech bylo zaznamenáno statisticky významné zlepšení u všech hodnocených škál (MG‑ADL, QMG ‚ MGC – MG Composite) [24].
V otevřené extenzi studie REGAIN pokračovalo 117 pacientů a byli sledováni až čtyři roky. U pacientů z placebové větve došlo po přechodu na léčbu ekulizumabem k rychlému zlepšení všech sledovaných parametrů, u pacientů dosud léčených ekulizumabem zlepšení stabilně přetrvávalo (graf 1) [9]. Byl tedy prokázán dlouhodobý efekt, 56 % pacientů dosáhlo minimální manifestace příznaků nebo farmakologické remise [9]. Oproti skupině s placebem došlo u pacientů léčených ekulizumabem k menšímu počtu exacerbací (15 vs. 6) [24]. Oproti roku před zahájením studie REGAIN bylo zaznamenáno výrazné snížení výskytu exacerbací o 75 % (p ≤ 0,0001). V extenzi studie již bylo povoleno zredukovat imunosupresivní léčbu. Celkem se podařilo z důvodu zmírnění příznaků MG přerušit léčbu, nebo alespoň snížit dávku jednoho imunosupresiva téměř u poloviny pacientů (48,7 %) [9]. V tomto režimu bylo pozorováno snížení denní dávky alespoň jednoho imunosupresiva u 65 % pacientů; u 43,6 % pacientů byla dříve zahájená léčba imunosupresivy ukončena [25].
Lék byl ve studii REGAIN i v její extenzi dobře tolerován, s uspokojivým bezpečnostním profilem. Nejběžnějšími nežádoucími účinky byly bolest hlavy a záněty horních cest dýchacích, zejména nazofaryngitidy, tíže příznaků byla lehká nebo středně těžká. Nebyl zaznamenán zásadní rozdíl ve výskytu nežádoucích událostí mezi oběma skupinami pacientů. Po celou dobu studie se neobjevil žádný případ meningitidy [9].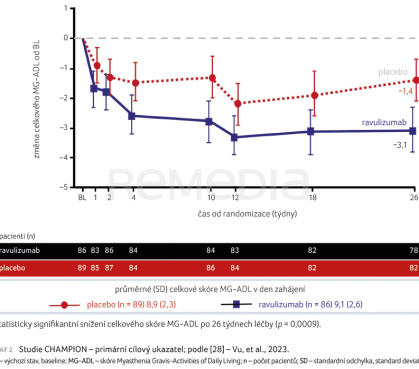
Stran doporučeného dávkování se při zahájení léčby podává 900 mg ekulizumabu i.v. čtyři po sobě následující týdny, poté je aplikována udržovací dávka 1 200 mg každé dva týdny. Sérové koncentrace ekulizumabu mohou být ovlivněny podáním plazmy, IVIG či plazmaferézou. Jestliže je při standardní dávce léku nutné souběžné podávání, pak je doporučena dodatečná aplikace přípravku v dávce 600 mg při každé plazmaferéze, výměně plazmy nebo jednom cyklu IVIG.
Ravulizumab
Ravulizumab je upravená molekula ekulizumabu s prodlouženým účinkem. Záměnou několika aminokyselin v Fc i Fab oblasti došlo nejen k prodloužení eliminačního poločasu, ale i k větší afinitě k C5. Lék je proto možné podávat i.v. každých osm týdnů [26]. V ČR je schválen od roku 2022 pro léčbu MG na podkladě výsledků studie CHAMPION. Je indikován u stejných onemocnění jako ekulizumab. V případě MG je doporučován jako přídatná terapie ke standardní léčbě u dospělých AChR Ab pozitivních pacientů s gMG [16,27].
Do dvojitě zaslepené, placebem kontrolované studie CHAMPION fáze III bylo zařazeno 175 AChR Ab pozitivních pacientů. Studie trvala 26 týdnů a nemocní byli opět rozděleni v poměru 1 : 1 (ravulizumab vs. placebo). Jednalo se o MG pacienty s generalizovanou formou MGFA II–IV, s MG‑ADL ≥ 6 bodů, s chronickou imunosupresivní medikací ve stabilních dávkách. Došlo ke statisticky významnému zlepšení změny celkového skóre MG‑ADL ve 26. týdnu oproti hodnotě při randomizaci (–3,1 vs. –1,4; p < 0,001), graf 2 [28]. Stejně tak došlo ke statisticky významnému zlepšení (p <0,001) celkového QMG u pacientů léčených ravulizumabem (–2,8) oproti skupině kontrolované placebem (–0,8). Jako klinicky významné bylo opět definováno zlepšení celkového skóre QMG o nejméně pět bodů a celkového skóre MG‑ADL o nejméně tři body. Ke zlepšení o pět bodů a více došlo ve skóre QMG u 30 % pacientů léčených ravulizumabem oproti 10,5 % pacientů s placebem [29]. Ke zlepšení těchto dvou hlavních parametrů došlo již po jednom týdnu.
Také v případě extenze studie CHAMPION byl po celou dobu sledování (34 týdnů) prokázán setrvalý efekt léčby ravulizumabem, a to i mezi jednotlivými dávkami. V původní větvi s placebem bylo zaznamenáno rychlé zlepšení, které přetrvávalo do konce extenze [30].
Obecně byl ravulizumab dobře tolerován. Nebyl patrný rozdíl v incidenci nebo tíži příznaků mezi skupinou léčenou ravulizumabem oproti placebu. Nejběžnějšími nežádoucími účinky byly bolest hlavy a nezávažné infekce [31].
Doporučené dávkování je rozděleno do tří skupin dle tělesné hmotnosti. U pacientů s hmotností ≥ 40 až 60 kg je nasycovací dávka 2 400 mg 0. a 14. den, poté se podává 3 000 mg po osmi týdnech. Pacienti s hmotností mezi ≥ 60 až < 100 kg mají nasycovací dávku 2 700 mg a chronickou dávku 3 300 mg. Pacienti vážící ≥ 100 kg dostanou vstupně 3 000 mg a chronicky 3 600 mg [16,27].
Závěr
Inhibitory C5 složky komplementu jsou slibnou lékovou skupinou, a to zejména pro aktivní a/nebo těžší formy generalizované myasthenia gravis s pozitivními protilátkami proti acetylcholinovému receptoru. Vedle rychlého nástupu účinku a relativně dobrého bezpečnostního profilu má tento přípravek i jiný mechanismus účinku než ostatní imunomodulační léky určené k léčbě myasthenia gravis.
Literatura
[1] Alhaidar MK, Abumurad S, Soliven B, Rezania K. Current Treatment of Myasthenia Gravis. J Clin Med 2022; 11: 1597.
[2] Skeie GO, Apostolski S, Evoli A, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol 2010; 17: 893–902.
[3] Wiendl H, Abicht A, Chan A, et al. Guideline for the management of myasthenic syndromes. Ther Adv Neurol Disord 2023; 16: 17562864231213240.
[4] Hoffmann S, Harms L, Schuelke M, et al. Complement deposition at the neuromuscular junction in seronegative myasthenia gravis. Acta Neuropathol 2020; 139: 1119–1122.
[5] Howard JF. Myasthenia gravis: the role of complement at the neuromuscular junction. Ann N Y Acad Sci 2018; 1412: 113–128.
[6] Chapel H, Haeney M, Misbah SA, Snowden N. Essentials of Clinical Immunology 6th edition. John Wiliey & sons 2014. Translated to the Czech version: Thon V, et al. Základy klinické imunologie. Praha: Triton, 2018.
[7] Warwick CA Keyes AL, Woodruff TM, Usachev YM. The complement cascade in the regulation of neuroinflammation, nociceptive sensitization, and pain. J Biol Chem 2021; 297: 101085.
[8] Girardi G, Lingo JJ, Fleming SD, Regal JF. Essential Role of Complement in Pregnancy: From Implantation to Parturition and Beyond. Front Immunol 2020; 11: 1681.
[9] Muppidi S, Utsugisawa K, Benatar M, et al. Long‑term safety and efficacy of eculizumab in generalized myasthenia gravis. Muscle Nerve 2019; 60: 14–24.
[10] Mantegazza R, Bonanno S, Camera G, Antozzi C. Current and emerging therapies for the treatment of myasthenia gravis. Neuropsychiatr Dis Treat 2011; 7: 151–160.
[11] Menon D, Bril V. Pharmacotherapy of Generalized Myasthenia Gravis with Special Emphasis on Newer Biologicals. Drugs 2022, 82: 865–887.
[12] Howard JF Jr. Myasthenia gravis: the role of complement at the neuromuscular junction. Ann N Y Acad Sci 2018; 1412: 113–128.
[13] Vanoli F, Mantegazza R. What are the pharmacotherapeutic considerations for the treatment of myasthenia gravis? Expert Opin Pharmacother 2022; 23: 1471–1474.
[14] Nishimura J, Yamamoto M, Hayashi S, et al. Genetic Variants in C5 and Poor Response to Eculizumab. N Engl J Med 2014; 370: 632–639.
[15] Saccà F, Pane C, Espinosa PE, et al. Efficacy of innovative therapies in myasthenia gravis: A systematic review, meta‑analysis and network meta‑analysis. Eur J Neurol 2023; 30: 3854–3867.
[16] Státní ústav pro kontrolu léčiv. Dostupné na: https://prehledy.sukl.cz/
[17] Devalaraja‑Narashimha K, Huang C, Cao M, et al. Pharmacokinetics and pharmacodynamics of pozelimab alone or in combination with cemdisiran in non‑human primates. PLoS One 2022; 17: e0269749.
[18] Jindal S, Pedersen DV, Gera N, et al. Characterization of the bispecific VHH antibody gefurulimab (ALXN1720) targeting complement component 5, and designed for low volume subcutaneous administration. Mol Immunol 2024; 165: 29–41.
[19] Hillmen P, Young NS, Schubert J, et al. The Complement Inhibitor Eculizumab in Paroxysmal Nocturnal Hemoglobinuria. N Engl J Med 2006; 355: 1233–1243.
[20] Legendre CM, Licht C, Muus P, et al. Terminal Complement Inhibitor Eculizumab in Atypical Hemolytic–Uremic Syndrome. N Engl J Med 2013; 368: 2169–2181.
[21] Pittock SJ, Berthele A, Fujihara K, et al. Eculizumab in Aquaporin‑4–Positive Neuromyelitis Optica Spectrum Disorder. N Engl J Med 2019; 381: 614–625.
[22] Muppidi S. The Myasthenia Gravis‑Specific Activities of Daily Living Profile. Ann N Y Acad Sci 2012; 1274: 114–119.
[23] Katzberg HD, Barnett C, Merkies ISJ, Bril V. Minimal clinically important difference in myasthenia gravis: Outcomes from a randomized trial. Muscle Nerve 2014; 49: 661–665.
[24] Howard JF, Utsugisawa K, Benatar M, et al. Safety and efficacy of eculizumab in anti‑acetylcholine receptor antibody‑positive refractory generalized myasthenia gravis (REGAIN): a phase 3, randomised, double‑blind, placebo‑controlled, multicentre study. Lancet Neurol 2017; 16: 976–986.
[25] European Medicines Agency. Soliris® (eculizumab). Summary of Product Characteristics. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/soliris‑epar‑productinformation_en.pdf
[26] McKeage K. Ravulizumab: First Global Approval 2019. Drugs 2019; 79: 347–352.
[27] European Medicines Agency. Ultomiris® (ravulizumab). Summary of Product Characteristics. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/ultomiris‑epar‑productinformation_en.pdf
[28] Vu T, Wiendl H, Katsuno M, et al. Ravulizumab in Myasthenia Gravis: A Review of the Current Evidence. Neuropsychiatr Dis Treat 2023; 19: 2639–2655.
[29] Ndegwa S, Mierzwinski‑Urban M. Emerging Drugs for Generalized Myasthenia Gravis. Can J Heal Technol 2022; 2: 1–31.
[30] Meisel A, Annane D, Vu T, et al. Long‑term efficacy and safety of ravulizumab in adults with anti‑acetylcholine receptor antibody‑positive generalized myasthenia gravis: results from the phase 3 CHAMPION MG open‑label extension. J Neurol 2023; 270: 3862–3875.
[31] Howard JF, Vu T, Mantegazza R, et al. Efficacy of ravulizumab in patients with generalized myasthenia gravis by time from diagnosis: A post hoc subgroup analysis of the CHAMPION MG study. Muscle Nerve 2024; 69: 556–565.