Ortotopická transplantace srdce
Souhrn
Špinarová M, Špinarová L, Krejčí J. Ortotopická transplantace srdce. Remedia 2024; 34: 125–130.
Ortotopická transplantace srdce (OTS) je léčebná metoda pacientů v terminální fázi srdečního selhání, u kterých byly vyčerpány všechny farmakologické i nefarmakologické léčebné postupy. Vybrat vhodného pacienta k provedení srdeční transplantace a zvolit vhodný okamžik výkonu je velmi komplexní rozhodnutí. Pacient musí splňovat jednak indikační kritéria, jednak nesmí mít kontraindikace. Sledování pacientů po OTS zahrnuje v prvních 1–2 letech po operaci plánované endomyokardiální biopsie k odhalení rejekce. Dále se pravidelně provádí echokardiografie a laboratorní vyšetření zaměřené nejen na hodnocení koncentrací imunosupresiv. Koronarografie slouží k odhalení vaskulopatie štěpu. Pacient musí doživotně užívat imunosupresivní léčbu, u níž je snaha o maximální individualizaci, ale která přesto s sebou přináší četné komplikace. Pacienti po úspěšné OTS se však vracejí do plnohodnotného a kvalitního života. Nové technologie a postupy v transplantačním programu jsou stále předmětem širokého výzkumu.
Klíčová slova: ortotopická transplantace srdce – imunosuprese – rejekce – komplikace.
Summary
Spinarova M, Spinarova L, Krejci J. Orthotopic heart transplantation. Remedia 2024; 34: 125–130.
Orthotopic heart transplantation (OTS) is a method for patients in the terminal stage of chronic heart failure, for whom all pharmacological and non‑pharmacological treatments have been used. Choosing the right patient for a heart transplant and choosing the right moment for the procedure is a very complex decision. The patient must meet the indication criteria, and must not have any contraindications. Planned endomyocardial biopsies to detect rejection are carried in the first 1‑2 years after surgery. In addition, echocardiography, laboratory tests and other specialized methods are regularly performed. Coronary angiography serves to detect graft vasculopathy. The patient has to take individualized immunosuppressive treatment for the rest of his or her life despite the risk of numerous complications. However, patients after successful OTS return to a full and quality life. New technologies and procedures in the transplant program are still the subject of extensive research.
Key words: orthotopic heart transplantation – immunosuppression – rejection – complications.
Úvod
Ortotopická transplantace srdce (OTS) je zavedená léčebná metoda pacientů v konečné fázi srdečního selhání, u kterých byly vyčerpány všechny farmakologické i nefarmakologické léčebné postupy. Samotná transplantace je chirurgická metoda, nicméně celý postup je výsledkem široké multioborové spolupráce.
První transplantace srdce byla provedena 3. prosince 1967 lékařem Christianem Barnardem v Kapském Městě v Jihoafrické republice. Příjemcem byl 54letý L. Washkansky, který zemřel 18. den po operaci v důsledku bronchopneumonie [1]. První transplantace srdce v Evropě byla provedena dr. Christianem Cabrolem 27. dubna 1968 v Paříži [2]. První transplantaci srdce v Československu provedl 9. července 1968 tým akademika Šišky; první úspěšná OTS v pražském Institutu klinické a experimentální medicíny (IKEM) proběhla v roce 1984, v Brně v roce 1992.
Současný mezinárodní transplantační registr organizuje International Society for Heart and Lung Transplantation (ISHLT). Do této databáze přispívá celkem 437 center pro transplantaci srdce dospělých pacientů, 306 center pro transplantaci srdce pediatrických pacientů a dále centra pro transplantaci plic. Poslední aktualizovaná data byla publikována v říjnu 2023. Tato data například ukázala, že celkový počet transplantací srdce dospělých se mírně snižuje (35 159 OTS v letech 1992–2000 oproti 30 060 v letech 2010–2017), nejvíce transplantací se provádí v Severní Americe, častěji jsou transplantováni muži (77,9 %), průměrného věku 54 let. Medián přežití se prodlužuje, do roku 2009 to bylo 12,1 roku a očekává se, že je nyní ještě vyšší. Přibývá také retransplantací [3].
V České republice se v současné době provádí OTS v IKEM Praha a v Centru kardiovaskulární a transplantační chirurgie (CKTCH) Brno ve spolupráci s FN u sv. Anny v Brně, v posledních letech v průměru 70krát ročně. Hospitalizační mortalita se pohybuje pod 5 %. Rok po transplantaci přežívá více než 85 % pacientů, pět let přežívá 70 %, 10 let 50–60 % pacientů. Medián přežití je 12,2 roku. Česká centra do mezinárodního registru ISHLT nepřispívají.
Indikace a kontraindikace
Vybrat vhodného pacienta k provedení srdeční transplantace a zvolit vhodný okamžik výkonu je velmi komplexní rozhodnutí. Pacient musí splňovat jednak indikační kritéria, jednak nesmí mít kontraindikace, které by limitovaly jeho další přežívání po výkonu. Pro indikaci OTS není rozhodující základní diagnóza srdečního selhání, nejčastěji se jedná o dilatační kardiomyopatii následovanou ischemickou chorobou srdeční. Je samozřejmostí, že pacient musí mít plnou léčbu chronického srdečního selhání [4].
Mezi objektivní posouzení tíže srdečního selhání patří spiroergometrie, kdy hodnoty parciálního tlaku kyslíku ve smíšené žilní krvi (pVO2) < 12 ml/kg/min při užívání betablokátorů nebo < 14 ml/kg/min při jejich intoleranci představují potenciální indikaci k transplantaci srdce. Pacienti se spotřebou kyslíku 14–18 ml/kg/min mohou být indikováni k OTS, pokud mají další přídatná rizika, jako jsou velmi těžká deprese systolické funkce levé komory (ejekční frakce levé komory [EF LK] < 20 %), arytmie, koncentrace sérového sodíku < 120 mmol/l, blok levého Tawarova raménka na elektrokardiografickém (EKG) vyšetření nebo kardiothorakální index > 0,75. K hodnocení validity testu je potřeba, aby respirační kvocient činil > 1,05. Další parametry získané ze zátěžového testu, které jsou důležité pro rozhodování, představují u žen a u osob mladších 50 let: pVO2 < 50 % a ventilační efektivita – VE/VCO2 slope > 35 [5].
U pacientů, kteří mají zvýšenou prekapilární komponentu plicní hypertenze, kdy plicní vaskulární rezistence (PVR) převyšuje 3,5 Wj navzdory farmakologickému testování její reverzibility, není transplantace možná z důvodu rizika selhání pravé komory dárcovského srdce. V takovém případě je možné zvážení implantace levostranné srdeční podpory (left ventricle assist device, LVAD) a následné přehodnocení stavu (tzv. bridge to candidacy). Rovněž pacienti, kteří se klinicky horší či u nich dochází k rozvíjející se poruše funkce dalších orgánů a nemuseli by se transplantace srdce dožít, mají naději v implantaci LVAD v rámci strategie „bridge to transplantation“.
Existuje stále mnoho pacientů s terminálním srdečním selháním, kteří k srdeční transplantaci již indikováni být nemohou. Možnosti léčby těchto pacientů se významně rozšířily zavedením dlouhodobých mechanických srdečních podpor.
LVAD může být implantována selektovaným pacientům s terminálním srdečním selháním, kteří nejsou vhodnými kandidáty k OTS, jako strategie „destination therapy“. Předpokladem této indikace je dobrá spolupráce s pacientem, nepřítomnost krvácivých onemocnění, resp. intolerance antikoagulační léčby, dále sociální zázemí a přijatelná funkce pravé komory srdeční. Pro velkou většinu případů pokročilého srdečního selhání v populaci je třeba optimálně nastavit systém paliativní péče.
Xenotransplantace je experimentální metodou mezidruhového přenosu orgánu. Pro lidské srdce jsou nejvíce zkoumána geneticky upravená prasata. Ačkoliv tato metoda má nesporné výhody zejména v rozšíření počtu dárcovských orgánů, je zde stále mnoho komplikací zejména ve smyslu rejekce, přenosu infekce nebo etické otázky, širší uplatnění tak dosud nenašla [6].
V experimentální rovině se také stále pohybuje tkáňové inženýrství a transplantace kmenových buněk, které po slibném začátku zatím větší změny v transplantačním programu nepřinesly [7].
Vývoj kompletního umělého srdce (total artificial heart, TAH) se datuje už někdy k roku 1969. V současné době je jediným používaným přístrojem ve Spojených státech amerických 70cc SynCardia dočasné totální umělé srdce (TAH‑t; SynCardia Systems, Tucson, Arizona), a to pro velmi specifickou skupinu pacientů s terminálním biventrikulárním srdečním selháním jako „bridge to transplantation“. Další TAH (např. Carmat) jsou předmětem výzkumu [6].
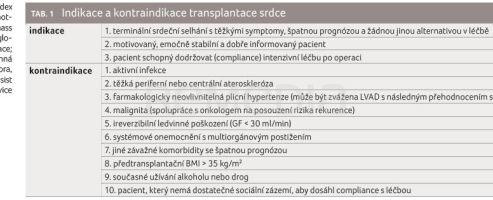 Indikace a kontraindikace transplantace srdce shrnuje tabulka 1.
Indikace a kontraindikace transplantace srdce shrnuje tabulka 1.
Operace
Dárcovský štěp je odebrán od zemřelého bez závažného srdečního onemocnění. Legislativně může být dárcem kdokoliv, kdo není v registru nedárců orgánů, nicméně dle zvyklostí pracovišť je v ČR nutný souhlas rodiny zemřelého (zákon č. 285/2002 Sb.).
Dárce se s příjemcem musí shodovat v krevní skupině, jen výjimečně se volí univerzální dárci. Hodnotí se velikost a konstituce orgánu, své místo má i genetické testování. Naopak nejsou podstatné pohlaví či rasa [8].
V průběhu operace je nahrazeno srdce příjemce srdcem dárce, a to tak, že příjemce dostává od dárce celý srdeční sval, včetně koronárních cév. Operace je velmi náročná, trvá obvykle několik hodin, provádí se v mimotělním oběhu a vyžaduje velmi zkušený tým a mezioborovou spolupráci. Bezprostřední pooperační péče pak probíhá na příslušném kardiochirurgickém pracovišti.
Potransplantační sledování
Nejtěžším obdobím pro pacienty po OTS bývá obvykle první rok po výkonu, kdy se nemocní zotavují po operaci, zvykají si na nový režim a léčbu a postupně se vracejí do normálního života. Velmi důležitá je v této době spolupráce s pacientem i jeho rodinou. Neustálé obavy z odmítnutí orgánu, nové léčebné režimy a změna životního stylu mohou vést k úzkosti a depresi. Spolupráce psychologa či psychiatra je jednoznačně doporučována [8].
Sledování pacientů po OTS zahrnuje v prvních 1–2 letech po operaci plánované endomyokardiální biopsie (EMB) – odběr vzorku srdeční tkáně cestou v. subclavia či v. jugularis z hrotu pravé komory k odhalení rejekce, tedy odhojení štěpu. Pravidelně se provádí echokardiografie a laboratorní vyšetření. Dále je doporučováno provést koronarografii, optimálně ve spojení s intravaskulárním ultrazvukem (IVUS) či dnes častěji optickou koherentní tomografií (OCT) v prvním měsíci a dále po prvním roce od transplantace srdce. Další opakování již závisí na nálezu a klinickém stavu pacienta. Důvodem je odhalení přítomnosti či progrese vývoje vaskulopatie štěpu [9]. Ve speciálních případech je možné využít i magnetickou rezonanci, případně další zobrazovací a vyšetřovací metody.
Imunosupresivní léčba
Aby se srdce neodhojilo, tedy nedošlo k rejekci, musí pacient trvale užívat imunosupresiva, která podáváme v kombinaci, abychom zabránili rozvoji rejekce na různých úrovních. Imunosupresiva se mohou v játrech metabolizovat stejnou cestou jako řada dalších léků (antibiotika, antihypertenziva, léky pro léčbu žaludečních vředů aj.) a může docházet k ovlivnění jejich koncentrací a tím i účinnosti.
Rozlišujeme tyto základní skupiny imunosupresiv:
- inhibitory kalcineurinu (calcineurin inhibitors, CNI): cyklosporin a takrolimus,
- inhibitory mTOR (savčí cíl rapamycinu, mammalian target of rapamycin): everolimus a sirolimus,
- antiproliferativní látky: mykofenolát mofetil a azatioprin,
- kortikoidy: prednison.
 Základním lékem, který významně zlepšil přežívání pacientů po transplantaci, byl cyklosporin, jenž společně s azatioprinem tvořil klasickou imunosupresi v 80. a 90. letech 20. století. Novější léčebná schémata nahradila azatioprin mykofenolát mofetilem. Místo cyklosporinu se používá novější CNI – takrolimus. Ve speciálních případech mohou být do léčby zavedeny inhibitory mTOR (everolimus nebo méně používaný sirolimus), ať již v kombinaci s CNI, nebo mykofenolát mofetilem – tzv. calcineurin‑free režim. Důvody pro používání inhibitorů mTOR jsou zejména kalcineurinová nefropatie, vaskulopatie štěpu, myopatie, cyklosporinová neurotoxicita nebo malignita [10]. Součástí léčby jsou iniciálně poměrně vysoké dávky kortikoidů, které se při nekomplikovaném průběhu postupně snižují. Po prvním roce od transplantace se snažíme ve všech režimech kortikoidy pacientům vysadit a výslednou doživotní léčbou je dvojkombinace imunosuprese [9,11].
Základním lékem, který významně zlepšil přežívání pacientů po transplantaci, byl cyklosporin, jenž společně s azatioprinem tvořil klasickou imunosupresi v 80. a 90. letech 20. století. Novější léčebná schémata nahradila azatioprin mykofenolát mofetilem. Místo cyklosporinu se používá novější CNI – takrolimus. Ve speciálních případech mohou být do léčby zavedeny inhibitory mTOR (everolimus nebo méně používaný sirolimus), ať již v kombinaci s CNI, nebo mykofenolát mofetilem – tzv. calcineurin‑free režim. Důvody pro používání inhibitorů mTOR jsou zejména kalcineurinová nefropatie, vaskulopatie štěpu, myopatie, cyklosporinová neurotoxicita nebo malignita [10]. Součástí léčby jsou iniciálně poměrně vysoké dávky kortikoidů, které se při nekomplikovaném průběhu postupně snižují. Po prvním roce od transplantace se snažíme ve všech režimech kortikoidy pacientům vysadit a výslednou doživotní léčbou je dvojkombinace imunosuprese [9,11].
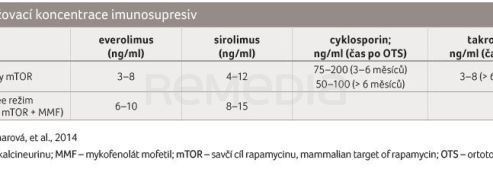
 V zásadě platí, že v rámci jedné skupiny léky nekombinujeme. Provádíme kombinaci mezi jednotlivými skupinami. Základní kombinace imunosupresiv ukazuje tabulka 2 a kombinační léčbu s podáním inhibitorů mTOR tabulka 3 [12]. U pacientů v časnější době od transplantace srdce dáváme přednost kombinaci CNI a mykofenolátu, v době déle než rok od transplantace si můžeme mezi režimy vybrat. Důvodem opatrnosti v užití inhibitorů mTOR v časném období (zejména v případě calcineurin‑free režimu) je obava ze vzniku častějších rejekcí a horšího hojení ran. Kombinace s cyklosporinem jsou v současné době již historické a de novo je cyklosporin nasazován ve zcela výjimečných případech. Hodnoty udržovacích koncentrací imunosupresiv ukazuje tabulka 4 [12].
V zásadě platí, že v rámci jedné skupiny léky nekombinujeme. Provádíme kombinaci mezi jednotlivými skupinami. Základní kombinace imunosupresiv ukazuje tabulka 2 a kombinační léčbu s podáním inhibitorů mTOR tabulka 3 [12]. U pacientů v časnější době od transplantace srdce dáváme přednost kombinaci CNI a mykofenolátu, v době déle než rok od transplantace si můžeme mezi režimy vybrat. Důvodem opatrnosti v užití inhibitorů mTOR v časném období (zejména v případě calcineurin‑free režimu) je obava ze vzniku častějších rejekcí a horšího hojení ran. Kombinace s cyklosporinem jsou v současné době již historické a de novo je cyklosporin nasazován ve zcela výjimečných případech. Hodnoty udržovacích koncentrací imunosupresiv ukazuje tabulka 4 [12].
Komplikace po srdeční transplantaci
Časné – jsou řešeny na chirurgickém pracovišti:
- poruchy funkce štěpu,
- časná rejekce,
- infekce.
Pozdní – řeší kardiolog v dlouhodobém sledování:
- rejekce,
- vaskulopatie štěpu,
- komplikace imunosupresivní léčby.
Rejekce
 Při jakékoliv alotransplantaci orgánu může dojít k rejekci, tedy k odmítnutí nebo odhojení štěpu. Podle mechanismu vzniku rozeznáváme rejekci celulární nebo humorální, podle rychlosti nástupu ji dělíme na hyperakutní, akutní a chronickou [11].
Při jakékoliv alotransplantaci orgánu může dojít k rejekci, tedy k odmítnutí nebo odhojení štěpu. Podle mechanismu vzniku rozeznáváme rejekci celulární nebo humorální, podle rychlosti nástupu ji dělíme na hyperakutní, akutní a chronickou [11].
Hyperakutní rejekce se vyskytuje jen velmi zřídka a objevuje se do 24 hodin od transplantace. Jde o protilátkami zprostředkovanou rejekci, ve které klíčovou roli hrají trombózy srdečních venul, jejichž důsledkem je obstrukce drenáže v transplantovaném srdci [11].
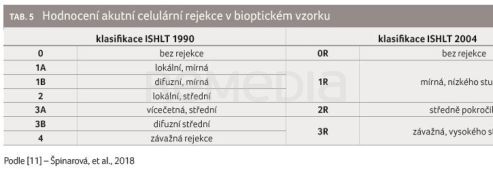
Akutní celulární rejekce je zprostředkována T lymfocyty a projevuje se lymfocytární infiltrací v myokardu s pozdějším rozpadem buněk a infiltrací polymorfonukleáry. Její mírné formy jsou relativně časté především v prvních týdnech a měsících po operaci. Její frekvence s odstupem od transplantace obvykle klesá. Může mít dramatickou a život ohrožující podobu, nebo naopak proběhnout asymptomaticky. Dnes jsou rejekční epizody většinou mírné. Rejekci lze spolehlivě prokázat pouze histologicky v bioptickém vzorku z myokardu (tab. 5) [11]. K přesnějšímu hodnocení bioptického vzorku lze využít molekulární mikroskop (MMDx®), který měří genovou expresi. Pomocí čipové technologie jsou kvantifikovány tisíce molekul mRNA najednou, které jsou pak vyhodnoceny tzv. machine‑learning algoritmem pro výpočet skóre pravděpodobnosti jednotlivých typů rejekce, akutního poškození či fibrózy [13]. V České republice se toto vyšetření provádí v IKEM v Praze.
 Z běžně dostupných biomarkerů lze využít natriuretické peptidy, troponiny a interleukiny, nicméně k významnému nárůstu obvykle dochází až u velmi pokročilých stupňů rejekce, a jejich citlivost v časné fázi je tak velmi nízká.
Z běžně dostupných biomarkerů lze využít natriuretické peptidy, troponiny a interleukiny, nicméně k významnému nárůstu obvykle dochází až u velmi pokročilých stupňů rejekce, a jejich citlivost v časné fázi je tak velmi nízká.
V posledních desetiletích došlo k velkému pokroku i v neinvazivní diagnostice rejekce. Jednou z možností je stanovení genetické exprese pomocí AlloMap, které byly hodnoceny v geneticky profilovaných studiích CARGO a CARGO II [14,15]. Využití AlloMap k detekci akutní celulární rejekce prokázalo non‑inferioritu oproti klasickým známkám rejekce a výsledkům EMB. Nízká variabilita v genetické expresi také vyšla jako prediktivní faktor lepšího přežívání pacientů po OTS a mohla by být využita k větší individualizaci imunosupresivní terapie [15]. V České republice toto vyšetření není dostupné.
Další neinvazivní diagnostický test pro sledování akutní rejekce pacientů, a to jak celulární, tak humorální, představuje stanovení bezbuněčné DNA od dárce (donor‑derived cell‑free DNA, ddcfDNA). Hodnota ddcfDNA začne často stoupat až týdny před stanovením diagnózy z bioptického vzorku. Jedná se tedy o velmi časný a citlivý marker poškození štěpu, který by mohl být potenciálně použit k přizpůsobení imunosuprese – zvyšující se koncentrace může naznačovat potřebu posílení léčby, zatímco nízké koncentrace by mohly umožnit její redukci. Tyto neinvazivní testy lze navíc provádět častěji než biopsie, limitací je však nákladová efektivita a doba potřebná k získání výsledku; v současné době není součástí rutinní diagnostiky [16].
Humorální rejekce je zprostředkována specifickými cytotoxickými protilátkami. Vyskytuje se ve formě hyperakutní (viz výše), často provázené srdečním selháváním, a ve formě chronické, která je sdružena se sníženým dlouhodobým přežíváním, neboť je rizikovým faktorem vývoje koronární nemoci štěpu. Metoda detekce zahrnuje barvení C4d ve tkáních, které má větší senzitivitu i specificitu než histologické charakteristiky. Humorální rejekce nereaguje na běžnou léčbu T lymfocyty zprostředkované rejekce. Terapie je tak zaměřena na odstranění protilátek plazmaferézou a jejich neutralizaci pomocí intravenózně podávaných imunoglobulinů.
Z monoklonálních protilátek máme data pro rituximab, bortezomib, ekulizumab a alemtuzumab. Rituximab je anti‑CD20 chimérická myší a lidská monoklonální protilátka selektivně působící na B lymfocyty. Používá se jak k desenzibilizaci, tak k léčbě akutní humorální rejekce [7]. Některá data však ukazují vyšší výskyt vaskulopatie štěpu u pacientů iniciálně léčených rituximabem [17]. Bortezomib je inhibitor proteazomu vyvinutý k léčbě mnohočetného myelomu. Jednotlivá kazuistická data naznačují jeho využití k léčbě akutní humorální rejekce, výsledky z větších studií však chybějí [7]. Ekulizumab je inhibitor komplementu. Bylo zjištěno, že jeho použití v rámci profylaktické indukce u vysoce senzibilizovaných příjemců snižuje výskyt akutní humorální rejekce [18]. Alemtuzumab je humanizovaná anti‑CD52 monoklonální protilátka. Většina důkazů pro jeho použití v rámci antirejekční léčby však pochází z transplantace ledvin [19].
Vaskulopatie štěpu je charakterizována intimálními změnami na věnčitých tepnách. Někdy je také označována jako koronární nemoc štěpu (cardiac allograft vasculopathy, CAV). Změny na koronárních tepnách se liší od klasické aterosklerózy. Jde o difuzní intimální hyperplastický proces, při němž lamina elastica interna zůstává intaktní. Na rozdíl od aterosklerózy zde nebývají kalcifikace a nenalézáme klasická segmentální zúžení. Lumen cév se však postupně uzavírá, přitom na koronarogramu nemusejí být tyto změny dlouho vůbec patrné. Stejně tak využití jednofotonové emisní výpočetní tomografie (SPECT) je velmi omezené. Spolehlivou metodou k identifikaci vaskulopatie je pak vyšetření OCT či IVUS [20]. Etiologie je nejasná. Předpokládá se kombinace imunologického (počet rejekcí, humorální rejekce, imunokompatibilita skupiny DR antigenů hlavního histokompatibilního systému) a neimunologického (věk a ischemická choroba srdeční [ICHS] dárce, doba studené ischemie, věk, ICHS, hyperlipoproteinemie, obezita a diabetes mellitus u příjemce) poškození endoteliálních buněk rezultujícího v myointimální proliferaci a cytomegalovirové (CMV) infekce. Progrese může být velmi rychlá. Léčba je svízelná, kromě režimových opatření jako u ICHS (nekuřáctví, léčba hyperlipoproteinemie a hypertenze) se doporučuje podávání antiagregačních léků, blokátorů kalciových kanálů a inhibitorů angiotenzin konvertujícího enzymu (ACE) a především statinů. Mezi metody volby patří také změna imunosuprese: switch z takrolimu a mykofenolátu na kombinaci takrolimus a everolimus, který představuje účinnější antiproliferativní látku. Spíše ve výjimečných případech je možné provést revaskularizaci (obvykle perkutánní koronární intervenci, PCI). Pokročilá forma, která může vést až k dysfunkci štěpu, se řeší retransplantací srdce.
Komplikace imunosuprese
Infekce jsou nejčastější příčinou morbidity a mortality v prvním roce po transplantaci. Možný je výskyt nejen běžných komunitních infekcí, ale v důsledku četných hospitalizací rovněž nozokomiálních nákaz. Často se setkáváme i s různými oportunními infekcemi, které bývají nezřídka spojeny s obtížnější diagnostikou a léčbou. Častými patogeny jsou CMV, herpes viry, Pneumocystis carinii, legionella a mykózy. V případě nutnosti nasazení antiinfekční terapie je zásadní myslet na možné interakce této léčby s imunosupresivy [21].
Potransplantační hypertenze je spojena se zvýšením tonu sympatiku a s nepřítomností nočního poklesu krevního tlaku. Její výskyt se udává 70–90 % u pacientů po srdeční transplantaci [22]. Léčba je svízelná, ve většině případů je třeba kombinační terapie. Ve farmakologické léčbě je základním předpokladem snaha udržet co nejnižší účinnou koncentraci cyklosporinu či jeho nahrazení takrolimem, a pokud je to možné, vysadit v průběhu prvního roku kortikoidy. Podávají se blokátory kalciových kanálů i pro jejich možný preventivní vliv na vznik vaskulopatie, následují inhibitory ACE, betablokátory a diuretika [9,23]. V léčbě hypertenze po OTS je doporučováno dosažení stejných cílových hodnot jako u běžné populace [11].
Nefropatie souvisí s podáváním CNI cyklosporinu nebo takrolimu. Proto se snažíme o minimalizaci jejich dávek, resp. o zavedení režimu v kombinaci s inhibitory mTOR. Je však třeba pacienta pečlivě sledovat, aby na druhé straně nedošlo k poddávkování a vzniku rejekce. Mezi příjemci, kteří zemřou v průběhu jednoho roku po transplantaci, se příčina úmrtí v důsledku selhání ledvin celosvětově odhaduje na 1,3–9,9 % [24]. Pokud dojde po OTS k výrazné progresi zhoršení renálních funkcí, je možností u vybraných jedinců dotransplantování ledviny.
Hyperlipoproteinemie se popisuje u 60–80 % pacientů po srdeční transplantaci. Koncentrace cholesterolu se zvyšují již v prvních třech týdnech, nejčastěji ke vzestupu dochází v průběhu prvních 6–18 měsíců. V léčbě se uplatňují dieta, redukce dávky kortikoidů a podávání statinů a ezetimibu [8,11]. Nedávná data z malých studií ukázala i bezpečnost použití inhibitorů proprotein konvertázy subtilisin/kexin typu 9 (PCSK9) bez významnějšího ovlivnění hodnoty imunosuprese [25]. Ačkoliv došlo k významnému snížení koncentrace LDL cholesterolu, pouze jedna z provedených studií měla angiografický follow‑up [26]. Přesto se zdá rozumné inhibitory PCSK9 využít u pacientů s obtížně kontrolovatelnou hyperlipidemií [8].
Diabetes mellitus souvisí s podáváním kortikoidů. Zhoršování diabetu podporuje také takrolimus. Je třeba sledovat hodnoty glykemie a v případě nového vzniku diabetu začít s dietní a farmakologickou léčbou. U pacientů, kteří již diabetes měli, se často přechází na inzulin či jsou jeho dávky zvyšovány. Jako výhodné se jeví podávání metforminu, při jehož užívání byl u pacientů po OTS prokázán i snížený výskyt malignit [27]. Data z menších studií ukazují i příznivý efekt použití inhibitorů sodíko‑glukózového kotransportéru 2 (SGLT2) ve smyslu redukce hmotnosti, glykovaného hemoglobinu, zlepšení lipidového spektra a snížení dávek inzulinu bez výraznějšího rizika infekčních komplikací [28]. Větší randomizované studie však zatím nebyly provedeny.
Častá je i prevalence metabolického syndromu. Pokud má pacient metabolický syndrom již před transplantací, je to další rizikový faktor dlouhodobého přežívání. Metabolický syndrom představuje rovněž rizikový faktor pro výskyt vaskulopatie štěpu [29].
Jaterní poruchy jsou většinou dávány do souvislosti s podáváním cyklosporinu. Je rovněž ovlivněn metabolismus bilirubinu, může docházet k cholestáze a tvorbě žlučových kamenů.
Z gastrointestinálních potíží je častá dyspepsie, kortikoidy mohou aktivovat vředovou chorobu nebo vést k jejímu rozvoji.
Osteoporóza je dána především vysokými dávkami kortikoidů. Více se objevuje u žen a starších pacientů. Léčba spočívá ve snaze o vysazení kortikoidů, podání vápníku, bisfosfonátů, kalcitoninu, vitaminu D a v rehabilitaci.
Poruchy krvetvorby, zvláště pokles počtu bílých a následně i červených krvinek, může způsobit zejména mykofenolát mofetil a také inhibitory mTOR. Léčba spočívá v úpravě dávek či ve vysazení myelotoxické léčby a nasazení jiného imunosupresiva, v podání prednisonu, při těžších útlumech v indikaci krevních převodů, ev. růstových faktorů [11].
Závažným problémem jsou pak malignity. Pacienti po transplantaci srdce mají mnohonásobně větší riziko vzniku maligních onemocnění než jejich stejně staří vrstevníci [30]. Celosvětově je celková míra malignity po OTS 5,1 % u pacientů po jednom roce, 16 % u pacientů po pěti letech a 27,7 % u pacientů po 10 letech. Nejčastějším maligním onemocněním u příjemců OTS je karcinom kůže s výskytem 1,7 % u pacientů po jednom roce, 9,6 % u pacientů po pěti letech a 18,5 % u pacientů po 10 letech [24]. Mužské pohlaví, retransplantace, předchozí malignita a imunosuprese jsou identifikovanými rizikovými faktory pro malignitu po OTS. Protektivní faktory zahrnují profylaxi aciklovirem, indukční terapii, použití sirolimu nebo everolimu a ženské pohlaví [31]. Terapie těchto pacientů je obtížná, cílem je nutná rovnováha mezi imunoterapií malignity a imunosupresí – zde se preferuje léčba inhibitory mTOR [32]. Úmrtí z důvodů malignity přibývá s prodlužujícím se přežíváním pacientů.
Závěr
Přes všechny uvedené možné komplikace představuje transplantace srdce pro pacienty s těžkým srdečním selháním prodloužení života a zlepšení jeho kvality. Nemocní odkázaní často na předchozí několikaměsíční pobyt na lůžku, kontinuální infuze katecholaminů, opakované punkce výpotků apod. mohou po OTS vést zcela normální život. Velká část transplantovaných se vrací do zaměstnání, mohou sportovat, cestovat, řídit motorové vozidlo, žít plnohodnotný kvalitní život.
Otázkou zůstává, kam směřuje budoucnost srdečních transplantací. Je patrné, že obrovský vývoj zaznamenala především imunosupresivní léčba se zaměřením zejména na individualizaci profilu každého pacienta. Spolu s velmi dynamickou progresí diagnostiky a léčby rejekce se tak významně prodloužilo přežívání pacientů po OTS.
Předmětem výzkumu budoucnosti jsou pak technologie schopné konkurovat transplantaci lidského srdce, jako jsou tkáňové inženýrství nebo plně implantovatelné systémy mechanické podpory, které by rozšířily možnosti léčby terminálního srdečního selhání pro další pacienty.
MUDr. Monika Špinarová, Ph.D., MSc.
I. interní kardioangiologická klinika LF MU a FN u sv. Anny
Pekařská 664/53, 602 00 Brno
e-mail: monika.spinarova@fnusa.cz
Literatura
[1] Barnard CN. The operation. A human cardiac transplant: an interim report of a successful operation performed at Groote Schuur Hospital, Cape Town. S Afr Med J 1967; 41: 1271–1274.
[2] Hosain N, Amin F, Leprince P. Christian Cabrol MD. A Tribute to pioneer cardiac surgeon Christian Cabrol 1 year after his death, on the 50th Anniversary of the First European Human Heart Transplantation that he performed in 1968. Eur Heart J 2018; 39: 1661–1671.
[3] Singh TP, Cherikh WS, Hsich E, et al. Graft survival in primary thoracic organ transplant recipients: A special report from the International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2023; 42: 1321–1333.
[4] 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Dostupné na: https://www.escardio.org/Guidelines/Clinical‑Practice‑Guidelines/Acute‑and‑Chronic‑Heart‑Failure [navštíveno 26. 8. 2023]
[5] Crespo‑Leiro MG, Metra M, Lund LH, et al. Advanced heart failure: a position statement of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2018; 20: 1505–1535.
[6] Weber BN, Kobashigawa JA, Givertz MM. Evolving Areas in Heart Transplantation. JACC Heart Fail 2017; 5: 869–878.
[7] Crespo‑Leiro MG, Costanzo MR, Gustafsson F, et al. Heart transplantation: focus on donor recovery strategies, left ventricular assist devices, and novel therapies. Eur Heart J 2022; 43: 2237–2246.
[8] Velleca A, Shullo MA, Dhital K, et al. The International Society for Heart and Lung Transplantation (ISHLT) guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2023; 42: e1–141.
[9] Costanzo MR, Dipchand A, Starling R, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010; 29: 914–956.
[10] Rothenburger M, Zuckermann A, Bara C, et al. Recommendations for the use of everolimus (Certican) in heart transplantation: results from the second German‑Austrian Certican Consensus Conference. J Heart Lung Transplant 2007; 26: 305–311.
[11] Špinarová L, Špinar J, Vítovec J. Transplantace srdce. Vnitř Lék 2018; 64: 860–866.
[12] Špinarová L, Vítovec J. Kombinační imunosupresivní léčba. Kardiol Rev Int Med 2014; 16: 472–474.
[13] Halloran PF, Potena L, Van Huyen JPD, et al. Building a tissue‑based molecular diagnostic system in heart transplant rejection: The heart Molecular Microscope Diagnostic (MMDx) System. J Heart Lung Transplant 2017; 36: 1192–1200.
[14] Deng MC, Eisen HJ, Mehra MR, et al. Noninvasive discrimination of rejection in cardiac allograft recipients using gene expression profiling. Am J Transplant 2006; 6: 150–160.
[15] Crespo‑Leiro MG, Stypmann J, Schulz U, et al. Clinical usefulness of gene‑expression profile to rule out acute rejection after heart transplantation: CARGO II. Eur Heart J 2016; 37: 2591–2601.
[16] Agbor‑Enoh S, Shah P, Tunc I, et al. Cell‑Free DNA to Detect Heart Allograft Acute Rejection. Circulation 2021; 143: 1184–1197.
[17] Starling RC, Armstrong B, Bridges ND, et al. Accelerated Allograft Vasculopathy With Rituximab After Cardiac Transplantation. J Am Coll Cardiol 2019; 74: 36–51.
[18] Law YM, Nandi D, Molina K, et al. Use of the terminal complement inhibitor eculizumab in paediatric heart transplant recipients. Cardiol Young 2020; 30: 107–113.
[19] Gale SE, Ravichandran B, Ton VK, et al. Alemtuzumab Induction Versus Conventional Immunosuppression in Heart Transplant Recipients. J Cardiovasc Pharmacol Ther 2019; 24: 435–441.
[20] Táborský M, Kautzner J, Linhart A, et al. Kardiologie. Praha: Mladá fronta, 2017.
[21] Ozábalová E, Krejčí J, Hude P, et al. Transplantace srdce a infekce. Vnitř Lék 2017; 63: 535–539.
[22] Lund LH, Khush KK, Cherikh WS, et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty‑fourth Adult Heart Transplantation Report – 2017; Focus Theme: Allograft ischemic time. J Heart Lung Transplant 2017; 36: 1037–1046.
[23] Špinarová L, Hude P, Krejčí J, et al. Farmakoterapie hypertenze po transplantaci srdce. Vnitř Lék 2012; 58: 224–227.
[24] Khush KK, Cherikh WS, Chambers DC, et al. The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty‑sixth adult heart transplantation report – 2019; Focus Theme: Donor and recipient size match. J Heart Lung Transplant 2019; 38: 1056–1066.
[25] Sandesara PB, Dhindsa D, Hirsh B, et al. PCSK9 inhibition in patients with heart transplantation: A case series. J Clin Lipidol 2019; 13: 721–724.
[26] Sammour Y, Dezorzi C, Austin BA, et al. PCSK9 Inhibitors in Heart Transplant Patients: Safety, Efficacy, and Angiographic Correlates. J Card Fail 2021; 27: 812–815.
[27] Peled Y, Lavee J, Raichlin E, et al. Metformin therapy reduces the risk of malignancy after heart transplantation. J Heart Lung Transplant 2017; 36: 1350–1357.
[28] Sammour Y, Nassif M, Magwire M, et al. Effects of GLP‑1 receptor agonists and SGLT‑2 inhibitors in heart transplant patients with type 2 diabetes: Initial report from a cardiometabolic center of excellence. J Heart Lung Transplant 2021; 40: 426–429.
[29] Sanchez‑Lazaro I, Sanchez‑Gomez JM, Martinez‑Dolz L, et al. 260 Is Metabolic Syndrome Important in the Development of Cardiac Allograft Vasculopathy in Heart Transplantation Patients? J Heart Lung Transplant 2012; 31: S94.
[30] Špinarová L, Hude P, Krejčí J, et al. Osud pacientů přežívajících deset let po transplantaci srdce se zřetelem k výskytu maligního onemocnění. Cor Vasa 2009; 51: 415–418.
[31] Mudigonda P, Berardi C, Chetram V, et al. Implications of cancer prior to and after heart transplantation. Heart Br Card Soc 2022; 108: 414–421.
[32] Holdaas H, De Simone P, Zuckermann A. Everolimus and Malignancy after Solid Organ Transplantation: A Clinical Update. J Transplant