Glatiramer acetát – protizánětlivé a neuroprotektivní mechanismy účink
Glatiramer acetát (GA) je spolu s rekombinantními interferony beta prvním lékem, který byl úspěšně použit v léčbě nemocných s roztroušenou sklerózou mozkomíšní (RS). Chemicky se jedná o směs syntetických peptidů, které se svou strukturou podobají myelinovému bazickému proteinu považovanému za hlavní terč autoreaktivních T lymfocytů u nemocných s RS. Po subkutánní aplikaci je GA internalizován dendritickými buňkami, které jej ve formě antigenních peptidů předkládají v lymfatických uzlinách T lymfocytům. Rozpoznání těchto peptidů vede ke stimulaci regulačních subsetů T lymfocytů označovaných jako Treg a Th2, které prostřednictvím cytokinů tlumí aktivity základní složky poškozujícího zánětu u nemocných s RS, tj. subsetů Th17 a Th1. Zmnožené T lymfocyty specifické pro GA přecházejí přes hematoencefalickou bariéru a v CNS dále přispívají k tlumení poškozujícího zánětu. Tvorbou neurotrofních působků BDGF a NT-3,4 stimulují neuronální a oligodendrocytové progenitory k diferenciaci a migraci do demyelinizačních lézí. Vykazují tak i neuroprotektivní účinky. Snaha zavádět do klinické praxe nová léčiva určená pro pacienty s RS podnítila vývoj přípravků nazývaných glatiramoidy.
S ohledem na charakteristiky jsou glatiramoidy řazeny do samostatné skupiny nebiologických komplexních léčiv. Pravidla pro jejich uvádění do klinické praxe zatím nebyla formulována. Výsledky experimentálních studií naznačují, že svým složením a účinkem nejsou nové glatiramoidy srovnatelné s glatiramer acetátem.
Úvod
Roztroušená skleróza mozkomíšní (RS) je autoimunitní, demyelinizační a neurodegenerativní onemocnění nejasné etiopatogeneze [1]. Je charakterizována imunopatologickým zánětem, který postihuje CNS. Přestože RS patří mezi nejlépe prozkoumané imunopatologické nemoci a je pro ni ustaven zvířecí model experimentální autoimunitní encefalitidy (EAE), nestačí současné znalosti k nalezení postupů, které by nemocné s RS vyléčily [2]. Terapeutické zásahy cílí především na poškozující zánět, který je příčinou narušení myelinových obalů nervových vláken v demyelinizačních lézích. Zásadní zvrat v osudu nemocných s remitující-relabující formou RS (RR RS) znamenalo zavedení rekombinantních interferonů beta (IFNβ) a glatiramer acetátu (GA) do klinické praxe před zhruba dvaceti lety. Jejich aplikace signifikantně snižuje počet relapsů a zabraňuje progresi disability. Díky intenzivnímu výzkumu jsou nyní u nemocných s RS používána léčiva, která se svým mechanismem účinku zcela liší od předchozí generace léčiv. Přesto si původní přípravky – chorobu modifikující léky (disease-modifying drugs, DMDs) – zachovávají významné postavení v léčbě nemocných s RS [3]. Tento přehledný článek shrnuje novější poznatky o mechanismech působení GA a ukazuje na jeho možný potenciál ovlivnit neurodegenerativní procesy. Reflektuje i situaci, že se do klinického používání dostávají nové glatiramoidy, které zařazujeme do skupiny tzv. follow-on drugs [4].
Základní charakteristiky GA
GA je umělý kopolymer, který vznikl syntézou L-alaninu, L-lysinu, L-kyseliny glutamové a L-tyrosinu v poměru 4,2 : 3,4 : 1,4 : 1,0. GA se svou strukturou podobá myelinovému bazickému proteinu (MBP), který je považován za terč autoreaktivních T lymfocytů v modelu EAE i u nemocných s RS. Patří k paradoxům vědy, že GA poprvé syntetizovali vědci Weizmannova institutu jako látku, kterou chtěli indukovat EAE. V experimentech se však překvapivě ukázal naprosto opačný efekt – GA chránil před rozvojem EAE. Po desetiletích experimentální činnosti, která zahrnovala jak otázky syntézy GA, její standardizace a reprodukovatelnosti, tak vypracování palety testů in vitro, a s použitím zvířecích modelů, které ověřují biologické účinky jednotlivých šarží, byly pozitivní terapeutické efekty GA potvrzeny v klinických studiích.
Z již uvedených aminokyselin jsou v prvním kroku syntetizovány velké polymerní řetězce o molekulové hmotnosti (m. h.) okolo 1 500 000. Ty jsou následně v kyselém prostředí štěpeny za vzniku štěpů o m. h. 5000–9000,
z nichž většina má m. h. okolo 7000. Svou velikostí dosahující rozpětí 3–30 nm se GA řadí mezi nanočástice. GA nelze plně charakterizovat dostupnými analytickými metodami. Při popsaném postupu může teoreticky vzniknout až 1029 různých chemických entit. Na GA nelze aplikovat standardní kritéria, která jsou vyžadována jak u běžných „chemických“ léčiv, tak u biologik. U glatiramoidů nelze stanovit složení, chemickou strukturu, farmakokinetiku a farmakodynamiku. Z těchtodůvodů jsou glatiramoidy řazeny do samostatné skupiny léčiv označovaných jako komplexní nebiologické látky (non-biological complex drugs, NBCD). Absolutním požadavkem je přísné dodržování výrobního postupu, který je předmětem tajemství, a ověřování imunomodulačních parametrů jednotlivých výrobních šarží složitými biologickými testy. Jenom tak lze získat GA deklarovaných vlastností pro klinické aplikace.
Mechanismus účinku, farmakodynamika
GA prokazatelně tlumí poškozující zánět u nemocných s RS. Jsou přinášeny i důkazy, že pozitivně zasahuje do procesů neurodegenerace, které jsou podle současného konceptu součástí patogeneze RS od samého počátku. GA zůstává v místě subkutánní aplikace, v těle se sám zřejmě nešíří. V místě aplikace interaguje ne zcela známým způsobem s buňkami vrozené imunity, především s dendritickými buňkami. Ty se následně vyvazují z dané lokalizace a putují do sekundárních lymfatických uzlin. Klasické pokusy, uskutečňované ještě před poznáním zásadní úlohy dendritických buněk ve zpracování a prezentaci antigenů T lymfocytům, popisovaly schopnost další skupiny buněk prezentujících antigen, tj. makrofágů, navazovat peptidy GA přímo na molekuly hlavního histokompatibilního systému (human leucocyte antigens, HLA) II. třídy a zajišťovat tak rozpoznání těchto antigenů T lymfocyty. Podle současného paradigmatu tyto funkce přísluší dendritickým buňkám. Makrofágy se vlivem GA funkčně proměňují. Je potlačeno jejich vyzrávání do prozánětlivého fenotypu M1 tvořícího cytokiny TNFα (tumor nekrotizující faktor alfa), IL-6, IL-12 a IL-23 (interleukin 6, 12 a 23). GA naopak indukuje jejich diferenciaci do protizánětlivého fenotypu M2c, který tvorbou IL-10 a TGFβ (transforming growth factor beta, transformující růstový faktor beta) tlumí nežádoucí zánětlivou reakci. I to je součástí žádoucích protizánětlivých účinků GA.
Dendritické buňky při své cílené migraci do lymfatických uzlin GA internalizují a vnitrobuněčně zpracovávají. Imunogenní peptidy odvozené od GA navazují na molekuly HLA II. třídy a prezentují je v uzlinách T lymfocytům. S ohledem na molekulární podobnost GA a MBP je pravděpodobné, že antigenní fragmenty GA rozpoznávají autoreaktivní klony T lymfocytů zaměřené na imunodominantní epitopy MBP. Dendritické buňky se vlivem GA proměňují. Na svém povrchu nemusejí exprimovat v dostatečné míře kostimulační molekuly, např. CD80/CD86, CD40. Za těchto okolností dochází k tomu, že autoreaktivní T lymfocyt, který prostřednictvím TcR rozpozná antigen, namísto aktivace a klonální expanze podléhá apoptóze. Zesílenou expresí inhibičních molekul, např. CTLA4 (CD154), poskytuje dendritická buňka inhibiční/anergizační podněty autoreaktivním T lymfocytům. K dispozici máme řadu experimentálních nálezů, ale i klinických dat dokazujících, že dendritické buňky proměňují vlivem GA své membránové interakce i cytokinové mikroprostředí tak, že tlumí diferenciaci subsetu Th0 T lymfocytů do subsetů Th1 a Th17, GA naopak zesiluje jejich vyzrávání do subsetů Treg a Th2. Podle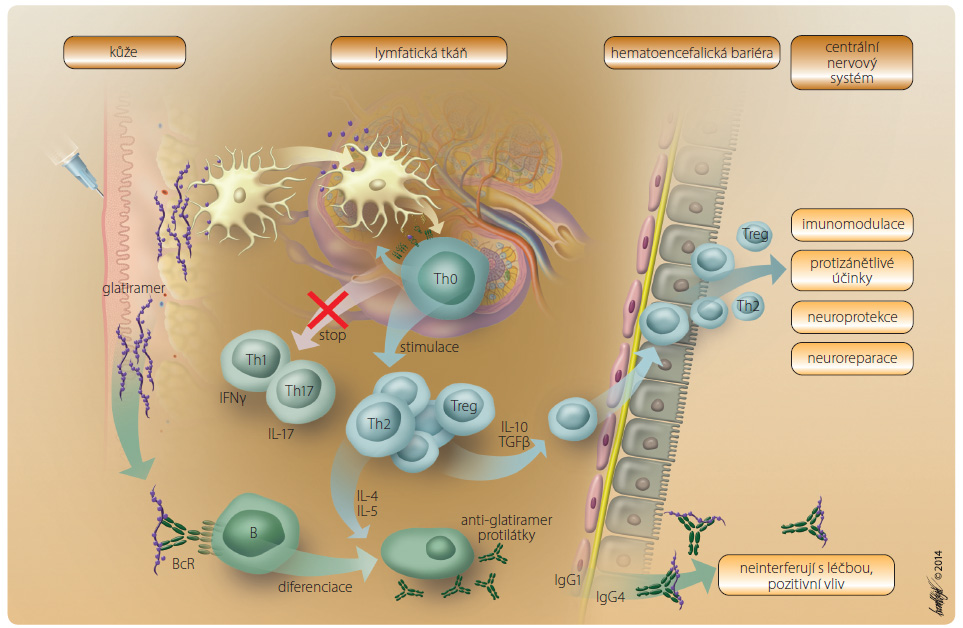 paradigmatu platného pro RS jsou subsety Th1 a Th17 považovány za zásadní součást poškozujícího zánětu. Přesmyk k aktivitám subsetů Treg a Th2 je spojen s indukcí homeostatických mechanismů, které tlumí poškozující zánět. T lymfocyty, především v subsetech Treg a Th2, aktivované v periferních lymfatických orgánech přestupují přes hematoencefalickou bariéru do CNS a tvorbou IL-10, TGFβ a IL-4 zde tlumí poškozující zánět.
paradigmatu platného pro RS jsou subsety Th1 a Th17 považovány za zásadní součást poškozujícího zánětu. Přesmyk k aktivitám subsetů Treg a Th2 je spojen s indukcí homeostatických mechanismů, které tlumí poškozující zánět. T lymfocyty, především v subsetech Treg a Th2, aktivované v periferních lymfatických orgánech přestupují přes hematoencefalickou bariéru do CNS a tvorbou IL-10, TGFβ a IL-4 zde tlumí poškozující zánět.
Vyloučena není ani možnost, že se GA samostatně dostává do CNS. Pravděpodobnější však bude jeho transport prostřednictvím dendritických buněk. Homeostatické působení GA by se za těchto okolností mohlo projevit přímo v CNS. Pro tento mechanismus působení GA však zatím nejsou k dispozici všechny experimentální důkazy [5].
GA a B lymfocyty
Je prokázáno, že u převážné většiny nemocných s RS se s odstupem od zahájení léčby GA vytvářejí ve vysoké koncentraci protilátky, které specificky reagují s GA. Jejich přítomnost léčebný účinek GA nesnižuje, na rozdíl od léčby biologiky, např. IFNβ, kde je tvorba protilátek odpovědná za selhání léčby. Naopak přítomnost protilátek proti GA je známkou dobré klinické odpovědi. Tento paradox lze vysvětlit několika způsoby, zatím však s minimem experimentálních důkazů.
Je možné, že protilátky proti GA zkříženě reagují s imunodominantními epitopy MBP. Svou vazbou encefalitogenní epitopy MBP neutralizují a prostřednictvím receptoru pro složku C3b komplementu a receptoru CR1 jsou autoantigeny eliminovány cestou retikuloendotelového systému. Snižuje se tak aktivace autoreaktivních T lymfocytů. Dalším možným vysvětlením je dobře dokumentovaná schopnost B lymfocytů zpracovat a prezentovat antigeny T lymfocytům. Prostřednictvím B lymfocytů tedy mohou být stimulovány pro GA specifické T lymfocyty subsetů Treg a Th2, které tlumí poškozující zánět u nemocných s RS. Konečně třetím, velmi pravděpodobným vysvětlením příznivého klinického účinku protilátek proti GA je, že jejich přítomnost svědčí pro klonální expanzi B lymfocytů specifických pro GA. Ty mohou prostupovat přes hematoencefalickou bariéru do CNS, kde jsou stimulovány zde přítomnými encefalitogenními peptidy odvozenými od MBP přímo in situ v CNS. Zde jsou zdrojem celého spektra cytokinů, které zahrnují i působky odpovědné za reparace nervových struktur [6].
GA a reparace nervové tkáně
Struktury CNS jsou pod permanentním tlakem zprostředkovaným oxidačním poškozením, excitotoxicitou a jistě i infekčními agens [7]. Je logické, že molekulární a buněčné léze v CNS musejí být průběžně reparovány. Děje se tak, třebaže obnovný potenciál CNS je v porovnání s jinými orgány nízký. Významnou roli v procesech udržování a reparace struktur CNS sehrávají buňky imunitního systému, které řízeně vstupují a vystupují z CNS přes hematoencefalickou bariéru. Imunocyty jsou v CNS významným zdrojem cytokinů, které regulují procesy regenerace [8, 9]. Přesvědčivé důkazy o úloze buněk imunity v ochraně před neurodegenerativními procesy přinášejí experimenty, kdy je zablokován vstup imunocytů do CNS. Výsledkem je významná neurodegenerace u experimentálních zvířat.
Základem obnovy struktur CNS jsou neuronální progenitorové buňky a progenitory oligodendrocytů. Bylo prokázáno, že T lymfocyty specifické pro GA tvoří neurotrofiny BDGF-1 (brain-derived growth factor 1) a NT-3,4
(neurotrophic factor 3, 4). Ty spolu s cytokinem IGF-1 (insulin-like growth factor 1) stimulují neuronální a oligodendrocytární progenitory k proliferaci, diferenciaci a migraci do demyelinizačních lézí. Zde dochází k remyelinizaci, atonálnímu růstu, zvratu neurodegenerace a k neuroprotekci. Velmi pravděpodobně tak působí také již zmíněné B lymfocyty specifické pro GA. Lze tedy uzavřít, že GA působí nejen protizánětlivě a imunomodulačně, ale pozitivně zasahuje i do procesů neurodegenerace u nemocných s RS.
GA a následné glatiramoidy
Po vypršení patentové ochrany se v klinické praxi začínají rychle uplatňovat generické kopie originálních léků a biosimilární léčiva nahrazující biologika. Jejich zavádění je v zemích Evropské unie regulováno Evropskou lékovou agenturou (European Medicines Agency, EMA) a ve Spojených státech amerických Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA). Protože tyto přípravky nemusejí projít celým finančně náročným schvalovacím řízením jako originální léčiva, je jejich cena obvykle nižší [10].
Pro již zmíněné unikátní vlastnosti nelze GA zařadit ani mezi generika, ani mezi biosimilární léčiva. Glatiramoidy vytvářejí zatím nepočetnou skupinu tzv. NBCD (non-biological complex drugs) léčiv spolu s lipozomy a nanočásticemi obsahujícími železo. Procesy, které by regulovaly nová léčiva v této skupině tzv. follow-on, nejsou v současnosti definovány. To se ukazuje jako nedostatek, protože konkrétně v případě glatiramoidů již existují tři výrobci, kteří uvádějí vlastní glatiramoidy na lokální trh a plánují globální expanzi. Byly provedeny zatím dílčí výzkumy, které porovnávají chemické a funkční charakteristiky nových glatiramoidů s přirozeně referenčním léčivem GA. Byly prokázány neshody ve velikosti peptidů a odlišnosti ve tvaru následných glatiramoidů. Za velmi problematickou je považována skutečnost, že výrobci nových glatiramoidů nedokáží zajistit konzistentní chemické parametry v jednotlivých výrobních šaržích. Tyto parametry jsou naprosto důsledně dodržovány výrobcem GA.
Imunobiologické vlastnosti nových glatiramoidů byly porovnány s působením GA v experimentech na myších, kde byla sledována genová exprese za užití genových čipů technologie Illumina. Jak GA, tak následné glatiramoidy shodně stimulovaly T-lymfocytární systém. Avšak pouze GA indukoval expresi genů, které určují diferenciaci do subsetu Treg T lymfocytů inhibujících poškozující subsety Th17 a Th1. Následné glatiramoidy navíc, v kontrastu s GA, stimulovaly expresi skupiny genů regulujících aktivity myeloidních buněk, zvláště monocytové makrofágové linie odpovědné za prozánětlivé aktivity [11, 12].
Závěr
Podrobnější poznání mechanismů účinku GA ukazuje, že tento lék má kromě schopnosti tlumit poškozující zánět v CNS nemocných s RS také potenciál pozitivně ovlivnit procesy neurodegenerace/neuroreparace v mozku. S ohledem na současné znalosti bude nutné přistupovat k zavádění následných glatiramoidů do klinické praxe velmi obezřetně. Mělo by na ně být nahlíženo jako na nové léky, které by měly projít celým schvalovacím procesem. Existují experimentální údaje, které implikují, že u pacientů již léčených GA není přechod k následné léčbě glatiramoidy žádoucí [13].
Seznam použité literatury
- [1] Lassman H, van Horssen J. The molecular basis of neurodegeneration in multiple sclerosis. FEBS Lett 2011; 585: 3715–3723.
- [2] Rangachari M, Kuchroo VK. Using EAE better understand principles of immune function and autoimmune pathology. J Autoimmun 2013; 45: 31–39.
- [3] Winkelmann A, Loebermann M, Reisinger EC, et al. Multiple sclerosis treatment and infectious issues: update 2013. Clin Exp Imunol 2014; 175: 425–438.
- [4] Holloway Ch, Mueller-Berghaus J, Lima BS, et al. Scientific considerations for complex drugs in light of established and emerging regulatory guidance. Ann N Y Acad Sci 2012; 1276: 26–36.
- [5] Lalive PH, Neuhaus O, Benkhoucha M, et al. Glatiramer acetate in the treatment of multiple sclerosis: emerging concepts regarding its mechanism of action. CNS Drugs 2011; 25: 401–414.
- [6] Ure DR, Rodriguez M. Polyreactive antibodies to glatiramer acetate promote myelin repair in murine model of demyelinating disease. FASEB J 2002; 16: 1260–1262.
- [7] Lee J, Giordano S, Zhang J. Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling. Biochem J 2012; 441: 523–540.
- [8] Peferoen L, Kipp M, van der Valk P, et al. Oligodendrocyte-microglia cross-talk in the central nervous system. Immunology 2014; 141: 302–313.
- [9] Skaper SD, Facci L, Giusti P. Mast cells, glia and neuroinflammation: partners in crime? Immunology 2014; 141: 314–327.
- [10] Schellekens H, Klinger E, Mühlebach S, et al. The therapeutic equivalence of complex drugs. Regul Toxicol Pharmacol 2011; 59: 176–183.
- [11] Varkony H, Weinstein V, Klinger E, et al. The glatiramoid class of immunomodulator drugs. Expert Opin Pharmacother 2009; 10: 657–668.
- [12] Towfic F, Funt JM, Fowler KD, et al. Comparing the biological impact of glatiramer acetate with the biological impact of a generic. PLoS One 2014; 9: 1–11.
- [13] Schellekens H, Stegemann S, Weinstein V, et al. How to regulate nonbiological complex drugs (NCBD) and their follow-on versions: points to consider. AAPS J 2014; 16: 15–21.