Migréna a komorbidity
Část přednášek odborného setkání se zaměřila na management migrény a komorbidit, a to i z klinického hlediska. Diskutovány byly především komorbidity psychiatrické, kardiovaskulární a neurologické.
Migréna
Epizoda bolesti hlavy potká během života téměř každého, čímž se řadí mezi jeden z nejfrekventovanějších neurologických symptomů [1]. Ke správnému určení příčiny je důležité na základě podrobně odebrané anamnézy zjistit její frekvenci, intenzitu, lokalizaci, spouštěcí mechanismy a doprovodné projevy. Dle Mezinárodní klasifikace bolestí hlavy (International Classification of Headache Disorders‑3, ICHD‑3) se mezi nejčastější primární bolesti hlavy řadí migréna, která postihuje až 15 % celosvětové populace [2]. Jedná se o chronické a vysilující onemocnění, které se vyznačuje záchvaty velmi silné bolesti, dysfunkcí autonomního nervového systému a u přibližně jedné třetiny pacientů je doprovázena i předcházející aurou [3]. Celoživotní riziko rozvoje migrény je vysoké, u žen přibližně 33 % a 18 % u mužů [4]. Rozvoj migrény není striktně vázán na určitou věkovou kategorii, typicky však začíná v období puberty a adolescence, méně často pak po 50. roce života [2,5].
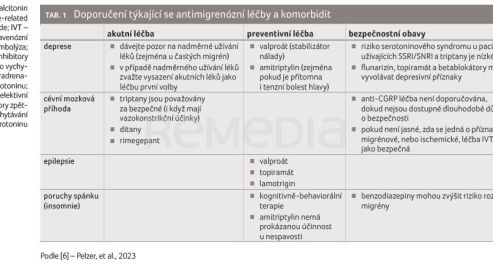 Komorbidita zahrnuje současný výskyt dvou nebo více zdravotních postižení, která mohou vzniknout ve vzájemné korelaci nebo na sobě zcela nezávisle [1]. Pojí se s nižší adherencí pacientů k léčbě, což vede k celkově vyšším nákladům na zdravotní péči. Mezi nejčastější komorbidní stavy u migrény patří psychiatrické, kardiovaskulární, neurologické onemocnění a další (tab. 1) [6].
Komorbidita zahrnuje současný výskyt dvou nebo více zdravotních postižení, která mohou vzniknout ve vzájemné korelaci nebo na sobě zcela nezávisle [1]. Pojí se s nižší adherencí pacientů k léčbě, což vede k celkově vyšším nákladům na zdravotní péči. Mezi nejčastější komorbidní stavy u migrény patří psychiatrické, kardiovaskulární, neurologické onemocnění a další (tab. 1) [6].
Psychiatrická onemocnění
Psychiatrickou zátěž u migreniků tvoří převážně deprese, úzkosti a bipolární porucha. Všechna zmíněná onemocnění predisponují ke zvýšenému riziku rozvoje migrény, které je dále eskalováno, pokud se u pacienta vyskytují současně [7,8]. Komorbidita migrény a deprese se považuje za obousměrnou asociaci, kde významný faktor představuje migréna chronická a migréna s aurou, u nichž je výskyt depresí až třikrát častější [9,10].
Úskalím depresivní symptomatiky, často podporující nadužívání analgetické medikace (medication overuse headache, MOH) při migrenózních atakách, je postupná chronifikace migrény [11], což dále vede ke snížené odpovídavosti na léčbu, a tím i k omezení terapeutických možností. V patofyziologii psychiatrických poruch významnou roli hrají familiární výskyt, genetické a environmentální faktory. K nim přispívá vliv stresu, který se sám o sobě řadí mezi často udávané subjektivní spouštěče migrenózní ataky [12]. Před nasazením preventivní terapie je vhodné doplnění screeningového testu deprese pro zvolení správné medikace, jelikož některá profylaktika (topiramát, flunarizin a betablokátory) mohou depresivní symptomy potencovat [13]. Naproti tomu jiná, například valproát, mohou mít náladu stabilizující efekt, tudíž jsou u pacientů s depresivním laděním ideálním kandidátem.
Amitriptylin je výhodné zvolit u pacientů s tenzním typem bolesti hlavy kombinované s poruchou spánku. Selektivní inhibitory zpětného vychytávání serotoninu (SSRI) nebo inhibitory zpětného vychytávání noradrenalinu a serotoninu (SNRI) nemají dostatečný antimigrenózní efekt, avšak jedná se o často dlouhodobě užívanou medikaci pacientů trpících depresemi (či úzkostnými poruchami). Riziko vzniku serotoninového syndromu u pacientů užívajících zároveň SSRI nebo SNRI a triptany (agonisty serotoninu) pro akutní léčbu migrény je nízké [14].
Jak již bylo řečeno, koincidence deprese u migrény může významně ovlivnit míru odpovědi na profylaktickou léčbu [15]. Jedním z takových případů je terapie onabotulinumtoxinem A, na niž je zaznamenána významně nižší odpověď u těchto pacientů [16]. V posledních letech se do popředí dostaly anti‑CGRP (calcitonin gene‑related peptide) monoklonální protilátky jakožto dostupná, bezpečná a interakčně neagresivní terapie v léčbě migrén [17]. Také post hoc analýzy v porovnání s placebem ukazují, že preventivní medikace anti‑CGRP při léčbě chronické migrény s depresí je významně efektivnější [18].
Kardiovaskulární onemocnění
Vazba kardiologických komorbidit, v popředí s cévní mozkovou příhodou a ischemickými srdečními příhodami, s primárními bolestmi hlavy je v poslední dekádě opakovaně prokázána mnoha výzkumy. Studie na zvířatech také dokazují vliv mikroembolizací jako spouštěče šíření korové deprese i bez následného rozvoje vzniku mikroinfarktů [19]. Již dlouhodobě je znám vyšší výskyt PFO (foramen ovale patens) u pacientů trpících migrénou s aurou. Ten tudíž zvyšuje nejen kardio‑ a cerebrovaskulární riziko, ale také četnost výskytu migrény s aurou [20]. V aktuálních guidelines však jeho uzávěr u pacientů s migrénou není indikován. Již dlouho se považuje za nutné zpozornět obzvláště u pacientek, které trpí vysoce aktivní formou migrény s aurou s četnými atakami, jsou toho času ve věku pod 45 let, mají anamnézu nikotinismu a současně užívají hormonální antikoncepci [21]. Otázkou ale je, zda by stejné riziko platilo i pro novou perorální antikoncepci s nižšími dávkami estrogenu. Při volbě antimigrenózní medikace je nutné vzít v potaz efekt standardně užívaných látek na vaskulární systém často způsobujících vazokonstrikci či zvýšení krevního tlaku [22]. Zásadní revoluci v akutní léčbě migrény představoval příchod triptanů, agonistů serotoninových receptorů, aktivujících vazokonstrikci dilatovaných cerebrálních tepen [23]. Pro tuto vlastnost bylo jejich indikační spektrum významně omezeno u pacientů s anamnézou kardiovaskulárního a cerebrovaskulárního rizika. Empiricky však byla opakovaně tato obava vyvrácena. Dokonce systematické sledování a observační studie publikované v roce 2015 nepopisují žádnou asociaci mezi užitím triptanů a rizikem kardiovaskulární příhody [24]. Je to vysvětleno patofyziologickým mechanismem vaskulárních chorob, v nichž vazokonstrikce sama o sobě hraje minoritní roli [25]. Jiná situace však nastává u pacientů s hemiplegickou migrénou a migrénou s kmenovou aurou při recentní ischemické cévní mozkové či srdeční příhodě nebo dekompenzované hypertenzi. Pro nasazení triptanů u těchto pacientů nemáme dostatečné množství průkazných studií o bezrizikovosti jejich dlouhodobého užívání, proto je zahájení této léčby kontraindikováno [26]. V případě dlouhodobě užívaných ergotaminových derivátů s působením nejen na serotoninové, ale i na dopaminergní a adrenergní receptory nastává významný vazokonstrikční efekt dominantně na extrakraniální, avšak minimálně na intrakraniální cévy, a tím absence vlivu na prokrvení mozkové cirkulace. Léky jsou asociovány se zvýšeným rizikem závažných ischemických komplikací. Jejich volba je tedy kontraindikována a považujeme je již za obsoletní formu terapie migrény. Léčebné metody pro akutní migrenózní ataky se u nás nově rozrůstají o možnost preskripce léků z řady gepantů, antagonistů CGRP receptoru. Ty představují pro pacienty s kardiovaskulárním rizikem nové obzory díky absenci vazokonstrikčního efektu. Jejich nasazení je tedy u těchto pacientů výhodné, přesto je nutný obezřetný přístup [27,28].
Roztroušená skleróza
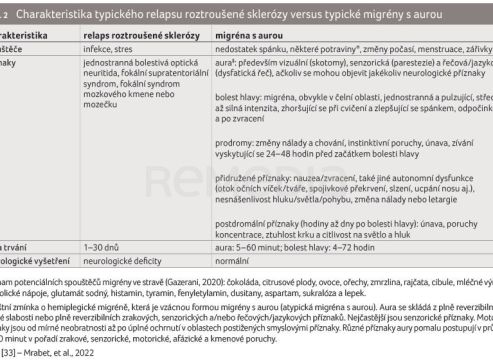 Bolest hlavy je dále jedním z typických průvodních jevů při roztroušené skleróze (RS). Prevalence výskytu primárních bolestí hlavy u pacientů s RS se pohybuje v rozmezí 35,5–70 %, přičemž nejčastějšími druhy jsou migréna a tenzní bolesti [29]. Obě onemocnění, migréna a RS, mají typicky nástup v produktivním období života při plánování založení rodiny a budování kariéry. Omezení, k nimž vedou, mají vliv nejen na rodinné, osobní a pracovní aktivity pacienta, ale znamenají i celkové společensko‑ekonomické dopady. Pokud se například bolest hlavy s aurou vyskytne u pacienta s diagnostikovanou RS, je důležité z hlediska diferenciální diagnostiky rozlišit, zda se jedná o ataku RS, či záchvat migrény. Recidivu RS definují akutní nebo subakutní fokální nebo multifokální příznaky CNS, které trvají alespoň 24 hodin a jsou následovány variabilním zotavením. Mohou zahrnovat například unilaterální optickou neuritidu, supratentoriální, kmenový či cerebelární syndrom [30]. Naproti tomu u migrény jsou fokální CNS symptomy vázané na auru, typicky vizuální, v 90 % (skotomy, výpadky zorného pole, jiskření, rozmazané či tunelové vidění), senzitivní (parestezie obličeje nebo končetin), poruchy řeči, motorické (hemiparézy – u familiární hemiplegické migrény, FHM) [31,32]. Obvykle se rozvíjejí během pěti minut a přetrvávají méně než 60 minut s plnou reverzibilitou. Typicky se projeví jeden symptom odpovídající dané oblasti zasažené mozkové kůry. Kratší délka trvání je zásadním diferenciačním faktorem mezi migrénou s aurou a atakou RS. Dalším důležitým symptomem přispívajícím k diagnóze migrény je následný rozvoj typických bolestí hlavy do 60 minut od příznaků aury. Diferenciální diagnostika migrény a relapsu RS může být obzvláště komplikovaná při prolongaci příznaků aury déle než tři hodiny nebo absenci nástupu migrenózní bolesti hlavy.
Bolest hlavy je dále jedním z typických průvodních jevů při roztroušené skleróze (RS). Prevalence výskytu primárních bolestí hlavy u pacientů s RS se pohybuje v rozmezí 35,5–70 %, přičemž nejčastějšími druhy jsou migréna a tenzní bolesti [29]. Obě onemocnění, migréna a RS, mají typicky nástup v produktivním období života při plánování založení rodiny a budování kariéry. Omezení, k nimž vedou, mají vliv nejen na rodinné, osobní a pracovní aktivity pacienta, ale znamenají i celkové společensko‑ekonomické dopady. Pokud se například bolest hlavy s aurou vyskytne u pacienta s diagnostikovanou RS, je důležité z hlediska diferenciální diagnostiky rozlišit, zda se jedná o ataku RS, či záchvat migrény. Recidivu RS definují akutní nebo subakutní fokální nebo multifokální příznaky CNS, které trvají alespoň 24 hodin a jsou následovány variabilním zotavením. Mohou zahrnovat například unilaterální optickou neuritidu, supratentoriální, kmenový či cerebelární syndrom [30]. Naproti tomu u migrény jsou fokální CNS symptomy vázané na auru, typicky vizuální, v 90 % (skotomy, výpadky zorného pole, jiskření, rozmazané či tunelové vidění), senzitivní (parestezie obličeje nebo končetin), poruchy řeči, motorické (hemiparézy – u familiární hemiplegické migrény, FHM) [31,32]. Obvykle se rozvíjejí během pěti minut a přetrvávají méně než 60 minut s plnou reverzibilitou. Typicky se projeví jeden symptom odpovídající dané oblasti zasažené mozkové kůry. Kratší délka trvání je zásadním diferenciačním faktorem mezi migrénou s aurou a atakou RS. Dalším důležitým symptomem přispívajícím k diagnóze migrény je následný rozvoj typických bolestí hlavy do 60 minut od příznaků aury. Diferenciální diagnostika migrény a relapsu RS může být obzvláště komplikovaná při prolongaci příznaků aury déle než tři hodiny nebo absenci nástupu migrenózní bolesti hlavy.
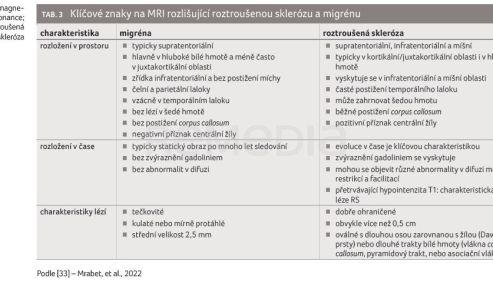 Současné výzkumy se aktuálně snaží o podrobnou interpretaci změn na magnetické rezonanci mozku (MRI) u pacienta s migrénou bez komorbidity RS. Zásadní pro stanovení diagnózy RS zůstává splnění specifických radiodiagnostických kritérií v korelaci s klinickým nálezem (tab. 2, 3) [33].
Současné výzkumy se aktuálně snaží o podrobnou interpretaci změn na magnetické rezonanci mozku (MRI) u pacienta s migrénou bez komorbidity RS. Zásadní pro stanovení diagnózy RS zůstává splnění specifických radiodiagnostických kritérií v korelaci s klinickým nálezem (tab. 2, 3) [33].
Epilepsie
Mezi další časté komorbidity migrény se řadí epilepsie, jejíž vazba s migrénou by se dala popsat jako obousměrná. Epileptický paroxysmus může souviset s rozvojem migrenózní ataky, stejně tak migrenózní ataka s rozvojem epileptického záchvatu. Prevalence migrény je přítomna u 8–24 % pacientů s epilepsií, z čehož vyplývá, že jsou ohroženi až dvojnásobným rizikem oproti běžné populaci [34]. Současná klinická manifestace bolesti hlavy a epilepsie může vést k vzájemnému prolínání jejich symptomů. Příkladem může být vizuální aura před záchvatem nebo postiktální bolest hlavy. Společný výskyt obou onemocnění se zejména vyskytuje u FHM. U této formy onemocnění byly identifikovány tři zásadní genetické mutace v genech CACNA1A (FHM1), ATP1A2 (FHM2) a SCN1A (FHM3), které se všechny podílejí na vzniku iontových transportérů a jsou pravděpodobně zodpovědné za zvýšení hodnoty glutamátu v neuronech [35]. Fenomén šíření kortikální deprese u migrény s aurou podněcuje po hyperexcitabilitě depolarizační blok, který nastoluje dlouhotrvající neuronální depresi. Depolarizační blok byl zaznamenán také u iktální, interiktální a postiktální epileptické aktivity [36]. Vzhledem k faktu, že profylaktické užívání antiepileptické medikace prokazatelně snižuje četnost migrenózních atak, to svědčí o jejich patofyziologickém propojení [37].
Závěr
Existuje mnoho patofyziologických mechanismů, které mohou objasnit vazbu migrény s dalšími nemocemi. Důslednou anamnézou můžeme odkrýt spouštěče migrenózních atak a zároveň včas identifikovat současný výskyt dalších onemocnění, jejichž brzké rozpoznání může vést k rychlejšímu a efektivnějšímu určení léčebné strategie. To nám mimo eliminaci míry zátěže na zdravotní stav pacienta umožní také mírnit dopady na celkovou kvalitu života ve smyslu omezení kariérní seberealizace a rodinné pohody. Léčba migrény ve spojení s komorbidními stavy si tedy žádá obezřetný a striktně individualizovaný přístup.
MUDr. Ľubica Joppeková1,2; MUDr. Hana Záhumenská2
1 Lékařská fakulta Masarykovy univerzity v Brně; 2 Neurologická klinika FN Brno
Literatura
[1] Andlin‑Sobocki P, Jönsson B, Wittchen HU, et al. Cost of disorders of the brain in Europe. Eur J Neurol 2005; 12: 1–27.
[2] Jensen R, Stovner LJ. Epidemiology and comorbidity of headache. Lancet Neurol 2008; 7: 354–361.
[3] Goadsby PJ. Mechanisms and Mangement of Headache. J Royal Coll Physicians Lond 1999; 33: 228–234.
[4] Stewart WF, Wood C, Reed ML, et al. Cumulative lifetime migraine incidence in women and men. Cephalalgia 2008; 28: 1170–1178.
[5] Feigin VL, Nichols E, Alam T, et al. Global, regional, and national burden of neurological disorders, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol 2019; 18: 459–480.
[6] Pelzer N, de Boer I, van den Maagdenberg AMJM, Terwindt GM. Neurological and psychiatric comorbidities of migraine: Concepts and future perspectives. Cephalalgia 2023; 43: 3331024231180564.
[7] Merikangas KR, Angst J, Isler H. Migraine and psychopathology. Results of the Zurich cohort study of young adults. Arch Gen Psychiatry 1990; 47: 849–853.
[8] Romo‑Nava F, Blom T, Cuellar‑Barboza AB, et al. Revisiting the bipolar disorder with migraine phenotype: Clinical features and comorbidity. J Affect Disord 2021; 295: 156–162.
[9] Rist PM, Schürks M, Buring JE, et al. Migraine, Headache and the Risk of Depression: Prospective Cohort Study. Cephalalgia 2013; 33: 1017–1025.
[10] Ashina S, Serrano D, Lipton RB, et al. Depression and risk of transformation of episodic to chronic migraine. J Headache Pain 2012; 13: 615–624.
[11] Louter MA, Bosker JE, van Oosterhout WPJ, et al. Cutaneous allodynia as a predictor of migraine chronification. Brain 2013; 136: 3489–3496.
[12] van Casteren DS, Verhagen IE, Onderwater GL, et al. Sex differences in prevalence of migraine trigger factors: A cross‑sectional study. Cephalalgia 2021; 41: 643–648.
[13] Celano CM, Freudenreich O, Fernandez‑Robles C, et al. Depressogenic effects of medications: a review. Dialogues Clin Neurosci 2011; 13: 109–125.
[14] Orlova Y, Rizzoli P, Loder E. Association of Coprescription of Triptan Antimigraine Drugs and Selective Serotonin Reuptake Inhibitor or Selective Norepinephrine Reuptake Inhibitor Antidepressants With Serotonin Syndrome. JAMA Neurol 2018; 75: 566–572.
[15] Raffaelli B, Fitzek M, Overeem LH, et al. Clinical evaluation of super‑responders vs. non‑responders to CGRP(‑receptor) monoclonal antibodies: a real‑world experience. J Headache Pain 2023; 24: 16.
[16] Schiano di Cola F, Caratozzolo S, Liberini P, et al. Response Predictors in Chronic Migraine: Medication Overuse and Depressive Symptoms Negatively Impact Onabotulinumtoxin‑A Treatment. Front Neurol 2019; 10: 678.
[17] Charles A, Pozo‑Rosich P. Targeting calcitonin gene‑related peptide: a new era in migraine therapy. Lancet 2019; 394: 1765–1774.
[18] Lipton RB, Cohen JM, Galic M, et al. Effects of fremanezumab in patients with chronic migraine and comorbid depression: Subgroup analysis of the randomized HALO CM study. Headache 2021; 61: 662–672.
[19] Nozari A, Dilekoz E, Sukhotinsky I, et al. Microemboli may link spreading depression, migraine aura, and patent foramen ovale. Ann Neurol 2010; 67: 221–229.
[20] Koppen H, Palm‑Meinders IH, Mess WH, et al. Systemic right‑to‑left shunts, ischemic brain lesions, and persistent migraine activity. Neurology 2016; 86: 1668.
[21] Øie LR, Kurth T, Gulati S, et al. Migraine and risk of stroke. J Neurol Neurosurg Psychiatry 2020; 91: 593–604.
[22] Chan KY, Vermeersch S, de Hoon J, et al. Potential mechanisms of prospective antimigraine drugs: a focus on vascular (side) effects. Pharmacol Ther 2011; 129: 332–351.
[23] Razzaque Z, Pickard JD, Ma QP, et al. 5‑HT1B‑receptors and vascular reactivity in human isolated blood vessels: assessment of the potential craniovascular selectivity of sumatriptan. Br J Clin Pharmacol 2002; 53: 266–274.
[24] Cameron C, Kelly S, Hsieh SC, et al. Triptans in the acute treatment of migraine: a systematic review and network meta‑analysis. Headache 2015; 55: 221–235.
[25] Frąk W, Wojtasińska A, Lisińska W, et al. Pathophysiology of cardiovascular diseases: new insights into molecular mechanisms of atherosclerosis, arterial hypertension, and coronary artery disease. Biomedicines 2022; 10: 1938.
[26] Catella‑Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345: 1809–1817.
[27] Rubio‑Beltran E, Chan KY, Danser AJ, et al. Characterisation of the calcitonin gene‑related peptide receptor antagonists ubrogepant and atogepant in human isolated coronary, cerebral and middle meningeal arteries. Cephalalgia 2020; 40: 357–366.
[28] Argunhan F, Brain SD. The vascular‑dependent and ‑independent actions of calcitonin gene‑ related peptide in cardiovascular disease. Front Physiol 2022; 13: 833645.
[29] Busillo V, Pizza V, Cassano D, et al. Headache and multiple sclerosis. PharmacologyOnLine 2014; 70: 68–72.
[30] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17: 162–173.
[31] Fraser CL, Hepschke JL, Jenkins B, et al. Migraine Aura: Pathophysiology, Mimics, and Treatment Options. Semin Neurol 2019; 39: 739–748.
[32] Viana M, Sances G, Linde M, et al. Clinical features of migraine aura: Results from a prospective diary‑aided study. Cephalalgia 2017; 37: 979–989.
[33] Mrabet S, Wafa M, Giovannoni G. Multiple sclerosis and migraine: Links, management and implications. Mult Scler Relat Disord 2022; 68: 104152.
[34] Rogawski MA, Migraine and epilepsy‑Shared mechanisms within the family of episodic disorders. In: Avoli M, Noebels JL, Rogawski MA, et al. Jasper’s Basic Mechanisms of the Epilepsies, Oxford University Press, 2012.
[35] Hoffmann J, Charles A. Glutamate and Its Receptors as Therapeutic Targets for Migraine. Neurotherapeutics 2018; 15: 361–370.
[36] Mantegazza M, Cestèle S. Pathophysiological mechanisms of migraine and epilepsy: Similarities and differences. Neurosci Lett 2018; 667: 92–102.
[37] Demarquay G, Rheims S. Relationships between migraine and epilepsy: Pathophysiological mechanisms and clinical implications. Rev Neurol (Paris) 2021; 177: 791–800.