Úspěšná léčba chronické myeloidní leukemie – zkušenost z reálné klinické praxe
Souhrn
Čičátková P, Horňák T, Žáčková D. Úspěšná léčba chronické myeloidní leukemie – zkušenost z reálné klinické praxe.
Terapie chronické myeloidní leukemie inhibitory tyrozinkináz vedla k dramatickému zlepšení prognózy pacientů s tímto onemocněním. Po splnění cíle v podobě prodloužení délky života na roveň zdravým vrstevníkům je pozornost lékařů i pacientů nyní soustředěna na kvalitu jejich života. Velký potenciál je přisuzován nejnovějšímu tyrozinkinázovému inhibitoru asciminibu, který působí unikátním mechanismem účinku v podobě vazby do myristoylové kapsy. Níže je popsán případ pacienta léčeného asciminibem ve čtvrté linii po selhání i nesnášenlivosti dříve podávaných inhibitorů tyrozinkináz. Klíčová slova: chronická myeloidní leukemie – inhibitory tyrozinkináz – asciminib – inhibitor STAMP.
Summary
Cicatkova P, Hornak T, Zackova D. Successful treatment of chronic myeloid leukemia – an experience from real clinical practice.
The chronic myeloid leukemia therapy with tyrosine kinase inhibitors has led to a dramatic improvement of prognosis for patients with this disease. After achieving the goal of prolongation life expectancy to that of healthy peers, the focus of both doctors and patients is now on the quality of life. There is significant potential in the latest tyrosine kinase inhibitor, asciminib, which works through a unique mechanism by binding to the myristoyl pocket. The following case report describes a chronic myeloid leukemia patient treated with asciminib in the fourth line after failure or intolerance of previously administered tyrosine kinase inhibitors. Key words: chronic myeloid leukemia – tyrosine kinase inhibitors – asciminib – STAMP inhibitor.
Úvod
Prognóza chronické myeloidní leukemie (CML) v chronické fázi (chronic phase, CP) se díky zavedení inhibitorů tyrozinkináz (TKI) v čele s imatinibem dramaticky zlepšila a desetileté přežití těchto pacientů ve studii IRIS (International Randomized Study of Interferon and STI571) dosáhlo 83,3 %. Zároveň však byl po 10 letech od zahájení léčby imatinib vysazen u více než poloviny pacientů [1]. Tato skutečnost podtrhuje význam TKI vyšších generací a zdůrazňuje potřebu vyvíjet další TKI včetně těch s odlišným místem působení, než je adenosintrifosfátová (ATP) vazebná doména.
Prvním TKI s jiným mechanismem účinku je inhibitor STAMP (Specifically Targeting the BCR‑ABL1 Myristoyl Pocket) asciminib působící cestou myristoylové kapsy, což vede k inhibici patologické kinázy BCR::ABL1 [2]. Dveře do klinické praxe tomuto TKI otevřela studie ASCEMBL porovnávající u pacientů v CP předléčených alespoň dvěma TKI účinnost a bezpečnost asciminibu (40 mg 2× denně) oproti bosutinibu (500 mg 1× denně). Mezi pacienty léčenými asciminibem jsme v porovnání s bosutinibem viděli vyšší podíl dosažení velké molekulární odpovědi (major molecular response, MMR) jak po 24 měsících terapie (25,5 % vs. 13,2 %), tak po 96 měsících terapie (37,6 % vs. 15,8 %) [3,4]. Taktéž snášenlivost asciminibu se jevila velmi slibná, k ukončení terapie vedly nežádoucí účinky u 7,7 % pacientů léčených asciminibem v porovnání s 23,6 % pacientů léčených bosutinibem. Nejčastější nežádoucí účinky zahrnovaly bolest hlavy (19,9 %), únavu (14,7 %), arteriální hypertenzi (13,5 %), průjem, bolesti kloubů (shodně 12,8 %) a nevolnost (11,5 %) [4]. Postavení asciminibu v terapii CML i zkušenosti s jeho podáváním v reálné klinické praxi byly již v minulosti publikovány i v českém písemnictví [5–8]. Předkládaná kazuistika ukazuje případ pacienta léčeného asciminibem ve čtvrté linii léčby.
Popis případu
Pacient ve věku 42 let byl v září 2014 odeslán na hematologii praktickým lékařem pro splenomegalii a mírnou leukocytózu. Molekulárně genetickým vyšetřením byla potvrzena přítomnost fúzního genu BCR::ABL1 s typem transkriptu b2a2, a tak stanovena diagnóza CML v CP. Pacient trpěl přidruženými onemocněními v podobě arteriální hypertenze, dyslipidemie, obezity a Gilbertova syndromu.
V rámci první linie byla v říjnu 2014 zahájena terapie nilotinibem v plné dávce 600 mg na den. Po dvou týdnech terapie bylo dosaženo kompletní hematologické odpovědi, avšak také se začaly objevovat nežádoucí účinky v podobě trombocytopenie stupně závažnosti 2, elevace bilirubinu stupně závažnosti 2 a také elevace amylázy a lipázy stupně závažnosti 1 (všechny nežádoucí účinky byly hodnoceny dle CTCAE – Common Terminology Criteria for Adverse Events). Elevace bilirubinu se v prvních měsících terapie zhoršovala až na hodnoty odpovídající stupni závažnosti 3 a terapie musela být v průběhu roku 2015 opakovaně přerušována. Od prosince 2015 byl nilotinib podáván v redukované dávce 300 mg denně. Na elevaci bilirubinu měl jistý podíl i Gilbertův syndrom, ale při užívání snížené dávky nilotinibu již u bilirubinu nedocházelo k významnému nárůstu koncentrace, která se pohybovala maximálně na hodnotách odpovídajících stupni závažnosti 2. Léčebná odpověď v uzlových bodech v průběhu prvního roku léčby byla optimální dle kritérií ELN (European LeukemiaNet), přičemž po 12 měsících terapie, v říjnu 2015, byla hladina transkriptu BCR::ABL1 0,022 % na mezinárodní škále (international scale, IS), což odpovídá úrovni MMR [9]. Terapie probíhala s dobrou tolerancí i optimální účinností až do konce roku 2016. V lednu 2017 byla zaznamenána ztráta MMR s nárůstem transkriptu BCR::ABL1 na 1,3 % IS. Byla provedena mutační analýza s negativním výsledkem a také sternální punkce rovněž potvrzující ztrátu kompletní cytogenetické odpovědi.
Po konfirmaci ztráty MMR v únoru 2017 (hladina transkriptu BCR::ABL1 2,8 % IS) byla terapie změněna na dasatinib. Promptně bylo dosaženo hluboké molekulární odpovědi (deep molecular response, DMR, tj. hladina transkriptu BCR::ABL1 ≤ 0,01 %) s transkriptem BCR::ABL1 na úrovni 0,002 % IS. Opět se ale objevila trombocytopenie stupně závažnosti 2, kdy při hodnotě trombocytů 56 × 109/l byla dávka dasatinibu redukována na střídavě 80 mg a 60 mg denně. V říjnu 2017, po devíti měsících terapie, byla jednorázově zaznamenána ztráta MMR se vzestupem hladiny transkriptu BCR::ABL1 na 0,18 % IS. Následným odběrem však nebyla konfirmována a opět byla potvrzena DMR. Trombocytopenie se zlepšila na hodnoty kolísající mezi trombocytopenií 1. stupně závažnosti a jejich normálním počtem a pacient pokračoval v terapii sníženou dávkou dasatinibu s dobrou tolerancí i uspokojivou odpovědí.
V dubnu 2019, po 28 měsících terapie dasatinibem, došlo k opětovné progresi trombocytopenie na 2. stupeň závažnosti s nutností další redukce dávky na 60 mg denně (přechodně s víkendovou pauzou). V lednu 2020 byla konfirmována ztráta MMR (hodnota transkriptu BCR::ABL1 1,1 % IS). Dávka dasatinibu byla navýšena nejprve na 80 mg a později na plnou dávku 100 mg a provedená mutační analýza znovu prokázala negativní výsledek. Po přechodném poklesu hladiny transkriptu jeho hodnota opětovně narostla a v prosinci 2020 byla terapie změněna na ponatinib v dávce 30 mg denně. Již po dvou měsících terapie byla obnovena MMR, která přetrvávala i při dalších kontrolách, což vedlo v červnu 2021 ke snížení dávky ponatinibu na 15 mg denně. Pro ztrátu MMR byla dávka ponatinibu v říjnu 2021 opět navýšena na 30 mg. Přestože to vedlo nejen k promptnímu obnovení MMR, ale i DMR s nedetekovatelným transkriptem BCR::ABL1, léčebná odpověď v dalším průběhu znovu kolísala a došlo i k hraniční ztrátě MMR (0,13 % v srpnu 2022).
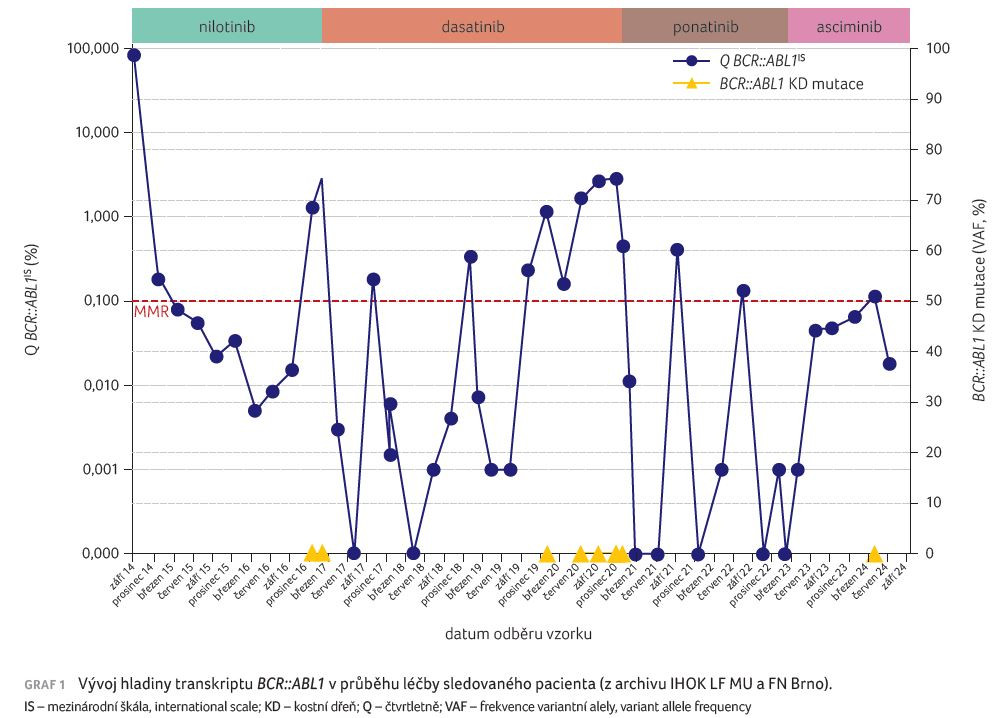 Vzhledem k nutnosti podávat alespoň 30 mg ponatinibu k udržení léčebné odpovědi a kvůli obavám z nežádoucích účinků při dlouhodobé terapii jsme se rozhodli léčbu změnit na asciminib v rámci specifického léčebného programu. Terapie byla zahájena v lednu 2023 ve standardním dávkování 40 mg 2× denně. Pacient léčbu od počátku subjektivně výborně toleroval, nicméně v květnu 2023 mu byla diagnostikována porucha glukózové tolerance s nutností zavedení diety s omezením cukrů. Prozatím nedošlo k rozvoji diabetes mellitus. Poslední kontrola proběhla v září 2024, po 20 měsících terapie asciminibem, kdy se již neobjevily žádné další nežádoucí účinky a léčebná odpověď dlouhodobě setrvává na úrovni MMR s ojedinělým zakolísáním těsně nad tuto hranici. Vývoj hladiny transkriptu BCR::ABL1 od diagnózy po celou dobu terapie ukazuje graf 1.
Vzhledem k nutnosti podávat alespoň 30 mg ponatinibu k udržení léčebné odpovědi a kvůli obavám z nežádoucích účinků při dlouhodobé terapii jsme se rozhodli léčbu změnit na asciminib v rámci specifického léčebného programu. Terapie byla zahájena v lednu 2023 ve standardním dávkování 40 mg 2× denně. Pacient léčbu od počátku subjektivně výborně toleroval, nicméně v květnu 2023 mu byla diagnostikována porucha glukózové tolerance s nutností zavedení diety s omezením cukrů. Prozatím nedošlo k rozvoji diabetes mellitus. Poslední kontrola proběhla v září 2024, po 20 měsících terapie asciminibem, kdy se již neobjevily žádné další nežádoucí účinky a léčebná odpověď dlouhodobě setrvává na úrovni MMR s ojedinělým zakolísáním těsně nad tuto hranici. Vývoj hladiny transkriptu BCR::ABL1 od diagnózy po celou dobu terapie ukazuje graf 1.
Závěr a diskuse
Spektrum nežádoucích účinků, které provázejí terapii jednotlivými TKI, je alespoň částečně určováno dalšími blokovanými tyrozinkinázami. Proto také některé nežádoucí účinky, včetně cytopenií, mohou provázet terapii vícero TKI, jak jsme pozorovali i při terapii našeho pacienta. Trombocytopenie byla přítomna jak při léčbě nilotinibem, tak při léčbě dasatinibem. Po pěti letech léčby nilotinibem ve studii ENESTnd se závažná trombocytopenie (gr. 3 a více) vyskytla u 10,4 % pacientů a při podávání dasatinibu ve studii DASISION byl výskyt tohoto nežádoucího účinku pozorován u 22 % léčených dasatinibem [10,11]. Proto jsou pravidelné kontroly krevního obrazu při terapii všemi TKI nezbytnou součástí monitorování nejen účinnosti této terapie, ale také právě její hematologické toxicity. I hepatotoxicita pozorovaná u našeho pacienta patří k obávaným nežádoucím účinkům léčby TKI, nicméně při terapii nilotinibem patří spíše ke vzácnějším (v rámci studie ENESTnd byla pozorována u 1,8 % pacientů léčených nilotinibem v dávce 600 mg denně) a na hyperbilirubinemii se u našeho pacienta významně podílel i Gilbertův syndrom prokázaný již v předchorobí. Kolísání léčebné odpovědi je pozorováno u nemalé části pacientů. U prezentovaného případu byla k udržení léčebné odpovědi nutná plná dávka dasatinibu (spojená se současným výskytem nežádoucích účinků) i vyšší dávka ponatinibu, jejíž dlouhodobé podávání je taktéž rizikové s ohledem na závažné nežádoucí účinky vyskytující se při terapii tímto přípravkem.
V předložené kazuistice bylo potvrzeno, že asciminib je vhodnou alternativou nejen pro referovaného pacienta, ať už s ohledem na udržení optimální léčebné odpovědi, nebo pro absenci závažných nežádoucích účinků. Porucha glukózové tolerance odhalená u našeho pacienta mohla mít kromě terapie asciminibem spojitost také s obezitou a životním stylem. Asciminib se tak jeví jako bezpečná volba pro předléčené pacienty, nicméně pro posouzení dlouhodobé účinnosti i snášenlivosti je třeba delšího sledování.
Předkládaná práce vznikla díky podpoře Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1558/2023.
MUDr. Petra Čičátková
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e‑mail: petra.cicatkova@fnbrno.cz
Literatura
[1] Hochhaus A, Larson RA, Guilhot F, et al. Long‑term outcomes of imatinib treatment for chronic myeloid leukemia. N Engl J Med 2017; 379: 919–927.
[2] Hughes TP, Mauro MJ, Cortes JE, et al. Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019; 381: 2315–2326.
[3] Rea D, Mauro MJ, Boquimpani C, et al. A phase 3, open‑label, randomized study of asciminib, a STAMP inhibitor, vs bosutinib in CML after 2 or more prior TKIs. Blood 2021; 138: 2031–2041.
[4] Hochhaus A, Rea D, Boquimpani C, et al. Asciminib vs bosutinib in chronic‑phase chronic myeloid leukemia previously treated with at least two tyrosine kinase inhibitors: longer‑term follow‑up of ASCEMBL. Leukemia 2023; 37: 617–626.
[5] Čičátková P, Horňák T, Kvetková A, Žáčková D. Asciminib a jeho postavení v léčbě chronické myeloidní leukemie. Onkol Revue 2024; 11: 1–5.
[6] Čičátková P, Horňák T, Jurček T, Žáčková D. Chronická myeloidní leukemie – potřebujeme ještě nové inhibitory tyrozinkináz? Onko Revue 2023; 10(Suppl 1): 34–36.
[7] Čičátková P, Žáčková D. Postavení inhibitorů tyrozinkináz v léčbě chronické myeloidní leukemie. Onkol Revue 2023: 10: 1–6.
[8] Horňák T, Čičátková P, Žáčková D. Asciminib – nová léčebná možnost v léčbě CML. Farmakoterapie 2023; 1: 313–324.
[9] Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 36: 966–984.
[10] Hochhaus A, Saglio G, Hughes TP, et al. Long‑term benefits and risk of frintline nilotinib vs. imatinib for chronic myeloid leukemia in chronic phase: 5‑year update of the randomized ENESTnd trial. Leukemia 2016; 30: 1044–1054.
[11] Cortes JE, Saaglio G, Kantarjian HM, et al. Final 5‑year study results of DASISION: The dasatinib versus imatinib study in treatment‑näive chronic myeloid leukemia patients trial. J Clin Oncol 2016; 34: 2333–2347.
Kompletní ZASTŘENO Asciminib najdete na https://www.remedia.cz/specialy/zaostreno-asciminib/