Tříletá léčba psoriázy bimekizumabem ve světle recentních analýz
Bimekizumab (BKZ) představuje monoklonální protilátku IgG1, která selektivně inhibuje interleukin (IL) 17A a 17F. V léčbě pacientů se středně těžkou až těžkou ložiskovou psoriázou prokázal BKZ v přímém srovnání s ustekinumabem, adalimumabem a secukinumabem rychlou, superiorní a setrvalou účinnost [1–5]. Na nedávném kongresu Evropské akademie pro dermatologii a venerologii (European Academy of Dermatology and Venerology, EADV), který se konal 11.–14. října 2023 v Berlíně, byly představeny výsledky analýz s různým zaměřením hodnotících léčbu BKZ v horizontu tří let.
Udržení odpovědi na léčbu
Práce autorů Thaçi a kol. sledovala dlouhodobou účinnost a setrvalou odpověď na léčbu BKZ [6]. Do sledování byli zařazeni pacienti z pěti studií fáze III/IIIb, kteří dosáhli v týdnu 16 kompletní nebo téměř kompletní odpovědi. Jedná se o dosud největší soubor dat shromážděných z klinických studií fáze III BE VIVID, BE READY, BE SURE a otevřené extenze (OLE) BE BRIGHT a studie fáze IIIb a její extenze BE RADIANT [1–5]. Uspořádání blíže popisuje obrázek 1. Pacienti byli do týdne 16 randomizováni k podávání BKZ v intervalu čtyř týdnů (Q4W). V následném udržovacím období a OLE dostávali pacienti BKZ v interva’lu Q4W nebo osmi týdnů (Q8W). Sledováno bylo udržení odpovědi PASI 90 (90% zlepšení Psoriasis Area and Severity Index), PASI 100 (100% zlepšení PASI) a IGA (Investigator’s Global Assessment) 0/1 po dobu tří let. Dopad kožního onemocnění na kvalitu života pacienta byl hodnocen pomocí Dermatology Life Quality Index (DLQI) u pacientů s PASI 100 v týdnu 16. Data byla vyhodnocena souhrnně (BKZ celkem) a pro podskupinu pacientů, kteří dostávali dávkování BKZ Q4W/Q8W/Q8W (počáteční/udržovací/OLE).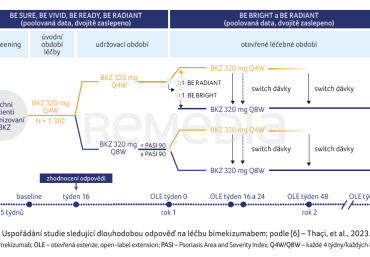
Pro počáteční období léčby BKZ Q4W bylo randomizováno celkem 1 362 pacientů. Z nich 86,9 % dosáhlo v týdnu 16 odpovědi PASI 90, 62,4 % PASI 100 a 86,9 % IGA 0/1. Do otevřeného sledování vstoupilo 995 pacientů s odpovědí PASI 90, 719 s odpovědí PASI 100 a 985 nemocných s odpovědí IGA 0/1.
Z pacientů s odpovědí PASI 90, PASI 100 a IGA 0/1 v týdnu 16 si v prvním roce (48. týden) odpovědi udrželo 96,0 %, 88,7 % a 95,8 %. U pacientů s odpovědí PASI 100 v týdnu 16 se míra odpovědi DLQI 0/1 během prvního roku léčby zvýšila a dosáhla podílu 89,1 %. Tyto vysoké úrovně odpovědí se udržely až do třetího roku (týden 144), jak přehledně shrnuje graf 1A–D. Podobně tomu bylo u sledované skupiny pacientů s odpovědí v týdnu 16, kteří dostávali BKZ Q4W/Q8W/Q8W (graf 2A–D). Míra přerušení studie u pacientů s odpovědí PASI 90, PASI 100 a IGA 0/1 v týdnu 16 z důvodu ztráty účinnosti a pro nežádoucí účinky během udržovacího období a OLE byla nízká (0,7 % [8/1 102] a 7,0 % [77/1 102] pacientů).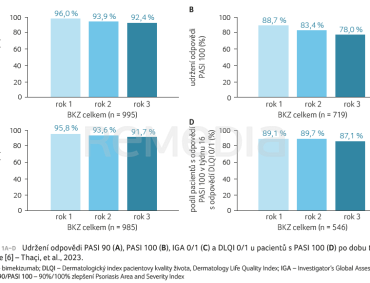
Shromážděná data z pěti studií doložila, že u pacientů s odpovědí na léčbu v 16. týdnu byla tato vysoká míra klinické odpovědi udržována po dobu tří let. Vysoké úrovně odpovědi byly také zachovány u sledované skupiny pacientů, kteří dostávali BKZ Q4W/Q8W/Q8W, což je schválený dávkovací režim pro většinu pacientů s psoriázou [7].
Tříletá data účinnosti léčby v oblastech s velkým dopadem
Na psoriázu ve kštici, palmoplantární a nehtové postižení se zaměřila další analýza tříletých dat účinnosti léčby BKZ Meroly a kol. [8]. Psoriatické léze na pokožce hlavy, dlaních a chodidlech a psoriatické změny na nehtech významně snižují kvalitu života pacientů. Výsledky dokládající efekt dvouleté léčby BKZ v těchto oblastech byly prezentovány na předchozím kongresu EADV [9], aktuální analýza předkládá výsledky již tříletého období.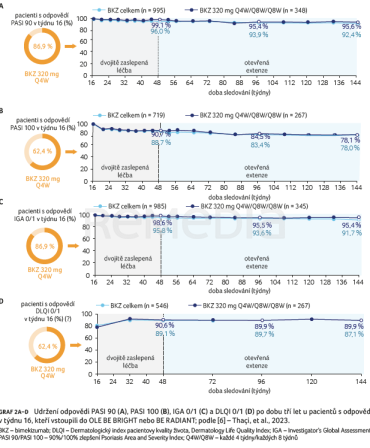
Do sledování byli zařazeni pacienti se středně závažnou až závažnou hlavovou a palmoplantární psoriázou (scalp IGA nebo pp‑IGA ≥ 3) nebo s postižením nehtů (modified Nail Psoriasis Severity Index [mNAPSI] > 10). Jak ukazuje graf 3A–C, v průběhu tří let dosáhl a udržel si kompletní vyčištění pokožky hlavy (83,7 %), palmoplantární psoriázy (91,6 %) a nehtové psoriázy (69,5 %) vysoký podíl pacientů léčených BKZ bez ohledu na dávkový režim. V případě postižení pokožky hlavy a palmoplantární psoriázy dosáhla většina pacientů vyčištění již do 16. týdne, u postižení nehtů se podíl pacientů s mNAPSI = 0 zvyšoval během celého prvního roku a v dalším průběhu setrvával. Tento vývoj reflektuje delší dobu potřebnou k růstu a reparaci nehtu. Stejný trend výsledků bylo možné pozorovat ve skupině pacientů, kteří dostávali BKZ v dávkování Q4W/Q8W/Q8W.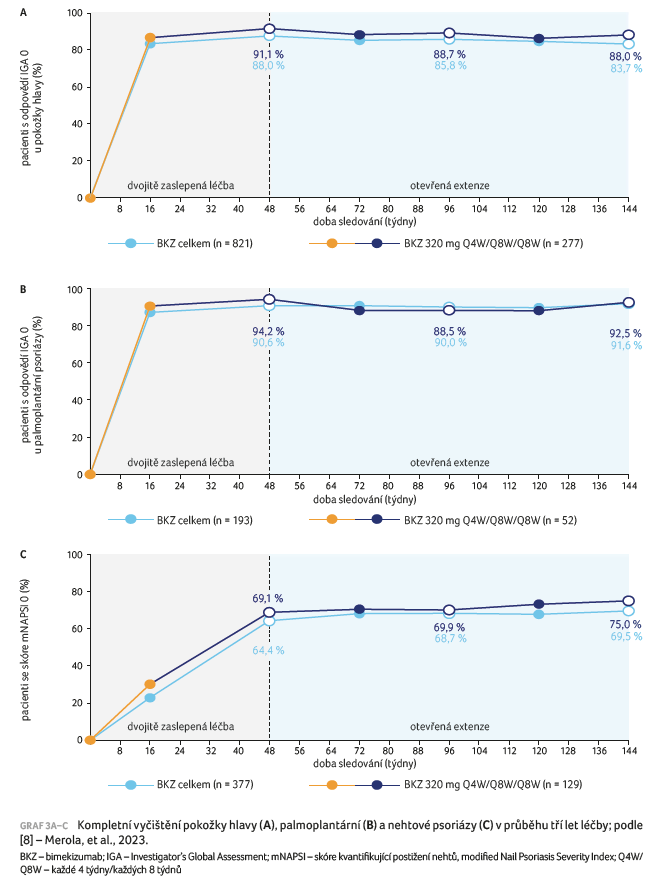
Odpověď na léčbu bimekizumabem po jejím přerušení
Záměrem analýzy Antonia Constanza a kol. bylo dozvědět se, jestli a na jak dlouho lze udržet klinickou odpověď po vysazení léčby BKZ, a zjistit, zda je možné po obnovení léčby znovu dosáhnout klinické odpovědi a udržet ji po dobu až dvou let [10]. Ve studii fáze III BE READY byla střední doba do relapsu, hodnoceno jako ztráta odpovědi PASI 75 (≥ 75% zlepšení PASI), od poslední dávky BKZ (12. týden) v týdnu 16 u pacientů s odpovědí PASI 90 32 týdnů; medián doby do ztráty odpovědi PASI 90 byl 28 týdnů [11].
Prezentována jsou nyní tříletá data dvou skupin pacientů studie BE READY a jejího prodloužení BE BRIGHT, kteří ukončili a znovu zahájili léčbu. První skupinu (skupina placeba v týdnu 16–56) tvoří pacienti původně randomizovaní k podávání BKZ v dávce 320 mg Q4W, kteří dosáhli odpovědi PASI 90 v týdnu 16 a byli rerandomizováni k následnému podávání placeba – na 40týdenní období randomizovaného vysazení, než vstoupili do OLE. Pacienti, kteří si udrželi odpověď PASI 75 po celé toto období randomizovaného vysazení, pokračovali v léčbě placebem až do týdne 56, poté vstoupili do OLE. Po vstupu do OLE došlo k povinnému přechodu na léčbu BKZ Q4W (obr. 2).
Druhou skupinu (skupina únikové léčby) tvořili pacienti, u kterých došlo při léčbě placebem k relapsu onemocnění (odpověď nižší než PASI 75 při kterékoliv návštěvě mezi týdnem 20–56). Tito pacienti byli zařazeni do 12týdenní únikové větve a byla u nich v otevřeném uspořádání opětovně zahájena léčba BKZ Q4W. Ti, kteří dosáhli PASI 50 po 12 týdnech únikové léčby, vstoupili do OLE a obdrželi (dle dosažení odpovědi PASI) buď BKZ Q4W, nebo Q8W (obr. 2).
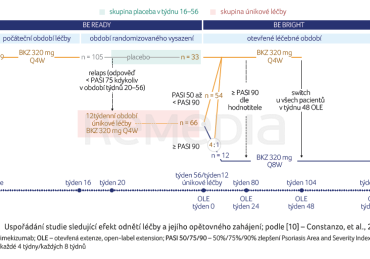 V týdnu 16 dosáhlo odpovědi PASI 90 celkem 90,8 % (317/349) pacientů randomizovaných k léčbě BKZ Q4W a 105 z nich bylo rerandomizováno k následnému podávání placeba (skupina placeba v týdnu 16–56). V rámci této placebové léčby si odpověď PASI 75 až do týdne 56 udrželo 31,4 % (33/105) pacientů. Odpověď PASI 90 zůstala zachována u 51,5 % (17/33) a odpověď PASI 100 byla v týdnu 56 zaznamenána u 33,3 % (11/33) pacientů. Týden 56 byl považován za týden 0 OLE. Po vstupu do OLE a obnovení léčby BKZ došlo k výraznému nárůstu odpovědí (graf 4A, B).
V týdnu 16 dosáhlo odpovědi PASI 90 celkem 90,8 % (317/349) pacientů randomizovaných k léčbě BKZ Q4W a 105 z nich bylo rerandomizováno k následnému podávání placeba (skupina placeba v týdnu 16–56). V rámci této placebové léčby si odpověď PASI 75 až do týdne 56 udrželo 31,4 % (33/105) pacientů. Odpověď PASI 90 zůstala zachována u 51,5 % (17/33) a odpověď PASI 100 byla v týdnu 56 zaznamenána u 33,3 % (11/33) pacientů. Týden 56 byl považován za týden 0 OLE. Po vstupu do OLE a obnovení léčby BKZ došlo k výraznému nárůstu odpovědí (graf 4A, B).
Z pacientů randomizovaných k podávání placeba došlo u 62,9 % (66/105) k relapsu a tito pacienti vstoupili do ramene únikové léčby před vstupem do OLE (skupina únikové léčby). U 90,8 % (59/65) z nich bylo znovu dosaženo odpovědi PASI 90 a 63,1 % (41/65) pacientů dosáhlo PASI 100 po 12 týdnech obnovené léčby BKZ Q4W (týden 0 OLE). Dosažená míra odpovědí PASI 90 zůstala zachována až do týdne 96 OLE, odpovědí PASI 100 přibylo (graf 5).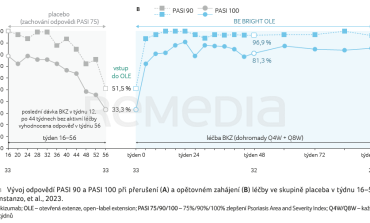
Jak předkládají výsledky analýzy, téměř jedna třetina pacientů léčených BKZ Q4W, kteří dosáhli PASI 90 v týdnu 16, si udržela alespoň odpověď PASI 75 po dobu 40 týdnů po vysazení léčby. Po opětovném zahájení léčby se pak míra dosažení téměř úplného/úplného vyčištění kůže výrazně zlepšila. Naprostá většina pacientů, u kterých došlo během období podávání placeba k relapsu, dosáhla po 12 týdnech opakované léčby BKZ odpovědi PASI 90/PASI 100. V obou skupinách bylo dosažení vysoké míry odpovědi po dobu dvou let opětovné léčby BKZ setrvalé, což naznačuje, že přerušení léčby BKZ po dobu až 40 týdnů a její opětovné zahájení významně neovlivnilo dlouhodobou kontrolu onemocnění.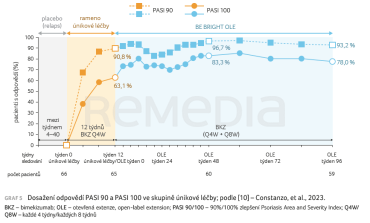
Bezpečnost a snášenlivost léčby
Cílem práce Marka Lebwohla a kol. bylo zhodnocení bezpečnosti léčby BKZ po dobu tří let [12]. Data byla opět shromážděna ze studií fáze III BE SURE, BE VIVID a BE READY, OLE BE BRIGHT a studie fáze IIIb a její extenze BE RADIANT [1–5]. Pacienti dostávali BKZ Q4W nebo Q8W. Dříve prezentovaná data za dvouleté období ukázala, že léčba BKZ je u pacientů se středně závažnou až závažnou psoriázou dobře tolerována [13].
Nežádoucí účinky související s léčbou (treatment‑emergent adverse events, TEAE) byly kódovány pomocí MedDRA v19.0 a byly hlášeny po dobu tří let jako míra incidence upravená dle expozice (exposure‑adjusted incidence rates, EAIRs) na 100 pacientoroků (patient‑years, PY) pro všechny pacienty, kteří dostali ≥ 1 dávku BKZ. Údaje byly zaznamenány také samostatně pro jednotlivé roky 1–3 expozice BKZ (tab. 1).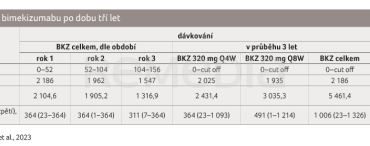
Celková expozice BKZ byla 5 461,4 PY (n = 2 186). Četnost TEAE se s delší expozicí BKZ snižovala nebo se nezvyšovala a byla numericky nižší u pacientů užívajících BKZ Q8W oproti Q4W. Během tříletého období došlo k 21 úmrtím; žádné nebylo hlášeno jako související s léčbou. V souladu s předchozím pozorováním byly nejčastějšími TEAE nazofaryngitida (14,1/100 PY), orální kandidóza (10,0/100 PY) a infekce horních cest dýchacích (6,2/100 PY).
EAIR orální kandidózy se snižovala s expozicí BKZ. Žádné případy orální kandidózy nebyly závažné, převážná většina byla mírné nebo střední závažnosti (99,1 %). Z důvodu orální kandidózy přerušil léčbu pouze malý podíl pacientů (1,7 %). Ke snížení výskytu orální kandidózy v průběhu času mohl přispět i zvyšující se podíl pacientů přecházejících na schválenou udržovací dávku BKZ Q8W. Míra závažných infekcí byla nízká (1,3/100 PY); nejčastěji hlášenou byla infekce koronavirem (0,3/100 PY). Globální pandemie covidu‑19 probíhala souběžně s BE RADIANT a OLE BE BRIGHT. Závažné infekce koronaviry se vyskytovaly v míře 0,1, 0,2 a 0,5/100 PY v roce 1, 2 a 3 expozice BKZ, což pravděpodobně přispívá k numericky zvýšenému výskytu závažných infekcí v roce 3 oproti roku 2.
EAIR laboratorního zvýšení hodnot alaninaminotransferázy nebo aspartátaminotransferázy na více než trojnásobek a pětinásobek horní hranice normy zůstaly obecně podobné v průběhu prvního až třetího roku. EAIR zánětlivého onemocnění střev, závažných nežádoucích srdečních příhod, malignit, předpokládaných sebevražedných myšlenek a chování či neutropenie byly nízké. Nebyly hlášeny žádné případy aktivní tuberkulózy.
Léčba BKZ během tří let prokázala příznivý bezpečnostní profil, přičemž nebyly pozorovány žádné nové bezpečnostní signály. Míra incidence TEAE se s delší expozicí BKZ nezvýšila.
Literatura
[1] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487–498.
[2] Gordon KB, Foley P, Krueger JG, et al. Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double‑blind, placebo‑controlled, randomised withdrawal phase 3 trial. Lancet 2021; 397: 475–486.
[3] Warren RB, Blauvelt A, Bagel J, et al. Bimekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med 2021; 385: 130–141.
[4] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021; 385: 142–152.
[5] Strober B, Tada Y, Mrowietz U, et al. Bimekizumab maintenance of response through 3 years in patients with moderate‑to‑severe plaque psoriasis: results from the BE BRIGHT open‑label extension trial. Br J Dermatol 2023; 188: 749–597.
[6] Thaçi D, Armstrong A, Gordon KB, et al. Bimekizumab 3‑year maintenance of response in Week 16 responders with moderate to severe plaque psoriasis: Results from five phase 3/3b trials. 32nd European Academy of Dermatology and Venerology Congress. Berlin, 11‑14 October 2023; Poster 2540.
[7] Souhrn údajů o přípravku Bimzelx. Dostupné na: https://www.sukl.cz
[8] Merola JF, Conrad C, Hampton P, et al. Bimekizumab 3‑year in high‑impact areas in moderate to severe plaque psoriasis: Pooled results from five phase 3/3B trials. 32nd European Academy of Dermatology and Venerology Congress. Berlin, 11‑14 October 2023; Poster 2547.
[9] Merola JF, Gottlieb AB, Morita A, et al. Bimekizumab efficacy in high‑impact areas for patients with moderate to severe plaque psoriasis: Pooled results through two years from the BE SURE and BE RADIANT Phase 3 trials. European Academy of Dermatology and Venerology Congress. Milano, 7‑11 September 2022; Poster 1467.
[10] Costanzo A, Papp K, Griffiths CEM, et al. Bimekizumab response through 3 years in patients with plaque psoriasis who stopped and re‑started treatment. 32nd European Academy of Dermatology and Venerology Congress. Berlin, 11‑14 October 2023; Poster 2511.
[11] Blauvelt A, Wu JJ, Reich K, et al. Bimekizumab efficacy in patients with moderate to severe plaque psoriasis during the randomized withdrawal and retreatment phase of BE READY, a phase 3 trial. American Academy of Dermatology (AAD) Congress, 5‑8 August, 2021. Poster 27380.
[12] Lebwohl M, Strober B, Langley RG, et al. Bimekizumab 3‑year safety and tolerability in moderate to severe plaque psoriasis: Long‑term pooled analysis from five phase 3/3B trials. 32nd European Academy of Dermatology and Venerology Congress. Berlin, 11‑14 October 2023; Poster 2315.
[13] Gordon KB, Langley RG, Warren RB, et al. Bimekizumab Safety in Patients With Moderate to Severe Plaque Psoriasis: Pooled Results From Phase 2 and Phase 3 Randomized Clinical Trials. JAMA Dermatol 2022; 158: 735–744.