Aktuální možnosti léčby karcinomu pankreatu v roce 2022
Souhrn:
Němeček R. Aktuální možnosti léčby karcinomu pankreatu v roce 2022. Remedia 2022; 32: 225–231.
Karcinom pankreatu je nádorové onemocnění s velmi špatnou prognózou, které představuje třetí nejčastější příčinu úmrtí na zhoubný nádor ve vyspělých zemích a jehož incidence a mortalita dle predikcí nadále významným způsobem porostou. Téměř 80 % pacientů je diagnostikováno s pokročilým neresekabilním onemocněním, a je tudíž odkázáno na paliativní protinádorovou léčbu s limitovanou účinností. V případě 10–20 % nemocných, kteří úspěšně absolvovali radikální resekci lokalizovaného onemocnění a následnou adjuvantní chemoterapii, však u naprosté většiny dojde k relapsu onemocnění do 2–3 let od operace. Příčiny lze hledat v pozdním stanovení diagnózy v důsledku dlouhého klinicky asymptomatického průběhu, v komplikované anatomické lokalizaci, ve výrazné nádorové heterogenitě znesnadňující testování nových léčiv a v neposlední řadě i v přítomnosti denzního nádorového stromatu omezujícího přístup cytostatik i cílených léčiv do nádorové tkáně. V tomto sdělení uvádíme souhrn aktuálních možností diagnostiky a léčby lokalizovaných i pokročilých forem karcinomu pankreatu včetně možností molekulární diagnostiky a cílené léčby podskupin.
Summary:
Nemecek R. Current treatment options for pancreatic carcinoma in 2022. Remedia 2022; 32: 225–231.
Pancreatic ductal adenocarcinoma has a very poor prognosis and poses the third‑leading cause of cancer‑related deaths. Its incidence and mortality have been predicted to increase significantly in the upcoming years. Almost 80% of patients are diagnosed with advanced unresectable disease and rely on palliative anticancer treatment with limited efficacy. However, in 10‑20% of patients who have successfully undergone radical surgical resection of the localized disease and subsequent adjuvant chemotherapy, the vast majority will relapse within 2‑3 years of surgery. The reasons can be found in late diagnosis due to the prolonged clinically asymptomatic course of the disease, complicated anatomical localization, significant tumor heterogeneity, which makes it difficult to test new drugs and, finally, the presence of dense tumor stroma, which complicates the access of cytostatics and targeted drugs into the tumor tissue. Here we present a summary of current treatment options for localized and advanced pancreatic cancer, including molecular diagnostics and targeted treatment of small patient subgroups,
Key words: pancreatic cancer, advanced disease, targeted therapy, FOLFIRINOX – BRCA1/2.
Úvod
Karcinom pankreatu (KP) představuje
jednu z největších onkologických výzev 21. století.
Jedná se o prognosticky nepříznivé nádorové onemocnění
rezistentní k léčbě, jehož incidence i mortalita
neustále narůstají a průměrné pětileté přežití se
pohybuje mezi 6–10 % [1]. V současné době je třetí
nejčastější příčinou úmrtí na zhoubný nádor
ve vyspělých zemích a dle predikcí se v nadcházejících
letech předpokládá posun na místo druhé, hned za nádory
plic. V České republice bylo v roce 2018 diagnostikováno
2 332 nových případů KP a 2 040 pacientů v důsledku
tohoto onemocnění ve stejném roce zemřelo (graf 1)
[2]. Nepříznivá prognóza souvisí mimo jiné i s pozdní
diagnostikou. Lokalizované (primárně resekabilní nebo hraničně
resekabilní) onemocnění je diagnostikováno jen u přibližně
10–25 % pacientů, u zhruba 25–30 % pacientů je
onemocnění lokálně pokročilé (tedy iniciálně inoperabilní)
a u asi 50–60 % pacientů je již v době diagnózy
potvrzena vzdálená diseminace onemocnění [3].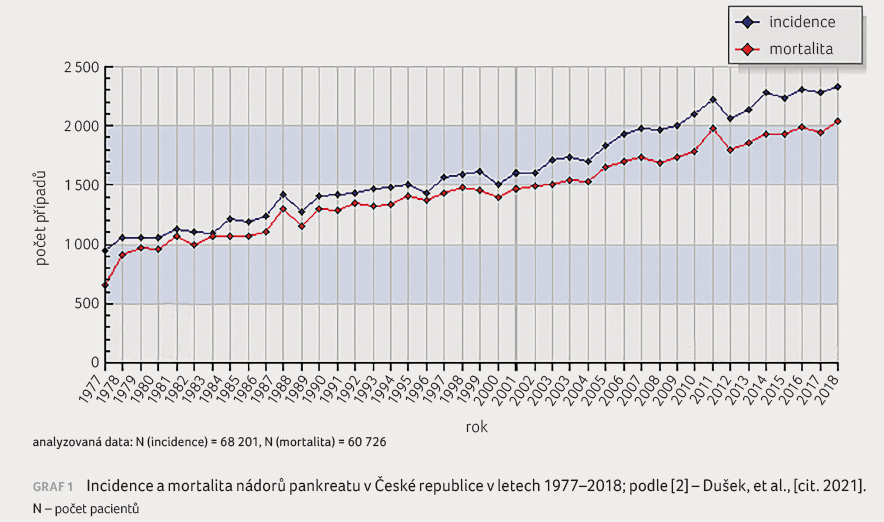
Rizikovými faktory pro vznik KP jsou zejména chronická pankreatitida, kouření a diabetes mellitus [4]. Důležitou roli však hraje i genetická predispozice. Přibližně 10 % pacientů s KP má jednoho nebo více příbuzných prvního stupně s tímto onemocněním, jen u 20 % z nich je však diagnostikován některý ze známých hereditárních nádorových syndromů. Ve zbylých 80 % případů zůstává konkrétní příčina na úrovni genů neznámá a používá se pojem „familiární karcinom slinivky břišní“. U osob s vysokým rizikem vzniku KP je indikován screening, doporučenou metodou je endoskopická ultrasonografie a magnetická rezonance (případně magnetická rezonanční cholangiopankreatikografie, MRCP).
Většina (zhruba 70–80 %) duktálních adenokarcinomů je lokalizována v hlavě pankreatu (případně v processus uncinatus), ostatní v těle (asi 20 %) a v kaudě (asi 10 %). Adenokarcinom hlavy pankreatu roste infiltrativně do okolí, proniká do retroperitoneální tukové tkáně, šíří se perineurálně, prorůstá do mezenterických a slezinných cév, infiltruje stěnu duodena, Vaterovu papilu a v pokročilejších stadiích diseminuje i na peritoneum. KP často metastazuje do regionálních lymfatických uzlin a hematogenně do jater, plic, nadledvin a dalších orgánů. Nádory hlavy pankreatu infiltrují nebo utlačují ductus choledochus s následným vznikem obstrukčního ikteru, který může být první známkou tohoto onemocnění. Mezi další klinické příznaky patří zejména bolest v epigastriu a v zádech způsobená infiltrací ganglion coeliacum, případně stenóza duodena projevující se až poruchou pasáže. Většina KP však zůstává dlouho asymptomatická, a je tudíž diagnostikována až v pokročilém stadiu.
K verifikaci lokalizovaného KP využíváme nejčastěji endosonograficky navigovanou aspirační biopsii tenkou jehlou (FNAB), u metastatického onemocnění dáváme přednost perkutánní biopsii jaterních metastáz pod kontrolou výpočetní tomografií (CT) nebo pod ultrazvukovou (UZ) kontrolou. Z hlediska histopatologického je pro adenokarcinom pankreatu typické denzní vazivové stroma spojené s chronickou obstrukční fibroproduktivní pankreatitidou, která nádorovou infiltraci doprovází a omezuje průnik cytostatik k nádorové tkáni. Po stránce molekulárního profilu je KP vysoce heterogenním onemocněním, a právě tato molekulárně genetická heterogenita je jedním z hlavních důvodů odlišného klinického chování nádorů se stejnými vstupními charakteristikami (stadium v době diagnózy, histologický typ atd.) v klinických studiích včetně rozdílné prognózy, odpovědi či rezistence na podávanou léčbu apod. Byla publikována řada prací rozdělujících nádory pankreatu na několik genetických podtypů [5]. Celogenomovým sekvenováním a porovnáním frekvence a distribuce chromozomálních strukturálních variant genomu byly stanoveny čtyři genomické subtypy: stabilní (20 % KP, ≤ 50 strukturálních variant [SV] na genom), tzv. scattered (rozptýlený – 36 % KP, 50–200 SV), tzv. locally rearranged (lokálně přeskupený – 30 % KP, ≥ 200 SV na ≤ 3 chromozomech) a nestabilní (14 % KP, ≥ 200 SV). U poslední uvedené skupiny byla zaznamenána velmi častá přítomnost defektů genů zodpovědných za opravu poškozené DNA (DNA damage response, DDR), konkrétně systému homologní rekombinace (HRR) – např. mutace genů BRCA1, BRCA2 nebo PALB2. U 1–2 % nádorů pankreatu byly rovněž potvrzeny defekty v opravném systému chybného párování bází (mismatch repair, MMR) vedoucí k mikrosatelitní instabilitě (MSI H).
Kromě výše uvedené genomické subtypizace bylo publikováno několik dalších transkriptomických molekulárních subtypizací, jejichž nomenklatura přesahuje rámec tohoto sdělení. Za zmínku však stojí, že syntézou několika rozdílných klasifikací byly identifikovány dva základní klinicky relevantní podtypy KP – skvamózní (basal like) a klasický. Skvamózní (basal like, quasi mesenchymal) fenotyp zahrnuje nádory s většinou metastatickým onemocněním, vysokým gradingem, aktivovaným stromatem, rezistencí k chemoterapii a špatnou prognózou. Naopak klasický fenotyp ukazuje na prognosticky mnohem příznivější onemocnění s normálním stromatem a dobře diferencovaným a relativně chemosenzitivním nádorem. Klinická studie COMPASS u pokročilých nádorů pankreatu potvrdila u obou skupin odlišnou četnost léčebných odpovědí (10 % u basal like vs. 33 % u klasických KP) i medián celkového přežití (5,9 měsíce u basal like vs. 9,3 měsíce u klasických KP). Hlavním rozlišovacím biomarkerem mezi oběma podtypy se zdá být exprese GATA6 (nízká exprese u basal like vs. vysoká exprese u klasických KP) [6].
Léčba lokalizovaného karcinomu
pankreatu – kde jsme?
Jedinou potenciálně kurativní metodou léčby lokalizovaného KP je radikální R0 resekce, která je však možná jen u přibližně 10–15 % pacientů s iniciálně resekabilním onemocněním. Definice resekability KP vychází především ze vztahu nádoru k anatomicky blízkým cévním strukturám, zejména k portální žíle, vena mesenterica superior, truncus coeliacus, arteria mesenterica superior a arteria hepatica communis [7]. Zjednodušeně lze říci, že zatímco infiltrace žilních struktur je většinou ještě chirurgicky řešitelná, infiltrace arteriálních kmenů znamená obvykle již neresekabilitu onemocnění. U dalších asi 10 % pacientů je onemocnění tzv. hraničně resekabilní (obkružuje důležité žíly z více než 180° a arteriální kmeny z méně než 180°) a u následujících zhruba 30 % pacientů je právě z důvodu pokročilejší infiltrace cév diagnostikováno již iniciálně lokálně pokročilé (a tedy vstupně inoperabilní) onemocnění. V klasifikaci resekability panují mezi jednotlivými centry četné neshody, což standardizaci léčby do značné míry komplikuje. Mezi základní typy radikálních operačních výkonů u KP patří hemipankreatoduodenektomie podle Whipplea (resekce pravého oddílu pankreatu při zachování ocasu slinivky s odstraněním celého duodena, žlučníku s ductus choledochus a částečnou resekcí žaludku), totální resekce pankreatu s lymfadenektomií (po které však dochází ke kompletní endokrinní i exokrinní insuficienci pankreatu s rozvojem obtížně zvladatelného diabetu) a distální pankreatektomie (u malých tumorů převážně endokrinního typu v levé části pankreatu).
I když se zdokonalily stagingové metody, chirurgické postupy a zlepšila se pooperační péče, dlouhodobé výsledky jsou stále neuspokojivé. I po správně provedené R0 resekci dochází k relapsu onemocnění u více než 80 % nemocných, a to většinou již do dvou let od operace. Po třech letech od diagnózy zůstává bez relapsu onemocnění méně než 40 % pacientů a pětileté přežití resekovaných pacientů se uvádí v rozmezí 15–30 % [5]. Medián doby do relapsu onemocnění (median disease free survival, mDFS) činí bez systémové léčby asi 6–7 měsíců, při podání adjuvantní chemoterapie (CHT) se zdvoj až ztrojnásobuje (na 13–21 měsíců). Podání adjuvantní CHT je tedy zcela zásadní a je indikováno u všech resekovaných pacientů, kteří jsou po náročné operaci z hlediska celkového stavu této léčby schopni. V reálné klinické praxi se však jedná jen o část o něco přesahující polovinu všech resekovaných nemocných. Z podávaných cytostatik se dlouhou dobu používaly režimy založené na aplikaci 5 fluorouracilu (5 FU) nebo gemcitabinu v monoterapii, které umožnily prodloužit mDFS ze 6–7 měsíců (bez léčby) na zmíněných 13–14 měsíců a medián celkového přežití (median overall survival, mOS) na zhruba 22–25 měsíců [8,9]. Mírného zlepšení bylo docíleno kombinací antimetabolitů gemcitabinu a kapecitabinu ve studii ESPAC 4 (mDFS 13,9 měsíce, mOS 28 měsíců), toxicita tohoto režimu však byla nezanedbatelná a výsledky jsou do značné míry kontroverzní [10].
Zásadní změnu přinesly až výsledky
studie PRODIGE 24, v níž bylo při použití
trojkombinace cytostatik (5 FU, irinotekan a oxaliplatina)
v režimu FOLFIRINOX dosaženo prodloužení mDFS na 21,6
měsíce a mOS na 54,4 měsíce [11]. Tato kombinace je
v současné době považována za zlatý standard
adjuvantní léčby pacientů v dobrém celkovém stavu. Naopak
u metastatického onemocnění srovnatelně efektivní kombinace
gemcitabinu s nab paklitaxelem v adjuvantní léčbě
KP ke značnému překvapení odborné veřejnosti selhala,
a v praxi se tudíž nepoužívá [12]. Ne každý pacient
po Whippleově operaci je ale schopen léčbu tripletem
FOLFIRINOX podstoupit, neboť četnost toxicity stupně 3–4 je
u tohoto režimu uváděna kolem 75 % [11]. Z tohoto
důvodu se u pacientů v horší kondici doporučuje
aplikace gemcitabinu v monoterapii nebo v kombinaci
s kapecitabinem. Adjuvantní CHT by měla být zahájena
do tří měsíců od operace a měla by trvat celých
šest měsíců. Adjuvantní chemoradioterapie (CHRT) po provedené
radikální resekci evidentní prospěch neprokázala a v Evropě
se nepoužívá, bývá však často zvažována v případě R1
resekce (ačkoliv i tato indikace je diskutabilní, neboť režim
FOLFIRINOX prokázal efektivitu i u této podskupiny
pacientů) [11]. Je li k dispozici klinická studie pro
adjuvantní indikaci, je zařazení pacienta do studiové léčby
vždy dobrou alternativou. Souhrn výsledků vybraných adjuvantních
studií u KP je uveden v tabulce 1 [13].
irinotekan a oxaliplatina)
v režimu FOLFIRINOX dosaženo prodloužení mDFS na 21,6
měsíce a mOS na 54,4 měsíce [11]. Tato kombinace je
v současné době považována za zlatý standard
adjuvantní léčby pacientů v dobrém celkovém stavu. Naopak
u metastatického onemocnění srovnatelně efektivní kombinace
gemcitabinu s nab paklitaxelem v adjuvantní léčbě
KP ke značnému překvapení odborné veřejnosti selhala,
a v praxi se tudíž nepoužívá [12]. Ne každý pacient
po Whippleově operaci je ale schopen léčbu tripletem
FOLFIRINOX podstoupit, neboť četnost toxicity stupně 3–4 je
u tohoto režimu uváděna kolem 75 % [11]. Z tohoto
důvodu se u pacientů v horší kondici doporučuje
aplikace gemcitabinu v monoterapii nebo v kombinaci
s kapecitabinem. Adjuvantní CHT by měla být zahájena
do tří měsíců od operace a měla by trvat celých
šest měsíců. Adjuvantní chemoradioterapie (CHRT) po provedené
radikální resekci evidentní prospěch neprokázala a v Evropě
se nepoužívá, bývá však často zvažována v případě R1
resekce (ačkoliv i tato indikace je diskutabilní, neboť režim
FOLFIRINOX prokázal efektivitu i u této podskupiny
pacientů) [11]. Je li k dispozici klinická studie pro
adjuvantní indikaci, je zařazení pacienta do studiové léčby
vždy dobrou alternativou. Souhrn výsledků vybraných adjuvantních
studií u KP je uveden v tabulce 1 [13].
Hraničně resekabilní karcinom
pankreatu
U hraničně resekabilních pacientů (asi 10 %) se odborná veřejnost jednoznačně kloní k podání neoadjuvantní CHT (samotné nebo v kombinaci s radioterapií) jakožto alternativy primární operace. Cílem neoadjuvantní léčby je kromě prodloužení mOS zejména dosažení downstagingu a zvýšení pravděpodobnosti R0 resekce, časná léčba mikrometastáz, identifikace pacientů s rychlou progresí onemocnění (kteří by z následné operace neprofitovali) a vyšší compliance pacientů se systémovou CHT před operací než po ní. Metaanalýza šesti prospektivních randomizovaných klinických studií zahrnujících 850 pacientů s resekabilním nebo hraničně resekabilním KP potvrdila prodloužení mOS při podání neoadjuvantní CHT nebo CHRT oproti primární operaci [14]. Nizozemská studie fáze III PREOPANC 1 porovnávající předoperační CHRT s gemcitabinem oproti primární operaci a následné adjuvantní CHT gemcitabinem prokázala prodloužení mOS v rameni s neoadjuvantní léčbou (15,7 měsíce vs. 14,3 měsíce; p = 0,025), a to zejména v podskupině pacientů s hraničně resekabilním KP (poměr rizik [HR] pro OS 0,67; p = 0,009). Současně byl potvrzen prospěch neoadjuvantní léčby v mDFS a v četnosti R0 resekcí [15]. Navazující studie fáze III PREOPANC 2 porovnává u stejné skupiny pacientů neoadjuvantní CHT 8 FOLFIRINOX s následnou resekcí oproti neoadjuvantní CHRT s gemcitabinem, resekci a adjuvantní CHT gemcitabinem, na výsledky je však třeba si počkat [16].
Perioperační CHT režimem mFOLFIRINOX nebo gemcitabin + nab paklitaxel podávaná u pacientů s resekabilním KP v rámci studie SWOG S1505 po dobu tří měsíců před operací a tří měsíců po operaci potvrdila srovnatelnou efektivitu obou uvedených režimů [17]. Zařazení stereotaktické radioterapie (STX RT) do konceptu neoadjuvantní léčby u hraničně resekabilních KP testovala studie Alliance A021501 (fáze II) prezentovaná na konferenci ASCO Gastrointestinal Cancers Symposium 2021. Tato studie porovnávala neoadjuvantní CHT 8 mFOLFIRINOX oproti CHT 7 mFOLFIRINOX následované STX RT v dávce 33–40 Gy. Prodloužení mOS při přidání STX RT k neoadjuvantní CHT u těchto pacientů prokázáno nebylo, STX RT vedla pouze k navýšení četnosti patologických kompletních remisí (z 0 na 11 %) [18]. Na základě uvedených dat lze shrnout, že současným standardem neoadjuvantní léčby u pacientů s hraničně resekabilním KP v dobrém celkovém stavu je režim mFOLFIRINOX (případně gemcitabin s nab paklitaxelem) podávaný po dobu minimálně tří měsíců s následným přešetřením (které je nutné k vyloučení rychlé progrese onemocnění), navazující radikální resekcí a adjuvantní CHT stejným režimem do celkového trvání systémové léčby šest měsíců.
Lokálně pokročilý karcinom
pankreatu
Lokálně pokročilé, inoperabilní onemocnění představuje přibližně jednu čtvrtinu až jednu třetinu všech případů KP a podle stupně arteriálního postižení jej lze rozdělit na dva typy: typ A s limitovaným postižením důležitých arteriálních kmenů a výrazně vyšší pravděpodobností dosažení resekability (a tudíž i delšího mOS) a typ B s lokálně pokročilejším onemocněním a dramaticky horší prognózou [19]. V rámci léčebných možností je jako standardní postup doporučována systémová CHT s potenciálně neoadjuvantním záměrem, přičemž využíváme identické režimy jako u metastatického onemocnění [13,20]. Preferovanou variantou u pacientů v dobrém celkovém stavu je opět triplet mFOLFIRINOX nebo kombinace gemcitabinu s nab paklitaxelem, pacienty v horší kondici léčíme gemcitabinem v monoterapii [21].
Odpověď na podávanou léčbu hodnotíme nejen podle zobrazovacích vyšetření (většinou CT), ale i na základě zlepšení stavu pacienta a zmírnění jeho obtíží (bolest, nechutenství, dyspepsie) a dynamiky koncentrace nádorového markeru CA 19 9. Přešetření provádíme obvykle po třech měsících léčby a v případě regrese žádáme o opětovné posouzení resekability cestou multidisciplinární komise. Pokud inoperabilita trvá, ale nedošlo k diseminaci onemocnění, lze zvážit možnost lokálního ošetření hypofrakcionovanou STX RT, případně konkomitantní CHRT ke zvýšení lokální kontroly. Recentní metaanalýza porovnávající devět studií s STX RT a 11 studií s CHRT potvrdila signifikantní navýšení četnosti dvouletého přežití (28,6 % vs. 13,7 %) a výrazné snížení četnosti akutní toxicity stupně 3–4 (5,6 % vs. 37,7 %) ve prospěch STX RT oproti CHRT [22]. Ačkoliv je STX RT technicky náročnou metodou vyžadující obvykle zavedení lokalizačních klipů do nádoru pomocí endosonografie, významnou výhodou této formy radioterapie je kromě velmi dobré efektivity zejména minimální přerušení systémové léčby a tím snížení rizika vzniku vzdálené diseminace [23]. STX RT se aplikuje obvykle v pěti frakcích a v celkové dávce 40 Gy a je doporučeno ji podávat pouze v tzv. vysokoobjemových centrech (high volume experienced centres) disponujících možnostmi moderních technik aplikace dávky a lokalizace tumoru s vyřešeným managementem minimalizace pohybů (motion management) [24,25].
Léčba metastatického karcinomu
pankreatu
Cílem léčby metastatického KP (mKP, 50–60 % nemocných) je dosažení regrese, nebo alespoň stabilizace nádorového onemocnění, prodloužení života pacientů a zlepšení jeho kvality. Medián přežití pacientů s mKP se bez použití protinádorové léčby pohyboval v rozmezí 3–4 měsíců. Aplikací gemcitabinu v monoterapii (v praxi od roku 1997) dokážeme prodloužit mOS na přibližně šest měsíců při mediánu doby do progrese onemocnění (median progression free survival, mPFS) zhruba 3–4 měsíce [26]. Ani přidání cíleného léku erlotinibu (inhibitor receptoru pro epidermální růstový faktor, EGFR) ke gemcitabinu ve studii z roku 2007 nepřineslo klinicky relevantní zlepšení výsledků (prodloužení mOS o necelé dva týdny), a tato kombinace se proto v běžné klinické praxi nepoužívá [27]. Opravdového pokroku bylo dosaženo až v roce 2011 ve studii PRODIGE 4/ACCORD 11, která prokázala signifikantně vyšší efektivitu trojkombinace FOLFIRINOX oproti monoterapii gemcitabinem ve všech sledovaných parametrech: dosažená léčebná odpověď 31,6 % vs. 9,4 %, mPFS 6,4 měsíce vs. 3,3 měsíce, mOS 11,1 měsíce vs. 6,8 měsíce [28]. Jednoleté přežití bylo ve prospěch kombinované léčby 48,4 % vs. 20,6 %. Tento kombinovaný režim je však provázen významně vyšším stupněm toxicity, a je proto určen pouze pro pacienty ve velmi dobrém celkovém stavu (performance status [PS] 0–1), ideálně mladší 70–75 let. Alternativou tripletu FOLFIRINOX je použití kombinace nab paklitaxel/gemcitabin, která ve studii MPACT (publikované v roce 2013) prokázala v přímém srovnání s gemcitabinem 29 % léčebných odpovědí (oproti 8 % při gemcitabinu), mPFS 5,5 měsíce vs. 3,7 měsíce a mOS 8,5 měsíce vs. 6,7 měsíce [29]. Metaanalýza randomizovaných studií potvrdila, že klíčovým faktorem pro predikci prospěchu z kombinované léčby je PS [30]. Nemocní s PS 0–1 či Karnofského indexem (KI) 90–100 % z kombinace jednoznačně profitovali, naopak pacienti s PS 2 či KI 60–80 % z ní profitovali výrazně méně.
Na základě výsledků výše uvedených studií lze tedy shrnout, že terapeutickým standardem pro první linii léčby mKP je u pacientů v dobrém celkovém stavu (PS 0–1) kombinovaná CHT režimem FOLFIRINOX nebo nab paklitaxel/gemcitabin [31]. Použití obou režimů je možné a správné. Snad mírně účinnější, ale současně i toxičtější se na základě některých srovnávacích studií jeví triplet FOLFIRINOX, který by měl být preferován zejména u mladších pacientů s podezřením na mutaci BRCA1 nebo BRCA2 (viz dále). U pacientů v horším celkovém stavu (PS 2) je preferována léčba gemcitabinem v monoterapii. V léčbě pokročilého KP byla testována řada dalších cílených léčiv (včetně cetuximabu, bevacizumabu, ruxolitinibu, tremelimumabu, durvalumabu a dalších), a přestože výsledky studií fáze I a II byly často velmi nadějné, žádný z uvedených přípravků v randomizované studii fáze III účinnost nepotvrdil.
Možnosti druhé linie léčby
metastatického karcinomu pankreatu
Zásadní podmínkou pro možnost dalšího podání CHT po selhání režimu první linie je dobrý celkový stav pacienta (PS 0–2). Obecně lze shrnout, že po prvoliniové léčbě na bázi 5 FU používáme léčbu na bázi gemcitabinu a naopak. V praxi to znamená, že u pacientů předléčených režimem FOLFIRINOX budeme ve druhé linii zvažovat režim nab paklitaxel/gemcitabin, případně pouze gemcitabin v monoterapii. U pacientů předléčených režimem nab paklitaxel/gemcitabin prokázala nejlepší výsledky kombinace nanolipozomálního irinotekanu (nal IRI) s 5 FU, jejíž použití oproti 5 FU v monoterapii vedlo ve studii NAPOLI 1 k prodloužení mOS ze 4,2 na 6,2 měsíce, mPFS z 1,5 na 3,1 měsíce a k navýšení podílu léčebných odpovědí z jednoho na 17 % [32]. Tato kombinace je tedy novým standardem léčby druhé linie po předléčení nab paklitaxelem/gemcitabinem. Alternativou je kombinace 5 FU s oxaliplatinou, která ve studii CONKO 003 prokázala efekt pouze v atypickém týdenním aplikačním schém
atu OFF (oxaliplatina + leukovorin + 5 FU; mOS 5,9 měsíce vs. 3,3 měsíce, mPFS 2,9 měsíce vs. 2,0 měsíce), zatímco klasická kombinace mFOLFOX6 v této indikaci selhala [33]. U pacientů, kteří zůstanou v dobrém celkovém stavu i po progresi na paliativní CHT druhé linie, lze v obou případech zvážit aplikaci 5 FU v monoterapii nebo v kombinaci s oxaliplatinou v rámci třetí linie léčby (samozřejmě již bez opory v datech z randomizovaných studií). Souhrn výsledků vybraných klinických studií fáze III u mKP je uveden v tabulce 2.
Cílená léčba podskupin
I v rámci pokročilého KP se podařilo na základě molekulárního profilování identifikovat několik podskupin pacientů, kteří mají prospěch z cílené léčby. První takovou skupinou jsou pacienti s germinální mutací v nádorově supresorovém genu BRCA1 nebo BRCA2 (5–7 % všech pacientů), která je predisponuje ke vzniku karcinomu prsu, ovaria nebo právě karcinomu pankreatu. U této skupiny nemocných se obecně popisuje výrazně vyšší citlivost na CHT platinovými deriváty, delší přežití než u nemocných s klasickým adenokarcinomem pankreatu a efektivita specifické skupiny cílených léčiv zvaných inhibitory PARP (poly [ADP ribóza] polymeráza). Mechanismus účinku těchto léků je komplexní a přesahuje rámec tohoto sdělení, důležité však je, že u pacientů s germinální mutací BRCA1 nebo BRCA2, u nichž nedošlo k progresi při léčbě s platinovým derivátem v první linii (typicky režim FOLFIRINOX), bylo při použití udržovací terapie inhibitorem PARP olaparibem ve studii POLO dosaženo zdvojnásobení doby do progrese onemocnění (z 3,8 na 7,4 měsíce) a nesignifikantního prodloužení mOS (z 18,1 na 18,9 měsíce) [34]. Kromě využití olaparibu je však u této skupiny pacientů z klinického hlediska naprosto zásadní především léčba platinovými deriváty (typicky oxaliplatinou v rámci režimu FOLFIRINOX), a to i v případě somatických mutací v některém z tzv. DDR genů (kromě BRCA1/2 i geny PALB2, CHEK, ATM a další), které jsou detekovatelné až u 17 % všech KP. Bylo totiž prokázáno, že mOS pacientů s pokročilým KP s DDR mutací je při léčbě platinovými deriváty dramaticky vyšší než při léčbě ostatními neplatinovými cytostatiky – typicky gemcitabinem s nab paklitaxelem (2,37 roku vs. 0,76 roku) [35]. Přitom právě léčba gemcitabinem v kombinaci s nab paklitaxelem je v západních zemích preferovanou variantou léčby první linie mKP a udává se, že až 50 % pacientů s KP je léčeno „neplatinovými“ chemoterapeutickými režimy.
Druhou podskupinou jsou pacienti s MSI H. Jedná se přibližně o 1 % pacientů s KP, u nichž byl poměrně jednoduchým a běžně dostupným imunohistochemickým vyšetřením potvrzen defekt opravného systému párování bází MMR. U těchto pacientů dochází ke kumulaci defektů v DNA s následnou tvorbou aberantních proteinů, které nádorová buňka vystavuje na svém povrchu, a tím atrahuje efektorové buňky imunitního systému. Při použití tzv. checkpoint inhibitorů (monoklonálních protilátek proti inhibičním receptorům na povrchu T lymfocytů) dochází k aktivaci imunitního systému s následným protinádorovým efektem. I když podíl léčebných odpovědí na léčbu checkpoint inhibitory (např. pembrolizumabem nebo nivolumabem) je v případě MSI H nádorů pankreatu výrazně nižší (asi 18 %) než u ostatních MSI H solidních nádorů (asi 28–40 %), výhodou této moderní imunoterapie je kromě odlišné (a většinou nižší) toxicity zejména fakt, že dosažená léčebná odpověď je často dlouhodobá [36].
Třetí podskupinou, která tvoří méně než 1 % pacientů s KP, jsou pacienti s tzv. NTRK fúzí (resp. fúzí genů pro neurotrofinové receptorové tyrozinkinázy 1, 2 a 3). V těchto velmi vzácných případech, jejichž identifikace vyžaduje specifické molekulárně genetické vyšetření, lze zvážit léčbu některým z NTRK inhibitorů (larotrektinibem nebo entrektinibem), které prokázaly svoji účinnost u různých typů nádorového onemocnění s NTRK fúzí [37,38]. Mezi další potenciálně cílové mutace u KP patří např. mutace BRAF, ALK, ROS1, FGFR1/4, RET, ERBB2 a další. Četnost každé z těchto mutací obvykle nepřesahuje 1 % a jejich diagnostika je možná jen v rámci komplexního sekvenování nové generace (next generation sequencing, NGS) vzorku nádorové tkáně. Bylo zjištěno, že tyto vzácné mutace se ve většině případů vyskytují u pacientů s absencí mutace onkogenu KRAS (Kirsten rat sarcoma virus), která je u KP přítomna téměř v 90 % případů. Vyšetření mutace KRAS tedy může nasměrovat onkologa k případné indikaci testování metodou NGS s cílem zachycení některé z potenciálně terapeuticky ovlivnitelných genových alterací.
Nové léčebné cíle u karcinomu
pankreatu
Přestože řada klinických studií časných fází testujících nové léky v indikaci lokálně pokročilého či mKP přinesla slibné výsledky, následné randomizované studie fáze III bohužel většinou selhaly. Četnost selhání (resp. pravděpodobnost negativního výsledku) studií fáze III u této diagnózy se udává kolem 87 %, a lze tedy konstatovat, že KP patří mezi nejrezistentnější nádorová onemocnění vůbec. Jednou z hlavních příčin rezistence nádorů pankreatu k léčbě je již výše zmiňovaná přítomnost denzního nádorového stromatu, která je mimo jiné výraznou překážkou v distribuci cytostatik i cílených léčiv do nádorové tkáně. Klinické studie se tudíž zaměřují na nádorové mikroprostředí a možnosti jeho ovlivnění. Monoklonální protilátka proti růstovému faktoru pojivové tkáně (connective tissue growth factor, CTGF) pamrevlumab v kombinaci s CHT nab paklitaxel/gemcitabin vedla ve studii fáze I/II u pacientů s lokálně pokročilým KP ke zvýšení četnosti kurativních resekcí (33 % vs. 8 %), a tím i k prodloužení OS [39]. Naděje byly vkládány i do ovlivnění jedné z klíčových komponent nádorového stromatu – kyseliny hyaluronové (HA). Vysoká koncentrace HA vede ke zvýšení intersticiálního tlaku, kompresi cév a je asociována s akcelerovaným růstem nádoru a horším přežitím pacientů. Zatímco studie fáze II s PEGylovanou formou rekombinantní lidské hyaluronidázy (PEGPH20) prokázala u pacientů s vysokou koncentrací HA signifikantní prodloužení mPFS při kombinaci s CHT nab paklitaxel/gemcitabin oproti CHT samotné, v prvoliniové studii fáze III (HALO 301), která zařazovala již jen pacienty s vysokou koncentrací HA, bohužel benefit v mOS ani mPFS při stejném uspořádání léčby prokázán nebyl [40,41]. Rovněž inhibitor kmenových buněk nádoru napabucasin (potlačující STAT3 signalizaci) i přes nadějné výsledky studie fáze Ib/II v následné studii fáze III efektivitu nepotvrdil [42].
Oblíbeným explorativním cílem klinických studií u nádorů pankreatu je ovlivnění metabolismu nádorových buněk – testuje se např. inhibitor mitochondriálního metabolismu devimistat v kombinaci s CHT, případně L asparagináza enkapsulovaná do erytrocytů (tzv. eryaspáza) [43,44]. Samostatnou kapitolu pak tvoří moderní imunoterapie, jejíž efektivita je však u nádorů pankreatu podstatně nižší než u ostatních malignit a s výjimkou malé podskupiny pacientů s MSI H tumory (asi 1 %) se prozatím v léčbě tohoto onemocnění nepoužívá [36]. V rámci výzkumu se ale testují kombinace anti PD 1 (protein programované buněčné smrti 1) a anti CTLA4 (cytotoxický T lymfocytární antigen 4) monoklonálních protilátek, vakcíny na bázi dendritických buněk či adenovirů a další. Je velmi pravděpodobné, že v oblasti imunoterapie lze do budoucna očekávat výrazný pokrok.
Závěr
I přes výrazný pokrok v diagnostice a léčbě zůstává KP nadále jedním z nejobávanějších nádorových onemocnění vůbec. Většina nemocných (asi 80 %) je diagnostikována s pokročilým neresekabilním onemocněním, a je tudíž odkázána na paliativní protinádorovou léčbu se stále ještě limitovanou účinností. Nicméně i u naprosté většiny z oněch 10–20 % pacientů, kteří úspěšně absolvovali R0 resekci lokalizovaného KP a následnou standardní adjuvantní léčbu, dojde k relapsu, a to obvykle během 2–3 let (po třech letech od diagnózy zůstává bez relapsu méně než 40 % nemocných) [45]. Příčiny můžeme hledat v pozdním stanovení diagnózy v důsledku dlouhého klinicky asymptomatického průběhu, v komplikované anatomické lokalizaci znemožňující resekabilitu i poměrně malých nádorů, ve výrazné nádorové heterogenitě znesnadňující testování nových léčiv a léčebných kombinací a v neposlední řadě v přítomnosti denzního nádorového stromatu znesnadňujícího přístup cytostatik i cílených léčiv do nádorové tkáně.
Probíhající klinický výzkum se zaměřením na nádorové mikroprostředí, metabolismus nádorových buněk a využití moderní imunoterapie přináší určitou naději, že se i u této jinak infaustní diagnózy dočkáme „lepších zítřků“. Ve světle nových dat potvrzujících dramaticky lepší přežití pacientů se somatickými či hereditárními mutacemi v některém z DDR genů při léčbě platinovými deriváty považujeme testování uvedených mutací již v době diagnózy KP za velmi důležité. Zejména u pacientů s nemetastatickým onemocněním je též vhodné zdůraznit klíčovou roli zkušeného multidisciplinárního týmu, který dokáže posoudit resekabilitu onemocnění a doporučit optimální terapeutickou strategii.
Kromě protinádorové léčby nelze opomenout rovněž efektivní léčbu podpůrnou, zejména adekvátní analgetickou medikaci, dostatečnou nutrici, kompenzaci obvykle přítomného diabetu a často opomíjenou nutnost perorální substituce pankreatických enzymů, která předchází rozvoji intenzivních dyspepsií a má obvykle i nezanedbatelný analgetický efekt.
Seznam použité literatury
- [1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68: 394–424.
- [2] Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita [2005] [cit. 2021‑3‑15]. Dostupné na: http://www.svod.cz. Verze 7.0 [2007], ISSN 1802 – 8861.
- [3] Ducreux A, Cuhna AS, Caramella C, et al. Cancer of the pankreas: ESMO Clinical Practice Guidelines. Ann Oncol 2015; 26(Suppl 5): v56–v68.
- [4] Maisonneuve P, Lowenfels AB. Risk factors for pancreatic cancer: a summary review of meta‑analytical studies. Int J Epidemiol 2015; 44: 186–198.
- [5] Casolino R, Braconi C, Malleo G, et al. Reshaping preoperative treatment of pancreatic cancer in the era of precision medicine. Ann Oncol 2021; 32: 183–196.
- [6] O’Kane GM, Grunwald BT, Jang GH, et al. GATA6 expression distinguishes classical and basal‑like subtypes in advanced pancreatic cancer. Clin Cancer Res 2020; 26: 4901–4910.
- [7] Isaji S, Mizuno S, Windsor JA. International consensus on definition and criteria of borderline resectable pancreatic ductal adenocarcinoma 2017. Pancreatology 2018; 18: 2–11.
- [8] Oettle H, Neuhaus P, Hochhaus A, et al. Adjuvant chemotherapy with gemcitabine and long‑term outcomes among patients with resected pancreatic cancer. JAMA 2013; 310: 1473–1481.
- [9] Neoptolemos JP, Stocken DD, Bassi C, et al. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection. JAMA 2010; 304: 1073–1081.
- [10] Neoptolemos JP, Palmer DH, Ghaneh P, et al. Comparison of adjuvant gemcitabine and capecitabine with gemcitabine monotherapy in patients with resected pancreatic cancer (ESPAC‑4): a multicentre, open‑label, randomised, phase 3 trial. Lancet 2017; 389: 1011–1024.
- [11] Conroy T, Hammel P, Hebbar M, et al. FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer. N Engl J Med 2018; 379: 2395–2406.
- [12] Tempero MA, Reni M, Riess H, et al. APACT: Phase III, multicenter, international, open‑label, randomized trial of adjuvant nab‑paclitaxel plus gemcitabine (nab‑P/G) vs gemcitabine (G) for surgically resected pancreatic adenocarcinoma. J Clin Oncol 2019; 37(15 Suppl): 4000.
- [13] Lambert A, Schwarz L, Borbath I, et al. An update on treatment options for pancreatic adenocarcinoma. Ther Adv Med Oncol 2019; 11: 1758835919875568.
- [14] Cloyd MJ, Heh V, Pawlik TM, et al. Neoadjuvant Therapy for Resectable and Borderline Resectable Pancreatic Cancer: A Meta‑Analysis of Randomized Controlled Trials. J Clin Med 2020; 9: 1129.
- [15] Versteijne E, van Dam JL, Suker M, et al. Neoadjuvant Chemoradiotherapy Versus Upfront Surgery for Resectable and Borderline Resectable Pancreatic Cancer: Long‑Term Results of the Dutch Randomized PREOPANC Trial. J Clin Oncol 2022; 40: 1220–1230.
- [16] Janssen QP, van Dam JL, Bonsing BA, et al. Total neoadjuvant FOLFIRINOX versus neoadjuvant gemcitabine‑based chemoradiotherapy and adjuvant gemcitabine for resectable and borderline resectable pancreatic cancer (PREOPANC‑2 trial): study protocol for a nationwide multicenter randomized controlled trial. BMC Cancer 2021; 21: 300.
- [17] Sohal D, Duong MT, Ahmad SA, et al. SWOG S1505: Results of perioperative chemotherapy (peri‑op CTx) with mfolfirinox versus gemcitabine/nab‑paclitaxel (Gem/nabP) for resectable pancreatic ductal adenocarcinoma (PDA). J Clin Oncol 2020; 38(Suppl 15): Abstr 4504.
- [18] Katz MHG, Shi Q, Meyers JP, et al. Alliance A021501: Preoperative mFOLFIRINOX or mFOLFIRINOX plus hypofractionated radiation therapy (RT) for borderline resectable (BR) adenocarcinoma of the pancreas. J Clin Oncol 2021; 39(Suppl 3): Abstr 377.
- [19] Chatzizacharias NA, Tsai S, Griffin M, et al. Locally advanced pancreas cancer: Staging and goals of therapy. Surgery 2018; 163: 1053–1062.
- [20] Seufferlein T, Hammel P, Delpero JR, et al. Optimizing the management of locally advanced pancreatic cancer with a focus on induction chemotherapy: Expert opinion based on a review of current evidence. Cancer Treat Rev 2019; 77: 1–10.
- [21] Suker M, Beumer BR, Sadot E, et al. FOLFIRINOX for locally advanced pancreatic cancer: a systematic review and patient‑level meta‑analysis. Lancet Oncol 2016; 17: 801–810.
- [22] Tchelebi LT, Lehrer EJ, Trifiletti DM, et al. Conventionally fractionated radiation therapy versus stereotactic body radiation therapy for locally advanced pancreatic cancer (CRiSP): An international systematic review and meta‑analysis. Cancer 2020; 126: 2120–2131.
- [23] Kim S‑H, Shin EJ. Endoscopic Ultrasound‑Guided Fiducial Placement for Stereotactic Body Radiation Therapy in Pancreatic Malignancy. Clin Endosc 2021; 54: 314–323.
- [24] Palta M, Godfrey D, Goodman KA, et al. Radiation Therapy for Pancreatic Cancer: Executive Summary of an ASTRO Clinical Practice Guideline. Pract Radiat Oncol 2019; 9: 322332.
- [25] Oar A, Lee M, Le H, et al. Australasian Gastrointestinal Trials Group (AGITG) and Trans‑Tasman Radiation Oncology Group (TROG) Guidelines for Pancreatic Stereotactic Body Radiation Therapy (SBRT). Pract Radiat Oncol 2020; 10: e136–e146.
- [26] Burris HA 3rd, Moore MJ, Andersen J, et al. Improvements in survival and clinical benefit with gemcitabine as first‑line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol 1997; 15: 2403–2413.
- [27] Moore MJ, Goldstein D, Hamm J, et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the National Cancer Institute of Canada Clinical Trials Group. J Clin Oncol 2007; 25: 1960–1966.
- [28] Conroy T, Desseigne F, Ychou M, et al. Groupe Tumeurs Digestives of Unicancer; PRODIGE Intergroup. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer. N Engl J Med 2011; 364: 1817–1825.
- [29] Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab‑paclitaxel plus gemcitabine. N Engl J Med 2013; 369: 1691–1703.
- [30] Tabernero J, Chiorean EG, Infante JR, et al. Prognostic factors of survival in a randomized phase III trial (MPACT) of weekly nab‑paclitaxel plus gemcitabine versus gemcitabine alone in patients with metastatic pancreatic cancer. Oncologist 2015; 20: 143–150.
- [31] Pusceddu S, Ghidini M, Torchio M, et al. Comparative Effectiveness of Gemcitabine plus Nab‑Paclitaxel and FOLFIRINOX in the First‑Line Setting of Metastatic Pancreatic Cancer: A Systematic Review and Meta‑Analysis. Cancers (Basel) 2019; 11: 484.
- [32] Wang‑Gillam A, Li CP, Bodoky G, et al. NAPOLI‑1 Study Group. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine‑based therapy (NAPOLI‑1): a global, randomised, open‑label, phase 3 trial. Lancet 2016; 387: 545–557.
- [33] Oettle H, Riess H, Stieler JM, et al. Second‑line oxaliplatin, folinic acid, and fluorouracil versus folinic acid and fluorouracil alone for gemcitabine‑refractory pancreatic cancer: outcomes from the CONKO‑003 trial. J Clin Oncol 2014; 32: 2423–2429.
- [34] Golan T, Hammel P, Reni M, et al. Maintenance Olaparib for Germline BRCA‑Mutated Metastatic Pancreatic Cancer. N Engl J Med 2019; 381: 317–327.
- [35] Pishvaian MJ, Blais EM, Brody JR, et al. Outcomes in Patients With Pancreatic Adenocarcinoma With Genetic Mutations in DNA Damage Response Pathways: Results From the Know Your Tumor Program. JCO Precision Oncology 2019; 3: 1–10.
- [36] Marabelle A, Le DT, Ascierto PA, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair‑Deficient Cancer: Results From the Phase II KEYNOTE‑158 Study. J Clin Oncol 2020; 38: 1–10.
- [37] Solomon JP, Benayed R, Hechtman JF, et al. Identifying patients with NTRK fusion cancer. Ann Oncol 2019; 30(Suppl 8): viii16–viii22.
- [38] Büchler T, Dundr P, Fínek J, et al. Praktický návod pro testování a cílenou léčbu dospělých pacientů se solidními nádory s genovou fúzí NTRK v běžné klinické praxi. Klin Onkol 2020; 33: 414–419.
- [39] Picozzi VJ, Pishvaian MJ, Mody K, et al. Effect of anti‑CTGF human recombinant monoclonal antibody pamrevlumab on resectability and resection rate when combined with gemcitabine/nab‑paclitaxel in phase 1/2 clinical study for the treatment of locally advanced pancreatic cancer patients. J Clin Oncol 2018; 36(15 Suppl): 4016–4016.
- [40] Hingorani SR, Zheng L, Bullock AJ, et al. HALO 202: Randomized Phase II Study of PEGPH20 Plus Nab‑Paclitaxel/Gemcitabine Versus Nab‑Paclitaxel/Gemcitabine in Patients With Untreated, Metastatic Pancreatic Ductal Adenocarcinoma. J Clin Oncol 2018; 36: 359–366.
- [41] Van Cutsem E, Tempero MA, Sigal D, et al. HALO 109‑301 Investigators. Randomized Phase III Trial of Pegvorhyaluronidase Alfa With Nab‑Paclitaxel Plus Gemcitabine for Patients With Hyaluronan‑High Metastatic Pancreatic Adenocarcinoma. J Clin Oncol 2020; 38: 3185–3194.
- [42] Bekaii‑Saab TS, Starodub A, El‑Rayes BF, et al. A phase Ib/II study of cancer stemness inhibitor napabucasin (BBI‑608) in combination with gemcitabine (gem) and nab‑paclitaxel (nabPTX) in metastatic pancreatic adenocarcinoma (mPDAC) patients (pts). J Clin Oncol 2017; 35(Suppl 4): Abstr 4106.
- [43] Alistar A, Morris BB, Desnoyer R, et al. Safety and tolerability of the first‑in‑class agent CPI‑613 in combination with modified FOLFIRINOX in patients with metastatic pancreatic cancer: a single‑centre, open‑label, dose‑escalation, phase 1 trial. Lancet Oncol 2017; 18: 770–778.
- [44] Hammel P, Fabienne P, Mineur L, et al. Erythrocyte‑encapsulated asparaginase (eryaspase) combined with chemotherapy in second‑line treatment of advanced pancreatic cancer: An open‑label, randomized Phase IIb trial. Eur J Cancer 2020; 124: 91–101.
- [45] Casolino R, Braconi C, Malleo G, et al. Reshaping preoperative treatment of pancreatic cancer in the era of precision medicine. Ann Oncol 2021; 32: 183–196.