Cetuximab – biologická léčba metastazujícího kolorektálního karcinomu
Kolorektální karcinom (KRK) je jedním z nejčastějších nádorových onemocnění v České republice s roční incidencí 7 000 osob. Téměř u poloviny pacientů se v průběhu onemocnění objeví metastázy. Léčba klinického stadia IV je paliativní, chemoterapie s fluorouracilem a leucovorinem je standardní léčbou po více než 40 let. Režimy zahrnující irinotecan nebo oxaliplatinu plus fluorouracil a leucovorin prokázaly signifikantně delší interval bez progrese nemoci a delší celkové přežití než samotný fluorouracil a leucovorin v 1. linii léčby metastatického onemocnění. Receptor pro epidermální růstový faktor (EGFR) je stimulován transformujícím růstovým faktorem- (TGF-) a EGF. Tento receptor je často zvýšeně exprimován u nádorových buněk kolorektálního karcinomu a koreluje s proliferací nádorových buněk, inhibicí apoptózy a jinými procesy důležitými pro nádorovou progresi včetně angiogeneze, invaze a metastazování. Výsledky prvních klinických studií s cetuximabem u metastatického KRK jasně prokázaly významnou aktivitu této anti-EGFR monoklonální protilátky u pacientů rezistentních k současně dostupným cytotoxickým látkám a navrhují použití cetuximabu v kombinaci s chemoterapií v 2. a 1. linii léčby pacientů s meta-statickým onemocněním. Současně probíhající klinické studie by měly definovat postavení cetuximabu v léčbě EGFR pozitivního kolorektálního karcinomu.
Úvod
Kolorektální karcinom představuje celosvětově závažný zdravotní a sociálně-ekonomický problém. Je třetí nejčastější příčinou úmrtí na nádorová onemocnění. V naší zemi v pořadí výskytu maligních onemocnění je kolorektální karcinom u žen na druhém místě (po nádorech prsu), u mužů představuje třetí nejčastější onemocnění (po nádorech plic a prostaty). V celosvětových statistikách v incidenci (roční počet nových onemocnění na 100 000 obyvatel) se Česká republika udržuje na předních místech, onemocní každý 20. obyvatel. U nádorů konečníku zaujímáme dokonce prvenství, vyšší výskyt onemocnění je pozorován u mužů. Alarmující je neustále rostoucí počet nových onemocnění. V roce 2000 onemocnělo zhoubným novotvarem tlustého střeva 4 217 osob, zhoubný novotvar rektosigmoideálního přechodu a konečníku byl diagnostikován u 3 129 mužů a žen. V témže roce zemřelo na kolorektální karcinom 4 336 osob, nejčastěji na metastatické postižení jater. Hlavním léčebným cílem u pacientů s metastatickým onemocněním je prodloužení přežití a zlepšení kvality života. Léčba spočívá v kombinaci různých přístupů, k nimž patří chirurgie, radioterapie a zejména systémová chemoterapie.
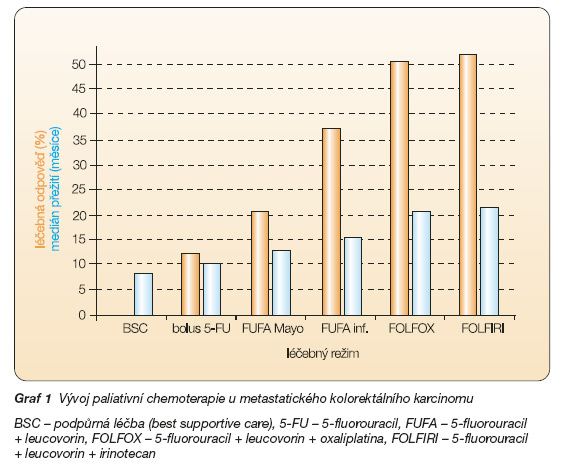
Randomizované studie III. fáze přinášejí nezpochybnitelné doklady o tom, že paliativní chemoterapie (CHT) prodlužuje medián přežití a zlepšuje kvalitu života ve srovnání s nemocnými, kterým byla poskytnuta pouze podpůrná péče (BSC). Medián přežití u pacientů léčených CHT se pohybuje kolem 11–17 měsíců, v případě jen podpůrné léčby je 5 měsíců. Téměř pět desetiletí se v léčbě kolorektálního karcinomu v indikaci paliativní chemoterapie používá antimetabolit 5-fluorouracil (5-FU) modulovaný leucovorinem (folinic acid – FA) – režim FUFA – v bolusovém nebo kontinuálním podání. K parciální remisi onemocnění dochází přibližně u 20 % nemocných s mediánem přežití 10–12 měsíců [1–6]. Přidání irinotecanu k FUFA režimu – režim (FOLFIRI) – nebo oxaliplatiny – režim (FOLFOX) – zvyšuje procento léčebných odpovědí (RR: 50 %) a zlepšuje přežití nemocných (OS > 17 měsíců). Je-li nemocný léčen sekvenčně kombinovanou chemoterapií s 5-fluorouracilem, irinotecanem a oxaliplatinou, jsou léčebné výsledky nejlepší. Medián přežití přesahuje 20 měsíců. Tato léková kombinace představuje v současnosti zlatý standard terapie metastatického onemocnění (graf 1) [7–10].
Závažnou překážkou déletrvajícího úspěchu léčby je však neselektivita cytotoxických látek a postupný rozvoj rezistence nádorových buněk. Většina dnes běžně používaných protinádorových chemoterapeutik totiž účinkuje s nízkou selektivitou vůči rychlejší proliferaci buněk, např. v kostní dřeni nebo trávicím ústrojí. Nežádoucí toxické působení na normální tkáně je příčinou častého suboptimálního dávkování protinádorových látek a neúspěchu léčby. To bývá provázeno vývojem rezistence vůči léku a metastazováním nádoru.
Na nádor v současnosti pohlížíme jako na „onemocnění klíčových regulačních drah", především drah zahrnujících komplexní regulaci růstu, diferenciaci a buněčnou smrt. Po zklamání z omezené účinnosti a snášenlivosti dostupných protinádorových terapií tak zákonitě další cesta vpřed vedla k molekulárnímu zacílení na hlavní patogenetické mechanismy, jež jsou podkladem vzniku nádorového onemocnění. V léčbě kolorektálního karcinomu se jeví jako nejslibnější inhibice extracelulární části receptoru pro epidermální růstový faktor (EGFR) pomocí monoklonální protilátky cetuximabu. Zvýšená exprese tohoto tyrozinkinázového receptoru označovaného též HER-1, erbB-1 byla prokázána u 25–80 % pacientů s metastazujícím kolorektálním karcinomem [11–13]. EGFR se skládá z extracelulární domény vázající ligand, transmembránového segmentu a intracelulární domény, se kterou je spojena tyrozinkinázová aktivita zodpovědná za přenos signálu. Vazbou přirozeně se vyskytujícího ligandu (epidermální růstový faktor, EGF nebo transformační růstový faktor-a, TGF-a) na receptor dochází k tvorbě homo- a heterodimerických komplexů aktivujících tyrozinkinázu s následnou autofosforylací tyrozinu [14, 15]. EGFR signální mechanismy se účastní řízení přežívání buněk, vývojového cyklu buňky, angiogeneze, pohybu buněk a buněčné invaze/metastazování. Cílená blokáda EGFR cetuximabem, vysoce specifickou monoklonální protilátkou, představuje další léčebnou alternativu vedoucí ke zlepšení léčebných výsledků pacientů s metastatickým kolorektálním karcinomem.
Farmakologické vlastnosti
Cetuximab je protinádorová látka, monoklonální chimérická IgG1 protilátka, inhibitor tyrozinkinázy receptoru pro růstový faktor (epithelial growth factor-receptor, EGFR). Je produkován za využití rekombinantní buněčné linie savčích buněk. Cetuximab je bezbarvý roztok, 1 ml infuzního roztoku obsahuje 2 mg cetuximabu. Jedna injekční lahvička obsahuje 50 ml infuzního roztoku.
Mechanismus účinku
Afinita vazby cetuximabu na extracelulární část EGFR je přibližně 5–10krát vyšší než u endogenních ligandů, EGF nebo TGF-a, což má za následek inhibici funkce receptoru [14, 15]. To dále indukuje internalizaci EGFR, která může vést k down-regulaci EGFR [16]. Terčem působení cetuximabu jsou také cytotoxické imunitní efektorové buňky působící proti EGFR pozitivním nádorovým buňkám (protilátková buňkami zprostředkovaná cytotoxicita, ADCC). Cetuximab ve zkouškách in vitro a in vivo u lidských nádorových buněk exprimujících EGFR zvýšenou expresí proteinu p27 inhiboval buněčnou proliferaci a indukoval apoptózu ovlivněním poměru proteinů bax/bcl-2 [17]. K dalším účinkům patří inhibice produkce faktorů angiogeneze nádorovými buňkami a snížení nádorové neovaskularizace a meta-statického potenciálu [18–21]. Bližší informace o mechanismu účinku cetuximabu lze nalézt v článku Cílená léčba v onkologii v tomto čísle Remedií.
Farmakokinetické vlastnosti
Farmakokinetické vlastnosti přípravku byly hodnoceny v klinických studiích při podávání cetuximabu v monoterapii nebo v kombinaci se současně podávanou chemoterapií nebo radioterapií u pacientů s odpovídající funkcí ledvin a jater (sérový kreatinin ≤ 1,5násobku, transaminázy ≤ 5násobku a bilirubin ≤ 1,5násobku horního limitu normálních hodnot). Cetuxi- mab nebyl hodnocen u pacientů, u kterých byl zjištěn jeden nebo více laboratorních parametrů: hemoglobin < 9 g/l, leukocyty < 3 000/mm3, celkový počet neutrofilů < 1 500/mm3, trombocyty < 100 000/mm3. Cetuximab byl podáván jednou týdně. Úvodní nasycovací dávka byla 400 mg/m2 tělesného povrchu, následující týdenní dávky byly 250 mg/m2. Průměrná plazmatická koncentrace se pohybovala v rozmezí 153–202 mg/ml. Průměrná clearance byla 0,022 l/h na m2 tělesného povrchu. Cetuximab má dlouhý biologický poločas s hodnotami od 79 do 129 hodin při cílové dávce. Sérové koncentrace cetuximabu dosáhly stabilních hodnot po třech týdnech podávání v monoterapii. Průměrné koncentrace byly 155,8 mg/ml v týdnu 3 a 151,6 mg/ml v týdnu 8 [22, 23].
Klinické údaje
Terapeutické indikace
Na základě uskutečněných klinických studií byl Výborem pro schvalování léčivých přípravků (Committee for Proprietary Medicinal Products, CPMP) při Evropské komisi pro hodnocení léčivých přípravků (European Agency for the Evaluation of Medicinal Products, EMEA) cetuximab doporučen v kombinaci s irinotecanem pro registraci k léčbě pacientů s metastazujícím kolorektálním karcinomem exprimujícím receptor pro epidermální růstový faktor po selhání cytotoxické léčby zahrnující irinotecan. Cetuximab v kombinaci s irinotecanem byl poprvé uveden na trh ve Švýcarsku v prosinci 2003, pro léčbu pacientů s metastatickým onemocněním je zaregistrován od února 2004 také ve Spojených státech a od 1. července 2005 i v České republice.
Dávkování a způsob podání
Cetuximab se podává pod dohledem lékaře v úvodní dávce 400 mg/m2 tělesného povrchu intravenózně in-line filtrací pomocí infuzní pumpy, infuzí po spádu nebo injekční pumpou. Doporučená doba infuze je 120 minut. Maximální rychlost infuze nesmí překročit 5 ml/min. Před zahájením první infuze musí být pacienti premedikováni antihistaminikem pro nebezpečí reakce z přecitlivělosti, tato premedikace je doporučena i při všech následných týdenních aplikacích, kdy je dávka cetuximabu snížena na 250 mg/m2 a doba aplikace zkrácena na 60 minut. V průběhu podávání infuze a minimálně 1 hodinu po jejím ukončení je nutné pečlivé monitorování vitálních funkcí. Irinotecan se nesmí podávat dříve než 1 hodinu po ukončení aplikace cetuximabu. Doporučená dávka je 350 mg/m2 tělesného povrchu jedenkrát za tři týdny. Léčba probíhá do progrese onemocnění. Důvodem pro ukončení léčby je i závažná (stupeň 3 nebo 4 podle stupnice National Cancer Institute – Common Toxicity Criteria, NCI-CTC) reakce z přecitlivělosti. Pokud se u pacienta vyskytne kožní reakce stupně 3 (kožní vyrážka postihující více než 50 % tělesného povrchu), musí být léčba cetuximabem přerušena a může být znovu zahájena bez jakékoli změny dávky v případě, jestliže dojde ke změně reakce na stupeň 2. Při opětovném výskytu závažných kožních reakcí je nutné léčbu znovu přerušit a po zlepšení na stupeň 2 pokračujeme v nižším dávkování cetuximabu (200 mg/m2 po druhém výskytu a 150 mg/m2 po třetím výskytu závažné kožní reakce) [24–29].
Nežádoucí účinky
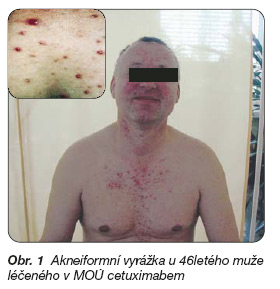
Během léčby cetuximabem jsou nejčastěji pozorovány kožní reakce, které se mohou objevit u více než 80 % pacientů, hlavně ve formě akneiformní vyrážky predilekčně postihující obličej, krk a trup (obr. 1).
Méně často jsou zaznamenány poruchy nehtů (např. paronychium). Většina kožních reakcí se objeví během prvního týdne léčby, po dodržení doporučené redukce dávky nebo dočasném přerušení léčby rychle odeznívají bez následků [30]. Při kombinaci s irinotecanem byly pozorovány stomatitida a průjem, neutropenie a astenie. Nauzea a vomitus se může vyskytnout u více než 10 % pacientů. U přibližně 5 % pacientů se objevuje konjunktivitida. Horečka byla zaznamenána u více než 10 % léčených. Mezi nejzávažnější nežádoucí účinky cetuximabu patří reakce z přecitlivělosti, incidence nepřesahuje 5 %. Mírné až středně závažné reakce (stupeň 1 nebo 2) zahrnují takové příznaky, jako je horečka, třesavka, nevolnost, vyrážka nebo dušnost. Pokud se tyto příznaky objeví, doporučuje se rychlost infuze snížit. Těžké formy reakcí z přecitlivělosti (stupeň 3 nebo 4) se vyznačují rychlým nástupem obstrukce dýchacích cest (bronchospasmus, stridor, chrapot), kopřivka a/nebo hypotenze. K těmto reakcím dochází obvykle v průběhu úvodní infuze s cetuximabem nebo 1 hodinu po jejím zahájení. Vyžadují okamžité a trvalé přerušení léčby cetuximabem a může být nutná pohotovostní léčba [24–29].
Klinické studie
Cetuximab byl v kombinaci s irinotecanem hodnocen ve 2 klinických studiích. Celkem 356 pacientů s metastazujícím kolorektálním karcinomem exprimujícím EGFR, u kterých došlo k předchozímu selhání cytotoxické terapie zahrnující irinotecan a jejichž minimální hodnota výkonnostního stavu podle Karnofského byla 60, dostalo kombinovanou léčbu.
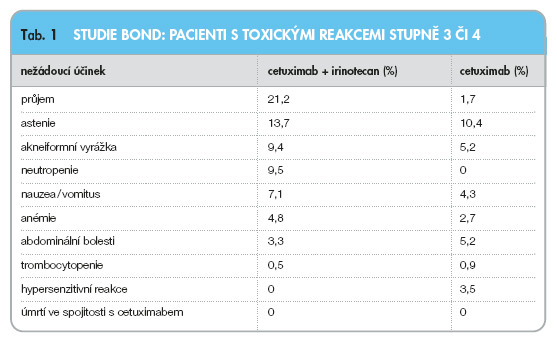
EMR 62 202-007 studie (BOND studie, Bowel Oncology with Cetuximab Antibody study) byla rozsáhlou multicentrickou randomizovanou klinickou studií, která probíhala v 57 centrech v 11 evropských zemích. Studie srovnávala kombinované podání cetuximabu s irinotecanem (218 pacientů) a cetuximabu používaného v monoterapii (111 pacientů). Medián věku pacientů byl 58–59 let. Irinotecan byl podáván v dávce 125 mg/m2 týdně po dobu 4 týdnů s následnou dobou bez léčby trvající 2 týdny nebo v dávce 180 mg/m2 každé 2 týdny nebo 350 mg/m2 každé 3 týdny. Cetuximab byl podáván v iniciální dávce 400 mg/m2 , následně 250 mg/m2 týdně. V této studii byl zaznamenán klinický benefit léčby cetuximabem v kombinaci s irinotecanem u více než poloviny pacientů. Parciální remise onemocnění (PR) znamenající zmenšení velikosti nádorových ložisek o více než polovinu byla zaznamenána u 23 % nemocných. Stabilizace onemocnění (SD) odpovídající buď ústupu nádorových měřitelných změn o méně než 50 %, nebo jejich progresi o méně než 25 % byla pozorována u 33 % léčených. Nutno poznamenat, že více než 45 % nemocných bylo předléčeno ≥≥ 3 liniemi předchozí cytotoxické léčby. Všichni zařazení pacienti měli před randomizací dokumentovanou progresi onemocnění při léčbě nebo do 3 měsíců po chemoterapii s irinotecanem. Doba do začátku progrese onemocnění při kombinované léčbě (TTP) byla 4,1 měsíce. Při podávání samotného cetuximabu byly výsledky následující: PR – 10,8 %, klinický benefit (PR, SD) – 32,4 % a TTP – 1,5 měsíce [27]. 45 pacientů iniciálně randomizovaných do ramene s cetuximabem bylo při dokumentované progresi onemocnění léčeno irinotecanem a cetuximabem. V této skupině byla u jednoho pacienta zaznamenána parciální remise onemocnění (1,9 %), u 21 pacientů byla konstatována stabilizace onemocnění (38,9 %). Nežádoucí účinky stupně 3 a 4 pozorované ve studii jsou uvedeny v tab. 1.
V této studii nebyl prokázán vztah mezi expresí EGFR a léčebnou odpovědí, vyšší procento léčebných odpovědí a delší přežití bylo dokumentováno u pacientů s kožní toxicitou. Medián přežití u pacientů s kožní toxicitou byl v kombinovaném režimu 9,1 měsíců, v monoterapii cetuximabem 8,1 měsíců, medián přežití u pacientů bez kožní toxicity byl v kombinovaném režimu s irinotecanem 3 měsíce resp. 2,5 měsíce v monoterapii.
Další provedenou studií je otevřená klinická studie IMCL CP02-9923 hodnotící účinnost kombinované léčby u 138 pacientů. Téměř 90 % pacientů dostávalo irinotecan v týdenním režimu v dávce 125 mg/m2.
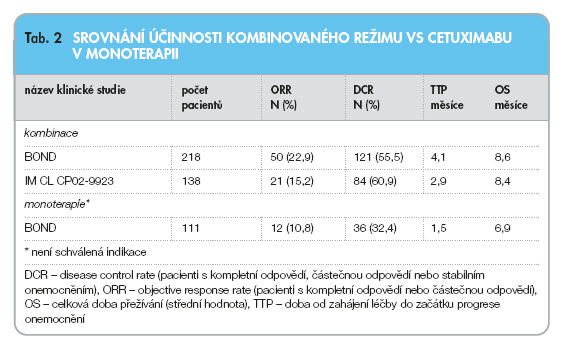
V těchto studiích byla účinnost kombinované léčby cetuximabem a irinotecanem vyšší než u cetuximabu v monoterapii, zvláště co se týká četnosti objektivních odpovědí (ORR), četnosti kontroly onemocnění (DCR) a doby do začátku progrese onemocnění. Údaje o účinnosti získané v těchto dvou studiích jsou shrnuty v tab. 2.
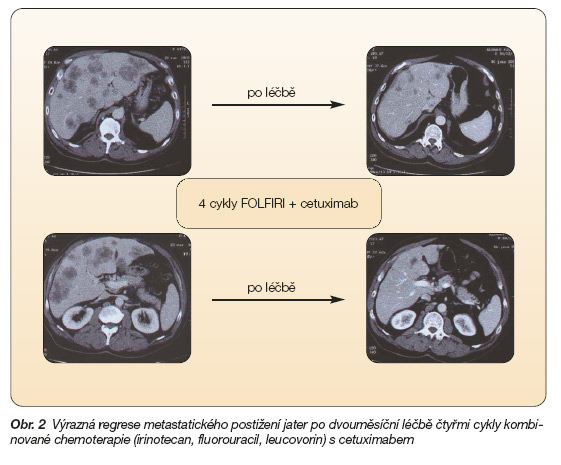
Cetuximab byl společně s irinotecanem, leucovorinem a fluorouracilem podáván také ve třech otevřených početně nevelkých studiích pacientům s pozitivitou EGFR s dosud neléčeným metastazujícím karcinomem kolorekta. K parciální remisi onemocnění došlo u 43 %, 53 % a 44% nemocných (obr. 2) [24–26].
Na základě těchto povzbudivých výsledků byly logicky iniciovány další klinické studie kombinací cetuximabu s irinotecanem nebo jinými látkami (např. oxaliplatinou) u pacientů s dosud neléčeným metastazujícím karcinomem kolorekta, jejichž výsledky jsou s napětím očekávány.
Závěr
Objev biologické terapie založené na monoklonálních protilátkách představuje zásadní změnu ve vývoji protinádorové léčby. Podkladem pro použití cetuximabu v léčbě pokročilého kolorektálního karcinomu je vysoký podíl nádorů s „overexpresí" EGFR, prokázaná synergistická protinádorová účinnost s cytostatiky v modelech in vitro a in vivo a přijatelná tolerance. Výsledky studie BOND podporují využití cetuximabu s irinotecanem k léčbě pacientů s metastatickým karcinomem exprimujícím EGFR po selhání cytotoxické léčby zahrnující irinotecan. Dává nemocným novou naději a lékařům poskytuje účinnou a dobře tolerovatelnou alternativu pro léčbu meta-statického chemorezistentního kolorektálního karcinomu, u něhož dříve již neexistovala žádná systémová léčba. Probíhající studie by měly pomoci objasnit další optimalizaci užití cetuximabu jako součást multimodální léčby kolorektálního karcinomu.
Seznam použité literatury
- [1] Poon MA, O´Connell JF, Moertel CG, et al. Biochemical modulation of fluorouracil: evidence of significant improvement of survival and quality of life in patients with advanced colorectal carcinoma. J Clin Oncol. 1989; 7: 1407–1418.
- [2] Colorectal Cancer Collaborative Group. Palliative chemotherapy for advanced colorectal cancer: systematic review and meta-analysis. BMJ 2000; 321: 531–535.
- [3] Buroker TR, O´Connell MJ, Weiand HS, et al. Randomized comparison of two schedules of fluorouroracil and leucovorin in the treatment of advanced colorectal cancer. J Clin Oncol 1995; 13: 1303–1311.
- [4] Labianca RF, Beretta GD, Pessi MA. Colorectal cancer: disease management considerations. Drugs 2001; 61 (12): 1751–1764.
- [5] Labianca R, Pessi MA, Zamparelli G. Treatment of colorectal cancer: current guidelines and future prospects for drug therapy. Drugs 1997; 53: 593–607.
- [6] Midgley R, Kerr D. Colorectal cancer. Lancet 1999; 353: 391–399.
- [7] Douillard JY, Cunningham D, Roth AD, et al. Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multi-centre randomised trial. Lancet 2000; 355: 1041–1047.
- [8] Saltz LB, Cox JV, Blanke C, et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. N Engl J Med 2000; 343: 905–914.
- [9] de Gramont A, Figer A, Seymour M, et al. Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 2000; 18: 2938–2947.
- [10] Giacchetti S, Perpoint B, Zidani R, et al. Phase III multicenter randomized trial of oxaliplatin added to chronomodulated fluorouracil-leucovorin as first-line treatment of metastatic colorectal cancer. J Clin Oncol 2000; 18: 136–147.
- [11] Raymond E, Faivre S, Armand JP. Epidermal growth factor receptor tyrosine kinase as a target for anticancer therapy. Drugs 2000; 60 (Suppl. 1): 15–23; discussion 41–42.
- [12] Ciardiello F, Tortora G. Anti-epidermal growth factor receptor drugs in cancer therapy. Expert Opin Investig Drugs 2002;11: 755–768.
- [13] Ciardiello F. Epidermal growth factor receptor tyrosine kinase inhibitors as anticancer agents. Drugs 2000; 60 (Suppl. 1): 25–32; discussion 41–42.
- [14] Baselga J. The EGFR as a target for anticancer therapy – focus on cetuximab. Eur J Cancer 2001; 37 (Suppl. 4): S16–22.
- [15] Kim ES, Khuri FR, Herbst RS. Epidermal growth factor receptor biology (IMC-C225). Curr Opin Oncol 2001; 13 (6): 506–513.
- [16] Kang X, Patel D, Shi J, et al. Anti-EGFR monoclonal antibody cetuximab binds the EGFR variant III receptor and internalizes phosphorylated receptor on the cell surface [abstract no. 498].Eur J Cancer 2002; 38 (Suppl. 7): S149.
- [17] Huang SM, Bock JM, Harari PM. Epidermal growth receptor blockade with C225 modulates proliferation, apoptosis, and radiosensitivity in squamous cell carcinomas of the head and neck. Cancer Res 1999; 59: 1935–1940.
- [18] Ciardiello F, Damiano V, Bianco R, et al. Antitumour of combined blockade of epidermal growth factor receptor and protein kinase A. J Natl Cancer Inst 1996; 88: 1770–1776.
- [19] Ciardiello F, Bianco R, Damiano V, et al. Antiangiogenic antitumoractivity of anti-epidermal growth factor receptor C225 monoclonal antibody in combination with edothelial growth factor antisense oligonucleotide in human GEO colon cancer cells. Clin Cancer Res 2000; 6: 3739–3747.
- [20] Perrotte P, Matsumoto T, Inoue K, et al. Anti-epidermal growth factor receptor antibody C225 inhibits angiogenesis in human transitional cell carcinoma growing orthotopically in nude mice. Clin Cancer Res 1999; 5: 257–264.
- [21] Matsumoto T, Perrotte P, Bar-Eli M, et al. Blockade of EGF-R (C225) signalling with anti-EGF-R monoclonal antibody (Mab) C225 inhibits matrix metalloproteinase-9 (MMP-9) expression and invasion of human transitional cell carcinoma (TCC) in vitro and in vivo [abstract no. 565]. 89th Annual Meeting of the American Association for Cancer Research; 1998 Mar 28–Apr 1; New Orleans.
- [22] Delbaldo C, Pierga JY, Dieras V, et al. Evaluation of pharmacokinetic (PK) interactions between cetuximab and irinotecan in patients with epidermal growth factor receptor (EGFR)-expressing advanced solid tumours. Results of a phase I study [abstract no. 552]. Eur J Cancer Suppl 2003; 1: (S167) 25–32.
- [23] Folprecht G, Lutz MP, Schoeffski P, et al. Pharmacokinetic (PK) evaluation of cetuximab in combination with weekly irinotecan (CPT-11) and 24h infusional 5-FU/folinic acid (FA) as first line treatment in patients (pts) with epidermal factor receptor (EGFR)-positive metastatic colorectal cancer [abstract no. 890]. Proc Am Soc Clin Oncol 2003; 22: 222.
- [24] Raoul JL, Van Laethem JL, Mitry E, et al. Phase II study of cetuximab combined with FOLFIRI (biweekly irinotecan plus infusional 5-FU and folinic acid (FA)) in patients (pts) with metastatic, Epidermal Growth Factor Receptor (EGFR)-ex-pressing colorectal cancer (CRC) [abstract no. 289]. Eur J Cancer Suppl 2003; 1: S89.
- [25] Rosenberg AH, Loehrer PJ, Needle MN, et al. Erbitux (IMC-C225) plus weekly irinotecan (CPT-11), fluorouracil and leucovorin in colorectal cancer that expresses the epidermal growth factor receptor [abstract no. 536]. 38th Annual Meeting of the American Society of Clinical Oncology 2002, May 18–21; Orlando.
- [26] Schöffski P, Lutz C-H, Folprecht G, et al. Cetuximab (C225, Erbitux) in combination with irinotecan, infusional 5-fluoro-uracil and folinic acid is safe and active in patients with metastatic colorectal cancer expressing epidermal growth factor-receptor. Results of a phase I study [abstract no. 495]. Cancer 2002; 38 (Suppl. 7): S148–9.
- [27] Cunningham D, Humblet Y, Siena S, et al. Cetuximab (C225) alone or in combination with irinotecan (CPT-11) in patients with epidermal growth factor receptor positive, irinotecan-refractory metastatic colorectal cancer [abstract no. 1012]. Proc Am Soc Clin Oncol 2003, May 22: 252 plus oral presentation.
- [28] Saltz L, Meropol NJ, Loehrer PJ, et al. Single agent IMC-C225 (Erbitux) has activity in CPT-11-refractory colorectal cancer (CRC) that expresses the epidermal growth factor receptor (EGFR) [abstract no. 504]. Proc Am Soc Clin Oncol 2002; May 21 (1): 127.
- [29] Saltz L, Rubin M, Hochster H, et al. Cetuximab (IMC-C225) plus irinotecan (CPT-11) is active in CPT-11-refractory colorectal cancer (CRC) that expresses epidermal growth factor receptor (EGFR) [abstract]. Proc ASCO 2001; Abstract 7.
- [30] Busam KJ, Capodieci P, Motzer R, et al. Cutaneous side-effects in cancer patients treated with the antiepidermal growth factor receptor antibody C225. Br J Dermatol 2001; 144: 1169–1176.