Inhibice žaludeční sekrece – pohled farmakologa
Souhrn:
Bultas J. Inhibice žaludeční sekrece – pohled farmakologa. Remedia 2022; 32: 304–311.
Inhibice žaludeční sekrece, konkrétně kyseliny solné, patří k nejrozšířenějším léčebným postupům. Léčena je dlouhodobě více než desetina dospělé populace. Vedle inhibitorů protonové pumpy (vodíko/draselné ATPázy) je zřetelná renesance starší skupiny léků – blokátorů histaminových receptorů H2 – a nově přichází skupina draslík‑kompetitivních inhibitorů acidity. Přehledný článek srovnává jednotlivé skupiny léků z pohledu mechanismu účinku, farmakokinetiky, farmakodynamiky, účinnosti a bezpečnosti.
Summary:
Bultas J. Inhibition of gastric secretion – a pharmacologist’s perspective. Remedia 2022; 32: 304–311.
Inhibition of gastric secretion, specifically hydrochloric acid, is one of the most widespread treatments. More than a tenth of the adult population is treated long‑term. In addition to proton pump (H/K ATPase) inhibitors, there is a distinct renaissance of the older group – histamine H2 receptor blockers – and a newly developed group of potassium‑competitive acid blockers. The overview article compares individual groups from the point of view of the mechanism of action, pharmacokinetics, pharmacodynamics, efficacy and safety.
Key words: proton pump inhibitors, histamine H2 receptor blockers, potassium‑competitive acid blockers.
Za posledních padesát let se
změnily nejen charakter řady onemocnění, ale též strategie
léčby. Obraz nemocniční chodby, kde pacient s achlorhydrií
před jídlem popíjel skleněnou trubičkou decinormální kyselinu
solnou, je dávno pryč. Naopak kyselina solná se dostala na pranýř.
Potlačení tvorby kyseliny chlorovodíkové v žaludku patří
k oblíbenému postupu nejen v léčbě vředové
a refluxní choroby, ale antisekreční léčba je také často
indikována plošně, a ne vždy opodstatněně. Právě ono
nadužívání vedlo před lety nestora české gastroenterologie
profesora Mařatku k následujícímu bonmotu: „Jednou se
budeme muset kyselině solné omluvit.“
Antisekreční léčba, konkrétně inhibitory protonové pumpy (PPI), je masově rozšířena. Při spotřebě více než 300 milionů definovaných denních dávek (DDD) je v České republice PPI chronicky léčeno více než 10 % dospělé populace, u seniorů se frekvence podávání PPI pohybuje nad 20 %. Přitom je stále více dokladů o řadě významných nežádoucích účinků PPI (např. v databázi PubMed se jedná o více než 1 600 prací na toto téma za poslední rok). Na nežádoucí účinky upozorňuje jak Evropská léková agentura (EMA), tak americký Úřad pro kontrolu potravin a léčiv (FDA). Není pochyb, že PPI jsou zásadním přínosem v léčbě řady závažných stavů, ovšem za podmínek správné indikace z pohledu choroby, správného výběru nemocného i optimální délky léčby.
V antisekreční léčbě nejsme odkázáni pouze na PPI, ale máme k dispozici též léčbu blokátory histaminových receptorů H2 (H2R) a nově přicházející skupinu kompetitivních inhibitorů protonové pumpy, tzv. draslík kompetitivních inhibitorů acidity označovaných jako prazany. Okrajový význam mají blokátory gastrinových receptorů. Tento přehled je koncipován ze zorného úhlu srovnání mechanismů účinku, účinnosti a bezpečnosti jednotlivých skupin léků.
Význam kyseliny solné v žaludku
Buňky žaludeční sliznice fundu a těla žaludku produkují řadu látek: kyselinu chlorovodíkovou, pepsinogen (aktivovaný při nízkém pH na pepsin), renin (u kojenců), vnitřní faktor (umožňující absorpci vitaminu B12), hlen a bikarbonáty. Vzhledem k zaměření tohoto článku se soustřeďme na kyselinu solnou. Její sekrece v žaludku, resp. kyselé prostředí, má celou řadu fyziologických funkcí. Primárním efektem je snížení hodnoty pH, to umožňuje aktivaci biologicky aktivních látek, zejména přeměnu proenzymu pepsinogenu na pepsin. Též aktivace vnitřního faktoru při nízké hodnotě pH je podmínkou vstřebávání vitaminu B12. Výrazně kyselé prostředí představuje první bariéru vstupu infekce do organismu. V neposlední řadě nízké pH umožňuje absorpci léčiv typu slabých hydrofilních kyselin, které procházejí membránou jen v nedisociovaném stavu. Příkladem je kyselina acetylsalicylová (s disociační konstantou 3,5), která se dobře vstřebává jen při nižším pH. Též řada jiných léčiv (např. dabigatran) se významně lépe absorbuje v kyselém prostředí. Naopak jiné léky (např. bisfosfonáty) se významně více absorbují při vyšším pH [1]. Změna hodnoty pH v žaludku, např. při léčbě PPI, tak významně ovlivňuje biologickou dostupnost řady léčiv vstřebávaných v žaludku. Obdobně vzestup či pokles hodnoty pH ve střevě ovlivňují aktivitu základního eliminačního systému cytochrom P450 3A4/P glykoprotein (CYP3A4/P gp), klinický význam však zatím není jasný [2].
Rovněž sekrece řady regulačních molekul je ovlivněna kyselostí žaludečních šťáv. Příkladem je sekrece gastrinu, která je nízkým pH utlumena, vyšším pH naopak aktivována. I zde je zřejmý klinický význam, vzestup hodnoty pH se zvýšenou sekrecí gastrinu zvýší motilitu žaludku, tonus kardie, a naopak sníží tonus pyloru – výsledkem je např. příznivé ovlivnění gastroezofageálního refluxu. Gastrin však též aktivuje proliferaci žaludečních enterochromafinních buněk s výsledným násobně vyšším rizikem rozvoje karcinomu žaludku při dlouhodobé léčbě PPI [3].
Jak je tedy zřejmé, potlačení žaludeční sekrece příznivě ovlivní řadu onemocnění vyvolaných acidopeptickou aktivitou na straně jedné, na straně druhé může zvýšit riziko vzniku řady alimentárních infekcí, resp. infekcí obecně, může významně ovlivnit biologickou dostupnost řady běžně užívaných léčiv či stimulací gastrinu zvýšit riziko rozvoje karcinomu žaludku a dalších, zejména neuroendokrinních nádorů v této lokalizaci. Potvrzuje se, že zásah do základních fyziologických pochodů organismu – a tím sekrece kyseliny solné nesporně je – není beztrestné. Proto bychom měli vždy před preskripcí léčiva zvažovat nejen přínos, ale i rizika. Volba správné indikace, optimální délky léčby i nejvhodnějšího léčiva by měly být samozřejmostí. Právě u antisekreční léčby ne vždy respektujeme správnou indikaci a léčbu aplikujeme u funkční dyspepsie („co kdyby to zabralo“), protahujeme ji na dobu medicínsky neodůvodněnou a zpravidla vždy sáhneme po nejúčinnějším léčivu, které však nemusí být nejbezpečnějším.
Řízení sekrece kyseliny solné
Sekrece kyseliny chlorovodíkové
v acinu parietální buňky je aktivována zejména třemi
sekretagogy. Humorální podněty (např. aminokyseliny z potravy)
či vzestup hodnoty žaludečního pH stimulují sekreci gastrinu.
Vedle aktivace vodíko/draselné ATPázy (H+/K+ ATPázy;
protonové pumpy) a sekrece pepsinogenu je zvýšena též
motilita žaludku a snížen tonus pyloru. Zvýšena je sekrece
žaludečních šťáv a urychleno vyprazdňování žaludku.
Gastrin působí buď přímo, či zprostředkovaně uvolněním
histaminu z enterochromafinních buněk (obr. 1) [4].
Neurogenní podněty, konkrétně aktivace vagu, uvolňují
acetylcholin, který cestou muskarinových receptorů M3
opět aktivuje přímo i nepřímo (uvolněním histaminu)
protonovou pumpu. Vedle sekrece kyseliny solné je v non parietálních
buňkách stimulován výdej pepsinogenu či hlenu a bikarbonátu.
Histamin, stimulovaný gastrinem či acetylcholinem c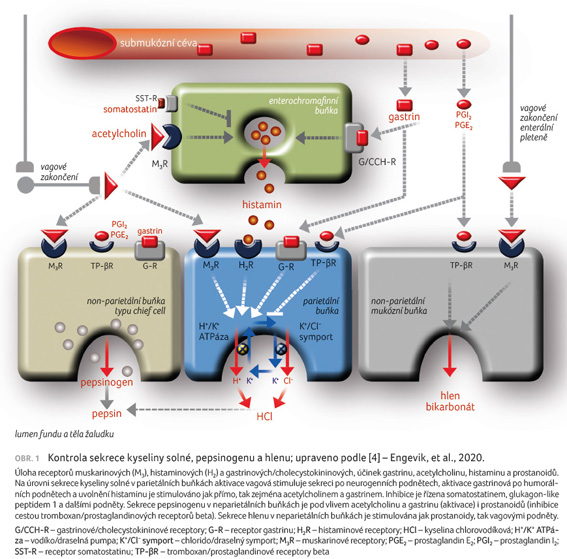 estou
H2R, aktivuje protonovou pumpu tzv. klasickou cestou
G proteinu, tedy stimulací adenylátcyklázy. Zvýšení
nabídky cyklického adenosinmonofosfátu (cAMP) zvyšuje aktivitu
cAMP dependentní proteinové kinázy s fosforylací
protonové pumpy, a tím i její aktivací. Histamin má
v hierarchii aktivátorů klíčové místo, zprostředkovává
efekt gastrinu i acetylcholinu.
estou
H2R, aktivuje protonovou pumpu tzv. klasickou cestou
G proteinu, tedy stimulací adenylátcyklázy. Zvýšení
nabídky cyklického adenosinmonofosfátu (cAMP) zvyšuje aktivitu
cAMP dependentní proteinové kinázy s fosforylací
protonové pumpy, a tím i její aktivací. Histamin má
v hierarchii aktivátorů klíčové místo, zprostředkovává
efekt gastrinu i acetylcholinu.
Terapeuticky se tak ke snížení sekrece kyseliny solné na této úrovni nabízí blokáda receptorů M3, což není výhodné jak pro malý efekt, tak pro nežádoucí účinky vyplývající z přítomnosti těchto receptorů v řadě jiných tkání. V praxi se spíše setkáváme se stimulací těchto receptorů, klinický význam má zvýšení sekrece s rizikem rozvoje vředové choroby při expozici nikotinu u kuřáků.
Blokáda gastrinových receptorů je opět nevýhodná z důvodu zpomalení evakuace žaludku, užívána je pouze k symptomatické léčbě některých neuroendokrinních nádorů provázených hypergastrinemií.
V praxi je účinná a bezpečná blokáda H2R. Zásah na vyšší etáži, tj. přímá inhibice protonové pumpy, blokuje sekreci nezávisle na stimulačním podnětu. Určitou nevýhodou je navození tzv. upregulace histaminových receptorů v parietálních buňkách po dlouhodobé blokádě H2R. Tento fenomén tolerance vyžaduje zvýšení koncentrace inhibitoru, tedy vyšší dávku léčiva. Receptory H2 jsou přítomny též v řadě dalších tkání: v dýchacích cestách (aktivují produkci hlenu), v cévách (kontrolují permeabilitu na úrovni kapilár) či v imunocytech. Význam této skutečnosti při léčbě blokátory H2R není zřejmý.
Praktický význam má též aktivace, resp. inhibice tromboxan/prostaglandinových receptorů beta (TP βR). V některých zemích se v profylaxi vředové choroby užívají, resp. spíše užívala analoga prostanoidů. Antisekreční efekt byl malý, spíše se uplatnil účinek cytoprotektivní, celkový význam byl však minimální. Z klinického pohledu je významný ulcerogenní účinek řady nesteroidních antiflogistik při inhibici cyklooxygenáz, resp. prostacyklin syntázy. Deficit prostaglandinů H2 a G2, prekurzorů prostaglandinu E2 či prostacyklinu působí při delší expozici predisponovaných osob ulcerogenně.
Funkce vodíko/draselné ATPázy (protonové pumpy) a možnosti jejího přímého ovlivnění
Protonová pumpa, přesněji H+/K+ ATPáza, aktivně secernuje protony do lumina acinu a zpět absorbuje kationty draslíku. Je funkčně spřažena s chlorido/draselným symportem (K+/Cl− symport), pumpou transportující katíonty draslíku a anionty chloru do acinu parietální buňky (obr. 1). Kationty draslíku tak jednou pumpou putují ven a druhou dovnitř buňky, proton (kation vodíku) a anion chloru zůstávají v lumen jako kyselina chlorovodíková.
Vedle zásahu na regulačních receptorech je možno ovlivnit protonovou pumpu i přímo. Při ireverzibilní blokádě H+/K+ ATPázy (při podávání PPI) je nutno resyntetizovat pumpy nové, k čemuž dochází za 24–48 hodin. Reverzibilní blokáda (při aplikaci draslík kompetitivních inhibitorů) naopak působí pouze po dobu vazby léčiva na receptor.
Selektivní blokátory histaminových
receptorů H2
První selektivní inhibitory sekrece kyseliny solné, blokátory H2R, byly zavedeny do klinické praxe téměř před 50 lety. U jejich vývoje stál stejný farmakolog – Sir James Black, který byl o dvacet let dříve zodpovědný za vznik prvního betablokátoru – propranololu. První dva blokátory H2R, cimetidin a ranitidin, byly postupně nahrazeny účinnějším a bezpečnějším famotidinem. Blokátory H2R dominovaly v léčbě vředové a gastroezofageální refluxní choroby, resp. funkční dyspepsie až do širšího zavedení účinnějších PPI. Zdá se však, že blokátory H2R v poslední době zažívají určitou renesanci, alespoň z řad gastroenterologů zaznamenáváme tyto hlasy.
Mechanismus účinku blokátorů H2R je dán selektivní kompetitivní blokádou H2R. Tyto receptory jsou zodpovědné za významnou část aktivace protonové pumpy. Jsou stimulovány histaminem, a jak bylo řečeno, vyplavení histaminu z enterochromafinních buněk je pod vlivem jak gastrinu, tak acetylcholinu. Blokáda H2R tak snižuje sekreci po neurogenních i humorálních podnětech.
Jediným v ČR užívaným blokátorem H2R je famotidin, který je vysoce selektivní, efekt na jiné histaminové receptory je minimální. Ačkoliv je inhibice kyseliny solné v porovnání s PPI slabší, 24hodinový pokles dosahuje 70 %. Inhibována je bazální, noční sekrece i sekrece stimulovaná jídlem či např. kofeinem, podmínky k léčbě vředové choroby jsou tak splněny. Na druhé straně vzestup pH (na hodnoty kolem 3) není tak výrazný jako při léčbě PPI, není tak inhibována absorpce řady léčiv, konkrétně kyseliny acetylsalicylové.
Po perorálním podání famotidinu se antisekreční efekt objevuje do 60 minut, vrcholový efekt za 23 hodin a délka trvání se pohybuje kolem 10–12 hodin. Biologická dostupnost dosahuje zhruba 50 %, eliminace je převážně renální [5]. Tolerance a bezpečnost famotidinu jsou vysoké, vzácné jsou poruchy vyprazdňování (průjmy či zácpa), k velmi vzácným nežádoucím účinkům patří vyšší únavnost, bolesti hlavy či svalové bolesti.
Dříve užívané blokátory H2R – cimetidin a ranitidin – byly opuštěny, důvodem byla nižší bezpečnost vyplývající zejména z inhibice metabolických systémů (oxidáz CYP1A2, 2C9 a 2D6). Famotidin metabolické systémy neinhibuje.
Blokátory gastrinových receptorů
(cholecystokininových receptorů 2)
Tato léková skupina, jejímž představitelem je netazepid – selektivní kompetitivní perorální antagonista gastrinových receptorů – má velmi úzkou indikaci. Užívá se pouze pro některé typy neuroendokrinních nádorů provázených hypergastrinemií (gastric NEN I a II, karcinoid žaludku). Užití v léčbě peptických lézí je omezeno, neboť blokáda gastrinových receptorů vede k významnému snížení žaludeční motility a ke zhoršení evakuace.
Inhibitory protonové pumpy
Inhibitory protonové pumpy, resp. blokátory H+/K+ ATPázy, jsou jedněmi z nejčastěji podávaných léčiv, dlouhodobě je užívá více než 10 % dospělé populace.
Mechanismem účinku je ireverzibilní blokáda H+/K+ ATPázy v acinu parietálních buněk žaludku. Jak nasvědčuje označení ATPáza, jedná se o aktivní transmembranózní transport protonů a kationtů draslíku z cytoplazmy do lumen acinu. K zachování elektroneutrality je současně pasivním transportérem – K+/Cl− symportem – zpět vstřebáván kation draslíku spolu se sekrecí chloridového aniontu do acinu. Obě pumpy tvoří funkční jednotku.
Po perorálním podání všechny PPI velmi dobře prostupují membránami a rychle se absorbují. Díky vysoké afinitě ke kyselému prostředí jsou rychle distribuovány do acinu. Lokální koncentrace PPI v acinu je asi tisíckrát větší než v plazmě. Tak je dosaženo dostatečné lokální koncentrace léčiva. Při hodnotě pH < 3 se PPI aktivují (vytvářejí sulfenamid) a uvolňují sulfhydrilovou skupinu. Tou se váží přímo na protonovou pumpu, čímž ji ireverzibilně inaktivují. Vlastní aktivace je u jednotlivých PPI různě rychlá: rabeprazol je aktivován během několika málo minut, naopak pantoprazol se aktivuje pomalu, po několika desítkách minut. Z hlediska rychlosti nástupu efektu je tak rabeprazol nejvýhodnější při ad hoc použití.
Aby nedošlo k nežádoucí aktivaci molekuly již v lumen žaludku, jsou PPI podávány v acidorezistentní formě. Limitní hodnota pH pro vytvoření sulfenamidu se mírně liší, nejvyšší (kolem 3,5) je u rabeprazolu, u ostatních je pH < 3. To znamená, že při léčbě PPI, kdy hodnota pH stoupá nad 3, je bioaktivace všech PPI omezena. Kyselost žaludečních šťáv je tak regulována na stejné úrovni – při poklesu hodnoty pH se vytvoří více aktivního metabolitu (pH stoupá nad 3), naopak tento vzestup sníží aktivaci mateřské látky (pH klesá). Díky tomuto mechanismu, kdy je účinek regulován v úzkém rozmezí nezávisle na koncentraci léčiva, mají PPI velmi široké terapeutické okno. K tomu, aby došlo k vytvoření aktivního metabolitu a inaktivaci H+/K+ ATPázy, je nutné, aby byla pumpa v aktivním stavu, což je zejména po jídle. Potřebná koncentrace PPI v plazmě je krátká, jen 1–2 hodiny. K dosažení optimálního efektu je tak výhodné podat léčivo 30–60 minut před jídlem, požití potravy protonové pumpy aktivuje a umožní jejich ireverzibilní blokádu. Jednorázová aplikace PPI v tomto režimu inhibuje asi 60 % funkčních pump, opakované podání pak 80–90 %. Zvýšení dávky PPI se neprojeví zvýšením efektu či zrychlením nástupu [6].
Délka účinku je u všech PPI stejná, pumpy jsou resyntetizovány po více než 24 hodinách, resp. každých 24 hodin je obnoveno 20 % pump. Při potřebě inhibice 70–80 % H+/K+ ATPáz k dosažení pH ≥ 3 (dostatečný vzestup k hojení peptického vředu) je dávkování PPI jedenkrát denně zcela dostatečné a není nutno aplikovat více denních dávek.
Z klinického hlediska má význam, že několik málo dnů po vysazení se objevuje rebound fenomén s hyperaciditou, jeho původem je upregulace protonových pump. Zhoršení potíží po přerušení aplikace tak ztěžuje ukončení léčby PPI. Vhodné je postupné vysazování či přechod na jinou antisekreční strategii při důrazu na přispění správné taktiky životosprávy (nejíst na noc, nejíst dráždivou stravu apod.).
Při podání ve farmakoekvivalentních dávkách nejsou praktické rozdíly v dosaženém efektu, tj. vzestupu hodnoty pH. Poločas plazmatické eliminace je u užívaných PPI stejný, pohybuje se kolem jedné hodiny [6]. Biologická dostupnost PPI po perorálním podání je dobrá, kolem 80–90 %. Eliminace PPI je hepatální, v biodegradaci dominuje polymorfní izoenzym CYP2C19. U nositelů genotypu s vysokou aktivitou této oxidázy je efekt PPI snížen. Izoenzym CYP2C19 je PPI inhibován, nejsilnějším inhibitorem je omeprazol, ve středu se nacházejí esomeprazol a lansoprazol a nejslabšími inhibitory jsou pantoprazol a zejména rabeprazol. Pouze nově zaváděný anaprazol není metabolizován CYP2C19 a není ani jeho inhibitorem.
Inhibitory protonové pumpy mají řadu
lékových interakcí – jedním typem jsou
interakce na bázi omezení absorpce slabých kyselin (zejména
kyseliny acetylsalicylové) či vzestup dosažitelnosti slabých
bází. Druhý typ reflektuje inhibici izoenzymu CYP2C19. Klinický
význam má snížení biodegradace řady antidepresiv (např.
citalopramu) s rizikem nadměrného účinku a se zvýšením
rizika náhlého koronárního úmrtí či zpomalená bioaktivace
klopidogrelu s rizikem selhání protidestičkového efektu, tj.
se zvýšením mortality a výskytu aterotrombotických příhod
[7,8].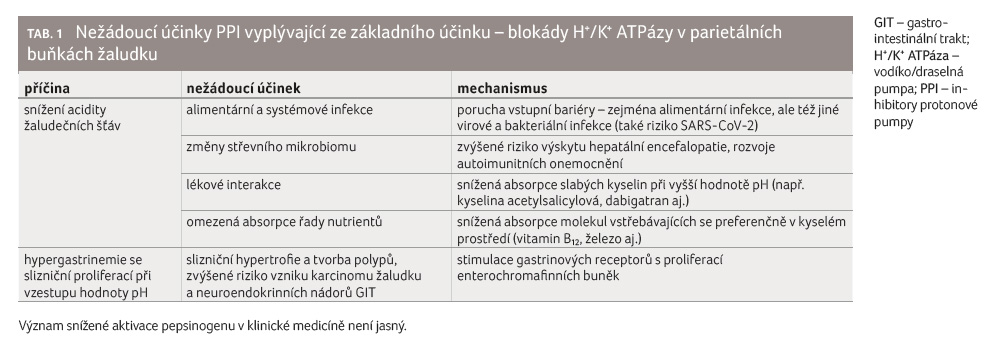
V současné době je dostupných několik PPI. Ve farmakoekvivalentních dávkách mají u většiny léčených prakticky identický efekt na inhibici sekrece. Určité rozdíly však existují při posuzování farmakogenetických vlivů, konkrétně na rychlost biodegradace oxidázou CYP2C19. U rychlých metabolizátorů (27 % evropské populace) a zejména u velmi rychlých metabolizátorů (5 %) je biodegradace tak překotná, že nemusí být dosaženo účinné koncentrace zejména omeprazolu, a efekt selhává [9]. Naopak u rabeprazolu je význam polymorfismu nejmenší a spolehlivost léčby největší. Rabeprazol je též nejslabším inhibitorem CYP2C19 v této lékové skupině. Další rozdíly jsou v rychlosti nástupu účinku: nejrychlejší bioaktivaci má rabeprazol, nejpomalejší pantoprazol a esomeprazol. Z pohledu lékových interakcí, farmakogenetiky i farmakokinetických vlastností je tak rabeprazol z dostupných PPI nejvýhodnější [6].
Nežádoucí účinky PPI mají různé
příčiny. Jedna vychází ze změny hodnoty pH v žaludku
při inhibici H+/K+ ATPázy (tab. 1).
Podkladem druhého typu je blokáda protonových pump (vakuolární
ATPázy) v jiných tkáních a třetím je inhibice
transportéru bivalentních kationtů TRPM (transient receptor
potential metastatin) 6/7 v enterocytech a epiteliích
nefronu (tab. 2).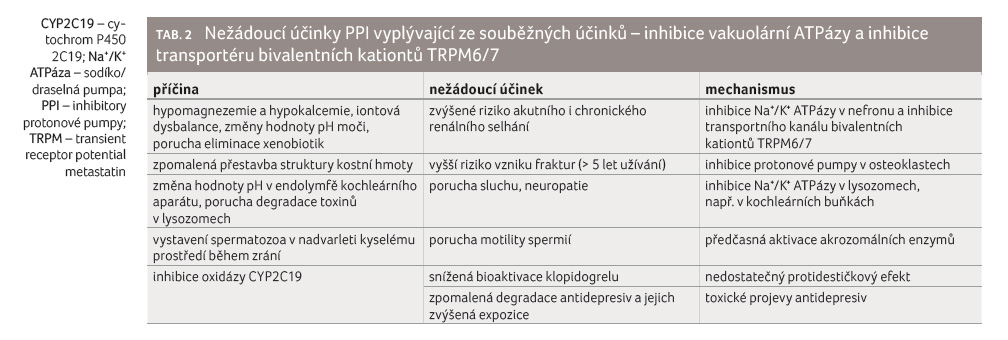
Vedle farmakodynamického účinku na inhibici protonové pumpy v žaludku mají PPI ještě řadu paralelních účinků. Ireverzibilně blokují též protonové pumpy, tzv. vakuolární ATPázy (V ATPázy) v jiných tkáních – v nefronu, v epiteliích kochleárního systému, v epiteliích nadvarlete, v acinu osteoklastu, resp. v lysozomech všech tkání. Z této inhibice vyplývá řada nežádoucích účinků, jimž byla věnována pozornost v několika předchozích článcích v tomto časopise [10].
Inhibice transportéru bivalentních kationtů TRPM6/7 (kalcia a magnezia) v enterocytech a epiteliích nefronu snižuje enterální absorpci a zvyšuje renální eliminaci těchto dvou důležitých kationtů. Riziko jejich deplece je zvýšeno zejména při současné léčbě kličkovými diuretiky, která ztráty obou kationtů podporují. Deplece magnezia a kalcia může vést k vyšší únavnosti, spasmům až křečím kosterního svalstva, poruchám srdečního rytmu, osteopenii a osteoporóze.
Draslík kompetitivní blokátory
acidity
Draslík kompetitivní blokátory acidity (prazany) jsou již řadu let úspěšně užívány v Asii, např. vonoprazan (Japonsko a dalších 14 zemí), tegoprazan a revaprazan (Jižní Korea), u fexuprazanu probíhá aktuálně registrační proces. V Evropě a ve Spojených státech amerických jsou dokončována klinická hodnocení předregistrační fáze u indoevropské populace. Tato nová skupina léků rovněž inhibuje sekreci kyseliny chlorovodíkové blokádou H+/K+ ATPázy, tedy protonové pumpy.
V porovnání s PPI mají draslík kompetitivní inhibitory řadu odlišností. Váží se na pumpu jen iontovými vazbami, nikoliv kovalentně, a tak působí reverzibilně, tj. na dobu účinné koncentrace léčiva. Dalším rozdílem je, že se váží na jiné místo pumpy, kompetitivně inhibují transport draslíku do lumina. Tím vyřadí z funkce celou funkční jednotku H+/K+ ATPázu i K/Cl symport. Třetím a zcela zásadním rozdílem je, že není doloženo, že by byla inhibována V ATPáza či transportér bivalentních kationtů TRPM6/7, bezpečnost při dlouhodobé léčbě by tak mohla být větší. Čtvrtým, rovněž důležitým rozdílem je absence inhibice oxidázy CYP2C19. Není tak ovlivněna biodegradace řady antidepresiv a není blokována bioaktivace klopidogrelu. Posledním rozdílem je méně výrazné ovlivnění hodnoty pH, která se při léčbě pohybuje kolem 3. Z pohledu léčebného efektu je tato hodnota dostatečná, z pohledu lékových interakcí můžeme očekávat menší dopad na zpomalení absorpce léčiv typu slabých kyselin, např. kyseliny acetylsalicylové. Přímé srovnání však v této oblasti zatím chybí.
Z farmakologického hlediska je u reverzibilních blokátorů důležitá doba účinné koncentrace v plazmě a délka vazby na cílovou strukturu. Dostupná je hodnota poločasu plazmatické eliminace: u vonoprazanu přibližně osm hodin, u tegoprazanu 4–5 hodin a u revaprazanu zhruba 2,5 hodiny [11]. U vonoprazanu tak dostačuje k účinné inhibici sekrece jedna denní dávka. Vonoprazan je metabolizován a inaktivován oxidázou CYP3A4 v játrech, silné inhibitory však farmakokinetiku významně neovlivnily.
Účinnost a bezpečnost v léčbě i v profylaxi vředové i refluxní choroby či v eradikaci Helicobacter pylori byla porovnávána s PPI zejména u vonoprazanu, efekt byl srovnatelný s lansoprazolem [12,13].
Lze konstatovat, že draslík kompetitivní inhibitory acidity jsou velmi nadějnou lékovou skupinou. Vzhledem k tomu, že studie u evropské populace mají být brzy dokončeny, je pravděpodobné zavedení prazanů na evropský trh v nejbližších letech.
Indikace antisekreční léčby
Indikací PPI stejně jako inhibitorů
H2R je léčba onemocnění na bázi zvýšené
sekrece či snížené odolnosti sliznice k působení trávicích
šťáv, tj. vředové choroby a gastroezofageálního refluxu.
Inhibitory protonové pumpy jsou nedílnou součástí
antihelikobakterové léčby. Další, při plošném podávání již
méně podloženou indikací jsou funkční dyspepsie a profylaxe
krvácení při antitrombotické léčbě. Porovnání tří
základních lékových skupin antisekreční léčby shrnuje tabulka 3 [14,15]. Pohled gastroenterologa na účinnost
a bezpečnost této léčby podá článek chystaný pro
publikaci v časopisu Remedia.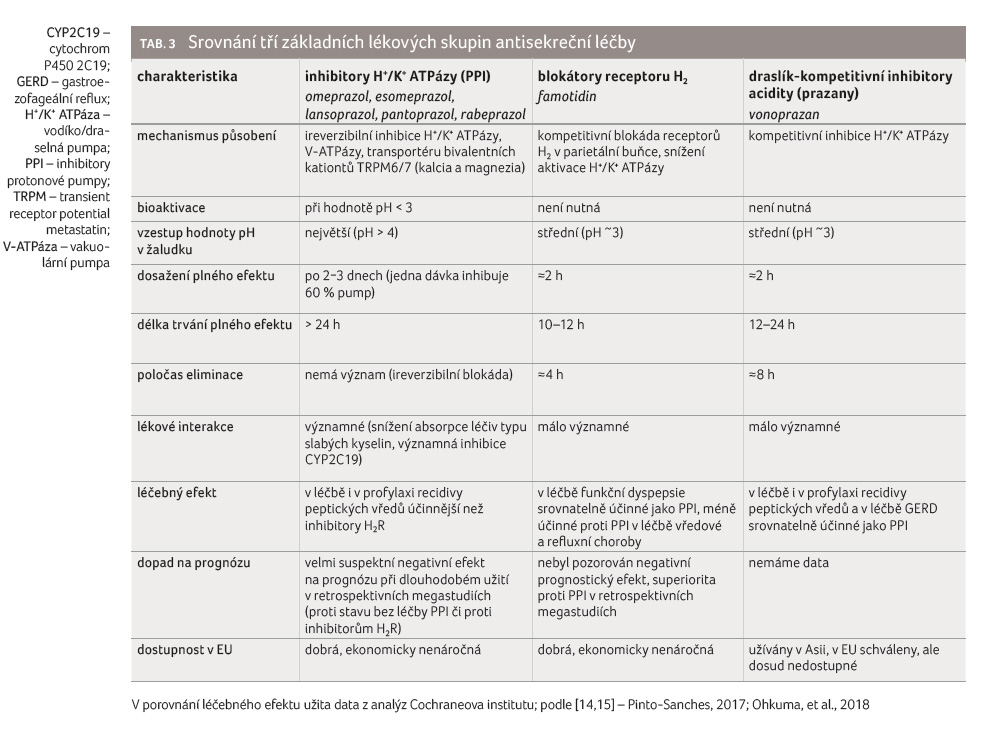
Seznam použité literatury
- [1] Mitra A, Kesisoglou F. Impaired Drug Absorption Due to High Stomach pH. Mol Pharm 2013; 10: 3970–3979.
- [2] Gaohua L, Miao X, Dou L. Crosstalk of physiological pH and chemical pKa under the umbrella of physiologically based pharmacokinetic modeling of drug absorption, distribution, metabolism, excretion, and toxicity. Expert Opin Drug Metab Toxicol 2021; 17: 1103–1124.
- [3] Ng AK‑Yet, Ng PY, Ip A, et al. Association between proton pump inhibitors after percutaneous coronary intervention and risk of gastric cancer. BMJ Open Gastro 2021; 8: e000719.
- [4] Engevik AC, Kaji I, Goldenring JR. The Physiology of the Gastric Parietal Cell. Physiol Rev 2020; 100: 573–602.
- [5] Langtry HD, Grant SM, Goa KL. Famotidine. An updated review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in peptic ulcer disease and other allied diseases. Drugs 1989; 38: 551–590.
- [6] Shin JM, Sachs G. Pharmacology of proton pump inhibitors. Curr Gastroenterol Rep 2008; 10: 528–534.
- [7] Wu WT, Tsai CT, Chou YC, et al. Cardiovascular Outcomes Associated With Clinical Use of Citalopram and Omeprazole: A Nationwide Population‑Based Cohort Study. J Am Heart Assoc 2019; 8: e011607.
- [8] Shi W, Yan L, Yang J, Yu M. Ethnic variance on long term clinical outcomes of concomitant use of proton pump inhibitors and clopidogrel in patients with stent implantation: a PRISMA‑complaint systematic review with meta‑analysis. Medicine 2021; 100: e24366.
- [9] Ionova Y, Ashenhurst J, Zhan J, et al. CYP2C19 Allele Frequencies in Over 2.2 Million Direct‑to‑Consumer Genetics Research Participants and the Potential Implication for Prescriptions in a Large Health System. Clin Transl Sci 2020; 13: 1298–1306.
- [10] Bultas J. Rub a líc inhibitorů protonové pumpy – jsou skutečně tak bezpečné, jak je deklarováno? Remedia 2020; 30: 91–106.
- [11] Abdel‑Aziz Y, Metz DC, Howden CW. Review article: potassium‑competitive acid blockers for the treatment of acid‑related disorders. Aliment Pharmacol Ther 2021; 53: 794–809.
- [12] Tadayuki O, Hiroto M. Potent Potassium‑competitive Acid Blockers: A New Era for the Treatment of Acid‑related Diseases. J Neurogastroenterol Motil 2018; 24: 334–344.
- [13] Howden CW. Insights on the Potential Use of Potassium‑Competitive Acid Blockers in Erosive Esophagitis. Gastroenterol Hepatol (N Y) 2021; 17: 178–180.
- [14] Pinto‑Sanches MI. Proton pump inhibitors for functional dyspepsia. Cochrane Database of Systematic Reviews 2017; 3: CD011194.
- [15] Ohkuma K, Iida H, Inoh Y, et al. Comparison of the early effects of vonoprazan, lansoprazole and famotidine on intragastric pH: a three‑way crossover study. J Clin Biochem Nutr 2018; 63: 80–83.