Inhibitory SGLT (1. část) – selektivita působení a farmakodynamické účinky
Souhrn:
Suchopár J. Inhibitory SGLT (1. část) – selektivita působení a farmakodynamické účinky. Remedia 2022; 32: 81–83.
Glifloziny patří mezi velmi perspektivní antidiabetika a kardiovaskulární léky. Jejich mechanismus účinku spočívá v inhibici transportního systému, který zajišťuje kotransport sodíku a glukózy (SGLT) a je exprimován v tenkém střevě (SGLT1), proximálním tubulu (SGLT2), ale i v jiných tkáních. Selektivita účinku vůči SGLT1 a SGLT2 je nejvýznamnějším faktorem ovlivňujícím farmakodynamické účinky gliflozinů. Článek je prvním v řadě textů, které dále popíší metabolismus a transport gliflozinů, míru a cesty jejich glukuronizace a lékové interakce.
Summary:
Suchopar J. SGLT inhibitors (part 1): a selectivity of action and pharmacodynamic effects. Remedia 2022; 32: 81–83.
Gliflozins are among the most promising antidiabetics and cardiovascular drugs. Their mechanism of action is the inhibition of sodium‑glucose co‑transporter (SGLT), which is expressed in the small intestine (SGLT1), the proximal tubule (SGLT2), and other tissues. The selectivity of action against SGLT1 and SGLT2 is the most important factor influencing the pharmacodynamic effects of gliflozins. The article is the first in a series of articles that further describe the metabolism and transport of gliflozins, the extent and pathways of their glucuronidation, and the drug interactions of gliflozins.
Key words: sodium‑glucose co‑transporter, SGLT1 – SGLT2 , gliflozins, dapagliflozin, canagliflozin, empagliflozin, ertugliflozin, sotagliflozin, pharmacodynamic properties.
Floretin je přírodní polyfenol
nacházející se v ovoci, např. v jablcích (obr. 1A)
[1]. Jeho glukosidem (přesněji 2’ β D glukopyranosidem)
je florizin (obr. 1B) [2]. Florizin představuje mimořádně
zajímavou látku, která byla objevena již v roce 1835, avšak
její schopnost vyvolávat glykosurii byla poprvé popsána až
v roce 1933 [3]. Florizin byl následně identifikován jako
první přírodní látka inhibující kotransport glukózy a sodíku.
Tento mechanismus je založen na inhibici SGLT (z anglického
sodium glucose linked transporter), který byl objeven až
v roce 1982 [4]. V roce 1987 byl první typ SGLT klonován
a teprve v roce 1994 byla náležitě pochopena a popsána
funkce i tkáňová distribuce a exprese SGLT [5,6].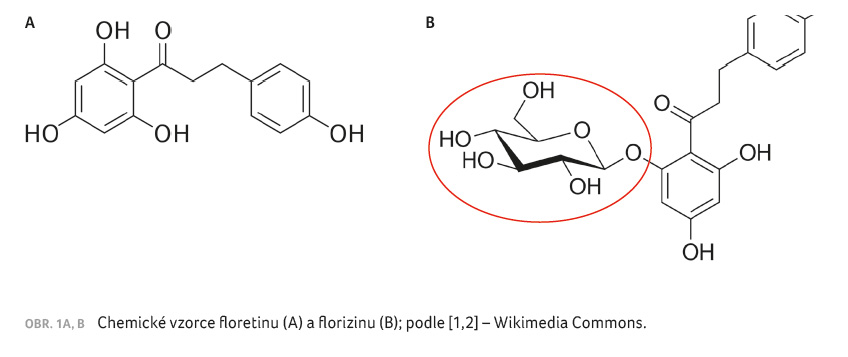
Florizin se nachází zejména v kůře jabloní a také v řadě dalších rostlin, v menším množství je pak obsažen v jablcích a dalším ovoci (švestky, meruňky a ve stopovém množství i jahody) [7]. Látka je inhibitorem SGLT1 a SGLT2 [8]. Tyto transportní systémy jsou spolu s transportními systémy GLUT (zejména GLUT2) spoluodpovědné za transport glukózy při jejím vstřebávání a při její eliminaci ledvinami. SGLT jsou exprimovány na apikální straně polarizovaných buněk a umožňují transport glukózy (spolu s natriem) přes buněčnou membránu enterocytů a tubulárních buněk ledvin.
Za zmínku stojí, že Evropané denně konzumují průměrně 0,7–7,5 mg florizinu v potravě, přičemž hlavním zdrojem jsou jablka a jablečný mošt [9]. Významní konzumenti jablek mohou mít denní příjem > 50 mg florizinu. Florizin primárně působí pouze ve střevě, kde inhibuje SGLT1. Je rychle odbouráván laktázou na neaktivní floretin. U osob, které mají sníženou aktivitu laktázy, nebo při podání vyšších dávek (> 20 mg/kg) však může florizin působit i na SGLT2 v ledvinách.
SGLT1 je exprimován v tenkém střevě, ledvinách (v distálnějších segmentech S2, a zejména S3 proximálního tubulu), příušních žlázách, podčelistních žlázách a v myokardu. SGLT1 je jedním z nejvýznamnějších transportních systémů zajišťujících vstřebávání glukózy z tenkého střeva a současně spolu se SGLT2 zajišťuje (ze zhruba 10–20 %) reabsorpci glukózy z primární moči [10,11].
Exprese SGLT2 je nejvýznamnější v ledvinách (zejména úvodní segment S1 proximálního tubulu). SGLT2 je hlavním transportním systémem, který je majoritně odpovědný (ze zhruba 80–90 %) za reabsorpci glukózy z primární moči [12].
Inhibice SGLT logicky vede ke snížení transportu glukózy, v případě SGLT1 ve střevě, v myokardu a v ledvinách a v případě SGLT2 v ledvinách. Po poznání mechanismu působení florizinu na SGLT byly intenzivně zkoumány mnohé syntetické látky, které vykazovaly výrazný inhibiční efekt na SGLT, s cílem vyvinout novou skupinu antidiabetik. Aby tyto léky byly rezistentní vůči laktáze, byla cukerná komponenta v jejich molekule navázána namísto kyslíku přímo na uhlík (za vzniku tzv. C glukosidů). Do klinické praxe bylo od roku 2013 postupně zavedeno několik inhibitorů SGLT2, z nichž některé mají vysokou selektivitu vůči SGLT2, jiné mají zvýrazněnou také inhibiční aktivitu vůči SGLT1. Inhibice SGLT2 navozuje upregulaci (zvýšení transportní aktivity) SGLT1, což vede k mírnému snížení celkové exkrece glukózy močí. Tofogliflozin je inhibitorem SLGT2 s nejvyšší selektivitou účinku, naopak mizagliflozin je inhibitorem SGLT1 s nejvyšší selektivitou účinku.
Základní otázkou z hlediska farmakodynamického působení je, zda selektivita účinku vůči SGLT2 je z klinického hlediska výhodná, respektive zda duální působení (tj. jak vůči SGLT2, tak i vůči SGLT1) představuje ve srovnání se selektivní inhibicí SGLT2 naopak výhodu. Z hlediska klinického využití jednotlivých typů inhibitorů SGLT se ukazuje, že míra selektivity může mít vliv na klinické využití léčiva.
Selektivní inhibitory SGLT1 jsou
profilovány k budoucímu využití jako léčiva určená
k terapii chronické idiopatické zácpy [13]. Konkrétní
klinické zkušenosti jsou však zatím omezeny pouze na studie
fáze II klinického hodnocení mizagliflozinu.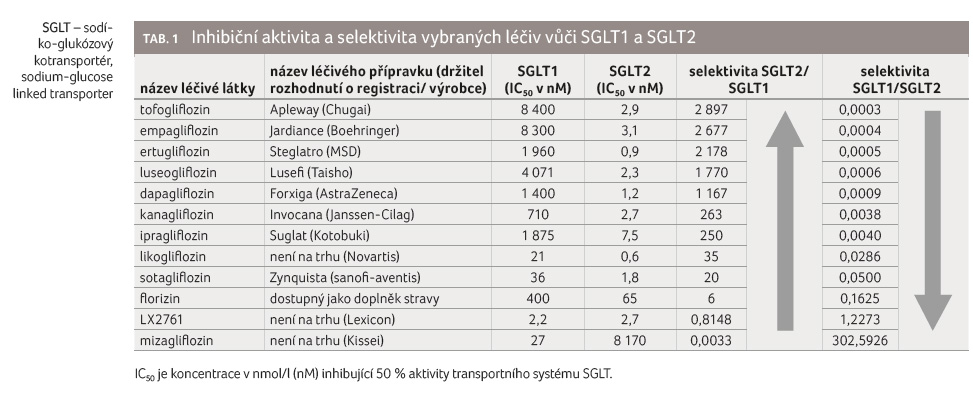
Přehled jednotlivých léčiv a jejich inhibiční aktivita vůči SGLT1 a SGLT2 jsou uvedeny v tabulce 1.
Inhibitory s vysokou selektivitou vůči SGLT2 jsou primárně určeny k terapii diabetu 2. typu (a diabetu 1. typu v případě dapagliflozinu), ke snížení rizika vzniku selhání funkce ledvin a k terapii srdeční nedostatečnosti se sníženou ejekční frakcí levé komory. Schopnost inhibitorů SGLT2 ovlivnit prognózu pacientů se srdečním selháním se sníženou ejekční frakcí je natolik impozantní, že se dokonce hovoří o revoluci v kardiovaskulární farmakoterapii [14]. Inhibitory SGLT2 mají již v současnosti využití při redukci tělesné hmotnosti, v budoucnosti pak patrně budou mít využití při terapii steatózy jater nealkoholické etiologie [15,16]. Jako jedna z potenciálních indikací připadá v budoucnosti v úvahu rovněž terapie časných stadií adenokarcinomu plic [17].
Du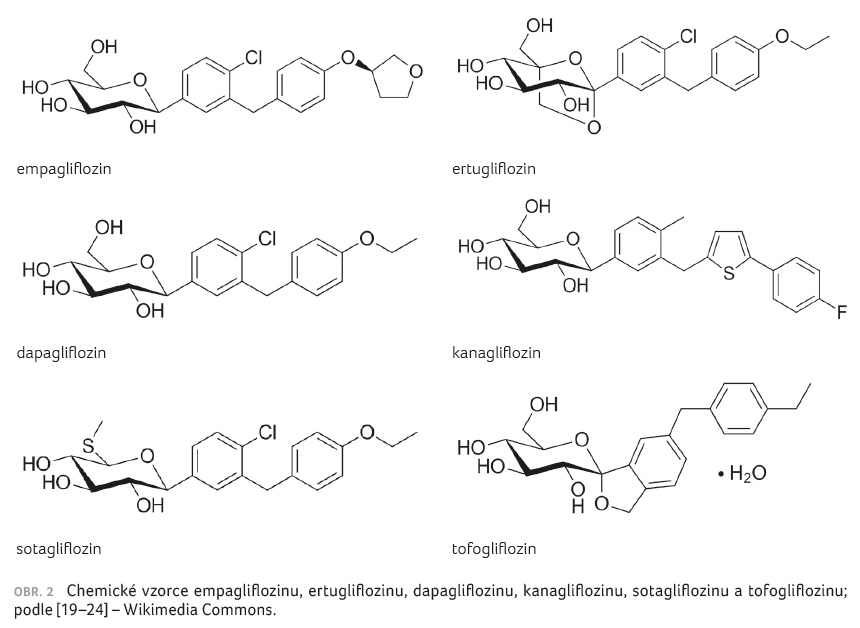 ální inhibitory SGLT1 a SGLT2
se pak aktuálně využívají k terapii diabetu 1. typu
(sotagliflozin) a v budoucnosti by tato léčiva mohla být
indikována k terapii srdečního selhání, včetně pacientů
se zachovalou ejekční frakcí, případně k zabránění
vzniku cévní mozkové příhody [18].
ální inhibitory SGLT1 a SGLT2
se pak aktuálně využívají k terapii diabetu 1. typu
(sotagliflozin) a v budoucnosti by tato léčiva mohla být
indikována k terapii srdečního selhání, včetně pacientů
se zachovalou ejekční frakcí, případně k zabránění
vzniku cévní mozkové příhody [18].
Chemická struktura inhibitorů SGLT2 je velmi podobná, jedná se o tzv. C glukosidy substituovaného fenylu (obr. 2) [19–24]. Tomu odpovídají obdobné farmakokinetické vlastnosti, metabolismus a transport těchto léčiv. Přesto je nezbytné uvést, že inhibitory SGLT2 nejsou z hlediska výše uvedených parametrů stejné.
Vedle SGLT1 a SGLT2 existují
ještě další transportní systémy SGLT. První z nich –
SGLT3 – není transportérem glukózy, ale glukózovým
senzorem, který je exprimován v centrální nervové soustavě
(CNS) [25]. Další, SGLT4, je také exprimován především v CNS,
umožňuje transport manózy, fruktózy a některých dalších
cukrů, nikoliv však glukózy; jeho role dosud není zcela objasněna
[26]. SGLT5 je exprimován v ledvinách, kde v segmentu S2
proximálního tubulu zajišťuje reabsorpci 65–85 % fruktózy
z primární moči, vedle toho je také transportérem pro
manózu a galaktózu [27,28]. SGLT6 (známý také jako SMIT2)
je exprimován v CNS, kde však netransportuje glukózu, ale
myo inositol a chiro inositol (šestiuhlíkové
alkoholové cukry), které jsou výchozím substrátem pro biosyntézu
různých fosfolipidů [29].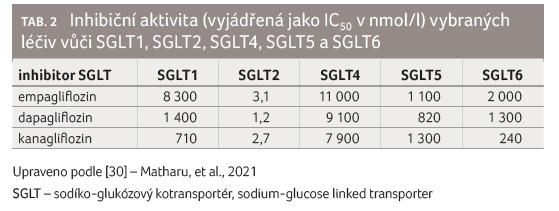
Žádný z výše uvedených inhibitorů SGLT1 a SGLT2 nemá absolutní selektivitu účinku a mohou tak, i když velmi slabě, působit i na SGLT3, SGLT4, SGLT5 nebo SGLT6, jak je uvedeno v tabulce 2 [30].
Seznam použité literatury
- [1] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=72839286
- [2] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=5770145
- [3] Chasis H, Jolliffe N, Smith HW. The action of phlorizin on the excretion of glucose, xylose, sucrose, creatinine and urea by man. J Clin Invest 1933; 12: 1083–1090.
- [4] Amsler K, Cook JS. Development of Na+‑dependent hexose transport in a cultured line of porcine kidney cells. Am J Physiol 1982; 242: C94–C101.
- [5] Hediger MA, Coady MJ, Ikeda TS, Wright EM. Expression cloning and cDNA sequencing of the Na+/glucose co‑transporter. Nature 1987; 330: 379–391.
- [6] Lee WS, Kanai Y, Wells RG, Hediger MA. The high affinity Na+/glucose cotransporter. Re‑evaluation of function and distribution of expression. J Biol Chem 1994; 268: 12032–12039.
- [7] Tian L, Cao J, Zhao T, et al. The Bioavailability, Extraction, Biosynthesis and Distribution of Natural Dihydrochalcone: Phloridzin. Int J Mol Sci 2021; 22: 962.
- [8] Blaschek W. Natural Products as Lead Compounds for Sodium Glucose Cotransporter (SGLT) Inhibitors. Planta Med 2017; 83: 985–993.
- [9] Niederberger KE, Tennant DR, Bellion P. Dietary intake of phloridzin from natural occurrence in foods. Br J Nutr 2020; 123: 942–950.
- [10] Lehmann A, Hornby PJ. Intestinal SGLT1 in metabolic health and disease. Am J Physiol Gastrointest Liver Physiol 2016; 310: G887–G898.
- [11] Song P, Onishi A, Koepsell H, Vallon V. Sodium glucose cotransporter SGLT1 as a therapeutic target in diabetes mellitus. Expert Opin Ther Targets 2016; 20: 1109–1125.
- [12] Ghezzi C, Loo DDF, Wright EM. Physiology of renal glucose handling via SGLT1, SGLT2 and GLUT2. Diabetologia 2018; 61: 2087–2097.
- [13] Fukudo S, Endo Y, Hongo M, et al. Safety and efficacy of the sodium‑glucose cotransporter 1 inhibitor mizagliflozin for functional constipation: a randomised, placebo‑controlled, double‑blind phase 2 trial. Lancet Gastroenterol Hepatol 2018; 3: 603–613. Erratum in: Lancet Gastroenterol Hepatol 2018, 3: e4.
- [14] Verdecchia P, Angeli F, Cavallini C, et al. The revolution of the anti‑diabetic drugs in cardiology. Eur Heart J Suppl 2020; 22(Suppl E): E162–E166.
- [15] Zaccardi F, Webb DR, Htike ZZ, et al. Efficacy and safety of sodium‑glucose co‑transporter‑2 inhibitors in type 2 diabetes mellitus: systematic review and network meta‑analysis. Diabetes Obes Metab 2016; 18: 783–794.
- [16] Seko Y, Nishikawa T, Umemura A, et al. Efficacy and safety of canagliflozin in type 2 diabetes mellitus patients with biopsy‑proven nonalcoholic steatohepatitis classified as stage 1–3 fibrosis. Diabetes Metab Syndr Obes 2018; 2018: 835–843.
- [17] Scafoglio CR, Villegas B, Abdelhady G, et al. Sodium‑glucose transporter 2 is a diagnostic and therapeutic target for early‑stage lung adenocarcinoma. Sci Transl Med 2018; 10: 467.
- [18] Koufakis T, Mustafa OG, Tsimihodimos V, et al. Insights Into the Results of Sotagliflozin Cardiovascular Outcome Trials: Is Dual Inhibition the Cherry on the Cake of Cardiorenal Protection? Drugs 2021; 81: 13651371.
- [19] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=32044238
- [20] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=40713066
- [21] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=53173834
- [22] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=53160136
- [23] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/w/index.php?curid=77715343
- [24] Wikimedia Commons. Dostupné na: https://commons.wikimedia.org/wiki/File:Tofogliflozin_monohydrate_skeletal_3D.svg
- [25] Soták M, Marks J, Unwin RJ. Putative tissue location and function of the SLC5 family member SGLT3. Exp Physiol 2017; 102: 5–13.
- [26] Tazawa S, Yamato T, Fujikura H, et al. SLC5A9/SGLT4, a new Na+‑dependent glucose transporter, is an essential transporter for mannose, 1,5‑anhydro‑D‑glucitol, and fructose. Life Sci 2005; 76: 1039–1050.
- [27] Fukuzawa T, Fukazawa M, Ueda O, et al. SGLT5 Reabsorbs Fructose in the Kidney but Its Deficiency Paradoxically Exacerbates Hepatic Steatosis Induced by Fructose. PLoS One 2013; 8: 1–11.
- [28] Ghezzi C, Gorraitz E, Hirayama BA, et al. Fingerprints of hSGLT5 sugar and cation selectivity. Am J Physiol – Cell Physiol 2014; 306: 864–870.
- [29] Sasseville LJ, Longpré J‑P, Wallendorff B, Lapointe J‑Y. The transport mechanism of the human sodium/myo‑inositol transporter 2 (SMIT2/SGLT6), a member of the LeuT structural family. Am J Physiol – Cell Physiol 2014; 307: C431–C441.
- [30] Matharu K, Chana K, Ferro CJ, Jones AM. Polypharmacology of clinical sodium glucose co‑transport protein 2 inhibitors and relationship to suspected adverse drug reactions. Pharmacol Res Perspect 2021; 9: e00867.