Kostní toxicita tenofoviru
Souhrn:
Murínová I. Kostní toxicita tenofoviru. Remedia 2019; 29: 196–200.
Role antiretrovirotik, ale i samotného viru lidského imunodeficitu (human immunodeficiency virus, HIV) při vzniku kostních toxicit je aktuálně pravidelně diskutovaným tématem na odborných fórech věnovaných problematice HIV/AIDS. Tenofovir disoproxil fumarát (TDF) patří mezi základní léčiva používaná v antiretrovirových režimech v léčbě infekce HIV. K jeho nejznámějšímu a nejčastěji se vyskytujícímu nežádoucímu účinku (NÚ) patří nefrotoxicita. Díky efektivní antiretrovirové medikaci se dnes infekce HIV řadí mezi chronická onemocnění. Klinici jsou tak ve své praxi nově postaveni před nutnost řešení projevů NÚ antiretrovirotik, které pro ně dříve nemusely být tolik v popředí zájmu. Sdělení předkládá popis mechanismu kostní toxicity TDF, návrh jeho monitoringu a managementu. V textu jsou dále komplexně diskutována úskalí identifikace kostní toxicity u lidí žijících s infekcí HIV.
Summary:
Murinova I. Tenofovir bone toxicity. Remedia 2019; 29: 196–200.
The role of antiretrovirals, as well as the human immunodeficiency virus (HIV) itself, on the occurrence of bone toxicity, is the currently regularly debated subject of HIV/AIDS expert forums. Tenofovir disoproxil fumarate (TDF) is one of the primary drugs used in antiretroviral regimens in the treatment of HIV infection. Its most well‑known and most common adverse side effect includes nephrotoxicity. Thanks to effective antiretroviral medication, HIV is now considered a chronic disease. In their practice, the clinicians now need to manage the side effects of antiretroviral drugs which has not been a priority in the past. The report presents a description of the TDF bone toxicity mechanism and a proposal for its monitoring and management. In the text, the pitfalls of bone toxicity identification in people living with HIV infection are further discussed.
Key words: tenofovir disoproxil fumarate, HIV, bone toxicity.
Úvod
Tenofovir disoproxil fumarát (TDF) je jedním ze základních léčiv používaných v antiretrovirových režimech v léčbě infekce HIV (human immunodeficiency virus). Patří mezi nukleotidové inhibitory reverzní transkriptázy (NtRTI). Reverzní transkriptáza (RT) je intracelulární enzym, jehož inhibicí dochází k zastavení replikačního cyklu HIV v hostitelské buňce.
Podávání TDF je z hlediska výskytu nežádoucích účinků (NÚ) spojováno hlavně s nefrotoxicitou. V posledních letech, kdy se dobře léčení a k antiretrovirové medikaci vysoce adherovaní lidé žijící s infekcí HIV, tj. pacienti rozumějící svému onemocnění a pravidelně užívající svoji medikaci, dožívají stejné délky života jako většinová populace žijící bez infekce HIV, však vystupuje do popředí mezi lékové problémy spojené s užíváním TDF i jeho negativní vliv na kost.
Tenofovir disoproxil fumarát a jemu podobná látka tenofovir alafenamid fumarát (TAF) jsou proléčiva tenofoviru (TFV). Jeho farmakologicky aktivní metabolit (tenofovir difosfát) je vlastní účinná látka a právě on je silným inhibitorem RT. Sám o sobě nebyl TFV nikdy použit jako perorální léčivo. Při fyziologickém pH je jeho biologická dostupnost a membránová permeabilita velmi nízká [1]. Nevstřebává se z gastrointestinálního traktu, a tak jeho plazmatická koncentrace po per os podání nedosahuje terapeuticky účinných hladin. Proto se klinicky používají estery jeho molekuly (TDF či TAF). Za potenciální nežádoucí výskyt nefrotoxicity či kostní toxicity při užívání jeho proléčiv (hlavně TDF) však může právě samotný TFV.
Mechanismus kostní toxicity TDF
Tenofovir disoproxil fumarát představuje nejznámější NtRTI, mezi nežádoucími účinky byly popsány bolesti kostí, zlomeniny kostí, snížená kostní mineralizace, osteomalacie a hypofosfatemie. Literatura uvádí, že ztráta kostní hmoty je u TDF o 1–3 % vyšší než u ostatních nukleosidových (NRTI) či nukleotidových inhibitorů RT [2,3]. Studie byly prováděny po dobu 48–96 týdnů.
Dokonce ve studii u zdravých HIV neinfikovaných mužů a žen užívajících TDF v rámci preexpoziční profylaxe byla pozorována reverzibilní kostní ztráta spojená s TDF [4]. Řada studií doložila reverzibilitu kostní toxicity po ukončení léčby TDF [5−7].
Ačkoliv existují důkazy in vitro, že TDF přímo ovlivňuje expresi genu osteoblastů a osteoklastů, předpokládaným mechanismem úbytku kostní hmoty souvisejícího s TDF je ztráta fosfátů způsobená proximální renální tubulární dysfunkcí [2]. Kostní toxicita TDF se tedy může vyskytnout souběžně s jeho negativním vlivem na ledviny.
Tubulární toxicita TDF
Příčinou tubulární toxicity TDF je
jeho mitochondriální toxicita. Na zvířecích modelech bylo
ukázáno, že vzroste li plazmatická koncentrace TFV nebo
je li inhibována jeho apikální sekrece v epiteliálních
buňkách proximálního tubulu, dochází k růstu
intracelulární koncentrace TFV. Výsledkem je inhibice
mitochondriální DNA polymerázy γ, což má za následek
insuficientní syntézu mitochondriální DNA, a dále sníženou
syntézu proteinů dýchacího řetězce a vznik morfologických
abnormalit mitochondrií (zvětšení, ztráta krist) [8], obr.
1. Dysfunkce dýchacího řetězce vede k nedostatečné
produkci adenosintrifosfátu, a v důsledku toho pak
tubulární buňky nemohou řádně zajistit reabsorpci iontů
a malých molekul, jako je draslík, glukóza, fosfát, kyselina
močová, aminokyseliny a β2 mikroglobulin.
Důsledkem je, že tyto molekuly jsou vylučovány v abnormálních
množstvích do moči, což definuje Fanconiho syndrom. Některé
proteiny respiračního řetězce se uvolňují do cytoplazmy,
což může indukovat apoptózu buňky. Výsledkem je pak akutní
tubulární nekróza.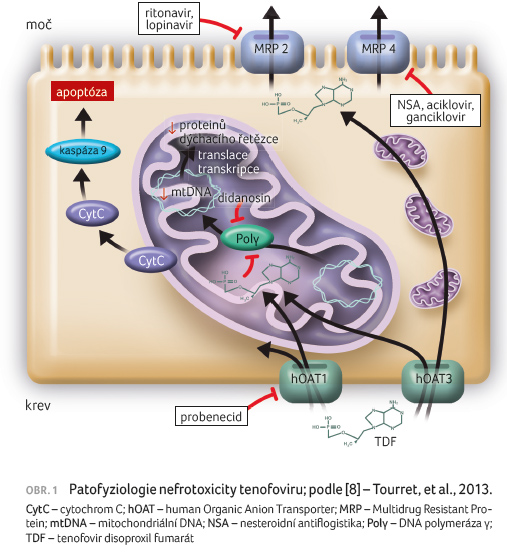
Intracelulární koncentrace TFV může být modifikována i léky, které specificky inhibují transportéry 2, 4 a pravděpodobně i 3 proteinu Multidrug Resistant Protein (MRP). Tyto transportéry zajišťují výstup TFV z nitra buňky do moči (obr. 1). Vylučování TFV do lumen ledvinného tubulu MRP2 je částečně inhibováno ritonavirem a lopinavirem [9]. Nesteroidní antiflogistika, aciklovir či ganciklovir mohou inhibovat MRP4. To může vést ke snížení clearance TFV a k jeho cytoplazmatické akumulaci v epiteliálních tubulárních buňkách. Současné podávání didanosinu také indukuje mitochondriální toxicitu, která by mohla zhoršit poškození mitochondrií indukované TFV [10]. Didanosin je též inhibitorem mitochondriální DNA polymerázy γ, dnes se již v ekonomicky vyspělých zemích jedincům žijícím s infekcí HIV nepodává.
Příčinou tubulární toxicity TFV mohou být i genetické odchylky. Dvě studie ukázaly, že polymorfismy v genu pro MRP2 byly spojeny s 5–6krát vyšším rizikem tubulární toxicity [11,12]. Současně se předpokládá, že polymorfismy v genu pro MRP4 by také mohly regulovat intracelulární koncentraci TFV.
Vzniklá hyperfosfaturie tak může vést ke snížení denzity kostního minerálu (bone mineral density, BMD), k osteomalacii, a to dokonce i při zachované glomerulární funkci [2]. Hypofosfatemie může mít dvojí původ. Jednak ve snížené proximální reabsorpci fosfátu v důsledku nefrotoxicity TDF, ale i ve snížené aktivaci vitaminu D. Poškození tubulární funkce ledvin indukované TFV vede ke snížení 1 α hydroxylace vitaminu D a ke snížení tubulární reabsorpce proteinů vázajících vitamin D [13]. U pacientů s deficitem vitaminu D byla popsána sekundární hyperparatyreóza indukovaná TDF [14−16].
Monitoring kostní toxicity TDF
Doporučený postup péče o dospělé infikované HIV a postexpoziční profylaxe infekce HIV Společnosti infekčního lékařství České lékařské společnosti Jana Evangelisty Purkyně z roku 2016 se konkrétně ke kostnímu screeningu při podávání TDF nevyjadřuje. Obecně doporučuje jedenkrát ročně monitoring Ca2+, PO43 , 25 hydroxyvitaminu D a parathormonu při dlouhodobém užívání antiretrovirové terapie (ART), při léčbě nefrotoxickými léky a při přítomnosti rizikových faktorů osteoporózy (postmenopauzální ženy, astenický habitus, hypogonadismus, užívání kortikoidů, zlomenina krčku femuru či nízkotraumatická zlomenina v anamnéze, kouření, konzumace alkoholu) [17].
Guidelines European AIDS Clinical Society (EASC) pracují při kostním screeningu pacientů žijících s infekcí HIV s vyhodnocováním klasických rizikových faktorů pro rozvoj osteoporózy – starší věk, ženské pohlaví, hypogonadismus, rodinná anamnéza zlomeniny kyčle, nízký BMI (≤ 19), deficit vitaminu D, kouření, fyzická inaktivita, anamnéza nízkotraumatické zlomeniny, užívání alkoholu (> 3 jednotky/den), užívání kortikoidů (minimálně 5 mg prednisonu denně déle než 3 měsíce nebo ekvivalentní dávky jiných steroidů) – a doporučují odhadnout riziko vzniku fraktury pomocí metody FRAX (Fracture Risk Assessment Tool) [18].
Kostní denzitometrie (DEXA/DXA screening) by podle EASC guidelines měla být zvážena u každé osoby splňující jedno nebo více kritérií uvedených dále [18]; výhodně před zahájením ART:
- Postmenopauzální ženy
- Muži ≥ 50 let
- Pacienti ve věku 40−50 let s vysokým rizikem zlomenin (> 20% 10leté riziko zlomeniny založené na hodnocení FRAX bez DXA)
- Anamnéza fraktury nízkého dopadu
- Vysoké riziko pádu
- Klinický hypogonadismus (symptomatický)
- Perorální podávání glukokortikoidů (minimálně 5 mg prednisonu denně po dobu delší než 3 měsíce či ekvivalentu)
S ohledem na předpokládaný mechanismus kostní toxicity TDF (tj. ztráta fosfátů způsobená jeho mitochondriální toxicitou v tubulech ledvin) stojí za zvážení, zda u pacientů žijících s infekcí HIV užívajících toto léčivo nevyšetřovat vstupně a dále v pravidelných intervalech během léčby právě sérovou koncentraci fosfátů a další ukazatele homeostázy fosfátů (např. clearance fosfátů).
Management kostní toxicity TDF
Kostní toxicitu TDF lze minimalizovat několika způsoby.
Volba léčby
Za prvé, pokud je to možné, vyvarovat se ART s TDF; zvláště u pacientů s kostním onemocněním, s významnými rizikovými faktory pro rozvoj osteoporózy, v případě dynamiky změn v kostních biomarkerech apod. Z NRTI/NtRTI tak volit abakavir (ABC), emtricitabin (FTC), lamivudin (3TC) či novější ester tenofoviru (tenofovir alafenamid fumarát, TAF). Vhodně společně v kombinaci s inhibitory integrázy (INSTI). Vyvarovat se i podávání TDF s inhibitory proteázy (PI), obr. 2.
Tenofovir alafenamid fumarát zatím
neprokázal stejné negativní účinky na kost jako TDF [18].
Antiretrovirová terapie s TAF má menší vliv na BMD
ve srovnání s obdobnými režimy s TDF [7,19].
Přechod z TDF na TAF vedl ve studiích ke zlepšení
BMD [20]. Změna na TAF a také použití INSTI v kombinaci
ART měly obdobný výsledek [2,20]. Z odlišného metabolismu TAF
a TDF v lidském organismu, tj. z důvodu konverze TAF
na TFV až v cílové buňce, a ne v plazmě, se
odvozuje jeho „pozitivní“ vliv na kost [1]. Tenofovir
alafenamid fumarát patří mezi nové molekuly v léčbě
infekce HIV a na jasné závěry je vhodné ještě počkat.
Je zapotřebí provést dlouhodobější studie s pozorováním
chronického vlivu TAF na kost.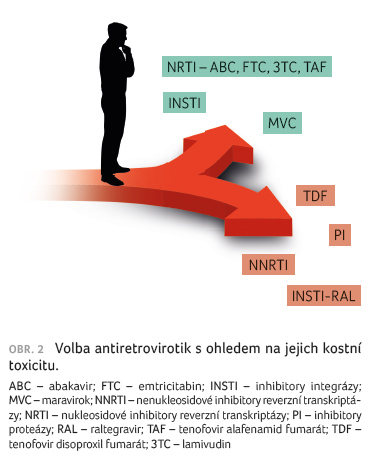
Pozitivní výsledky v oblasti vlivu na kost přinesly i závěry práce s jiným antiretrovirotikem – maravirokem (MVC). Ve studii A5303 bylo zjištěno, že MVC byl spojen s menším úbytkem kostní hmoty bederní páteře než TDF, což naznačuje, že MVC může být alternativou ART ke snížení kostní ztráty [21]. Aktuálně však MVC není rutinně používaným léčivem v ART.
Guidelines EASC doporučují zvážit náhradu TDF netenofovirovým léčivem nebo TAF, pokud je u pacienta diagnostikována osteoporóza či progresivní osteopenie, v anamnéze pacienta je záznam o nízkotraumatické zlomenině, FRAX skóre pro hlavní osteoporotickou zlomeninu je vyšší než 10 % anebo při společném použití PI/potencovaného ritonavirem (r) v ART [18].
Doporučené postupy Společnosti infekčního lékařství pro léčbu pacientů s osteoporózou uvádějí, že namísto TDF je vhodnější podávat z NRTI kombinaci ABC/3TC (pokud je HLA B*5701 negativní) nebo ABC/3TC + (efavirenz, EFV nebo atazanavir/potencovaný ritonavirem, ATV/r), pokud je RNA HIV 1 < 100 000 kopií/ml [17]. Nicméně zmíněné doporučené postupy ještě nereflektují nástup TAF na český trh, k němuž došlo na přelomu let 2016/2017.
Prevence kostní ztráty
Druhým přístupem je preventivní podávání některých léčiv s cílem oslabit ztrátu kostní hmoty. Nová data ukazují, že ztráta BMD po zahájení ART může být zmírněna profylaxí buď dlouhodobě působícími bisfosfonáty, nebo doplněním vitaminu D a vápníku [2].
Studie se suplementací vitaminu D3 (4 000 IU denně) a vápníku (1 000 mg denně jako kalcium karbonát) při zahájení léčby EFV/FTC/TDF ukázala zmírnění ztráty BMD přibližně o 50 % po 48 týdnech [22]. (Pozn.: Bezpečnost dlouhodobé suplementace 4 000 IU vitaminu D denně není prokázána a rozhodně vyžaduje monitorování kalciurie.)
Údaje o odpovídajícím dávkování a délce podávání vitaminu D chybějí a vyžadují další klinická hodnocení. Běžná denní suplementační dávka vitaminu D je u starší populace zhruba 800 IU. Guidelines EASC nabízejí rozpětí denní suplementace vitaminu D 800–2 000 IU [18]. Monitoring sérové koncentrace 25 hydroxyvitaminu D je doporučován po třech měsících. Podrobnější studie s podáváním vápníku (kolik a jak) u této kohorty pacientů též zatím chybí.
Užívání bisfosfonátů jako prevence rozvoje osteoporózy u léčených pacientů žijících s infekcí HIV je rovněž předmětem výzkumu. Ofotokun a kol. ve své práci podávali pacientům jednu infuzi kyseliny zoledronové (5 mg), která zabránila ztrátě kostní hmoty v bederní oblasti páteře, v kyčli a krčku stehenní kosti indukované ART (TDF/FTC + ATV/r) až po dobu 48 týdnů od podání [23]. Hoy a kol. ve své dvouleté studii došli k závěru, že každoroční jednorázové intravenózní podání kyseliny zoledronové (5 mg) pacientům léčeným ART s TDF mělo lepší účinky na BMD než převod pacientů z léčby TDF [24]. Další bádání týkající se použití bisfosfonátů pro prevenci nebo léčbu ztráty kostní hmoty související s HIV jsou tak opodstatněná.
Objevují se i práce, které ukazují na zlepšení stavu skeletu lidí žijících s infekcí HIV při podávání testosteronu [25].
Při diagnostice nízké BMD je potřeba pro správné rozvažování vyloučit i jiné příčiny sekundární osteoporózy.
Úskalí identifikace rizika kostní toxicity TDF
Příčinou negativního vlivu na kost může být nejen užívání TDF. V posledních letech bývá na odborných HIV/AIDS fórech diskutováno spojení kostních abnormalit (jako je nízká BMD, osteomalacie, osteopenie, osteoporóza, osteonekróza, zlomenina a další kostní poruchy) s výskytem samotné infekce HIV a s užíváním ART.
Současné odhady ukazují, že prevalence osteopenie a osteoporózy mezi jedinci žijícími s infekcí HIV se pohybuje v rozmezí 48–55 % a 10–34 %. S ohledem na stárnutí populace žijící s infekcí HIV se navíc očekává zvyšující se trend. Tato vysoká prevalence kostních onemocnění je spojena se zvýšenou mírou kostních zlomenin již v mladému věku populace žijící s infekcí HIV [2].
Byla provedena řada studií, které zvýšené riziko zlomenin u lidí žijících s infekcí HIV dokládají. Například rozsáhlá populační studie provedená Triantem a kol., která zahrnovala 8 525 pacientů infikovaných HIV a 2 208 792 kontrol neinfikovaných HIV, zjistila, že prevalence zlomenin mezi pacienty infikovanými HIV obou pohlaví byla dvakrát až čtyřikrát vyšší než u kontrol neinfikovaných HIV [26].
Přesné mechanismy vzniku kostních abnormalit indukovaných HIV nejsou ještě dobře známy a zdá se, že se jedná o multifaktoriální příčiny. Vliv má jednak přímo samotný HIV, roli hraje změněná imunita hostitele, přítomnost zánětu, přímý či nepřímý vliv ART, hypovitaminóza D, nedostatečný příjem vápníku aj. Navíc u jedinců žijících s infekcí HIV se často vyskytují rizikové faktory, které jsou pro nízkou denzitu kostního minerálu typické, tj. nízký BMI, kouření, příp. dále hypogonadismus, menopauza či užívání kortikosteroidů.
Předpokládá se, že poškození je způsobeno komplexní interakcí T lymfocytů s osteoklasty a osteoblasty, pravděpodobně ovlivněnými jak HIV, tak ART [20]. K dispozici jsou i studie, které naznačují, že HIV a jeho genové produkty hrají důležitou úlohu při interferování s vývojem a zráním kostí.
Další možný mechanismus onemocnění kostí vyvolaných HIV může být způsoben infekcí HIV osteoklastů. Ty jsou odvozeny z monocytů a jsou rezidentními makrofágy v kostní tkáni. Vzhledem k tomu, že osteoklasty jsou důležité pro remodelaci kostí, infekce osteoklastů HIV s největší pravděpodobností přispívá k osteolytické nemoci u pacientů infikovaných HIV [27].
V této oblasti byly provedeny i studie zaměřené na roli proteinů obalu HIV. Obalový protein viru Gp120, který se váže na receptor CD4 a koreceptor CCR5 nebo CXCR5, indukuje apoptózu osteoblastů včetně významně zvýšené regulace prozánětlivých cytokinů (tumor nekrotizujícího faktoru alfa) a pravděpodobně přispívá ke ztrátě kostní hmoty [20]. Dále např. gag P 55, prekurzorový protein pro matrix HIV, snižuje míru osteogeneze v mezenchymálních kmenových buňkách a zdá se tak, že i on má vliv na snižování BMD [20].
Svoji roli při vývoji kosti a snížení hustoty minerálů v kosti může zastávat i infekce HIV buněk kostní dřeně [20]. Kromě výše uvedeného jsou u pacientů infikovaných HIV často navíc laboratorním monitoringem zachyceny odchylky v hodnotách kostních minerálů, které mohou mít mnoho různých příčin.
Vzhledem k poruchám homeostázy fosfátů u lidí žijících s infekcí HIV se v literatuře objevují i zmínky o možné asociaci s tzv. syndromem frailty a rizikem vzniku fraktur [28,29]. Převážná většina ztráty kostní hmoty (o 2–6 %) nastává během prvních dvou let po zahájení ART (začátek již i po dvou týdnech užívání ART [30]) s následnou stabilizací BMD. Rovněž bylo pozorováno, že nižší počáteční počet CD4+ lymfocytů je spojen s vyšším stupněm ztráty BMD po zahájení ART [2,31].
Obecně většina skupin antiretrovirotik má negativní vliv na BMD – NRTI i NtRTI, nenukleosidové inhibitory reverzní transkriptázy (NNRTI), PI, ze skupiny INSTI raltegravir (RAL). Největší kostní ztráty se ukazují při užívání TDF a PI, nejméně u INSTI a TAF [18,20,31]. Mechanismy ztráty kostní hmoty související s PI jsou nejasné; informace ze studií in vitro jsou konfliktní a liší se podle léčiva.
Svoji roli v problematice kostních abnormalit u jedinců žijících s infekcí HIV má samozřejmě i vitamin D. U pacientů infikovaných HIV se velmi často vyskytuje nedostatek vitaminu D [14,32]. Odhady se pohybují v rozmezí 24–87 % v různých kohortách a zeměpisných místech [2].
Antiretrovirová terapie může též vést ke snižování sérové koncentrace 25 hydroxyvitaminu D. Největší pokles byl zaznamenán při podávání NNRTI efavirenzu. In vitro bylo prokázáno, že PI inhibují konverzi 25 hydroxyvitaminu D na aktivní metabolit 1,25 dihydroxyvitamin D [31]. Klinický význam těchto změn v metabolismu vitaminu D je zatím nejasný.
Závěr
To, že negativní vliv na kost má již samotný HIV a většina antiretrovirotik, ukazuje na složitost výsledného posuzování, zda za toxicitou stojí pouze přímý vliv TDF. Přesto se ukazuje nejen ze studií, že vliv TDF na snížení BMD je oproti ostatním antiretrovirotikům významný, a je proto potřeba na něj v klinické praxi myslet a snažit se ho minimalizovat.
V rámci celkového managementu kostního statusu jedinců žijících s infekcí HIV stojí za zvážení, zda preventivně, ještě před zahájením ART, u všech těchto pacientů nevyšetřovat sérové koncentrace 25 hydroxyvitaminu D, vápníku a fosfátů, během ART sledovat dynamiku jejich změn a v případě potřeby léčebně zasáhnout. Vše i na základě toho, že deficitem vitaminu D v Evropě a ve Spojených státech amerických trpí dle odhadů až 30–50 % populace [33]. Kostní denzitometrii se pak doporučuje provádět v souladu s guidelines EASC zatím jen u rizikových skupin.
Úsilí o nalezení správných řešení pro zastavení rostoucí prevalence osteopenie a osteoporózy v populaci lidí žijících s infekcí HIV je dnes výzvou pro nejednoho vědce i klinika. Ve výzkumném terénu je zapotřebí provést další studie k vytvoření optimálních šetrných kostních režimů ART. Úkolem (nejen) kliniků je nalézat a navrhovat vhodné intervaly kostního screeningu a preventivních opatření.
Výběr ART je někdy obtížný a eliminovat všechny (i potenciální) NÚ léčby není možné. Přínos ART a včasné zahájení léčby daleko převažuje nad jakýmikoliv riziky budoucích onemocnění kostí.
Seznam použité literatury
- [1] Snopková S, Havlíčková K, Husa P. Tenofovir alafenamid fumarát – nová generace tenofoviru. Klin mikrobiol inf lék 2016; 22: 111−117.
- [2] Moran C, Weitzmann M, Ofotokun I. Bone Loss in HIV Infection. Curr Treat Options Infect Dis 2017; 9: 52−67.
- [3] Stellbrink H, Orkin C, Arribas J, et al. Comparison of changes in bone density and turnover with abacavir‑lamivudine versus tenofovir‑emtricitabine in HIV‑infected adults: 48‑week results from the ASSERT study. Clin Infect Dis 2010; 51: 963−972.
- [4] Mulligan K, Glidden D, Anderson P, et al. Effects of Emtricitabine/Tenofovir on Bone Mineral Density in HIV‑Negative Persons in a Randomized, Double‑Blind, Placebo‑Controlled Trial. Clin Infect Dis 2015; 61: 572−580.
- [5] Glidden D, Mulligan K, McMahan V, et al. Brief Report: Recovery of Bone Mineral Density After Discontinuation of Tenofovir‑Based HIV Pre‑exposure Prophylaxis. J Acquir Immune Defic Syndr 2017; 76: 177−182.
- [6] Negredo E, Domingo P, Pérez‑Álvarez N, et al. Improvement in bone mineral density after switching from tenofovir to abacavir in HIV‑1‑infected patients with low bone mineral density: two‑centre randomized pilot study (OsteoTDF study). J Antimicrob Chemother 2014; 69: 3368−3371.
- [7] Sax P, Wohl D, Yin M, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate, coformulated with elvitegravir, cobicistat, and emtricitabine, for initial treatment of HIV‑1 infection: two randomised, double‑blind, phase 3, non‑inferiority trials. Lancet 2015; 385: 2606−2615.
- [8] Tourret J, Deray G, Isnard‑Bagnis C. Tenofovir Effect on the Kidneys of HIV‑Infected Patients: A Double‑Edged Sword? J Am Soc Nephrol 2013; 24: 1519−1527.
- [9] Cihlar T, Ray A, Laflamme G, et al. Molecular assessment of the potential for renal drug interactions between tenofovir and HIV protease inhibitors. Antivir Ther 2007; 12: 267−272.
- [10] Côté H, Magil A, Harris M, et al. Exploring mitochondrial nephrotoxicity as a potential mechanism of kidney dysfunction among HIV‑infected patients on highly active antiretroviral therapy. Antivir Ther 2006; 11: 79−86.
- [11] Izzedine H, Hulot J, Villard E, et al. Association between ABCC2 gene haplotypes and tenofovir‑induced proximal tubulopathy. J Infect Dis 2006; 194: 1481−1491.
- [12] Rodríguez‑Nóvoa S, Labarga P, Soriano V, et al. Predictors of kidney tubular dysfunction in HIV‑infected patients treated with tenofovir: A pharmacogenetic study. Clin Infect Dis 2009; 48: 108−116.
- [13] Fernandez‑Fernandez B, Montoya‑Ferrer A, Sanz A, et al. Tenofovir nephrotoxicity: 2011 update. Aids Res Treat 2011; 354908.
- [14] Rosenvinge M, Gedela K, Copas A, et al. Tenofovir‑linked hyperparathyroidism is independently associated with the presence of vitamin D deficiency. J Acquir Immune Defic Syndr 2010; 54: 496−499.
- [15] Childs K, Fishman S, Constable C, et al. Short communication: Inadequate vitamin D exacerbates parathyroid hormone elevations in tenofovir users. AIDS Res Hum Retroviruses 2010; 26: 855−859.
- [16] Masia M, Padilla S, Robledano C, et al. Early changes in parathyroid hormone concentrations in HIV‑infected patients initiating antiretroviral therapy with tenofovir. AIDS Res Hum Retroviruses 2012; 28: 242−246.
- [17] Snopková S, Rozsypal H, Aster V, et al. Doporučený postup péče o dospělé infikované HIV a postexpoziční profylaxe infekce HIV. 2016. Dostupné na: http://infekce.cz/DoporART16.htm. [Přístup získán 16. 8. 2017].
- [18] European AIDS Clinical Society Guidelines, Version 9.1. Dostupné na: http://www.eacsociety.org/files/2018_guidelines‑9.1‑english.pdf. [Přístup získán 2. 12. 2018].
- [19] Wang H, Lu X, Yang X, et al. The efficacy and safety of tenofovir alafenamide versus tenofovir disoproxil fumarate in antiretroviral regimens for HIV‑1 therapy: meta‑analysis. Medicine (Baltimore) 2016; 95: e5146.
- [20] Ahmad A, Ahmad S, Ahmad N. HIV Infection and Bone Abnormalities. Open Orthop J 2017; 21: 777−784.
- [21] Taiwo B, Chan E, Fichtenbaum C, et al. AIDS Clinical Trials Group A5303 Study Team Less bone loss with maraviroc‑ versus tenofovir‑containing antiretroviral therapy in the AIDS clinical trials group A5303 study. Clin Infect Dis 2015; 61: 1179−1188.
- [22] Overton E, Chan E, Brown T, et al. Vitamin D and calcium attenuate bone loss with antiretroviral therapy initiation: A randomized trial. Ann Intern Med 2015; 162: 815−824.
- [23] Ofotokun I, Titanji K, Lahiri C, et al. A Single‑dose Zoledronic Acid Infusion Prevents Antiretroviral Therapy‑induced Bone Loss in Treatment‑naive HIV‑infected Patients: A Phase IIb Trial. Clin Infect Dis 2016; 63: 663−671.
- [24] Hoy J, Richardson R, Ebeling P, et al. Zoledronic acid is superior to tenofovir disoproxil fumarate‑switching for low bone mineral density in adults with HIV.AIDS 2018; 32: 1967−1975.
- [25] Grant P, Li X, Jacobson L, et al. Effect of Testosterone Use on Bone Mineral Density in HIV‑Infected Men. AIDS Res Hum Retroviruses 2019; 35: 75−80.
- [26] Triant V, Brown T, Lee H, et al. Fracture prevalence among human immunodeficiency virus (HIV)‑infected versus non‑HIV‑infected patients in a large U.S. healthcare system. J Clin Endocrinol Metab 2008; 93: 3499−3504.
- [27] Gohda J, Ma Y, Huang Y, et al. HIV‑1 replicates in human osteoclasts and enhances their differentiation in vitro. Retrovirology 2015; 12: 7.
- [28] Bregigeon S, Galinier A, Zaegel‑Faucher O, et al. Frailty in HIV infected people: a new risk factor for bone mineral density loss. AIDS 2017; 31: 1573−1577.
- [29] Wang R, Shlipak M, Ix J, et al. Association of Fibroblast Growth Factor‑23 (FGF‑23) With Incident Frailty in HIV‑Infected and HIV‑Uninfected Individuals. J Acquir Immune Defic Syndr 2019; 80: 118−125.
- [30] Casado J. Renal and Bone Toxicity with the Use of Tenofovir: Understanding at the End. AIDS Rev 2016; 18: 59−68.
- [31] Moran C, Weitzmann M, Ofotokun M. The protease inhibitors and HIV‑associated bone loss. Curr Opin HIV AIDS 2016; 11: 333−342.
- [32] Cotter A, Powderly W. Endocrine complications of human immunodeficiency virus infection: hypogonadism, bone disease and tenofovir‑related toxicity. Best Pract Res Clin Endocrinol Metab 2011; 25: 501−515.
- [33] Broulík P, Broulíková K. Vitamin D v praktické medicíně. Interní Med 2013; 15: 256−260.