Nanočástice pro lékové formy
V poslední době lze pozorovat velký rozvoj částicových lékových forem. Některé z nich, např. pelety, mikročástice a lipozomy, našly ve farmakoterapii již své uplatnění. Na jiné, zejména tzv. chytré nanočástice schopné reagovat na různé stimuly, využití teprve čeká. „Chytré“ nano- a mikročástice jsou předmětem zájmu mnoha různých oborů: chemických věd, životního prostředí, biotechnologie, medicíny a farmaceutického průmyslu. Nacházejí uplatnění v grafickém umění, zemědělství, výpočetní technice (elektronický inkoust) apod. Nanotechnologie, související s mikroelektronikou a rozvojem výpočetní techniky, představují významný stupeň ve vývoji vědy a technologií, kde se překrývají objevy v biologii, diagnostice, terapii, mikroelektronice, počítačovém inženýrství a v oblasti vývoje syntetických polymerů. Článek seznamuje s nejdůležitějšími typy farmaceuticky využitelných nanočásticových systémů a s některými jejich pomocnými látkami.
Úvod
V posledních přibližně padesáti letech je možné pozorovat ve farmaceutické technologii přechod od jednotkových lékových forem (tablet, tobolek, injekčních roztoků, mastí) k vývoji násobných forem, např. pelet, mikročástic a nanočástic, a k jejich postupnému zavádění do terapeutické praxe. Důvodem jsou nepochybné přednosti, které částicové lékové formy nabízejí. Z farmakoterapeutického hlediska je to především zmírnění vedlejších nežádoucích účinků jak lokální, tak i systémové povahy, zvýšení účinnosti terapie, řízené uvolňování a účinek léčiv [1, 2]. Mikročástice a nanočástice mohou sloužit jako nosiče pro transport některých obtížně vstřebatelných léčiv (perorálně podaný heparin, inzulin, hormony) do míst pro ně absorpčně přijatelnějších nebo mohou léčivou látku dopravit do cíle jejího terapeutického působení.
Od nanočásticových forem se očekává především účinnější a bezpečnější farmakoterapie nádorových onemocnění, která spočívá v tom, že se léčivo dostane do postižené tkáně nebo orgánu a bude tam efektivněji působit na zhoubné buňky, čímž se výrazně sníží jeho nežádoucí účinky na zdravou tkáň. Je to právě subcelulární velikost těchto lékových mininosičů, která umožňuje transport léčiv do orgánů, tkání, buněk a nemocných částí těla, které zůstávají jiným lékovým formám nedostupné. Jsou určeny pro cílené uvolňování a působení léčiva při perorálním, parenterálním i lokálním podání, pro aplikaci do oka i nosu. Volbou metody přípravy a aktivizací povrchu částic je možné nasměrovat je na různé cíle. Očekává se od nich využití při řízeném transportu cytostatik, specifickém doručení antibiotik a antiparazitik, v perorálních lékových transportních systémech pro inzulin, proteiny, geny, pro vakcíny i při topické aplikaci.
Definice nanočástic, vysvětlení pojmů
Definice nanočástic není jednotná a pojem zahrnuje několik strukturou rozdílných typů částic. Zdá se, že nanočástice nejlépe vystihuje rozmezí definované metrickým systémem, tj. jsou to všechny částice větší než 1 nm a menší než 1000 nm (1 mm); mikročástice se nacházejí pak v rozmezí 1–1000 mm (tab. 1).
Velikost částic se vztahuje k průměru kulatých částic nebo k přibližnému průměru nepravidelných částic. Vzhledem k tomu, že většina postupů vede ke vzniku částic v určitém rozmezí velikostí, měla by se velikost částic chápat vždy jako určitý rozsah velikosti částic [3].
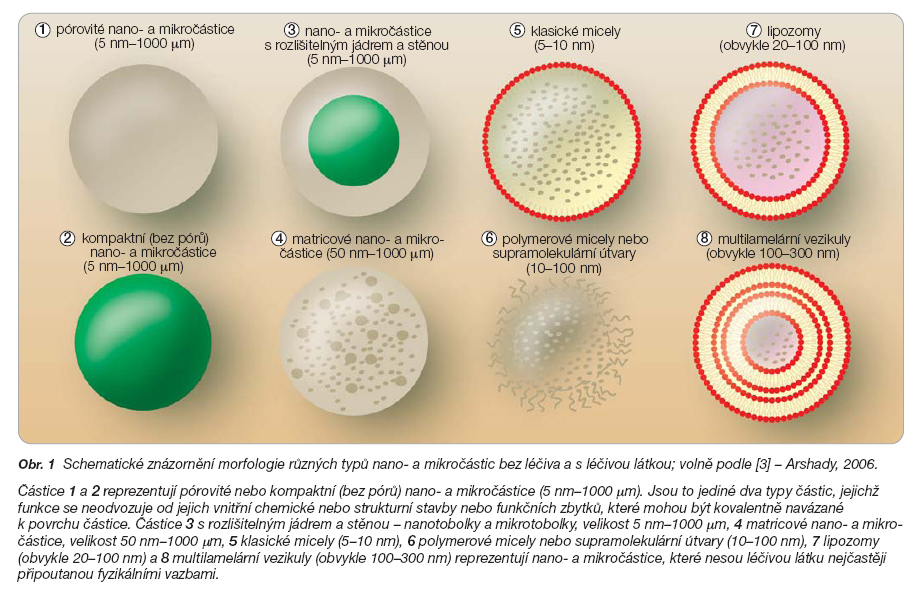
Kromě velikosti se částice liší také svou strukturou a morfologií (obr. 1).
Většina nano- a mikročástic je založena na organických polymerech nebo fosfolipidech, popsány jsou však také prázdné buňky, většinou erytrocyty získané dialýzou [4].
Klasické nanočástice a jejich polymery
Podle stavby se nanočástice dělí na nanosféry a nanotobolky. Nanotobolky se vyznačují zřetelně odděleným jádrem a stěnou, zatímco nanosféry mají spíše matricovou strukturu s léčivem v ní dispergovaným nebo naadsorbovaným na povrch částice [1].
Pro přípravu nanočástic se používají různé postupy, které je možné dělit z několika hledisek, např. podle výsledného produktu, tj. zda vzniknou nanosféry nebo nanotobolky. Většina nanosfér (a také mikrosfér) vzniká polymerizací a polykondenzací, většina nanotobolek (a mikrotobolek) fyzikálně-chemickými procesy z předem připravených polymerů. Vzniklé částice mívají omezenou stabilitu a musí se zesíťovat nebo jinak upravit pro další zacházení. Výběr metody přípravy závisí na aplikaci a na vlastnostech léčiva, které má být do nanočástic zpracováno. Rozhodujícími kritérii při výběru metody přípravy a vhodných pomocných látek jsou biokompatibilita, rozkladné produkty, profil požadovaného uvolňování léčiva a cesta podání léku. Formulace nanočástic tedy vyžaduje počáteční a velmi přesnou definici potřeby a účelu, jimž má sloužit.
Historicky první metody použité k přípravě nanočástic vynalezli odborníci z oblasti chemie polymerů, konkrétně technologie pro vyvíjení latexů. Metody byly založeny na polymerizaci monomerů in situ v různých médiích. Průkopníky v této oblasti byli Birrenbach a Speiser, kteří vytvořili na počátku 70. let první polymerizované nanočástice pro farmaceutické použití. Pro některé nevýhody a omezení těchto postupů byly navrženy alternativní metody založené na dobře popsaných izolovaných nebo přírodních makromolekulách, čímž se rozšířily možnosti formování nanočástic. Nejdůležitější údaje z historického vývoje nanočásticových systémů jsou shrnuty v tab. 2 [5].
Pro přípravu nanočástic se používá řada pomocných látek, jejichž počet díky rychlému vývoji v této oblasti stále stoupá. Vzhledem k tomu, že se používají většinou k parenterální aplikaci, ať už se jedná o implantáty aplikované subkutánně nebo o částice určené pro podání intramuskulární a intravenózní, popř. do oka, nosu, nesmí to být látky toxické a musí být biodegradovatelné. Rozklad v organismu probíhá několika cestami, mezi něž lze zahrnout hydrolýzu nebo enzymatický rozklad. K základním a nejčastěji používaným materiálům patří alifatické polyestery (kyselina polymléčná – polylaktid, polyglykolová – polyglykolid, jejich kopolymery, poly-e-kaprolakton), polyalkylkyanoakryláty, polyhydroxyalkanoáty, želatina a polysacharidy [18].
Alifatické polyestery jsou syntetické, netoxické, biodegradovatelné polymery. Ve vodném prostředí podléhají hydrolýze, esterové vazby se štěpí a uvolňuje se netoxická hydroxykarboxylová kyselina. Metabolizují se případně až na oxid uhličitý a vodu cestou cyklu kyseliny citronové. Rychlost biodegradace a uvolňování léčiva z těchto systémů lze dále ovlivnit změnami fyzikálně-chemických vlastností polymerů, např. krystalinitou, hydrofobními vlastnostmi, stereochemií monomeru, mírou kopolymerizace nebo molekulovou hmotností. Jsou to látky biokompatibilní, vhodné pro parenterální podávání léčiv. V humánní i veterinární praxi jsou nosiči systémů pro implantaci. Poly-e-kaprolakton [18] je biodegradovatelný polymer s velmi pomalou degradací, která je výhodná pro lékové systémy s řízeným uvolňováním léčiva.
Použití polyalkylkyanoakrylátů v nanočásticových lékových formách navrhli v 80. letech minulého století Couvreur a kol. Důvodem byla polymerizace proveditelná ve vodném prostředí, jejich biodegradovatelnost nezbytná pro intravaskulární podání a osvědčené používání jako chirurgický šicí materiál v humánní medicíně, které bylo zárukou jejich nízké toxicity. Byly připraveny polyalkylkyanoakrylátové nanočástice s cytostatiky, antibiotiky, léčivy povahy peptidů a proteinů. Nejvýznamnější výhodou těchto nanočástic je možnost endocytózy a transportu léčivé látky dovnitř buňky [19].
Ze skupiny polyhydroxyalkanoátů je polyhydroxybutyrát nejprostudovanějším polymerem, připravuje se biosyntézou a degraduje se prostřednictvím mikroorganismů v různých prostředích.
Želatina je rozšířenou farmaceutickou pomocnou látkou: používá se pro výrobu želatinových tobolek, jako plnivo a pojivo v tabletách. Pro účely mikroenkapsulace byla vyvinuta upravená arylsulfonylovaná želatina.
Upravené přírodní polysacharidy se běžně používají v biomedicínských, farmaceutických, zemědělských a potravinářských produktech. Živé organismy mohou polysacharidy nejen syntetizovat, ale také degradovat většinou enzymatickou cestou. Největší pozornost je věnována alginátům, které se využívají k opouzdření živých buněk, včetně bakterií, kvasinek, plísní, rostlinných a zvířecích buněk. Protože je příprava alginátových částic snadná a probíhá za velmi mírných podmínek bez použití škodlivých chemických látek, přežívá většina buněk [18].
„Chytré" nanočástice a jejich potenciální použití
Pod pojmem „chytré" nebo „inteligentní" nanočástice [3] se označují částice schopné odpovídat na specifické prostředí nebo stimul. Tyto tzv. spouštěcí mechanismy mohou mít různou povahu, např. fyzikální (teplota, tlak, světlo atd.), fyzikálně-chemickou (bobtnání/smršťování, solvatace/desolvatace), iontovou (elektrolyty, pH, chelatace), molekulovou (receptorovou), enzymatickou (hydrolýza) nebo kombinovanou. Citlivost částic na uvedené podněty je dána vlastní strukturou nebo složením částic, případně připojením funkčních skupin k vlastní částici. Připojené skupiny předávají částici svoje vlastnosti (např. senzitivitu azoskupin na světlo). Odpověď na stimul může ale také přijít od enkapsulovaného materiálu nebo ji vyvolá samotný proces, který částice zprostředkují [4].
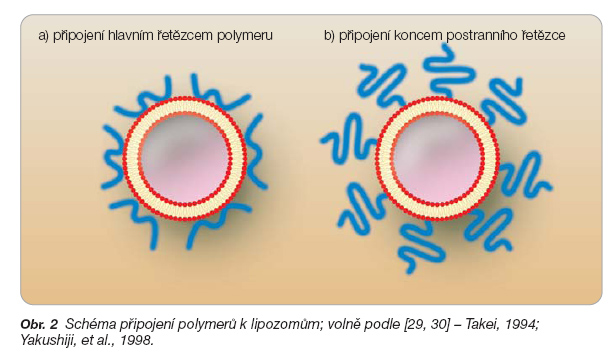
Příkladem „chytrých" částic využitelných ve funkci lékových mininosičů jsou polymerové lipozomy. Lipozomy představil Bangham a kol. v 60. letech minulého století a od té doby našly uplatnění ve farmacii a medicíně, v biologii, v kosmetickém a potravinářském průmyslu [20]. Lipozomy však nabízejí především výhodu nosičů léčiv. Mohou nést hydrofilní léčiva ve svém vnitřním hydrofilním jádře nebo hydrofobní látky ve své lipofilní membráně [2]. Připravují se z přírodních lipidů, jsou tedy biodegradovatelné a biokompatibilní. Jejich fyzikálněchemické vlastnosti je možné měnit složkami použitými v jejich formulaci a jejich velikost lze řídit mezi 25–1000 nm výběrem vhodné metody přípravy. Udělení požadované vlastnosti lipozomům mohou zprostředkovat přírodní i syntetické polymery, které je možné připojit jak k vnějšímu, tak i k vnitřnímu povrchu lipozomové membrány. Odtud pochází i označení polymerové lipozomy. Prvními polymery připojenými k povrchu lipozomů byly pravděpodobně makrogoly (polyethylenglykoly – PEG). Povrchová modifikace lipozomů makrogoly zvýšila dobu jejich cirkulace v krvi díky výrazné hydrofilitě a vysoké flexibilitě makrogolových řetězců a umožnila jejich využití jako nosičů léčiv pro parenterální aplikaci [19, 21]. Polymery je možné připojit k povrchu lipozomů dvěma způsoby: buď hlavní částí polymeru nebo koncem postranních řetězců (obr. 2).
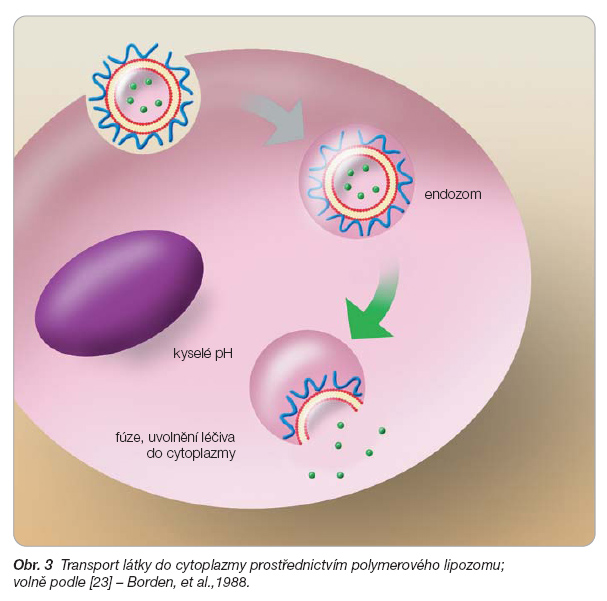
Velmi zajímavé jsou lipozomy citlivé na slabě kyselé pH, při kterém se mohou rozpadat a uvolňovat obsažené léčivo. Takové lipozomy jsou potenciálně využitelné ve farmakoterapii rakoviny, protože intersticiální tekutina některých nádorů u člověka má pH znatelně nižší, než je pH normální tkáně [22]. Některé lipozomy podléhají fúzi, dostávají se přes membránu dovnitř buňky a uvolňují svůj obsah jako odpověď na slabě kyselé pH endozomu. Mohou být tedy užitečné jako transportní systémy pro molekuly, které membránou neprostupují, a zařídit jejich doručení do cytoplazmy (obr. 3). Tuto vlastnost mohou lipozomům udílet polykarboxylové kyseliny [24], poly-N-izopropylakrylamidy [25, 26], sukcinylované polyglycidoly [27, 28].
Lipozomy citlivé na změnu teploty se mohou připravit připojením termosenzitivních polymerů, tj. takových polymerů, které podléhají konformační změně v závislosti na teplotě. Termosenzitivní polymery navázané na povrch lipozomů udílejí lipozomům citlivost na teplotní změny. Polymery navázané na povrch lipozomů konci bočních řetězců (obr. 2b) jsou vhodnější, protože takto navázané polymery mají větší konformační svobodu, změna konformace je výraznější a uvolnění obsahu lipozomů je rychlejší [29, 30].
Na stimul reagující nano- a mikrosféry jsou zajímavými materiály, jejichž fyzikálně-chemické a koloidní vlastnosti se mění při reakci na teplotu, pH, světlo, iontovou sílu, elektromagnetické nebo magnetické pole [31]. Citlivost polymerových částic na teplotu vychází z reverzibilní hydratace a dehydratace jejich nosných polymerů, tj. výrazných změn v bobtnavosti polymeru při určité teplotě. Polymery mají plně hydratované řetězce při teplotách nižších, než je dolní kritická rozpouštěcí teplota, ale při teplotách vyšších, než je tato hranice, se řetězce svinují, interagují mezi sebou navzájem, a vytvářejí tak gel nebo sraženinu. U nano- a mikrotobolek závisí bobtnavost na tloušťce stěny a hustotě zesíťování. První částice založené na poly(N-izopropyl-akrylamidu) byly připraveny již v roce 1986 [32]. Nejčastěji užívanými monomery pro přípravu částic citlivých na pH jsou kyseliny akrylová a methakrylová. Chování částic závisí na vnitřních elektrostatických odpudivých silách. Bobtnání částic je obvykle spojeno s určitým rozpětím hodnot pH. Kationtové částice, např. poly(styren-2-vinylpyridinové), bobtnají při kyselém pH díky protonaci pyridinových skupin, zatímco deprotonace vede k jejich smršťování při zásaditém pH [33]. U amfoterních částic obsahujících jak karboxylové skupiny, tak aminoskupiny je reakce na pH složitější [34]. Byly připraveny tobolky s reverzibilním zavíráním a otevíráním stěny (nepropustné vs. propustné) při různých fyzikálně-chemických podmínkách, např. pH [35], ionty [36], iontová síla [37]. Při otevření pórů je možná výměna molekul (např. léčivých látek) mezi částicí a okolním prostředím.
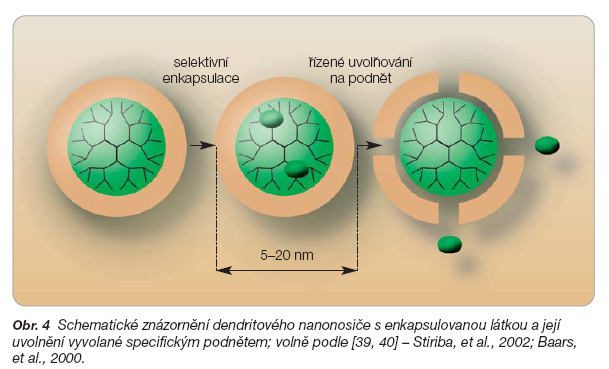
Výjimkou mezi ostatními nanočásticemi jsou dendritové polymery (dendrimery). Mají dobře definovanou trojrozměrnou strukturu s patrným jádrem a stěnou, jsou vysoce funkční a je možné je formovat chemickou syntézou po stupních [38]. Na rozdíl od zesíťovaných aglomerátů a dalších asociátů mají dendrimery jednotnou molekulovou strukturu, kterou lze přesně řídit v rozmezí 5–20 nm. Je možné do nich uzavřít molekuly aktivních látek, které se k nim poutají nekovalentními vazbami (iontovými, vodíkovými, hydrofobními), a mohou tak tvořit vhodný mezičlánek ke kovalentním polymerním konjugátům s léčivy na jedné straně [1] a k fyzikálně uzavřeným léčivům v částicích na straně druhé [39]. Další výhodou, která dělá z dendrimeru velmi flexibilní nosiče, je možnost speciální úpravy dendrimerové molekuly na míru molekuly navázané látky. Experimentálně se připravily dendrimery citlivé na pH (s polypropyleniminy), na světlo (založené na o-nitrobenzyletherové skupině, azobenzenu a dalších fotosenzitivních skupinách), na teplo, ale také na chemické nebo enzymatické změny. Schematické znázornění dendrimeru s navázanou látkou ukazuje obr. 4.
Velkým pokrokem při syntéze dendrimerů bylo použití bohatě větvených polymerů a charakterizování vlastností jejich koncových částí. Po inkorporaci léčiva do dendrimeru se stěna uzavře a otevírá se při reakci na určitý podnět, např. změnu pH [41]. Fotosenzitivita dendrimeru je pravděpodobně založena na změně struktury s dvojnými vazbami vykazující cis-trans izomerii. Tyto dendrimery mohou reagovat na světlo rozkladem (rozštěpením fotolabilních vazeb), fotoizomerizací s konformačními změnami nebo polymerizací za vzniku komplexních dendritových struktur. Dendrimery reagující na světlo konformačními změnami mají jako jediné výhodu vratné přeměny, tj. možnosti „přepínání" dendrimeru z jedné formy do druhé. Vhodnou skupinou pro tento účel je azobenzen, který lze umístit do okrajové části dendrimeru, do jeho jádra nebo do celé struktury. Dendrimery tak mohou reagovat různými změnami struktury a vytvářet potenciál pro různé aplikace využitelné např. ve fotodynamické terapii. Po selektivním doručení fotosenzitivního léčiva a jeho nosiče do nádorové tkáně následuje ozáření, které má za následek vznik reaktivního kyslíku oxidujícího nitrobuněčné organely a smrt buňky. Dendrimery navíc samovolně formují micely o velikosti 50–55 nm, stabilní při fyziologických podmínkách, které disociují při pH ~ 5, tedy při podmínkách nacházejících se často v pevných nádorech (tumorech). Zhang a kol. [42] dosáhli dobrých výsledků s těmito dendrimery u buněk karcinomu plic. Kromě pH a fotosenzitivních dendrimerů byly připraveny také dendrimery reagující na chemickou reakci: na redukci nitroskupiny a její přeměnu na aminoskupinu vedoucí ke spontánní samodestrukci dendrimeru a k uvolnění navázaného paklitaxelu [43, 44].
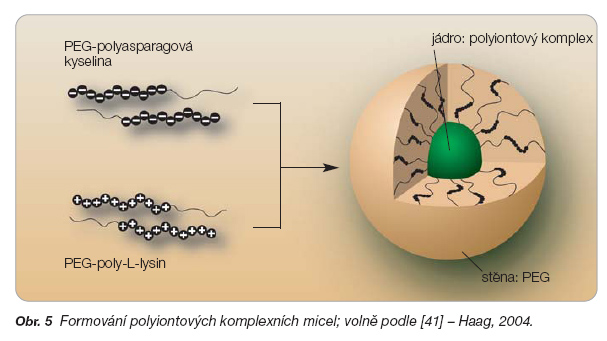
Také polyiontové komplexní micely formované z některých polyelektrolytů a opačně nabitých biologicky aktivních molekul, např. enzymů a oligonukleotidů, mají ve své struktuře rozlišitelné jádro a stěnu. Jejich velikost se pohybuje v rozmezí 20–50 nm, může být i větší. Tyto micely vznikají iontovou asociací, tj. elektrostatickou interakcí mezi dvěma opačně nabitými polyelektrolytovými kopolymery s makrogolovou částí (obr. 5).
Stěna tvořená PEG je hydrofilní, jádro je polyiontové a je vhodným rezervoárem pro umístění různých látek, např. léčiv. Micely lze tvořit smícháním roztoků těchto polymerů, např. PEG-poly-L-lysinu a PEG-polyasparagové kyseliny, v pufru při termodynamicky stálých podmínkách [45]. Nespornou výhodou je konstantní velikost a úzký velikostní rozsah micel srovnatelný s přírodními viry [46]. Vzhledem k tomu, že se micely formují nekovalentními vazbami (mezimolekulovými elektrostatickými interakcemi), jsou citlivé na změnu podmínek, tj. mohou odpovídat na různé podněty, a stávají se tak zajímavými biomateriály. Z terapeutického hlediska jsou zajímavé micely nesoucí oligonukleotidy, které reagují na změnu koncentrace glutathionu. Pro zajištění lepší stability jsou micely vratně zesíťované disulfidovými vazbami. Jejich funkce je založena na skutečnosti, že koncentrace glutathionu je vyšší v buňce než v krvi, a na poznatku, že disulfidové vazby jsou stabilnější v krvi a labilní v intracelulárním prostředí. Micely s inkorporovanými enzymy odpovídající na změnu koncentrace soli mění stabilitu a funkčnost enzymů a jsou využitelné pro biotechnologické a medicínské účely [47].
Závěr
Některé nanočástice, např. lipozomy, se již používají v klinické praxi, mnohé však ještě na své praktické využití čekají; jejich funkce je ověřena pouze v podmínkách in vitro, otázkou zůstává jejich chování in vivo stejně jako jejich toxicita pro živý organismus.
„Chytré" nanočástice jsou novou zajímavou oblastí s mnoha potenciálními aplikacemi v chemii, farmacii a medicíně, včetně řízeného transportu léčiv. Například pH senzitivní dendrimery schopné uvolnit připoutanou látku ve vodném prostředí při změně pH mohou být užitečné při transportu nukleotidů a cytostatik; fotosenzitivní dendrimery zase pro své využití ve fotodynamické terapii. Ostatní uvedené dendrimery jsou převážně ve stadiu raného výzkumu, nabídnou však nepochybně v budoucnu mnoho dalších aplikací.
Snadná příprava je nespornou výhodou polyiontových komplexních micel, které představují velmi různorodou a flexibilní skupinu „chytrých" nanočástic ve smyslu možnosti úpravy složení, velikosti částic, vratnosti procesu tvorby micel a řízeného uvolňování včleněné látky jako reakce na změnu podmínek. Představují potenciál jak pro diagnostické, tak pro terapeutické aplikace genů a léčiv.
Lze očekávat, že nanočástice najdou v terapii chorob své nezastupitelné postavení a částečně vytěsní dosud používané konvenční lékové formy, které s nimi nejsou srovnatelné jak z hlediska farmakokinetiky, tak i z hlediska farmakodynamiky.
Seznam použité literatury
- [1] Rabišková M. Od Galéna k lékovým systémům. Remedia 2006; 16: 427–431.
- [2] Rabišková M. Pelety – moderní léková forma. Remedia 2006; 16: 605–608.
- [3] Arshady R. Smart nano- and microparticles. London, Kentus Books 2006; 417.
- [4] Manchester M. Virus-based nanoparticles: Novel biomolecular senzore for targeting cancer. 6th Annual Cambridge Healthtech, USA Washington D.C., 2005.
- [5] Mathiowitz E. Encyclopedia of controlled drug delivery. New York, Interscience Publication John Willey & Sons, Inc 2003; 2: 641–662.
- [6] Birrenbach G, Speiser PP. Micelles and their use as adjuvants in immunology. J Pharm Sci 1976; 65: 1763–1766.
- [7] Kreuter J, Speiser PP. New adjuvants on a polymethylmethacrylate base. Infect Immun 1976; 13: 204–210.
- [8] Couvreur P, Roland M, Speiser PP. US Patent, 1982, 4 329 332.
- [9] Al Khouri Fallouh N, Roblot-Treupel L, Fessi H, et al. Development of a new process for the manufacture of polyisobutylcyanoacrylate nanocapsules. Int J Pharm 1986; 28: 125–132.
- [10] Scheffel U, Rhodes BA, Natarajan TK, et al. Albumin microspheres for studies of reticuloendothelial system. J Nucl Med 1972; 13: 498–503.
- [11] Marty JJ, Oppenheim RC, Speiser PP. Nanoparticles – a new colloidal drug delivery system. Pharm Acta Helv 1978; 53: 17–23.
- [12] Widder K, Flouret G, Senyei AE. Magnetic Microspheres: Synthesis of novel parental drug carrier. J Pharm Sci 1979; 68: 79–82.
- [13] Gurny R, Peppas NA, Harrington DD, et al. Development of biodegradable and injectable latices for controlled release of potent drugs. Drug Dev Ind Pharm 1981; 7: 1–25.
- [14] Fessi H, Devissaguet JP, Puisieux F, et al. Fr. Patent 1986, 2 608 988.
- [15] Fessi H, Puisieux F, Devissaguet JP, et al. Nanocapsule formation by interfacial polymer deposition following solvent displacement. Int J Pharm 1989; 55: R1–R4.
- [16] Bindschaedler C, Gurny R, Doelker E. US Patent 1990, 350 968.
- [17] Leroux JC, Allémann E, Doelker E. New approach for the preparation of nanoparticles by an emulsification-diffusion method. Eur J Pharm Biopharm 1995; 41: 14–18.
- [18] Domb AJD, Kost J, Wiseman DM. Handbook of biodegradable polymers. Harwood Academic Publishers, Amsterdam 1997; 3–317.
- [19] Woodle MC, Lasic DD. Sterically stabilized liposomes. Biochim Biophys Acta 1992; 1113: 171–179.
- [20] Bangham AD, Horne RW. Negative staining of phospholipids and their structural modification by surface-active agents as observed in the electron microscope. J Mol Biol 1964; 8: 660–668.
- [21] Lasic DD, Needham D. The „Stealth“ liposome: a prototypical biomaterial. Chem Rev 1995; 95: 2601–2628.
- [22] Yatvin MB, Kreutz W, Horwitz BA, Shinitzky, M. pH-Sensitive liposomes: possible clinical implications. Science 1980; 210: 1253–1255.
- [23] Borden K, Eum K, Langley K, et al. pH-Dependent vesicle-to-micelle transition in an aqueous mixture of dipalmitoylphosphatidylcholine and a hydrophobic polyelectrolyte. Macromolecules 1988; 21: 2649–2651.
- [24] Thomas JL, Devlin BP, Tirrell, DA. Kinetics of membrane micellization by the hydrophobic polyelectrolyte poly(2-ethylacrylic acid). Biochim Biophys Acta 1996; 1278: 73–78.
- [25] Heskins M, Guillet JE. Solution of properties of poly(N-isopropylacrylamide). J Macromol Sci Chem 1968; A2: 1441–1455.
- [26] Schild HG. Poly(N-isopropylacrylamide): experiment, theory and application. Prog Polym Sci 1992; 17: 163–179.
- [27] Kono K, Takagishi T. Fusogenic polymer-modified liposomes for the delivery of genes and charged fluorophores. Methods in Enzymology 2003; 373: 422–432.
- [28] Ahkong QF, Fischer D, Tampion W. et al. Mechanism of cell fusion. Nature 1975; 253: 194–195.
- [29] Takei YG, Aoki T, Sanui K, et al. Dynamic contact angle measurement of temperature-responsive surface properties for poly(N-isopropylacryl-amide) grafted surfaces. Macromolecules 1994; 27: 6163–6166.
- [30] Yakushiji T, Sakai K, Kikuchi A, et al. Graft architectural effects on thermoresponsive wettability changes of poly(N-isopropylacrylamide)-modified surfaces. Langmuir 1998; 14: 4657–4662.
- [31] Ibarz G, Dahne L, Donath E, et al. Smart micro- and nanocontainers for storage, transport and release. Adv Mater 2001; 13: 1324–1327.
- [32] Pelton RH, Chibante P. Preparation of aqueous lattices with N-isopropylacrylamide. Colloids Surfaces 1986; 20: 247–256.
- [33] Loxley A, Vincent B. Equilibrium and kinetic aspects of the pH dependent swelling of poly(2-vinylpyridine-co-styrene) microgels. Colloid Polym Sci 1997; 275: 1108–1114.
- [34] Kashiwabara M, Fujimoto K, Kawaguchi H. Preparation of monodisperse, reactive hydrogel mic rospheres and their amphoterization. Colloid Polym Sci 1995; 273: 339–345.
- [35] Sauer M, Streich D, Meier W. pH sensitive nanocontainers. Adv Mater 2001; 13: 1649–1651.
- [36] Chu LY, Yamaguchi T, Nakao S. A molecular recognition microcapsule for environmental stimuli responsive controlled release. Adv Mater 2002; 14: 386–389.
- [37] Deng YH, Yang WL, Wang CC, et al. A novel approach for preparation of thermo-responsive polymer magnetic microspheres with core-shell structure. Adv Mater 2003; 15: 1729–1732.
- [38] Stiriba SE, Frey H, Haag R. Dendritic polymers in biomedical applications from promise to clinical use in diagnostics and therapy. Angew Chem Int Ed 2002; 41: 1329–1334.
- [39] Stiriba SE, Frey H, Haag R. Dendritische polymere für medizinische Anwendungen: Auf dem Weg zum Einsatz in Diagnostik und Terapie. Angew Chem 2002; 114: 1385–1390.
- [40] Baars MWPL, Meijer EW. Host-guest chemistry of dendritic molecules. Top Curr Chem 2000; 210: 131–138.
- [41] Haag R. Supramolecular drug-delivery systems based on polymeric core-shell architectures. Angew Chem Int Ed 2004; 43: 278–282.
- [42] Zhang GD, Harada A, Nishiyama N, et al. Polyion complex micelles entrapping cationic dendrimer porphyrin: Effective photosensitizer for photodynamic therapy of cancer. J Control Release 2003; 93: 141–150.
- [43] Amir RJ, Pessah N, Shamis M, et al. Self-immolative dendrimers. Angew Chem Int Ed Engl 2003; 42: 4494–4499.
- [44] de Groot FMH, Albrecht C, Koekkoek R, et al. Cascade-release dendrimers liberate all end groups upon a single triggering event in the dendritic core. Angew Chem Internat Edn 2003; 42: 4490–4494.
- [45] Harada A, Kataoka K. Formation of polyion complex micelles in an aqueous milieu from a pair of oppositely charged block copolymers with poly(ethylene glycol) segments. Macromolecules 1995; 28: 5294–5299.
- [46] Harada A, Kataoka K. Polyion complex micelles with core-shell structure: Their physicochemical properties and utilities as functionality materials. Macromolecular Symposia Polymers in Medicine 2001; 172: 1–9.
- [47] Kakizawa Y, Harada A, Kataoka K. Glutathione-sensitive stabilization of block copolymer micelles composed of antisense DNA and thiolated poly(ethylene glycol)-block-poly(L-lysine): A potential carrier for systemic delivery of antisense DNA. Biomacromolecules 2001; 2: 491–497.