Od Galéna k lékovým systémům
Lékové formy mají za sebou dlouhou a bohatou historii, během níž přispívaly k udržení nebo k navrácení zdraví lidí i zvířat. S postupným rozvojem nejrůznějších vědních oborů nabývaly na významu a složitosti. V poslední době se stále častěji setkáváme s pojmem lékový systém, charakterizovaným nejen dávkou, ale především rychlostí, kterou se léčivá látka uvolňuje. Transportní lékový systém (drug delivery system) je navíc zodpovědný za doručení léčiva k požadovanému místu působení v organismu. Článek stručně seznamuje s historií lékových forem a s nejnovějšími trendy v oboru farmaceutická technologie-galenická farmacie.
Nezbytnost úpravy léčiva takovým způsobem, aby je mohl organismus přijmout a využít, vyjádřil již ve 2. století řecký lékař Claudius Galénos (130–201), který žil v maloasijském Pergamonu (obr. 1).
Byl osobním léčitelem římských císařů Marka Aurelia, Commoda, Pertinaxa. Galénos rozvinul anatomické a fyziologické poznatky Hippokratovy a pozvedl léčitelství od řemesla k nauce [1]. Z jeho vědění uloženého do řady knih čerpali byzantští a arabští léčitelé a lékaři a těžilo z nich v 5. až 11. století i rané mnišské léčitelství evropské. Ve své době velmi moderní byly požadavky na kvalitu léčiv, způsoby jejich zpracování, zachování vždy stejného předpisu, postupu a dávek. Jeho spisy obsahovaly i vlastní originální recepty; léky Galénem doporučované se nazývaly galenické; mnohem později také vědní obor, který se zabývá úpravou léčivých látek do vhodných aplikačních – lékových forem, se začal nazývat galenická farmacie (nyní také farmaceutická technologie či technologie léků) [1, 2].
Galén byl neomylnou autoritou až do vystoupení lékaře, alchymisty a filosofa Theophrasta Bombasta de Hohenheim zvaného Paracelsus (1493–1541). Ten svým chemickým pojetím života – tělo je chemická laboratoř a nemoci jsou důsledky poruch chemických pochodů v těle – přispěl k zavedení řady anorganických chemických léčivých látek a přípravků do terapie k nastolení porušené rovnováhy organismu. Galénovo jméno se za Paracelsa objevuje v terminologii, kdy se Materia Medica rozděluje na Medicamenta Galenica a Medicamenta Chymica. Paracelsovo učení se však prosadilo v praxi až během 17. století [2].
Nejstarší aplikační cestou je aplikace perorální. Zprávy o pilulkách, které se připravovaly z tvárné pilulkoviny řezáním, tvarováním a sušením, pocházejí z 2. stol př. Kr. Jsou jednou z nejstarších aplikačních dávkovaných forem. Léčivé roztoky, mazání i masti mají rovněž svou dlouhou historii. Ze starověku známe i oční aplikační formy – kolyria (collyrion), což byly původně tuhé tyčinkovité přípravky, které se vkládaly do tělních dutin a aplikovaly se i na oči. Předpisy arabských lékařů na tyto přípravky se udržely až do 18. století. Jejich častými složkami byly šafrán, opium, sloučeniny olova, mědi, ale také žluč nebo dešťová voda. S galenickými přípravky úzce souvisejí i rozmanité pomůcky používané při jejich přípravě, např. nádoby k drcení drog, pistily, lžičky, nádobky na léky, mlýnky, lisy. Dřevěné licí formy na čípky se používaly již v 15. století. Galenické laboratoře lékáren byly výzkumnými laboratořemi i přípravnami zároveň (obr. 2) [2].
Historie parenterální aplikace léčiv (pozn. parenterální léky jsou určeny k podání injekcí, infuzí nebo implantací do lidského či zvířecího těla) začala objevem krevního oběhu. Anglický lékař W. Harvey publikoval svoje poznatky v práci Exercitatio anatomica de motu cordis et sanguinis in animalibus v roce 1628 a krátce nato vznikla myšlenka intravenózní aplikace léčiv rozpracovaná J. S. Elsholtzem v knize Clysmatica nova z roku 1663. Tehdejší úroveň znalostí však nepřinesla v této oblasti úspěch, intravenózní aplikace upadla v zapomnění a zájem o ni se projevil až mnohem později [3].
Rozvoj přírodních věd, medicíny a strojírenství v 19. století přinesl mnoho nových léčivých látek zejména přírodního původu, používání destilované vody v přípravě aplikačních forem a řadu přístrojů, např. válcový mlýn pro přípravu mastí (1830), tabletovací stroj (1844), strojové pilulkovnice (1858), lis na čípky, kuličky a tyčinky (1884). Vznikaly nové aplikační formy jako želatinové tobolky (1834), škrobové oplatky, pasty a náplasti. Současně s vynálezem injekční stříkačky Ch. G. Pravazem (1853) a ampulky francouzským lékárníkem S. Limousinem (1886) se začala rozvíjet aplikace subkutánní. O její rozšíření se zasloužil A. Woods svou významnou prací New Method of Treating Neuralgia by Direct Application of Opiates to the Painful Points z roku 1885. Obnova intravenózní aplikace založené na vědomostech o krvi, asepsi a sterilizaci se přisuzuje A. S. Landererovi (1881). Ve stejné době se začala uplatňovat i aplikace intramuskulární, doporučená A. Lutonem (1830–1896).
Sterilizaci, bez které se výroba parenterálií neobejde, navrhli slavní bakteriologové. Suché teplo doporučil v roce 1870 Pasteur, proudící vodní páru v roce 1885 Koch [2, 3].
Na počátku 20. století se začala rozvíjet průmyslová výroba léčivých látek i léčivých přípravků. V letech 1934–37 se již více než polovina z celkového množství léků vyráběla průmyslově. Přes nesporná negativa přinesly obě světové války řadu nově vyvinutých léčiv, zejména antibiotik, rozvoj chemie a dalších vědních oborů. Nové léčivé látky se ve vhodných aplikačních formách začaly zavádět do terapie. Také vývoj nových léčivých přípravků se stal v důsledku zpřísněných požadavků na jejich kvalitu od poloviny minulého století složitějším [2]. Rozvíjí se analytická chemie a díky aplikaci moderních citlivých analytických metod a zavádění výpočetní techniky do farmakologie také farmakokinetika. S jejím rozvojem úzce souvisí vývoj nových lékových forem. Roste význam lékové formy – zpracování léčivé látky do léčivého přípravku a zájem o lékové formy s prodlouženým a řízeným uvolňováním a účinkem léčiva. K dosavadním lékovým formám přibyly retardované tablety, mikropelety, aerodisperze (aerosoly, spreje) a pěny, později také transdermální přípravky, z nichž se léčivo vstřebává kůží a dosahuje se jeho dlouhodobé terapeutické koncentrace v krvi [4].
K výhodám lékových forem s prodlouženým uvolňováním léčiva patří snížená frekvence dávkování léku, snížení výkyvů hladiny léčiva v krvi, menší výskyt nežádoucích účinků a s tím související zlepšená compliance pacienta. Rozvoj chemie polymerů významně ovlivnil vývoj nových aplikačních forem, protože nově syntetizované polymerní látky byly schopné řídit liberaci léčiva. Stále častěji se objevuje pojem lékový systém, který je charakterizován nejen dávkou léčiva, ale především konstantní definovanou rychlostí, kterou se léčivá látka uvolňuje po určitou dobu (hodiny, dny, měsíce) [5]. Matricové systémy, v nichž je léčivo stejnoměrně dispergováno v polymeru (obr. 3), založené na nerozpustných či rozpustných polymerních nosičích, se využily nejen pro podání perorální, kde jsou nejpoužívanější, ale také jako implantáty nebo oční inserty. Polymerové membrány byly využitelné pro rezervoárové lékové systémy (obr. 4) založené na řízeném rozpouštění, difuzi nebo osmóze [4]. Na základě nežádoucích účinků některých mastí, jejichž léčiva měla působit pouze lokálně, avšak zjistil se jejich průnik do systémové cirkulace, vznikla myšlenka transdermálního podávání léčiv.
Tato aplikace měla sloužit především pro nová léčiva povahy peptidů a proteinů a pro léčiva, jejichž perorální aplikace je velmi obtížná nebo není prozatím možná. Pro omezení daná vhodnými fyzikálně-chemickými vlastnostmi léčivé látky a její nízkou denní dávkou se používá podání formou transdermálních náplastí pouze přibližně u desítky léčiv. K výhodám transdermálních terapeutických systémů patří nízké vedlejší účinky zejména na gastrointestinální trakt a játra, dávkovací režim (aplikace na 48, 72 hod. i několik dní), snadná aplikace a snadné přerušení terapie, např. když pacient nesnáší přípravek či se vyskytnou nežádoucí účinky [6].
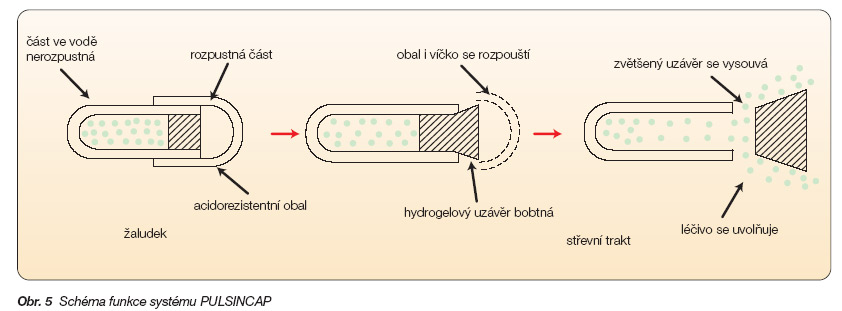
Poznatky o vlivu denních a nočních biorytmů na fyziologické funkce i průběh některých onemocnění publikované řadou odborníků na konci 90. let minulého století (Kleinbloesem 1987, Lambert 1987, Flechter 1989, Niestegge 1989, Mazer 1990) byly další výzvou, která iniciovala změny v technologii léků a podnítila vývoj lékových systémů se zpožděným a pulzním uvolňováním účinné látky [7]. Pro zpožděné uvolňování léčiva byl navržen např. Schererem systém Pulsincap v roce 1991 (obr. 5).
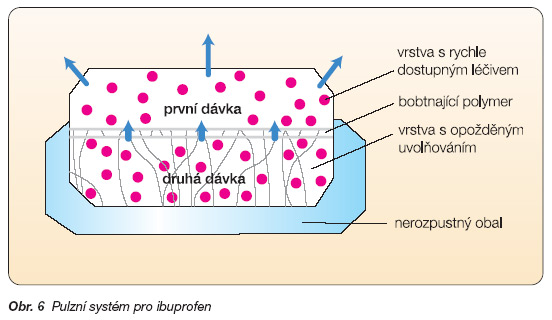
Systém tvoří tobolka s nerozpustným tělem a rozpustným víčkem. Celá tobolka je potažena obalem, který se nerozpouští v kyselém pH žaludku (acidorezistentní, enterosolventní obal). Uvnitř těla tobolky se nachází léčivo v rychle nebo pomalu rozpustné formě, podle požadavků terapie. Tělo je uzavřeno polymerovým uzávěrem. Žaludkem prochází tobolka nezměněna, chrání ji nerozpustný obal. Při změně pH v dvanáctníku se obal rozpouští, rozpouští se i víčko tobolky a uzávěr z hydrofilního polymeru začíná bobtnat, zvětšovat svůj objem a vysouvat se ven z těla tobolky. Po určité době ovlivnitelné vlastnostmi a tloušťkou uzávěru se obsah tobolky uvolní a je k dispozici pro absorpci [8]. Pulzní uvolňování léčiva zabezpečí např. částečně obalená tableta navržená Contem (obr. 6).
Neobalená část tablety uvolní léčivo brzy po aplikaci, druhá dávka se uvolní až po nabobtnání polymerové mezivrstvy. Systém byl navržen pro ibuprofen v roce 1989.
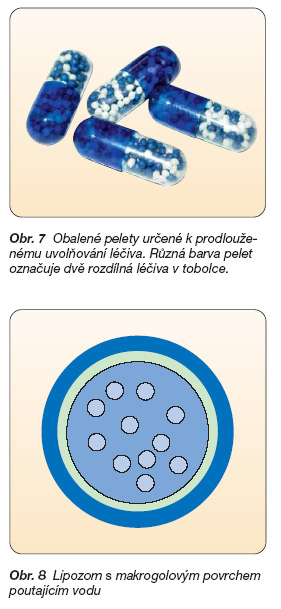
Velký přínos znamenaly částicové lékové formy, tj. lékové formy, které nejsou tvořeny jednou jednotkou, např. tabletou, ale skládají se z mnoha částic, z nichž každá řídí liberaci léčiva. Pelety určené pro perorální podání a uvedené na trh firmou Smith, Kline & French v roce 1952 jako „spansules" jsou sférické částice s obsahem léčiva o velikosti 0,5–2,0 mm (obr. 7). Za posledních padesát let prošly pelety vývojem formulačním i technologickým a získaly své uplatnění v moderní farmakoterapii pro své četné výhody technologické (řešení inkompatibilit u dvou a více léčiv v jedné dávce, možnost kombinací několika léčiv, ideální tvar pro obalování polymerními membránami atp.) i farmakoterapeutické (menší dráždění sliznice GIT, udržení optimální terapeutické koncentrace léčiva po požadovaný časový interval, transport nezávislý na vyprazdňování žaludku, zjednodušený dávkový režim) [9]. Mimo perorální aplikace se mikročásticové systémy začaly objevovat také v lékových formách určených pro podání parenterální, topické i transdermální. K jejich přípravě se používají především biodegradovatelné polymery ve funkci obalů nebo nosičů, které se v organismu pomalu odbourávají, jejich molekulová hmotnost se snižuje za současného pozvolného uvolňování léčiva. Jejich metabolity nejsou pro organismus toxické, jsou jimi např. kyselina mléčná nebo glykolová. Stále patrnější je přitom tendence zmenšování léčivých částic: mikročástice – jednotky až stovky mm, lipozomy – desetiny až jednotky mm, nanočástice – desítky až stovky nm. Velký přínos se od nich očekává při transportu léčiv povahy peptidů a proteinů včetně genových terapeutik. Např. obal mikrotobolky s inzulinem může být tvořen dvěma polymery A a B. Jakmile hladina glukózy v krvi dosáhne určité koncentrace, dojde k její interakci s polymerem B, v obalu mikrotobolky vzniknou póry, jimiž se inzulin uvolní [10].
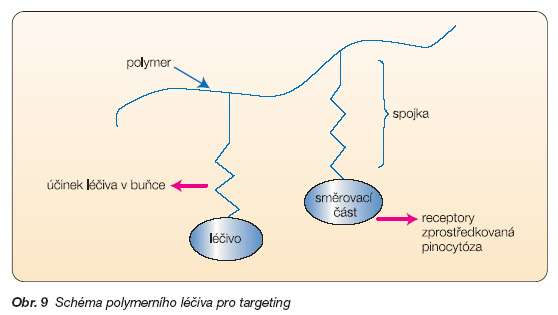
Částicové formy by měly sehrát důležitou roli v účinnější a bezpečnější farmakoterapii nádorových onemocnění, která spočívá v transportu léčiva především do postižené tkáně nebo orgánu a v jeho efektivnějším působení na zhoubné buňky. Sníží se tak výrazně jeho nežádoucí účinky na zdravou tkáň. Je to právě subcelulární velikost těchto lékových mininosičů, která umožňuje transport léčiv do orgánů, tkání, buněk a nemocných částí těla, které zůstávají jiným lékovým formám nedostupné. Volbou metody přípravy a aktivizací povrchu částic je možné nasměrovat je na různé cíle. Úpravou povrchu např. makrogoly, které na sebe vážou vrstvu vody, se částice stávají „neviditelnými" pro opsoniny, nejsou proto pohlcovány jako cizorodé částice makrofágy, což umožní jejich delší cirkulaci v krevním oběhu (obr. 8). Navázáním směrovací jednotky lze tyto částice usměrnit k určitým typům buněk (např. nádorových), kde proběhne receptory zprostředkovaná pinocytóza a uvolněné léčivo účinkuje pouze v zasažené buňce. Určitého úspěchu se dosáhlo s polymerními léčivy, tj. systémy složenými z polymerního nosiče, léčivé látky, která je na něj navázána spojkou, a směrovací části, kterou může být např. monoklonální protilátka (obr. 9).
Systémy mají velikost přibližně 5 nm, některé z nich jsou již v klinickém zkoušení. Očekává se od nich využití při cíleném transportu cytostatik (targeting), specifickém doručení antibiotik a antiparazitik, v perorálních lékových transportních systémech pro inzulin, proteiny, geny, pro vakcíny i při topické aplikaci [11].
Obr. 1 Claudius Galénos (130–201); převzato z [1] – Chalabala, et al., 1991
Obr. 2 Galenická laboratoř v 17. století; převzato z [2] – Broncová, et al., 2003
Obr. 3 Matrice s léčivem
Obr. 4 Rezervoárový systém
Obr. 5 Schéma funkce systému PULSINCAP
Obr. 6 Pulzní systém pro ibuprofen
Obr. 7 Obalené pelety určené k prodlouženému uvolňování léčiva. Různá barva pelet označuje dvě rozdílná léčiva v tobolce.
Obr. 8 Lipozom s makrogolovým povrchem poutajícím vodu
Obr. 9 Schéma polymerního léčiva pro targeting
Seznam použité literatury
- [1] Chalabala M, et al. Encyklopédia farmácie. Martin, Osveta, 1991.
- [2] Broncová D, et al. Historie farmacie v Českých zemích. Praha, Milpo Media, 2003.
- [3] Chalabala M, et al. Technologie léků. Praha, Galén, 2001.
- [4] Rabišková M. Vliv perorálních lékových forem na uvolňování a účinek léčiva. Scripta medica 1996; 67: 313–318.
- [5] Chalabala M, Rabišková M. Technologie lékových systémů, vztah k terapii a potřebám trhu, Scripta medica 1996; 70: 16–18.
- [6] Rathbone MJ, Hadgraft J, Roberts MS. Modified-Release Drug Delivery Technology. New York, Marcel Dekker, 2003.
- [7] Gurny R, Junginger H, Peppas NA. Pulsatile Drug Delivery. Stuttgart, Wissenschaftliche Verlaggesellschaft, 1993.
- [8] Rabišková M. Částicové lékové formy. Praktické lékárenství 2005; 1: 32–34.
- [9] Rabišková M. Pelety, základ perorálních lékových forem pro řízené uvolňování léčiva. Čes Slov Farm 1998; 47: 199–205.
- [10] Mathiowitz E. Encyclopedia of Controlled Drug Delivery. New York, John Wiley & Sons 1999; 493–742.
- [11] Hillery AM, LLoyd AW, Swarbrick J. Drug Delivery and Targeting, Taylor & Francis, London 2001.