Perorální matricové tablety s řízeným uvolňováním léčiva
Rozvoj farmakokinetiky a biofarmacie v 2. polovině minulého století byl podnětem k vývoji nových lékových forem. Perorální způsob podání léku je nejužívanější, proto se věnovala velká pozornost nejprve novým perorálním lékovým formám. Zpočátku byl zájem především o prodloužené uvolňování léčiva a jeho prodloužený účinek. Později, na základě poznatků chronofarmakologie o denních a nočních biorytmech, byly navrženy systémy se zpožděným účinkem léčiva. Matricové tablety složené z nosné pomocné látky s dispergovaným léčivem jsou nejjednodušším návrhem lékové formy s řízeným uvolňováním léčiva. Neobalené nebo s vhodným obalem umožňují účinek prodloužený, zpožděný i pulzní. Nové přípravky na nich založené, podložené znalostmi současné farmaceutické technologie, biofarmacie a farmakokinetiky přispívají k účinné a racionální farmakoterapii.
Úvod
Vývoj nových lékových forem úzce souvisí se vznikem farmakokinetiky, která se rozvíjela na základě moderních citlivých analytických metod a výpočetní techniky, a biofarmacie, která spojuje fyzikální a chemické vlastnosti léku s biologickými potřebami organismu. Oba vědní obory se zdokonalily a rozvinuly zejména v poslední třetině minulého století. Od té doby roste význam lékové formy, tedy význam technologie zpracování léčivé látky do léčivého přípravku, a zájem o lékové formy s prodlouženým a řízeným uvolňováním a účinkem léčiva, k jejichž výhodám patří snížená frekvence dávkování léku, redukce výkyvů plazmatické hladiny léčiva, nižší výskyt nežádoucích účinků a s tím související zlepšení compliance pacienta.
Vzhledem k tomu, že perorální aplikace představuje nejčastější cestu podání, byla věnována velká pozornost nejprve perorálním lékovým formám s řízeným uvolňováním léčivé látky. Řízené uvolňování léčiva může probíhat kontinuálně (prodloužené uvolňování) nebo diskontinuálně (zpožděné, pulzní uvolňování) podle potřeb organismu a léčby daného onemocnění.
Matricové tablety
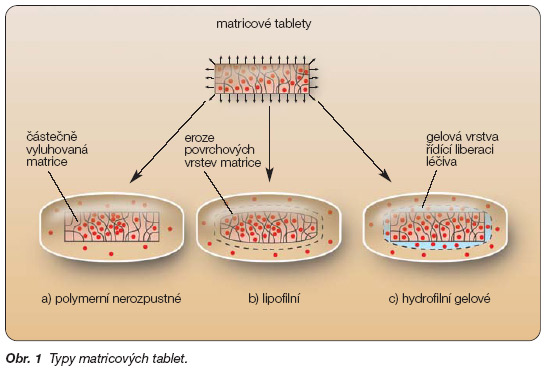
Matricové tablety jsou jednoduché lékové formy, které, na rozdíl od násobných forem, neobsahují částice. Tableta funguje jako jeden celek (systém) a její vlastnosti závisí především na vlastnostech nosné pomocné látky a vlastnostech léčivé látky, které mohou být do jisté míry upraveny dalšími vhodnými aditivy tak, aby přípravek splňoval požadované farmakologické vlastnosti a stabilitu. Podle charakteru nosiče (vehikula) se rozlišují polymerní nerozpustné, lipofilní, hydrofilní gelové, popř. směsné matricové tablety.
Polymerní nerozpustné matrice byly poprvé představeny v roce 1960 a od té doby se dočkaly širokého uplatnění v klinické praxi. Jsou tvořeny léčivou látkou dispergovanou v nerozpustných polymerech, např. polyakrylátech, ethylcelulose, polyvinylchloridu, polyethylenu, polystyrenu nebo některých kopolymerech. Vyrábějí se jednoduchými technologiemi přímého lisování prášků nebo lisování zrněných prášků (granulátů). Často obsahují i jiné pomocné látky. Nosný polymer tvoří pevnou pórovitou strukturu – skelet; proto se tento typ matric často označuje jako skeletové tablety. Během expozice v gastrointestinálním traktu (GIT) se tvar tablety nemění, léčivá látka se pomalu rozpouští a difunduje ve formě roztoku z výlisku do okolního prostředí, kde se absorbuje. Léčivo se tedy uvolňuje rychle z povrchu tablety, umožňuje tím dosažení terapeutické koncentrace léčiva v plazmě, poté se v závislosti na dráze, kterou musí roztok léčiva urazit z vnitřní části skeletu, uvolňování zpomaluje tak, aby se vyrovnal koncentrační deficit vzniklý rozkladem a eliminací léčiva (obr. 1a). Protože se léčivá látka uvolňuje po rozpuštění vodou vyplněnými kanálky, ovlivňuje uvolňování léčiva z matrice především její pórovitost. Rychlost uvolňování zvyšuje rostoucí rozpustnost léčiva ve vodě, jeho vyšší koncentrace nebo přidání dalších hydrofilních excipientů. Pomalejšího uvolňování léčiva se dosáhne naopak přidáním hydrofobních látek, které snižují smáčivost matrice a vyplňují některé její póry [1–3].
Léčivé látky mohou být včleněny do lipofilních matric z vosků a tuků technologií sprejového chlazení, termoplastickou granulací nebo přímým lisováním práškové směsi nosiče a léčiva. Základními nosnými látkami jsou mastné kyseliny, mastné alkoholy a jejich estery, např. stearylalkohol, cetylalkohol, glycerolmonostearát, glyceroldibehenát, karnaubský nebo montanglykolový vosk. Léčivá látka se z těchto matric uvolňuje erozí – postupným zmenšováním tablety na základě hydrolýzy a rozpouštění tuků a vosků vlivem působení enzymů a změny pH v GIT (obr. 1b). Povrchová eroze lipofilních matric, a tím i rychlost uvolňování léčiva závisí na vlastnostech a koncentraci nosné pomocné látky a na dalších přidaných excipientech. Ty mohou mít jak hydrofilní, tak lipofilní charakter a dolaďují disoluční profil léčivé látky na požadované optimum. V poslední době se s oblibou používají směsné matricové tablety [1, 4].
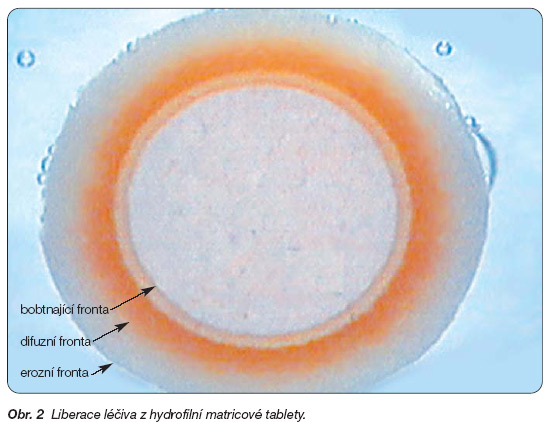
Hydrofilní gelové matrice představil americký patent z roku 1962 [1]. Základem hydrofilních gelových matric jsou bobtnající hydrofilní polymery typu celulosových derivátů (hydroxypropylmethylcelulosa, sodná sůl karboxymethylcelulosy, hydroxypropylcelulosa, hydroxyethylcelulosa, methylcelulosa), karbomerů, povidonu a dalších nosných pomocných látek (kyselina alginová, želatina, přírodní gumy) [5, 6]. Uvolňování léčiva je založeno na odlišném principu než u předchozích typů matric. Hydrofilní matrice jsou dynamické systémy, u kterých při styku s vodným prostředím probíhají procesy zvlhčení, hydratace a rozpouštění polymeru (obr. 1c). Po zvlhčení polymeru se uvolní počáteční dávka rozpuštěného léčiva z povrchu matrice s následným navozením jeho terapeutické koncentrace v krevní plazmě. Současně začne polymer hydratovat a vytvářet gelovou vrstvu na povrchu výlisku. Tvorba gelové bariéry na základě hydratace je prvním základním krokem k dosažení řízeného uvolňování léčiva. Ochranná vrstva gelu umožňuje vodě kontinuálně pronikat do tablety, pomalu, zvolna, bez toho, aby se tableta rozpadla. Rozpouštědlo zvýší pohyblivost polymerních řetězců a jejich rozvolnění umožní vznik nabobtnalého gelu. Původní gelová vrstva se postupně rozpouští, nahrazuje ji vrstva nová, která musí být dostatečně pevná, aby zpomalovala difuzi a dále prodlužovala uvolňování léčiva. Konzistenci povrchového gelu podmiňuje viskozita, koncentrace polymeru a jeho chemická struktura. Uvolňování léčivé látky z těchto systémů se děje v závislosti na rozpustnosti léčiva ve vodném prostředí difuzí (převažuje u léčiv dobře rozpustných), erozí (převažuje u léčiv špatně rozpustných) nebo kombinací obou dějů podle rozpustnosti léčiva a relaxace polymerových řetězců.
Průměr výlisku není konstantní, ale v průběhu liberace léčiva se mění. Zpočátku se průměr tablety zvětšuje nabobtnáním polymeru, hydratace a vznik gelu se posouvají směrem do suchého jádra matrice a velikost tablety se postupně zmenšuje, až výlisek zanikne (obr. 2). Rychlost uvolňování léčiva lze ovlivnit četnými formulačními a procesními faktory, z nichž nejdůležitější jsou rychlost hydratace polymeru, jeho viskozita a koncentrace, rozpustnost léčivé látky a vlastnosti dalších přidaných pomocných látek [7, 8]. Hydrofilní gelové matrice získaly široké uplatnění mezi matricovými systémy zejména pro jednoduchost výroby, malou finanční náročnost technologie a rozumnou cenu pomocných látek. K jejich dalším nesporným výhodám patří možnost použití pro špatně rozpustná léčiva.
Nevýhodou matricových tablet obecně je fakt, že rychlost uvolňování léčiva se postupně snižuje. Je to dáno zmenšujícím se povrchem tablety u hydrofilních, resp. lipofilních matric a prodlužující se vzdáleností difuze roztoku léčiva u polymerních nerozpustných matric. Některé zveřejněné vědecké práce řešily uvedený nedostatek úpravou geometrie tablet nebo použitím speciálních nosičů málo rozpustných v kyselém prostředí (žaludek) a rozpustnějších v neutrálním a zásaditém prostředí (střevní trakt) [2].
Obalené matricové tablety
Matricové tablety bývají často opatřené obalem, který může mít funkci korekční (chuť, barva, vzhled) nebo ochrannou, může napomáhat požadovanému profilu uvolňování léčiva nebo jej může zásadním způsobem měnit.
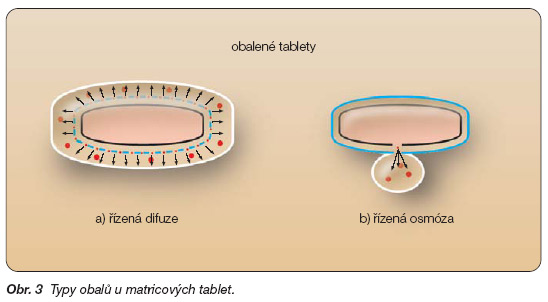
U matricových přípravků s prodlouženým uvolňováním léčiva obal většinou napomáhá funkci matrice a dotváří profil uvolňování léčivé látky z ní. Na základě své funkce se rozlišují obaly permeabilní (propustné) a semipermeabilní (polopropustné). Matricové tablety s permeabilními obaly uvolňují léčivo řízeným rozpouštěním a řízenou difuzí. Léčivá látka ve formě roztoku difunduje obalem nejčastěji póry, které vzniknou ve zvlhčeném obalu po rozpuštění hydrofilních přísad (obr. 3a). Semipermeabilní obaly dovolují trávicím tekutinám vstup do jádra matrice, ale znemožňují výstup roztoku léčivé látky ven. Díky nasycenému roztoku léčiva vzniká uvnitř přípravku vysoký osmotický tlak. Je-li obal opatřen otvorem vytvořeným např. laserovým paprskem, roztok léčiva jím uniká do prostředí s nižším osmotickým tlakem, tedy i do gastrointestinálního traktu. Popsané léčivé přípravky fungují na principu řízené osmózy (obr. 3b). Výhodou je konstantní rychlost liberace léčiva [9].
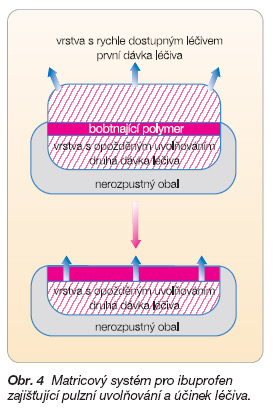
Acidorezistentní obaly nerozpustné v kyselém prostředí chrání matrici před rozpouštěním do doby, než dosáhne střevního traktu. Následkem je zpožděné uvolňování léčiva a jeho zpožděný účinek. Určitého zpoždění v uvolňování léčiva se dosáhne i obalem z některých hydrofilních polymerů. Tyto obaly fungují na principu gelové vrstvy s vysokou viskozitou a zpomalují po určitou časově omezenou dobu uvolňování léčiva podobně jako neobalené hydrofilní matrice. Kombinací hydrogelového a nerozpustného obalu lze dosáhnout pulzního uvolňování a účinku léčiva po perorálním podání. Příkladem může být matricový systém navržený v roce 1989 Contem pro ibuprofen [10]. Systém se skládá ze dvou účinných vrstev oddělených vrstvou hydrofilního polymeru a je částečně obalen (obr. 4). Vrchní vrstva s léčivem zůstává neobalená a zabezpečuje rychlé uvolnění léčivé látky. Spodní vrstva matrice s léčivem i s oddělující mezivrstvou je potažena nerozpustným obalem. Léčivá látka se z dolní vrstvy uvolní až po nabobtnání vrstvy hydrofilního polymeru, tj. s 5–6hodinovým zpožděním po aplikaci.
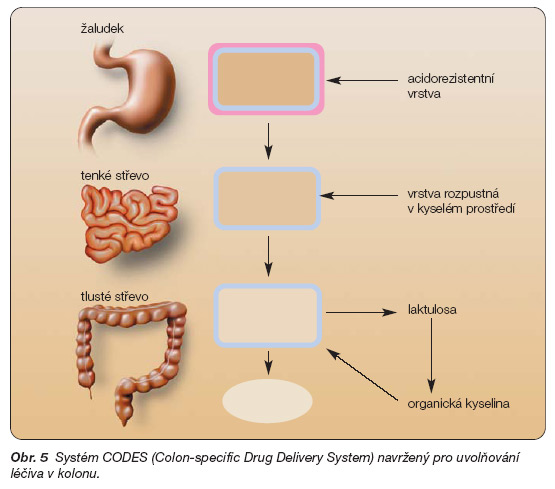
Kombinací vhodné technologie matricové tablety a několika obalů s rozdílnými vlastnostmi je možné dosáhnout i místně specifického uvolňování léčiva v GIT. CODES systém (Colon-specific Drug Delivery System) byl navržen pro uvolňování léčiva v kolonu. Matrice s léčivem a polysacharidy, které jsou degradovatelné střevními bakteriemi (např. laktulosa, mannitol, maltosa aj.), je potažena třemi typy obalů (obr. 5).
Bezprostředně na matrici se nanesl obal rozpustný v kyselém prostředí (polyakrylát Eudragit E). Ten se potáhl izolační vrstvou z hydrofilního polymeru (hydroxypropylmethylcelulosa) a vnější vrstvu tvořil acidorezistentní obal (polyakrylát Eudragit L). Prostřední vrstva zabraňuje interakci mezi opačně nabitými polymery. Obalená matricová tableta prochází nezměněná do střevního traktu, kde se v důsledku změny hodnoty pH rozpouští vnější acidorezistentní obal a postupně i meziobal z hydrofilního polymeru. Do jádra matrice se dostává trávicí tekutina, která rozpouští polysacharid (v systému CODES laktulosu) a ten zvolna proniká obalem do vnějšího prostředí. Po dosažení tlustého střeva se činností bakteriální mikroflóry rozloží a jedním z rozkladných produktů je organická kyselina. Ta mění pH hodnotu prostředí v bezprostřední blízkosti matrice na kyselou stranu, obal se rozpouští a léčivo se uvolňuje z matricové formy [11–13]. Řešení a návrhů lékových forem založených na matricích je celá řada a jsou předmětem patentové ochrany.
Léčivé přípravky
Nerozpustných polymerních matric tvořených akrylátovými polymery využívají AGAPURIN RETARD, AGAPURIN 600 RETARD, FERRONAT RETARD a SPOPHYLLIN RETARD, skelet z ethylcelulosy je základem přípravku DOLMINA 100 SR [14].
AGAPURIN RETARD a AGAPURIN 600 RETARD zabezpečují zpomalené uvolňování pentoxifylinu v dávce 400 mg, resp. 600 mg podávané dvakrát denně při chronických periferních vaskulárních onemocněních, poruchách cerebrovaskulární cirkulace apod. Matricové tablety s vyšším obsahem léčiva jsou navíc obaleny rozpustným polyakrylátovým obalem. Tablety nelze dělit ani kousat, fungují jako jeden systém. Jde o léky osvědčené ve farmakoterapeutické praxi, registrovány byly již v roce 1983, resp. v roce 1990.
Také FERRONAT RETARD poprvé registrovaný v roce 1983 se používá v praxi přes dvacet let. Obal z hydroxypropylmethylcelulosy a zeleného barviva chrání účinnou látku před oxidací, zlepšuje vzhled tablet a usnadňuje jejich polykání. Matrice obsahuje 285,6 mg bezvodého síranu železnatého odpovídajícího 105 mg elementárního železa ve funkci antianemické léčivé látky. Léčivo se po perorálním podání dobře vstřebává, za hodinu se uvolní přibližně 35 %, za 3 hodiny 40–60 % z celkového podaného množství léčiva. Matricová léková forma zabezpečující pomalou liberaci léčiva výrazně snižuje jeho nepříjemné vedlejší účinky gastrointestinální povahy, např. tlak u žaludku, pálení žáhy, nechutenství, nauzeu, zácpu a průjem. Přípravek se zásadně aplikuje celý, nedělený, nerozkousaný.
SPOPHYLLIN RETARD uvolňuje pomalu 100 mg, resp. 250 mg antiastmatika a bronchodilatancia theofylinu. Jeho uvolňování není zpožděné, a proto k zabránění noční nebo ranní dušnosti by se mělo podání večerní dávky posunout na 22.–24. hodinu. Matricové tablety SPOPHYLLIN RETARD jsou jednou z mála výjimek mezi přípravky s řízeným uvolňováním a lze je půlit.
DOLMINA 100 SR obsahuje 100 mg nesteroidního antirevmatika a antiflogistika sodné soli diklofenaku v ethylcelulosové nerozpustné matrici. Obal z hydroxypropylcelulosy koriguje hořkou chuť léčiva. Tableta se aplikuje jednou denně, maximální plazmatická koncentrace je dosažena za 1,5 až 2,5 hod. Krátký plazmatický poločas diklofenaku přibližně 2 hodiny je jedním z důvodů pro lékovou formu s prodlouženým uvolňováním a účinkem. Tableta se podává celá, funguje jako jeden systém. Přípravek je dostupný od roku 2000.
Na lipofilních matricích jsou založené přípravky DIACORDIN 90 RETARD, ENELBIN 100 RETARD, TRALGIT SR 100, 150, 200 a VOLTAREN RETARD [14].
Diklofenak sodný v dávce 100 mg je, podobně jako u přípravku DOLMINA 100 SR, obsažen v přípravku VOLTAREN RETARD. Lipofilní matrice založená na cetylalkoholu je potažena barevným obalem z hydroxypropylmethylcelulosy, sacharosy a dalších aditiv a maskuje nepřijatelnou chuť léčiva. Celistvost matrice zabezpečuje a disoluční profil léčiva optimalizuje hydrofilní povidon. Retardovaná forma léčiva příznivě ovlivňuje nepříjemné příznaky revmatických onemocnění, např. ranní ztuhlost a otoky kloubů. Přípravek nelze dělit, aplikuje se celá tableta. Lék je používán v praxi již 26 let.
V přípravku DIACORDIN 90 RETARD s 90 mg diltiazem-hydrochloridu je nosnou látkou montanglykolový vosk. Lipofilní matricové tablety jsou potaženy rozpustným barevným obalem, dávkují se dvakrát denně a jsou určeny pro terapii anginy pectoris a esenciální hypertenze. Hlavním důvodem je prodloužení účinku léčiva s krátkým biologickým poločasem. Farmakokinetika diltiazem-hydrochloridu má dvoufázový charakter: časný eliminační poločas v délce trvání 20–30 minut, terminální trvající 3,5 hod. a v retardované formě se prodlužuje až na 8 hodin. Účinek po podání matricových tablet nastupuje za 5–7 hodin a trvá 12 i více hodin. Tableta se podává celá, funguje jako jeden systém. Lék je registrován od roku 1989.
Montanglykolový vosk ve funkci nosné matricové látky využívá také ENELBIN 100 RETARD se 100 mg vazodilatační látky naftidrofuryl-hydrogenoxalátu. Plazmatický poločas léčiva je krátký, 40–60 minut, vzhledem k prodloužení liberace léčiva z lékové formy přetrvávají však účinné plazmatické koncentrace nejméně 3–5 hodin po podání. Přípravek se používá u poruch periferního prokrvení a buněčného metabolismu, diabetických angiopatií, Raynaudovy nemoci a syndromu aj. Dávkuje se 2–3krát denně. Matricové tablety jsou potaženy barevným rozpustným obalem z hydroxypropylmethylcelulosy. Přípravek nelze dělit. Lék se prakticky používá již 15 let.
U neobalených matricových tablet TRALGIT SR 100, 150, 200 je základní nosnou látkou glyceroldibehenát. Disoluční profil léčiva z lipofilní matrice optimalizuje nerozpustný hydrogenfosforečnan vápenatý. Tablety mají půlicí rýhu, lze je tedy na rozdíl od většiny ostatních přípravků s řízeným uvolňováním léčiva dělit a obvyklé dávkování dvakrát denně přizpůsobit individuálním potřebám pacienta. Tramadol, léčivá látka ze skupiny analgetik-anodyn, je syntetický opioid, jehož analgetické účinky jsou zprostředkovány agonistickým vlivem na opioidní receptory v centrálním nervovém systému a pravděpodobně také inhibicí uvolňování neurotransmiterů serotoninu a noradrenalinu. Po perorálním podání se vstřebává z více než 90 %. Liberací z lékové formy s prodlouženým účinkem se maximální plazmatické koncentrace dosáhne za 4–5 hodin po podání a plazmatické koncentrace tramadolu dostatečné pro jeho analgetický účinek přetrvávají asi 12 hodin. TRALGIT SR patří k novějším přípravkům ve farmakoterapeutické praxi.
Rychle hydratující typ hydroxypropylmethylcelulosy (HPMC) tvoří základ hydrofilních gelových matric přípravků IBALGIN 800 SR, NEUROL SR 0,5 a XANIDIL RETARD [14].
XANIDIL RETARD je nejstarším z této skupiny přípravků. Obsahuje 500 mg xantinolnikotinátu, látky s vazodilatačními účinky, používané k léčbě funkčních i organických poruch periferního a centrálního prokrvení. Dávkuje se dvakrát až třikrát denně. Léčivo se z hydrofilních tablet uvolňuje postupně v průběhu několika hodin, maximálních hladin v plazmě se dosáhne přibližně za 4 hodiny. Matrici tvoří HPMC dvou stupňů viskozity, požadovaný disoluční profil léčiva dotváří povidon. Přípravek nelze dělit, aplikuje se celá tableta.
IBALGIN 800 SR s 800 mg ibuprofenu se používá v klasických indikacích antiflogistik a antirevmatik. Ibuprofen se z lékové formy uvolňuje pozvolna, v nižších dávkách působí analgeticky, ve vyšších protizánětlivě. Dávkuje se dvakrát denně. Důvodem formulace lékové formy s prodlouženým účinkem je krátký biologický poločas ibuprofenu trvající přibližně 2 hodiny. Hydrofilní matrici tvoří dva typy HPMC s různou viskozitou, doplněné kyselinou stearovou a povidonem pro optimální funkci matrice. Tableta se podává celá, funguje jako jeden systém.
NEUROL SR 0,5 s alprazolamem v dávce 0,5 mg v neobalené hydrofilní gelové matrici se užívá u panických a úzkostných stavů. Alprazolam, benzodiazepinový derivát s výraznějšími účinky anxiolytickými a antipanickými při zachování účinků myorelaxačních, antikonvulzivních a sedativně-hypnotických, se pomalu uvolňuje erozí gelových vrstev matrice. Přestože jeho biologický poločas 12–15 hodin není příliš krátký, jeví se jeho lineární plazmatická koncentrace úměrná podané dávce z hlediska účinku jako velmi výhodná. Optimální dávku je nutno přizpůsobit závažnosti příznaků a individuální odpovědi pacienta na terapii. Přípravek nelze dělit, aplikuje se celá tableta.
Na řízené osmóze jsou založené dále uvedené přípravky OROS (ORální Osmotický Systém) [15]. K terapii hypertenze jsou určeny přípravky ALPRESS LP s prazosinem používaný ve Francii s dávkováním jednou denně, CARDURA XL s doxazosin-mesylátem, jediný registrovaný v České republice, DYNACIRC CR s isradipinem, COVERA-HS s verapamilem a PROCARDIA XL s nifedipinem, oba posledně jmenované přípravky užívané také v terapii anginy pectoris. GLUCOT-ROL XL obsahuje glipizid a používá se ke kontrole hyperglykémie u pacientů s diabetem nezávislým na podávání inzulinu. VOLMAX s albuterolem se podává pacientům s bronchospasmem. CONCERTA s methylfenidát-hydrochloridem se aplikuje hyperaktivním dětem starším šesti let. Volně prodejné jsou přípravky EFIDAC 24 s chlorfeniraminem pro zmírnění alergických projevů a překrvení nosní sliznice a SUDAFET 24 HOUR s pseudoefedrinem, který se podává při nachlazení, sinusitidě a některých respiračních alergiích. Přípravky OROS se nesmějí dělit; vzhledem k tomu, že fungují pouze jako jeden celek, hrozilo by předávkování.
Za nedlouhou dobu, která uplynula od vývoje perorálních matricových systémů k jejich výrobě, klinickému testování a praktickému použití, si tyto lékové formy získaly značnou oblibu v medicínské praxi. Mimo perorální aplikaci se matricové systémy dočkaly také uplatnění v transdermálních terapeutických nebo očních systémech, ve vaginálních aplikačních formách i jako implantáty. Z posledně jmenovaných se velká budoucnost předpovídá zejména biodegradovatelným formám.
Seznam použité literatury
- [1] Lieberman HA, Lachman L, Schwarz JB. Pharmaceutical dosage forms: Tablets. New York and Basel: Marcel Dekker Inc 1990; 3: 238–241.
- [2] Robinson JR, Lee VH. Controlled Drug Delivery New York and Basel: Marcel Dekker Inc 1987: 388–396.
- [3] Banker GS, Rhodes CT. Modern Pharmaceutics New York and Basel: Marcel Dekker Inc 2002: 504–515.
- [4] Rabišková M. Vliv perorálních lékových forem na uvolňování a účinek léčiva. Scripta medica 1996; 67: 313–318.
- [5] Sedláková M, Rabišková M, Spilková J. Přírodní polymery pro formulaci hydrofilních matricových tablet. Čes Slov Farm 2006; 55: 4–11.
- [6] Rabišková M, Vostalová L, Medvecká G, Horáčková D. Hydrofilní gelové matricové tablety pro perorální aplikaci léčiv. Čes Slov Farm 2003; 52: 211–217.
- [7] Vostalová L, Rabišková M, Medvecká G. Uvolňování diltiazemiumchloridu a ibuprofenu z hydrofilních matricových tablet. Čes Slov Farm 2003; 52: 295–298.
- [8] Sedláková M, Rabišková M, Švajdlenka E. Vliv disolučního média na uvolňování diltiazem-hydrochloridu z karbomerových matric. Čes Slov Farm 2006; 55: 65–71.
- [9] Komárek P, Rabišková M. Technologie léků. Praha, Galén 2006.
- [10] Conte U, Colombo P, LaMarna A, et al. Drug Dev Ind Pharm 1989; 15: 2583–2596.
- [11] Janovská L, Vetchý D, Rabišková M. Nové systémy pro targeting léčiv do tlustého střeva. Čes Slov Farm 2006; 55: 203–209.
- [12] Yang L, Chu JS, Fix JA. Colon-specific drug delivery: new approaches and in vitro/in vivo evaluation. Int J Pharm 2002; 235: 1–15.
- [13] Yang L, Watanabe S, Chu JS, et al. Effect of colonic lactulose availability on the timing of drug release onset in vivo from a unique Colon-specific Drug Delivery System (CODESTM). Pharm Res 2003; 20: 429–434.
- [14] http://www.aislp.cz, 24. 1. 2007.
- [15] http://www.alza.com/alza/products, 24.1. 2007.