Takrolimus s prodlouženým uvolňováním
Takrolimus patří do skupiny kalcineurinových inhibitorů. Blokuje translokaci řady transkripčních faktorů, které jsou nutné pro aktivaci T lymfocytů a syntézu interleukinu 2. V současné době patří mezi nejvíce používané imunosupresivní látky. Má poměrně úzké terapeutické rozmezí (doporučené údolní plazmatické koncentrace 5–20 ng/ml) a vzhledem k interindividuálně variabilní biologické dostupnosti a řadě lékových interakcí je nutné jeho hladiny monitorovat. Klasická léková forma takrolimu se podává ve 12hodinových intervalech. Vzhledem k tomu, že pohodlné a jednoduché dávkování přispívá k lepší adherenci k léčbě a ke kvalitě života pacientů, byla vyvinuta léková forma s prodlouženým uvolňováním s cílem prodloužit dobu vstřebávání tak, aby se 90 % látky uvolnilo za dobu 6–12 hodin a aby bylo při stejné denní dávce podávané 1krát denně dosaženo přibližně stejné plochy pod křivkou koncentrací léčiva v plné krvi. Farmakokinetika takrolimu ve formě s prodlouženým uvolňováním byla studována u zdravých dobrovolníků a u pacientů po transplantaci ledviny, jater a srdce. Jeho bezpečnost a účinnost byla testována při převodu z klasické lékové formy u stabilních příjemců po transplantaci ledvin. Převod bylo možné provést v poměru denních dávek 1 : 1 a celková expozice léčivu (hodnocená podle plochy pod křivkou koncentrací takrolimu) vysoce korelovala s hladinami léčiva na konci dávkovacího intervalu. U příjemců štěpu ledviny de novo byla bezpečnost a účinnost takrolimu, takrolimu ve formě s prodlouženým uvolňováním a mikroemulze cyklosporinu, které byly podávány spolu s mykofenolátem mofetilem a steroidy, porovnávána v jednoroční randomizované studii. Takrolimus ve formě s prodlouženým uvolňováním měl obecně stejný profil účinnosti a bezpečnosti jako jeho konvenční léková forma, přičemž umožňoval pohodlné dávkování 1krát denně. Při stejném denním dávkování byla celková expozice léčivu u obou forem obdobná a velmi dobře korelovala s hladinami léčiva na konci dávkovacího intervalu. Takrolimus s prodlouženým uvolňováním je možné podávat ve stejných indikacích jako konvenční takrolimus. Doporučené denní dávkování i cílové údolní koncentrace zůstávají rovněž stejné.
Úvod
Mechanismy přirozené a adaptivní imunity se podílejí na patogenezi řady onemocnění a jsou příčinou rejekce transplantovaných orgánů, tkání a buněk. Tlumení těchto mechanismů se uplatňuje zejména v transplantační medicíně a při léčbě systémových autoimunitních chorob. V prevenci orgánové či tkáňové rejekce se většinou používají kombinace 2 nebo více látek, které ovlivňují imunitní systém na různých úrovních a vzájemně se doplňují. Mezi základní imunosupresivní léky, jež jsou dnes součástí většiny imunosupresivních schémat, patří inhibitory intracelulární fosfatázy – kalcineurinu. Kalcineurin umožňuje jadernou translokaci řady transkripčních faktorů nutných pro aktivaci T lymfocytů a produkci interleukinu-2. Klinicky se používají 2 kalcineurinové inhibitory, takrolimus a cyklosporin A. Oběma těmto látkám byly v časopise Remedia v nedávné době věnovány přehledy [1, 2].
Zavedení cyklosporinu A do léčby a později zavedení takrolimu výrazně přispělo ke zlepšení jednoročního přežívání štěpů při orgánové transplantaci. Řada kontrolovaných mono- i multicentrických studií prokázala účinnost a bezpečnost takrolimu v profylaxi akutní rejekce po transplantaci ledvin, jater, srdce a dalších orgánů [3].
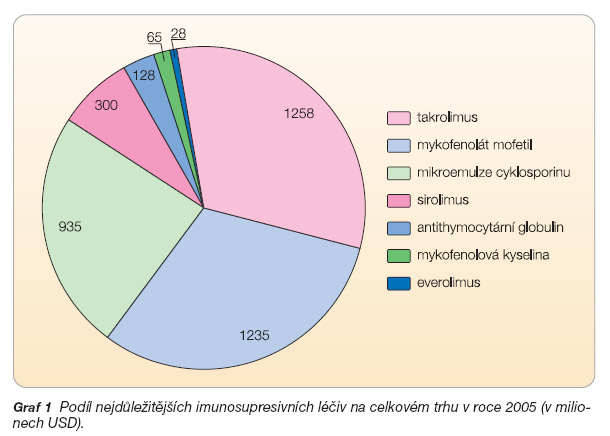
Přesto po prvním roce po transplantaci stále selhává ročně 3–5 % orgánů [4]. Řada studií ukázala, že takrolimus ve srovnání s cyklosporinem A působí příznivěji na dva důležité faktory dlouhodobého přežívání štěpů, jimiž jsou: 1. akutní rejekce v prvním roce a 2. rizikové ukazatele kardiovaskulárních onemocnění [5–10]. V roce 2004 byl takrolimus nejčastěji podávaným základním imunosupresivem při orgánových transplantacích [3]. V roce 2005 byla spotřeba takrolimu vyjádřená ve finančních jednotkách nejvyšší z imunosupresiv (graf 1) [11].
Za další důležitou příčinu rejekce, ztráty transplantovaného orgánu a případně smrti příjemce se považuje také nedodržování léčebného režimu a chybné užívání imunosupresivních léků [12–18]. Podle přehledu Denhaeryncka a kol. [19] bylo nepravidelné užívání imunosupresivních léků příčinou téměř 20 % epizod pozdních (po 1 roce) akutních rejekcí a 16 % případů selhání štěpu ledviny. Podle retrospektivní studie O"Carolla a kol. se špatná adherence k imunosupresivnímu režimu podílela na 10 % případů úmrtí po transplantaci jater a na 30 % případů chronické rejekce vyžadující retransplantaci [20]. Podobně po transplantaci srdce měli pacienti chybně užívající imunosupresivní léky větší výskyt koronárního postižení a dalších nežádoucích efektů léčby [21].
Compliance pacientů léčených imunosupresivy rozhodně patří mezi faktory, které lze ovlivnit. Za hlavní faktory špatné adherence k léčebnému režimu se obecně považují složitost léčebného schématu a časté nežádoucí účinky, zejména subjektivně pociťované. V analýze 272 příjemců štěpu ledviny Weng a kol. např. zjistili, že ve srovnání s dávkováním imunosupresiv 2krát denně byl poměr šancí (odds ratio) dodržení léčebného režimu u pacientů léčených jednou denní dávkou podstatně vyšší – 2,35 (95% CI: 1,01–5,45), naopak u pacientů léčených 3 dávkami podstatně nižší – 0,43 (95% CI: 0,22–0,86) [22]. Jednou z možností, jak zlepšit compliance, je volba jednoduchého dávkovacího režimu a snížení počtu předepsaných léků [23].
Vývoj takrolimu s prodlouženým uvolňováním
Nemodifikovaná léková forma takrolimu se rychle vstřebává v zažívacím ústrojí a dosahuje maximálních koncentrací za 1–2 hodiny po podání. Modifikovaná forma takrolimu byla vyvinuta s cílem prodloužit dobu vstřebávání tak, aby se 90 % látky uvolnilo za 6–12 hodin.
Příprava lékové formy zahrnuje 2 fáze. Nejprve je takrolimus smíchán s ethanolem, ethylcelulózou, hypromelózou a monohydrátem laktózy. Po vysušení jsou připraveny granule intermediární velikosti. Zatímco hypromelóza v granulích vytváří polymerní gel, který zpomaluje uvolňování takrolimu, ethylcelulóza vytváří difuzní matrix, jež reguluje uvolňování tím, že zpomaluje průnik vody do granulí. V druhé fázi jsou granule míseny s monohydrátem laktózy a magnezium stearátem a tato směs je plněna do kapslí. Aby bylo dosaženo požadovaných farmakokinetických vlastností, bylo postupně testováno několik výrobních postupů, přičemž současná formulace byla vyvinuta pod označením MR4 [24].
Mechanismus účinku
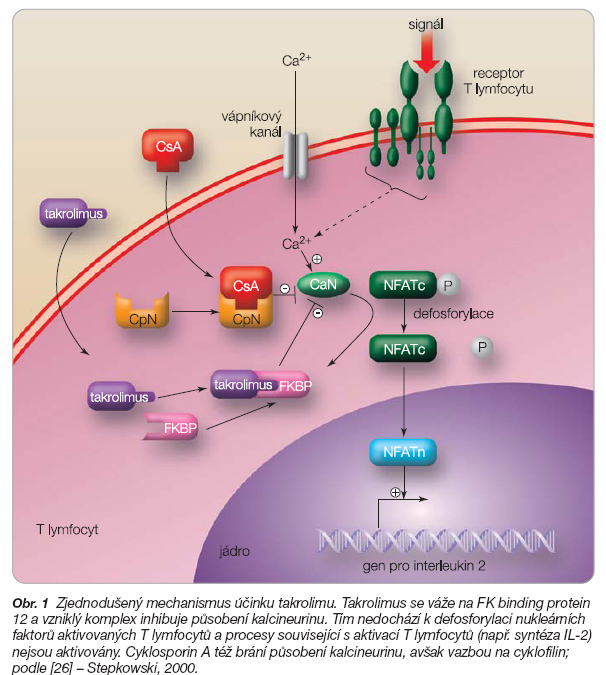
Takrolimus inhibuje cytoplazmatickou fosfatázu označovanou jako kalcineurin [25], a řadí se tak spolu s cyklosporinem A mezi imunosupresivní léčiva označovaná jako kalcineurinové inhibitory. Kalcineurin se podílí na regulaci imunitní odpovědi tím, že umožňuje přenos aktivačního signálu T lymfocytů do buněčného jádra. Defosforyluje několik transkripčních faktorů, které se řadí do skupiny NFAT (nuclear factors of activated T lymphocytes) a také NF-kB (nuclear factor kB), a ty se potom mohou translokovat přes jadernou membránu. NFAT patří v T buňkách mezi důležité aktivátory transkripce a následné syntézy regulačních cytokinů, jako jsou zejména interleukin-2 (IL-2), ale také IL-3, IL-4, IL-5, granulocyty-makrofágy kolonie stimulující faktor (GMCSF), interferon g (IFN-g) a tumor necrosis faktor a (TNF-a) [26–28].
V cytoplazmě se takrolimus váže na vazebný protein FKBP12 (FK binding protein 12), který je zodpovědný za buněčnou a tkáňovou distribuci takrolimu. Vzniklý komplex blokuje účinky kalcineurinu, čímž zabraňuje přenosu aktivačního signálu v aktivovaných lymfocytech (obr. 1).
Kalcineurin není schopen defosforylovat transkripční faktory aktivovaných lymfocytů (NFAT) a umožnit jejich translokaci do jádra. Tím je v jádru blokována transkripce řady aktivačních cytokinů, z nichž nejdůležitější je interleukin-2 (IL-2).
Takrolimus působí také na další procesy řízené či neřízené kalcineurinem (podrobněji viz citace [2]). Kombinace několika odlišných mechanismů účinku na aktivaci T buněk je pravděpodobně příčinou vysoké specificity imunosupresivního účinku, ale také poměrně širokého spektra nežádoucích účinků [29].
Farmakokinetické vlastnosti
Takrolimus v nemodifikované formě je dostupný v želatinových kapslích, které obsahují olejovitý roztok účinné látky. Podává se ve dvou denních dávkách s cílem dosáhnout ve většině indikací ustálených údolních koncentrací v plné krvi 5–15 ng/ml.
Při vývoji modifikované formy byly postupně testovány 4 formulace, označované jako MR-1, MR-2, MR-3 a MR-4. Protože podle firemních údajů měla formulace MR-4 přibližně stejný stupeň absorpce, ale podstatně nižší maximální dosaženou hladinu, byla právě tato zvolena pro další vývoj. Průměrné plochy pod křivkou krevních koncentrací ve srovnání s nemodifikovanou formou byly ve sledovaném čase a po vztažení k nekonečnu 93,7 % a 97,3 % [24].
Absorpce
Takrolimus se ze zažívacího ústrojí vstřebává rychle, ale nekompletně. Zatímco u nemodifikované formy je dosaženo maximálních koncentrací za 1–2 hod., u modifikované formy je to za 2–2,5 hod. Vstřebávání je variabilní a biologická dostupnost činí v průměru 20–25 %. Přítomnost žluči nemá na vstřebávání vliv, i po transplantaci jater proto může být léčba zahájena perorálně. Vstřebávání ze zažívacího ústrojí je lepší v ranních než ve večerních hodinách a je zpomaleno přítomností potravy.
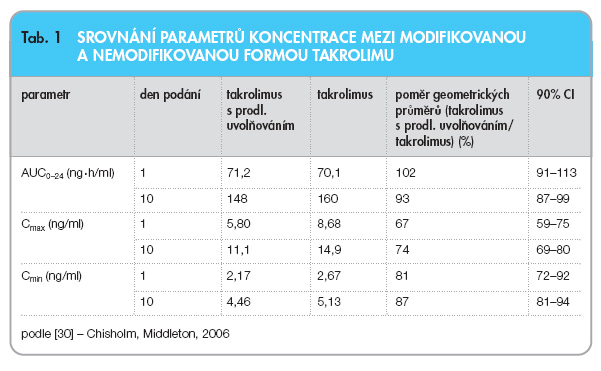
Porovnání farmakokinetických parametrů obou forem u 25 zdravých 19–50letých dobrovolníků ukazuje tab. 1 [30].
Nemodifikovaná forma byla podávána 2krát denně 2 mg, zatímco modifikovaná jen jednou denně 4 mg, a to po dobu 10 dnů. V této cross-over studii byla pak léčiva s odstupem 14 dní podávána v opačném pořadí. Z výsledků je zjevné, že plochy pod křivkou koncentrací léčiva v průběhu 24 hodin byly téměř stejné a rovněž koncentrace na konci dávkovacího intervalu se prakticky nelišily.
Farmakokinetické parametry byly dále porovnávány v otevřené multicentrické 6 týdnů trvající studii u pacientů po první transplantaci ledviny: 66 příjemců ve věku 18–65 let bylo randomizováno pro léčbu nemodifikovanou formou takrolimu 2krát denně nebo jednou denně formou modifikovanou. Současně byl podáván mykofenolát mofetil a kortikosteroidy [31]. Úvodní celková denní dávka byla 0,20 mg/kg s cílem dosáhnout údolních koncentrací 10–20 ng/ml a po 14 dnech 5–15 ng/ml. Kinetika byla vyšetřena po první dávce a znovu přibližně za 14 a 42 dnů. Celková expozice takrolimu byla u obou skupin velmi blízká, a to jak bezprostředně po zahájení léčby, tak i v pozdějším období. Přitom interindividuální variabilita byla nižší při použití modifikované formy takrolimu [31]. Údolní koncentrace takrolimu na konci dávkovacího intervalu velmi dobře korelovaly s plochou pod křivkou koncentrací takrolimu sledovanou po dobu 24 hodin (korelační koeficient byl v rozmezí 0,8–0,9).
V další otevřené multicentrické randomizované studii byly porovnávány farmakokinetické parametry u jaterních transplantací de novo, kdy 32 příjemců bylo léčeno nemodifikovanou formou 2krát denně a 45 příjemců modifikovanou formou takrolimu s iniciální denní dávkou 0,10 až 0,15 mg/kg s cílovými hladinami 10–20 ng/ml. Při vyšetření po podání první dávky byla plocha pod křivkou koncentrací AUC0–24 u klasické lékové formy 150 ng.h/ml a u modifikované formy 260 ng.h/ml. Kinetické parametry zjišťované po 2 a 7 týdnech léčby se nelišily. Stejně jako při transplantaci ledvin plochy pod křivkou dobře korelovaly s údolními koncentracemi (korelační koeficient přibližně 0,9) a byly srovnatelné mezi oběma skupinami [32].
Distribuce, biotransformace, exkrece a eliminace
Účinná látka u modifikované i nemodifikované formy takrolimu je totožná, a proto jsou farmakokinetické vlastnosti s výjimkou absorpce také stejné. Takrolimus se vysoce váže v červených krvinkách, kde bývá jeho koncentrace až 20krát vyšší než v plazmě. Takrolimus podléhá rozsáhlé biotransformaci v játrech a střevě a do moči se vyloučí méně než 1 % původní látky. Pouze jeden metabolit je mírně imunosupresivně aktivní. Clearance takrolimu je nízká a může být zvýšena v důsledku podávání kortikosteroidů, v důsledku hypoproteinémie a anémie. Terminální eliminační poločas takrolimu (t1/2b) byl zjištěn u zdravých dobrovolníků přibližně 35 hodin, zatímco u osob po transplantaci ledviny byl eliminační poločas 19 hodin a po transplantaci jater 12 hodin [33]. Podrobně byly farmakokinetické vlastnosti takrolimu popsány v předchozím přehledu [2].
Klinické zkušenosti v transplantologii
Bezpečnost a účinnost takrolimu s prodlouženým uvolňováním byla testována nejprve v kontrolovaných klinických studiích, ve kterých byla dosud používaná nemodifikovaná forma takrolimu u pacientů po transplantaci ledviny, jater a srdce nahrazena formou s prodlouženým uvolňováním, a později u příjemců ledviny de novo. Protože se jedná o stejnou účinnou látku, která má pouze odlišné farmakokinetické vlastnosti a jednodušší dávkování, bylo cílem těchto studií zejména prokázat, že s použitím modifikované formy takrolimu je možné dosáhnout obdobných cílových koncentrací a stejné léčebné účinnosti při zachovaném nebo lepším bezpečnostním profilu.
Konverzní studie
V otevřené zkřížené studii byla u skupiny 70 dospělých pacientů po transplantaci ledviny zahájena léčba klasickou formou takrolimu. Po stabilizaci dávky 8. den po transplantaci byla nahrazena formou modifikovanou ve stejné celkové dávce podávané 1krát denně. Kinetika takrolimu byla vyšetřena v 1., 7., 8., 14. a 21. den [34]. Průměrná denní dávka klasického přípravku byla 5,37 Î 3,47 mg. Během 35denního intervalu nemusela být upravena denní dávka modifikovaného takrolimu u 70 % pacientů. U pacientů, kteří pokračovali v prodlužovací studii po dobu 2 let, činily údolní koncentrace takrolimu 5,8 Î 2,8 až 7,1 Î 1,9 ng/ml při průměrných denních dávkách 5,8–6,2 mg [35].
Poměr 24hodinových ploch pod křivkou koncentrací takrolimu po dosažení ustáleného stavu byl 0,94, což svědčí pro ekvivalentní expozici léčivu. Údolní koncentrace takrolimu (Cmin) před konverzí i po konverzi velmi dobře korelovaly s plochou pod křivkou koncentrací (AUC0–24), což mimo jiné svědčí pro to, že monitorování léčiva s užitím údolních koncentrací je pro sledování celkové expozice plně dostačující. Tolerance takrolimu s prodlouženým uvolňováním v pokračovací studii byla obecně velmi dobrá a dvouleté přežívání pacientů a štěpů bylo 100 %, resp. 98,5 % [35].
Ve studii Flormana a kol. byla konverze studována u 70 stabilních pacientů po transplantaci jater, kteří byli minimálně 6 měsíců léčeni klasickou formou takrolimu [36, 37]. Farmakokinetika byla vyšetřena před převedením na léčbu modifikovanou formou, za 14 dní po převedení, poté opakovaně za dalších 14 dní, kdy byl znovu podáván takrolimus v nemodifikované formě, a nakonec opět za dalších 14 dní, po jejichž uplynutí byli pacienti opět konvertováni na léčbu takrolimem s prodlouženým uvolňováním. Průběh koncentrací takrolimu v plné krvi při léčbě oběma formami takrolimu ukazuje graf 2. Během studie nepotřebovalo 80 % pacientů úpravu celkové dávky. Po provedení korekce vzhledem k podávané dávce byla zjištěna signifikantně nižší interindividuální variabilita v celkové expozici v období, kdy pacienti užívali modifikovanou lékovou formu takrolimu (p < 0,05) [36, 37]; ta se poté osvědčila i ve dvouleté pokračovací studii, kdy se denní dávka léčiva pohybovala v průměru mezi 5,5 a 6 mg [37].
Další konverzní studie byla provedena u 85 pacientů, kteří užívali nemodifikovanou (klasickou, původní) formu takrolimu alespoň 6 měsíců po transplantaci srdce a jejichž údolní koncentrace takrolimu činily 5–15 ng/ml [38]. Podobně jako při transplantaci ledvin a jater, plochy pod křivkou koncentrací takrolimu se výrazně nelišily při použití obou lékových forem a údolní koncentrace vysoce korelovaly s celkovou expozicí léčivu.
Studie paralelně srovnávající obě formy takrolimu
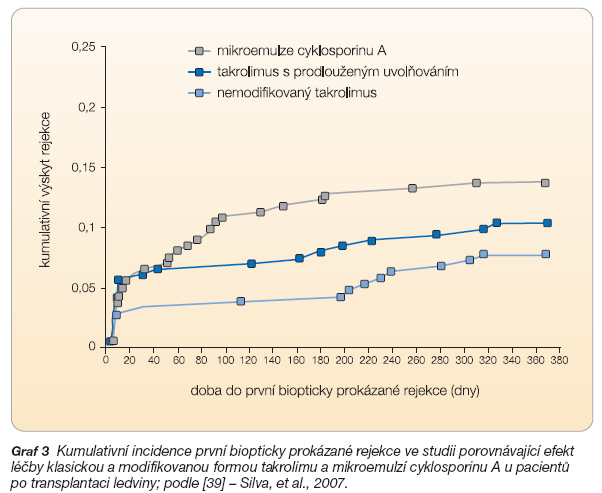
Účinnost a bezpečnost léčby takrolimem s prodlouženým uvolňováním při transplantaci ledvin de novo byla studována v multicentrické randomizované otevřené studii v rámci 3. fáze klinického hodnocení [39] trvající 1 rok, která proběhla v USA, Kanadě a Brazílii. Jejím cílem bylo prokázat, že takrolimus v modifikované lékové formě není méně účinný než klasická forma takrolimu či mikroemulze cyklosporinu A. Do studie bylo zařazeno celkem 668 pacientů, z nichž asi polovina dostala štěp od žijícího dárce. Pacienti byli náhodně přiděleni do jedné ze 3 skupin, které byly léčeny klasickou formou takrolimu, modifikovanou formou nebo mikroemulzí cyklosporinu A. Současně byla provedena indukce basiliximabem a byly podávány kortikosteroidy a mykofenolát mofetil.
Hlavním sledovaným parametrem bylo selhání účinnosti imunosupresivního schématu, což zahrnovalo úmrtí příjemce, selhání štěpu, prokázanou rejekci stupně 1 a vyššího podle Banffské klasifikace nebo ukončení sledování pacienta z jakékoli příčiny. Analýza ukázala, že tento primární ukazatel se vyskytl ve skupině léčené modifikovanou formou takrolimu ve 14 % případů, ve skupině léčené nemodifikovanou formou v 15,1 % a ve skupině léčené cyklosporinem A v 17,0 %, a nebyl tedy u testovaného přípravku častější než u ostatních skupin. Jednoroční kumulativní přežívání pacientů a štěpů bylo ve stejném pořadí u jednotlivých skupin: 98,6 % a 96,7 %; 95,7 % a 92,9 %; 97,7 % a 95,7 % a statisticky se mezi skupinami významně nelišilo. Kumulativní výskyt první biopticky prokázané rejekce ukazuje graf 3.
Statisticky významný rozdíl byl pouze mezi skupinou léčenou klasickou formou takrolimu a skupinou léčenou cyklosporinem A (p < 0,04).
Dávkování
Obecně se doporučuje užívat stejnou celkovou denní dávku, která se udává u takrolimu v nemodifikované formě. Protože se takrolimus s prodlouženým uvolňováním užívá zpravidla v kombinaci s dalšími léky s různou imunosupresivní potencí, mohou se doporučené dávky v jednotlivých schématech značně lišit. Doporučené údolní koncentrace v plné krvi se většinou mají pohybovat v rozmezí 7–20 ng/ml v časném potransplantačním období, později pak v rozmezí 5–12 ng/ml. Hladiny je vhodné monitorovat zhruba 2krát týdně v prvních 2 týdnech, po dosažení ustáleného stavu postupně v 1–2měsíčních intervalech. Protože clearance takrolimu je nízká, ustáleného stavu po změně dávky se dosahuje teprve v průběhu několika dnů. Obecné doporučení pro dávkování je uvedeno v tab. 2.
Vzhledem k cirkadiánním variacím rychlosti vstřebávání by se takrolimus s prodlouženým uvolňováním měl podávat 1krát denně, a to ráno na lačno přibližně 1 hodinu před jídlem. Kapsle je nutné spolknout celé. K zapití je nejvhodnější voda, nevhodný je grapefruitový džus. Obecná doporučení pro úpravu dávek za různých okolností jsou prakticky stejná jako u nemodifikované formy takrolimu a byla uvedena v nedávném přehledu [2].
Indikace
Indikace takrolimu se zpomaleným uvolňováním jsou prakticky totožné s indikacemi přípravku v nemodifikované formě. Použití přípravku s modifikovanou formou přináší především výhodu podávání v jedné denní dávce při zachování stejné imunosupresivní účinnosti a stejného bezpečnostního profilu. To může přispět ke zlepšení kvality života pacienta a k dosažení lepší adherence k předepsané terapii.
Základní indikací takrolimu uvedenou v souhrnu informací o přípravku v České republice je profylaxe rejekce při transplantacích ledvin a jater a dále odhojování štěpů ledviny, jater a srdce. Existuje však dostatek údajů, které opravňují k jeho použití také v jiných případech allotransplantace, jako je profylaxe odhojování při transplantacích srdce, pankreatu, plic, Langerhansových ostrůvků, allogenních buněk kostní dřeně a prevence reakce štěpu proti hostiteli při transplantaci hematopoetických buněk; obecně prakticky při všech typech allotransplantace, kdy je třeba potlačit odhojování transplantovaných orgánů, tkání či buněk imunitním systémem příjemce. V transplantačních indikacích se takrolimus zpravidla podává s dalšími imunosupresivními léky, jako jsou kortikosteroidy, azathioprin, mykofenolát mofetil nebo sirolimus (či everolimus).
Kromě toho může být takrolimus použit v léčbě autoimunitních onemocnění tam, kde je ostatní medikamentózní léčba nepostačující a předpokládaný přínos léčby převažuje nad možnými nežádoucími efekty.
Kontraindikace
Léčba takrolimem se zpomaleným uvolňováním je při použití v transplantační medicíně kontraindikována jen velmi zřídka, a to v případě přecitlivělosti vůči takrolimu či některým složkám přípravku, případně vůči jiným makrolidovým sloučeninám. V ostatních případech jsou kontraindikace většinou relativní, zejména pokud se nabízí možnost použít jiný adekvátně účinný imunosupresivní lék. Při léčbě autoimunitního onemocnění je jeho použití kontraindikováno u pacientů s nádorovými chorobami, primární či sekundární imunodeficiencí, nekontrolovanou infekcí, dále u pacientů s nekontrolovanou hypertenzí, těžkou poruchou funkce ledvin (s výjimkou pacientů již léčených náhradou funkce ledvin) a při těžší poruše funkce jater.
Nežádoucí účinky
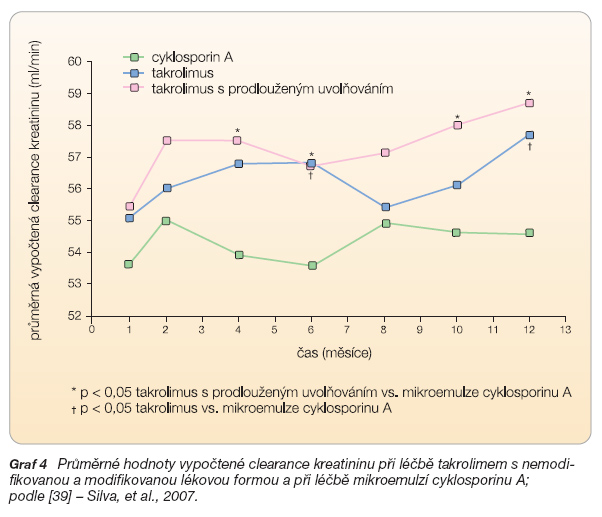
V dosud nejrozsáhlejší kontrolované studii zahrnující 214 pacientů léčených takrolimem s prodlouženým uvolňováním a 212 pacientů léčených takrolimem s nemodifikovanou lékovou formou v kombinaci s mykofenolátem mofetilem po transplantaci ledviny se podle očekávání spektrum nežádoucích účinků prakticky nelišilo [39]. Autoři ovšem zaznamenali nižší počet pacientů, u kterých se v průběhu jednoho roku zhoršovala renální funkce (odhadovaná clearance kreatininu), což by bylo možné vysvětlit nižšími maximálními koncentracemi takrolimu v krvi při použití modifikované formy (graf 4).
Vzhledem k tomu, že takrolimus je účinný imunosupresivní lék používaný v závažných indikacích, jsou ovšem nežádoucí účinky poměrně časté a jejich spektrum je široké. Ve většině případů závisí jejich intenzita a frekvence na dosahovaných krevních hladinách a ustupuje při snížení dávky. Obecně lze říci, že bezpečnostní profil takrolimu ve srovnání s jinými imunosupresivními léky, zejména s cyklosporinem A, je příznivý. Ve výše jmenované studii, kterou uskutečnil Silva a kol. [39], byly nežádoucí účinky léčby takrolimem s modifikovanou formou ve srovnání s léčbou mikroemulzí cyklosporinu A méně často důvodem ke změně způsobu alokované léčby (p < 0,001).
Běžně udávané nežádoucí účinky zahrnují nefrotoxicitu, neurotoxicitu, průjem a další zažívací problémy, výskyt infekcí (bakteriální, mykotické, virové), hypertenze a poruchy glycidového metabolismu. Ve srovnání s terapií cyklosporinem A se častěji vyskytuje průjem, poruchy glycidového metabolismu a některé typy neurotoxického postižení, zatímco naopak méně časté jsou hypertenze a hypercholesterolémie. Kromě toho takrolimus jen ojediněle působí hirzutismus, hyperplazii dásní a gingivitidu, jež se při léčbě cyklosporinem A vyskytují poměrně často, ale může rovněž působit pruritus a alopecii [40–42].
Lékové interakce
Takrolimus se metabolizuje jaterním mikrozomálním izoenzymem CYP 3A4 cytochromu P-450. Souběžné užívání léků rostlinného původu může ovlivnit metabolismus takrolimu, a tím zvýšit anebo snížit hladinu takrolimu v krvi. Např. třezalka tečkovaná je induktorem jaterních enzymů metabolizujících takrolimus a její podávání může vést ke snížení plazmatických hladin takrolimu, grapefruitová štáva naopak CYP 3A4 inhibuje. Takrolimus sám výrazně inhibuje metabolismus závislý na CYP 3A4.
Podstatná část takrolimu se váže na proteiny plazmy. Z toho důvodu jsou možné interakce s léčivy s vysokou vazbou na plazmatické bílkoviny (NSAID, perorální antikoagulancia, perorální antidiabetika).
Současné užívání takrolimu s léčivy se známým nefrotoxickým nebo neurotoxickým působením může zvýšit toxicitu (aminoglykosidy, vankomycin, kotrimoxazol, NSAID, ganciklovir anebo aciklovir).
Podávání takrolimu je někdy provázeno hyperkalémií. Proto je vhodné předcházet zvýšenému příjmu draslíku a jen s rozvahou indikovat kalium šetřící diuretika (amilorid, triamteren, spironolakton).
Klinicky relevantní interakce
Řada léčiv pravidelně působí zvýšení hladin takrolimu inhibicí CYP 3A4. Je proto vhodné vyvarovat se jejich použití nebo zvýšení hladin předcházet snížením dávky a monitorací hladin takrolimu. Mezi tato léčiva patří zejména – antimykotika: klotrimazol, itrakonazol, flukonazol, ketokonazol, vorikonazol; blokátory kalciových kanálů: nifedipin, nikardipin, diltiazem, verapamil; antibiotika: klarithromycin, josamycin, erythromycin; danazol, ethinylestradiol, omeprazol.
Naopak snížení hladin takrolimu lze očekávat při současném podávání rifampicinu, fenytoinu a fenobarbitalu a bolusových dávek kortikosteroidů.
Na potenciální interakce je třeba myslet i při použití dalších látek, o kterých je známo, že inhibují systém cytochromu P-450 3A. Patří mezi ně mimo jiné: bromokryptin, kortison, dapson, ergotamin, ethinylestradiol, gestoden, lidokain, mefenytoin, mikonazol, midazolam, nilvadipin, norethindron, quinidin, tamoxifen, (triacetyl)oleandomycin a verapamil. K dalším látkám, které naopak tento enzym indukují, patří: karbamazepin, metamizol a isoniazid.
Udává se, že hormonální antikoncepce může být při léčbě takrolimem méně účinná a zároveň může zvyšovat jeho hladiny. I když reálná data toto dostatečně nepotvrzují, je nutné při jejich indikaci vzít tuto možnost v úvahu.
Tak jako při užití jiných imunosupresiv, může být při podávání takrolimu méně účinná vakcinace. Kromě toho není vhodné používat živé či atenuované vakcíny.
Závěr
Studie, které byly uskutečněny v rámci 2. a 3. fáze klinického hodnocení, potvrdily, že léková forma takrolimu se zpomaleným uvolňováním (firemní název Advagraf) má stejnou klinickou účinnost a bezpečnost jako dosavadní forma takrolimu (firemní název Prograf), přičemž ale poskytuje výhodu pohodlnějšího podávání pouze 1krát denně. Snížení počtu denních dávek může přispět ke zlepšenému dodržování léčebného režimu a ke zlepšení kvality života pacientů. Ve srovnání s klasickým takrolimem zajišťuje modifikovaná forma takrolimu obdobnou celkovou expozici účinné látce. Cílové údolní koncentrace na konci dávkovacího intervalu jsou u obou forem stejné. Údolní koncentrace vysoce korelují s plochou pod křivkou koncentrací a jsou dostatečným ukazatelem pro terapeutické monitorování. Při převodu z léčby konvenční formou na léčbu novou formou takrolimu je možné použít stejnou denní dávku léku.
Seznam použité literatury
- [1] Dostál C, Pavelka K, Saudek F, et al. Ciclosporinum. Remedia 2005; 15: 33–52.
- [2] Saudek F. Tacrolimusum. Remedia 2006; 16: 61–79.
- [3] Fung JJ. Tacrolimus and transplantation: a decade in review. Transplantation 2004; 77 (Suppl. 9): S41–43.
- [4] Hariharan S, Johnson CP, Bresnahan BA, et al. Improved graft survival after renal transplantation in the United States, 1988 to 1996. N Engl J Med 2000; 342: 605–612.
- [5] Vincenti F, Jensik SC, Filo RS, et al. A long-term comparison of tacrolimus (FK506) and cyclosporine in kidney transplantation: evidence for improved allograft survival at five years. Transplantation 2002; 73: 775–782.
- [6] Jurewicz WA. Tacrolimus versus cyclosporin immunosuppression: long-term outcome in renal transplantation. Nephrol Dial Transplant 2003. (Suppl. 1): 7–11.
- [7] Margreiter R. Efficacy and safety of tacrolimus compared with ciclosporin microemulsion in renal transplantation: a randomised multicentre study. Lancet 2002; 359: 741–746.
- [8] Klein IH, Abrahams A, van Ede T, et al. Different effects of tacrolimus and cyclosporine on renal hemodynamics and blood pressure in healthy subjects. Transplantation 2002; 73: 732–736.
- [9] Krämer BK, Zülke C, Kammerl MC, et al. Cardio-vascular risk factors and estimated risk for CAD in a randomized trial comparing calcineurin inhibitors in renal transplantation. Am J Transplant 2003; 3: 982–987.
- [10] Webster AC, Woodroffe RC, Taylor RS, et al. Tacrolimus versus ciclosporin as primary immunosuppression for kidney transplant recipients: meta-analysis and meta-regression of randomised trial data. BMJ 2005; 331: 810.
- [11] Stakeholder Opinions: Kidney Transplantation – Switching to calcineurin inhibitor-free immunosuppression. Datamonitor 2006 [cited 2006 7. 4.]; Available from: http://www.datamonitor.com/ ~1c45a91c12e3405d9519dc067b25d83b~/industries/research/?pid=DMHC2157&type= Report.
- [12] Bunzel B. Attitude of patients toward transplantation of xenogenic organs. Langenbecks Arch Surg 2000; 385: 305.
- [13] Bunzel B, Laederach-Hofmann K. Solid organ transplantation: are there predictors for post-transplant noncompliance? A literature overview. Transplantation 2000; 70: 711–716.
- [14] Butler JA, Roderick P, Mullee M, et al. Frequency and impact of nonadherence to immunosuppressants after renal transplantation: a systematic review. Transplantation 2004; 77: 769–776.
- [15] De Geest S, Borgermans L, Gemoets H, et al. Incidence, determinants, and consequences of subclinical noncompliance with immunosuppressive therapy in renal transplant recipients. Transplantation 1995; 59: 340–347.
- [16] Gaston RS, Hudson SL, Ward M , et al. Late renal allograft loss: noncompliance masquerading as chronic rejection. Transplant Proc 1999; 31(4A): 21S–23S.
- [17] Hilbrands LB, Hoitsma AJ, Koene RA. Medication compliance after renal transplantation. Transplantation 1995; 60: 914–920.
- [18] Laederach-Hofmann K, Bunzel B. Noncompliance in organ transplant recipients: a literature review. Gen Hosp Psychiatry 2000; 22: 412–424.
- [19] Denhaerynck K, Dobbels F, Cleemput I, et al. Prevalence, consequences, and determinants of nonadherence in adult renal transplant patients: a literature review. Transpl Int 2005; 18: 1121–1133.
- [20] O“Carroll RE, McGregor LM, Swanson V, et al. Adherence to medication after liver transplantation in Scotland: a pilot study. Liver Transpl 2006; 12: 1862–1868.
- [21] Dobbels F, De Geest S, van Cleemput J, et al. Effect of late medication non-compliance on outcome after heart transplantation: a 5-year follow-up. J Heart Lung Transplant 2004; 23: 1245–1251.
- [22] Weng FL, Israni AK, Joffe MM, et al. Race and electronically measured adherence to immunosuppressive medications after decreased donor renal transplantation. J Am Soc Nephrol 2005; 16: 1839–1848.
- [23] Regazzi MB, Alessiani M, Rinaldi M. New strategies in immunosuppression. Transplant Proc 2005; 37: 2675–2678.
- [24] First MR, Fitzsimmons WE. Modified release tacrolimus. Yonsei Med J 2004; 45: 1127–1131.
- [25] Clipstone NA, Crabtree GR. Identification of calcineurin as a key signalling enzyme in T-lymphocyte activation. Nature 1992; 357: 695–697.
- [26] Stepkowski SM. Molecular targets for existing and novel immunosuppressive drugs. Expert Rev Mol Med. 2000; 2: 1–23.
- [27] Krönke M, Leonard WJ, Depper JM, et al. Cyclosporin A inhibits T-cell growth factor gene expression at the level of mRNA transcription. Proc Natl Acad Sci U S A 1984; 81: 5214–5218.
- [28] Macian F. NFAT proteins: key regulators of T-cell development and function. Nat Rev Immunol 2005; 5: 472–484.
- [29] Halloran PF. Immunosuppressive drugs for kidney transplantation. N Engl J Med 2004; 351: 2715–2729.
- [30] Chisholm MA, Middleton MD. Modified-release tacrolimus. Ann Pharmacother 2006; 40: 270–275.
- [31] Undre NA, for the Tacrolimus modified release kidney study group. Use of a once daily modified release tacrolimus regimen in de novo kidney transplant recipients. Am J Transplant 2005; 5 (Suppl. 11): Abstract 132.
- [33] Venkataramanan R, Swaminathan A, Prasad T, et al. Clinical pharmacokinetics of tacrolimus. Clin Pharmacokinet 1995; 29: 404–430.
- [34] Alloway R, Steinberg S, Khalil K, et al. Conversion of stable kidney transplant recipients from a twice daily Prograf-based regimen to a once daily modified release tacrolimus-based regimen. Transplant Proc 2005; 37: 867–870.
- [35] Alloway R, Steinberg S, Khalil K, et al. Two years postconversion from a Prograf-based regimen to a once-daily tacrolimus extended-release formulation in stable kidney transplant recipients. Transplantation 2007; 83: 1648–1651.
- [36] Florman S, Alloway R, Kalayoglu M, et al. Conversion of stable liver transplant recipients from a twice-daily Prograf-based regimen to a once-daily modified release tacrolimus-based regimen. Transplant Proc 2005; 37: 1211–1213.
- [37] Florman S, Alloway R, Kalayoglu M, et al. Once-daily tacrolimus extended release formulation: experience at 2 years postconversion from a Prograf-based regimen in stable liver transplant recipients. Transplantation 2007; 83: 1639–1642.
- [38] Alloway R, Vanhaecke J, Yonan N, et al. Conversion of stable heart transplant recipients from twice daily Prograf to once daily modified release tacrolimus. in 2006 Workd transplant congress. 2006, Boston.
- [39] Silva HT Jr, Yang HC, Abouljoud M, et al. One-year results with extended-release tacrolimus/MMF, tacrolimus/MMF and cyclosporine/MMF in de novo kidney transplant recipients. Am J Transplant 2007; 7: 595–608.
- [40] Peters DH, Fitton A, Plosker GL, Faulds D. Tacrolimus. A review of its pharmacology, and therapeutic potential in hepatic and renal transplantation. Drugs 1993; 46: 746–794.
- [41] Plosker GL, Foster RH. Tacrolimus: a further update of its pharmacology and therapeutic use in the management of organ transplantation. Drugs 2000; 59: 323–389.
- [42] Spencer CM, Goa KL, Gillis JC. Tacrolimus. An update of its pharmacology and clinical efficacy in the management of organ transplantation. Drugs 1997; 54: 925–975.