Transdermální buprenorfin
Buprenorfin je semisyntetický opioid, analgetikum-anodynum. Je parciálním agonistou m-receptorů, antagonistou k-receptorů a slabým agonistou d-receptorů. Řadí se mezi silné opioidy. Vysoká rozpustnost v tucích i ve vodě, nízká molekulární hmotnost a konfigurace molekuly usnadňují průnik do tkání jak při slizničním, tak při transdermálním i parenterálním podávání. Dechový útlum se vyskytuje při použití buprenorfinu zřídka a ojediněle je klinicky významný. Transdermální buprenorfin je k dispozici ve formě náplastí s 20 mg, 30 mg a 40 mg účinné látky (35, 52,5 a 70 mg/hod) pro léčbu středně silné a zejména silné chronické nádorové i nenádorové bolesti. Ekvianalgetický poměr dávky transdermálního buprenorfinu k dávce perorálního morfinu se pohybuje kolem hodnoty 1 : 100. V průběhu pěti let od zavedení transdermálního buprenorfinu do klinické praxe potvrdila řada studií příznivý poměr mezi kvalitní analgetickou účinností a nežádoucími účinky tohoto analgetika.
Úvod
Buprenorfin byl syntetizován před 40 lety jako látka odvozená od tebainu, jednoho z chemicky nejaktivnějších morfinových alkaloidů [8] . Tebain je součástí opia. V klinické praxi je buprenorfin jako silné analgetikum (analgetikum-anodynum) používán téměř 30 let [25], zhruba 10 let je používán i v léčbě závislosti na opioidech. Před pěti lety byl buprenorfin uveden na světový trh ve formě transdermálního terapeutického systému – matrixové náplasti.
Chemické a fyzikální vlastnosti
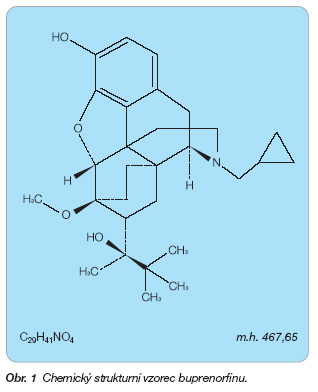
Buprenorfin je chemicky (2S)-2-[17(cyklopropylmethyl)-4,5a-epoxy-3-hydroxy-6-methoxy-6a,14-ethano-14a-morfinan-7a -yl]-3,3-dimethylbutan-2-ol (obr. 1).
Sumární vzorec: C29H41NO4
Molekulová hmotnost: 467,65
Farmakodynamické vlastnosti
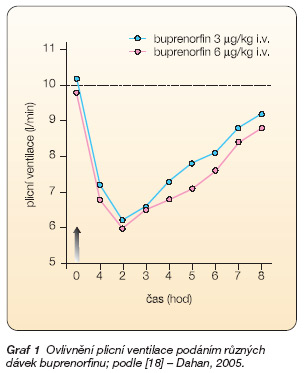
Buprenorfin je parciálním agonistou m-receptorů (OP3), antagonistou k-receptorů (OP2) a slabým agonistou d-receptorů (OP1). Má srovnatelnou afinitu k receptorům m a k a desetkrát nižší afinitu k d-receptorům [28, 30]. Vysoká rozpustnost v tucích i ve vodě, nízká molekulární hmotnost a konfigurace molekuly usnadňují průnik do tkání jak při slizničním, tak při transdermálním i parenterálním podávání. Snadný průnik do tkání však může příležitostně přispívat k výskytu emetického a dalších centrálně nervových nežádoucích účinků již při nízkých plazmatických koncentracích. Buprenorfin navozuje analgezii v závislosti na dávce a je přibližně 25–50krát silnější než hmotnostně srovnatelná dávka morfinu, analgezie po buprenorfinu trvá déle. Dechový útlum se vyskytuje při použití buprenorfinu zřídka a ojediněle je klinicky významný (graf 1) [18].
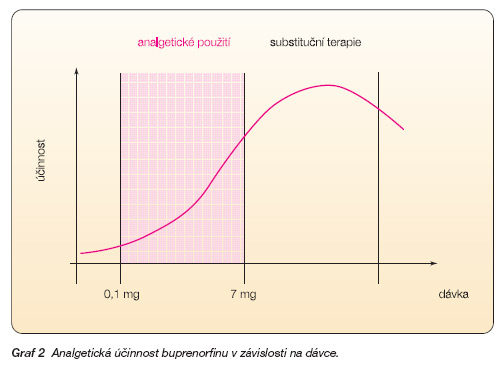
Křivka vazby buprenorfinu k subtypům opioidních receptorů má zvonovitý tvar. Zpočátku dochází se zvyšováním dávky k zesílení účinku, další zvyšování dávek však k větší intenzitě účinku nevede, případně účinek klesá. Analgetická odpověď u lidí v rozmezí akceptovatelného dávkování (0,1–10,0 mg/den) však nevykazuje oploštění křivky při rostoucích dávkách (graf 2) [11, 12, 55].
Analgetický účinek je výsledkem aktivity m-receptorů. Vazba a disociace z receptorů OP3 je pomalá. Z těchto důvodů nastupují účinky buprenorfinu pozvolna a dlouho přetrvávají [17, 27]. Početné studie u nemocných s nádorovou a pooperační bolestí prokázaly analgetický účinek buprenorfinu u střední až těžké bolesti při plazmatických hladinách 0,1–0,5 ng/ml [21].
Po náhlém vysazení buprenorfinu se mohou vyskytnout příznaky z odnětí. Tyto příznaky dosahují vrcholu v průběhu 2 týdnů, ale jsou mírnější než příznaky z odnětí morfinu [25]. Pomalý a méně intenzivní nástup syndromu z odnětí souvisí s pomalou disociací buprenorfinu z receptorů. Pravděpodobnost lékové závislosti i tolerance po krátkodobém i dlouhodobém podávání buprenorfinu je nižší než po jiných opioidech. Léčba buprenorfinem nevede k tzv. internalizaci opioidních receptorů (k jejich zmizení z buněčného povrchu), což snižuje pravděpodobnost rozvoje tolerance [56]. Rovněž psychomimetické účinky buprenorfinu jsou nižší než u jiných opioidů [26].
Dechový útlum se vyskytuje při použití buprenorfinu zřídka a ojediněle je klinicky významný. Přesto je podávání buprenorfinu kontraindikováno u pacientů se závažnými dechovými poruchami. Stupeň dechové deprese je v rozmezí terapeutických dávek závislý na dávce a její vrchol nastupuje později a trvá déle než po podání ekvianalgetické dávky morfinu [5, 25].
Podobně jako ostatní opioidy způsobuje buprenorfin miózu zornic v závislosti na podané dávce, a to i při transdermálním podávání [51, 52].
Farmakokinetické vlastnosti
Pro své výhodné fyzikálně-chemické vlastnosti se buprenorfin pohotově vstřebává z jakéhokoli kompartmentu, do nějž je vpraven. Po transdermálním podání jednotlivé náplasti 35 mg/hod (70 mg/hod) je dosaženo minimální efektivní koncentrace 100 pg/ml v plazmě po 21 (11) hodinách. Poté se plazmatická koncentrace dále zvyšuje a dosahuje vrcholu (cmax) 305 (624) pg/ml po přibližně 60 hodinách a nad hladinou 100 pg/ml se drží až do skončení 72hodinové aplikační periody [43]. Plazmatické koncentrace buprenorfinu a plocha pod křivkou v grafu změn koncentrace v průběhu času se progresivně zvyšují s počtem dalších aplikací a dosahují ustáleného stavu po třetím podání náplasti. Po opakovaných podáních náplastí dobrovolníkům byly zjištěny ustálené hladiny při podávání náplastí o síle 35 mg/hod mezi 263 a 379 pg/ml, při 52,5 mg/hod mezi 332 a 529 pg/ml a při 70 mg/hod mezi 390 a 578 pg/ml [14, 43]. Biologická dostupnost transdermálního buprenorfinu je přibližně 50%, což je srovnatelné s 50–60% dostupností po sublingválním podávání [21]. Buprenorfin je při plazmatických koncentracích 0–7 ng/ml z velké části vázán na plazmatické bílkoviny (96 %).
Buprenorfin je metabolizován v játrech převážně konjugací na buprenorfin glukuronid a částečně oxidací na N-dealkyl-buprenorfin (norbuprenorfin) s následnou konjugací [38]. Jaterní clearance je závislá na krevním průtoku játry. Žlučová exkrece je při vylučování nejdůležitější, bez ohledu na způsob podání. U osob s poškozenými jaterními funkcemi nebo u pacientů léčených jinými preparáty snižujícími jaterní očišťovací schopnost může být účinnost buprenorfinu zvýšena nebo prodloužena.
Eliminační poločas buprenorfinu (t1/2≤b) se pohybuje mezi 1,2–7,2 hod., s průměrem 2,2 hodiny po intravenózním podání 0,3 mg buprenorfinu při pooperační analgezii. Po transdermálním podání 35 (70) mg/hod byl eliminační poločas 25,3 (27,4) hodin [43].
Buprenorfin prochází do mateřského mléka matek užívajících vysoké dávky sublingválního buprenorfinu, proto není matkám léčeným buprenorfinem kojení doporučováno [2].
Indikace
Buprenorfin v různých lékových formách se používá k tlumení chronické nádorové i nenádorové bolesti. Buprenorfin má analgetickou účinnost ekvivalentní jiným silným opioidům a ve srovnání s jinými opioidy příznivější profil nežádoucích účinků [4]. Intenzitou svého účinku překonává slabé opioidy typu kodeinu, dihydrokodeinu a dextropropoxyfenu a dosahuje účinnosti silných opioidů typu morfinu a fentanylu. Buprenorfin je zařazován jako opioid pro třetí stupeň analgetického žebříčku (tedy silný opioid) dle WHO. Některé práce podporují důležitou roli buprenorfinu v léčbě neuropatické bolesti [33].
Kontraindikace
Přípravek nesmí užívat nemocní s přecitlivělostí na buprenorfin, jiné opioidy nebo na pomocné látky [2]. Kontraindikováno je rovněž podávání pacientům závislým na opioidech a při odvykací léčbě, pacientům v deliriu tremens, s myasthenia gravis, těhotným.
Velkou opatrnost vyžadují tyto stavy:
– ‑úrazy hlavy a stavy spojené se zvýšeným nitrolebním tlakem;
– ‑omezené funkce respiračního systému (chronická obstrukční bronchopulmonální nemoc, cor pulmonale, hypoxie, hyperkapnie, přítomnost dechového útlumu včetně polékového);
– ‑staří a vyčerpaní nemocní;
– ‑pacienti se závažným postižením jater, plic, ledvin, s kyfoskoliózou, myxedémem nebo hypotyreózou, nedostatečností kůry nadledvin, útlumem CNS, toxickou psychózou, hypertrofií prostaty nebo strikturou uretry, akutní intoxikací alkoholem;
– ‑pacienti s dysfunkcí žlučových cest.
Lékové interakce
Účinek buprenorfinu může být zesílen jinými léky působícími útlum centrálního nervového systému a dechového centra (např. opioidy, benzodiazepiny, sedativa, hypnotika, celková anestetika, antihistaminika, fenothiaziny, trankvilizéry, alkohol).
Buprenorfin je metabolizován prostřednictvím cytochromu P (CYP3A4). Současné podávání léků, které inhibují nebo indukují tento enzym, tak vede k zesílení nebo k zeslabení účinku buprenorfinu [2].
V terapeutických dávkách buprenorfin nesnižuje analgetickou účinnost standardních dávek opioidních agonistů. Tyto agonisty lze aplikovat ve standardních dávkách již před skončením účinnosti buprenorfinu, aniž by se tím snížily jeho analgetické účinky.
S opatrností je třeba podávat buprenorfin pacientům léčeným zároveň inhibitory monoaminooxidázy [2].
Transdermální podávání léčiv
O transdermálním podávání léčiv se začalo uvažovat ve 20. letech 20. století, k vlastnímu používání došlo výrazně později. V 50. letech se objevily masti s nitroglycerinem a v roce 1978 náplasti se skopolaminem. V současnosti se náplasťové podávání léčiv považuje za nejúspěšnější neinvazivní aplikační cestu po perorální aplikaci. Mezi příklady indikací léčiv podávaných formou náplastí jsou vedle opioidních analgetik (fentanyl, buprenorfin) místní anestetika (lidokain, EMLA), hormonální kontraceptiva a léky pro hormonální substituci, některá antihypertenziva (klonidin, propranolol), nitráty, skopolamin, nikotin pro odvykání kouření. Uvažuje se o využití náplastí pro léčbu Parkinsonovy choroby, Alzheimerovy choroby, kardiovaskulárních onemocnění, diabetu aj. Náplasti lze využít k celkovému podání (celotělová distribuce) i k hloubkovému průniku léčiv např. do přilehlých šlach či kloubů.
Zavedení transdermálních systémů pro podávání léků znamená výrazný pokrok ve vývoji lékových forem. Mezi výhody náplasťových systémů patří obejití jaterního first-pass efektu, omezení některých nežádoucích účinků léčiva, nezatěžování gastrointestinálního traktu polykáním tablet, nemožnost uplatnění případných poruch vstřebávání z GIT, snadné dodržování dávkovacího režimu při bezproblémové a neinvazivní aplikaci, dlouhodobé udržení stabilních hladin léčiva, dlouhý interval (zpravidla 72 hodin i déle) mezi podávanými dávkami. Pacienti tento způsob aplikace dobře přijímají, což vede k lepšímu dodržování léčebného režimu (compliance). Místo aplikace musí být pravidelně měněno. Naopak k omezením této aplikační formy patří velikost a polarita molekul léčiva (tedy ne každé lze použít), pomalý nástup účinku a horší kontrolovatelnost dávky v průběhu podávání, velikost denní dávky, možnost dráždění kůže. V souvislosti s tím lze definovat požadavky na látky vhodné pro transdermální podávání – molekulová hmotnost < 1000 D, vysoká rozpustnost v tucích i ve vodě, vysoká účinnost zajišťující vstřebání efektivního množství látky i z malé absorpční plochy, nesmí dráždit ani senzitizovat kůži [7, 9, 16, 19, 37, 50, 44].
Transdermální buprenorfin v klinické praxi
Zavedení transdermální formy buprenorfinu znamenalo renesanci zájmu o tento opioid a jeho analgetický potenciál tak mohl být podstatně lépe využit [44].
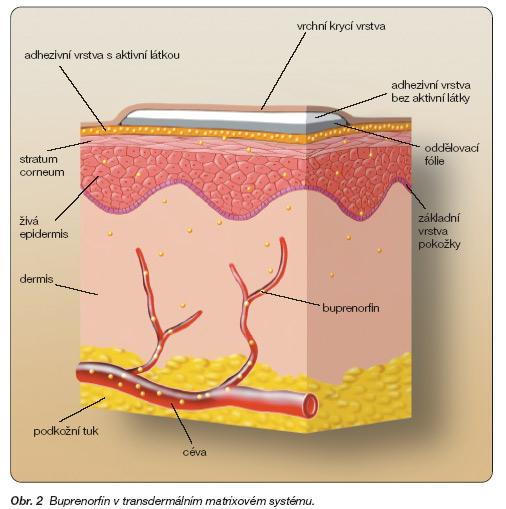
Buprenorfin je v náplasťové formě v matrixovém systému (obr. 2) na světovém trhu k dispozici od roku 2001, od roku 2003 pak v České republice ve formě náplastí s obsahem 20, 30 a 40 mg (s uvolňováním 35, 52,5 a 70 mg/hod) pro transdermální podání k léčbě středně silné a zejména silné chronické nádorové i nenádorové bolesti s garantovanou účinností po dobu 72 hodin (Transtec). Novinkou je prodloužení účinnosti náplasti až na 96 hodin, tzn. náplast může být měněna pouze 2krát za týden, např. v pondělí a ve čtvrtek.
Na trhu se objeví další, nízkodávkovaná forma náplasťového buprenorfinu umožňující dávkování 5, 10 nebo 20 mg/hod. Je určena pro mírnou až středně intenzivní chronickou bolest, přičemž trvání účinku jedné náplasti je 7 dní. Je indikován v případech chronické bolesti, kdy neopioidní analgetika neprokázala dostatečnou účinnost. U této formy jsou však v současnosti k dispozici jen omezené farmakokinetické údaje [44]. Náplast by měla být uvedena na trh v roce 2007 pod názvem Norspan. Z evropských zemí je v klinické praxi zatím zaveden pouze ve Velké Británii.
Matrixová náplast použitá jako nosič pro buprenorfin je pokročilejším transdermálním systémem, než je náplast rezervoárového typu. V podstatě sestává ze tří vrstev, z nichž nejdůležitější je vlastní přilnavá vrstva (matrix) obsahující účinnou látku. Ze spodní strany k ní lpí snímatelná fólie, ze svrchní strany pak krycí vrstva. V matrix je účinná látka homogenně rozprostřena v přilnavé látce. Tato technologie umožňuje uvolňování buprenorfinu na základě koncentračního gradientu mezi náplastí a kůží. Poškození náplasti neovlivní kontrolované uvolňování aktivní substance, takže tato technologie umožňuje případné zmenšení náplasti odstřižením tak, aby bylo možné podávat, zejména při počáteční titrační fázi, i menší dávku buprenorfinu. Snížení dávky bývá potřebné zejména u velmi mladých pacientů, seniorů, pacientů s nízkou tělesnou hmotností a rovněž u osob velmi vyčerpaných.
Náplast s buprenorfinem má zabarvení kůže. Lze ji snadno použít rovněž u pacientů s omezenou zručností. Výhodou je i možnost psát na její krycí povrch, např. poznamenat si datum nalepení nebo datum, kdy bude potřeba náplast vyměnit [44].
Studie s transdermálním buprenorfinem
Účinnost a snášenlivost transdermálního buprenorfinu byly ověřovány v několika studiích. Transdermální buprenorfin (TTS – transdermal therapeutic system) prokázal účinnost v randomizovaných placebem kontrolovaných dvojitě zaslepených studiích u středně intenzivních až závažných nádorových a závažných nenádorových bolestí nereagujících na neopioidní analgetika [11, 45, 48]. Studie Sittla a kol. [45] rovněž prokázala, že je možné bez problémů přejít od podávání tzv. slabých opioidů nebo nízkých dávek silných opioidů k podávání TTS buprenorfinu. Rovněž nejméně šestihodinový nepřerušovaný spánek byl významně častější u pacientů léčených TTS buprenorfinem ve srovnání s těmi, kterým bylo podáváno placebo.
V dlouhodobém sledování s průměrnou dobou léčby 7,5 měsíců byla analgezie označena přinejmenším za uspokojivou u 90 % pacientů. Téměř 60 % nemocných stačila v průběhu studie jedna síla náplasti, případně pouze doplněná nanejvýš jednou lingvetou (0,2 mg buprenorfinu) za den. Tento údaj svědčí o nízkém potenciálu rozvoje tolerance; 94,6 % pacientů označilo buprenorfinovou náplast z pohledu uživatele za pohodlnou [32].
Postmarketingové studie potvrdily účinnost TTS buprenorfinu u onkologické i neonkologické bolesti [24, 35]. V rozsáhlé německé studii s 13 179 pacienty ve věku 13–101 let nepotřebovala téměř polovina nemocných žádnou další analgetickou léčbu včetně tzv. záchranné medikace; 3690 pacientů (28 %) bylo léčeno pro nádorovou bolest, 9489 pacientů (72 %) pro nenádorovou bolest. V této skupině nemocných byly nejčastějšími potížemi bolesti u muskuloskeletálních onemocnění (77 % pacientů) a neuropatické bolesti (23 % pacientů). Počáteční dávka TTS buprenorfinu byla u 78 % nemocných z celého souboru 35 mg/hod. Pouze 18 % nemocných potřebovalo postupně zvyšovat dávku. TTS buprenorfin poskytoval účinnou analgezii pacientům s nádorovou i nenádorovou bolestí, bez ohledu na jejich věk a typ bolestivého syndromu. Při vstupním vyšetření označilo pouze 6 % pacientů úlevu od bolesti za dobrou nebo velmi dobrou, při první kontrole po zahájení léčby TTS buprenorfinem byla úleva od bolesti dobrá nebo velmi dobrá u 71 % a při závěrečném zhodnocení u 80 % pacientů. U méně než 5 % nemocných byla léčba přerušena pro neuspokojivou úlevu od bolesti. Nežádoucí účinky související s léčbou transdermálním buprenorfinem byly ve studii zaznamenány pouze u 10 % pacientů (2220 nežádoucích účinků u 1330 nemocných). Snášenlivost buprenorfinu nebyla závislá na věku či typu bolesti [24].
Ve studii Muriela a kol. [35] trvalo sledování nemocných čtvrt roku. Z 1223 nemocných bylo téměř 30 % ve věku 70–79 let a 82,4 % nemocných mělo neonkologickou bolest pohybového aparátu. Na začátku sledování dostávala velká většina pacientů (93,7 %) dávku 35 mg/hod. V průběhu sledování setrvalo v léčbě touto dávkou 82,2 % nemocných; 20,7 % pacientů používalo jako konkomitantní medikaci slabé opioidy, nejčastěji tramadol. Před zahájením transdermální léčby označovalo úlevu od bolesti za dobrou nebo velmi dobrou pouze 3,45 % pacientů, na konci sledovaného období to bylo 84,71 % nemocných. Výrazně se zlepšilo rovněž skóre kvality života. U 36,5 % nemocných byly uváděny nežádoucí účinky léku, v 16,2 % vedly k sejmutí náplasti.
Další retrospektivní studie proběhly ve Španělsku, publikovány byly v roce 2004. Věnovaly se účinnosti a bezpečnosti TTS buprenorfinu u chronických neuropatických, nociceptivních a nádorových bolestí [15, 41, 36] a dalším otázkám – přechodu z léčby morfinem k léčbě kombinací TTS buprenorfinu s tramadolem při průlomových bolestech [23, 6]. Výsledky potvrdily příznivý analgetický účinek transdermálního buprenorfinu ve studovaných indikacích a současně prokázaly, že buprenorfin neantagonizuje úlevu od bolesti navozenou čistými m-agonisty. TTS buprenorfin může být podáván spolu s tramadolem, který tak může být použit jako záchranná (rescue) medikace. Nicméně v uvedených studiích až 50 % pacientů nepotřebovalo doplnění transdermální léčby jiným analgetikem. Více než 60 % pacientů uvedlo, že tlumení bolesti transdermálním buprenorfinem bylo účinnější než dosavadní léčba, a více než dvě třetiny lékařů ohodnotily jeho účinnost jako velmi dobrou nebo dobrou. Celkově tyto práce potvrdily, že nízké dávky TTS buprenorfinu jsou efektivní u pacientů s dlouhodobou chronickou bolestí, u nichž dosavadní léčba včetně léčby slabými opioidy nebyla dostatečně účinná.
Použití transdermálního buprenorfinu u dětí
Léčba transdermálním buprenorfinem nebyla studována u pacientů mladších 18 let, použití léčivého přípravku u těchto pacientů se proto nedoporučuje [2]. Zejména pro déletrvající použití u chronické bolesti u dětí je dosud k dispozici jen málo publikovaných údajů. Chybějí validní farmakokinetické a farmakodynamické údaje. Zdá se však, že do budoucna může být buprenorfin jedním z nejzajímavějších analgetik určených pro dětský věk. Principiálně jiné nežádoucí účinky než u dospělých se neočekávají [34].
Praktické aspekty léčby transdermálním buprenorfinem
Typy náplastí s buprenorfinem
Náplasti s transdermálním buprenorfinem jsou v současnosti k dispozici ve třech velikostech, a tudíž i ve třech silách – čím větší je náplast, tím vyšší je dávka. Náplasti uvolňují 35, 52,5 nebo 70 mg buprenorfinu za hodinu, což přibližně odpovídá dávce 0,8, 1,2 nebo 1,6 mg/24 hod. Inovované náplasti jsou konstruovány tak, že uvolňují aktivní látku po dobu 72–96 hodin, což umožňuje, při zajištění kontinuální úlevy od bolesti, jejich výměnu pouze 2krát za týden. Analgetických plazmatických hladin je dosaženo v průběhu 12–24 hodin, ty pak zůstávají účinné po dobu 72–96 hodin. Rovnovážný stav je navozen po aplikaci třetí náplasti a následně již plazmatické hladiny nekolísají. To snižuje incidenci nežádoucích účinků souvisejících s kolísáním hladiny léčiva (peak and trough effect) [44].
Dávky sedmidenních náplastí jsou nižší – 5, 10 nebo 20 mg/hod (Norspan). Z nejsilnější z těchto náplastí se tak uvolňuje 0,48 mg buprenorfinu za 24 hodin. Farmakokinetická data prokazují, že koncentrace buprenorfinu uvolňovaná z konkrétní náplasti je přímo úměrná její ploše. Čas k dosažení ustálené plazmatické koncentrace se pohybuje mezi 24–48 hodinami, podíl celkové dávky uvolňované v sedmi dnech je 15 % [39]. Po sejmutí náplasti se snižují koncentrace buprenorfinu na polovinu v průběhu 12 hodin a pak dále postupně klesají s terminálním poločasem 26 hodin [40].
Zahájení léčby u pacientů dosud neléčených opioidy
Při zahajování léčby opioidy u pacientů, kteří doposud opioidy pravidelně neužívali, je nezbytné začít s nízkou dávkou a tu pak titrovat do dosažení požadovaného účinku. U pacientů dosud neléčených opioidy by tedy měla být léčba zahajována nejmenší buprenorfinovou náplastí – 35 mg/hod. U nemocných, u nichž lze předpokládat vysokou citlivost k opioidům, zejména u vyšších věkových skupin a pacientů s nízkou tělesnou hmotností, lze zahájit léčbu pouze s polovinou nejmenší náplasti, tedy s dávkou 17,5 mg/hod (tab. 1). Vzhledem k tomu, že buprenorfin je pevně inkorporován do matrixové náplasti, nehrozí únik účinné látky při rozstřižení náplasti.
Při zahájení léčby TTS buprenorfinem stoupá plazmatická hladina účinné látky pozvolna, proto je potřebné v prvních 12–24 hodinách pokračovat v předchozí zavedené analgetické léčbě. Po 24 hodinách je nutno analgezii zhodnotit. Při průlomové bolesti lze použít lingvety s 0,2 mg buprenorfinu, perorálního tramadolu s rychlým uvolňováním (25–50 mg) nebo jiného opioidu s rychlým uvolňováním [6]. Za optimální se považuje použití stejné molekuly, tedy sublingválního buprenorfinu, který zpravidla nevytváří nebo nezvyšuje nežádoucí účinky. Po třech dnech, při výměně první náplasti, zhodnotíme dosavadní analgezii a podle spotřebované záchranné medikace případně změníme (zvýšíme) dávku TTS buprenorfinu. Vzhledem k tomu, že hlavní cestou eliminace buprenorfinu je vylučování žlučí, není třeba dávkování redukovat u pacientů s omezenými funkcemi ledvin, např. ve vyšším věku nebo u diabetiků. Nedávné studie u hemodialyzovaných pacientů neprokázaly akumulaci buprenorfinu ani jeho metabolitu norbuprenorfinu [22, 10].
Nauzea a zvracení patří mezi nejčastější nežádoucí účinky při zahajování léčby opioidy. U těch opioid-naivních pacientů, u nichž lze předpokládat vyšší citlivost k opioidům nebo kteří jsou náchylní k nevolnosti a zvracení (např. pacienti s anamnézou kinetózy), se doporučuje na počátku léčby profylaktické podávání antiemetik.
Rotace opioidů
V léčbě intenzivní nádorové i chronické nenádorové bolesti bývá diskutován přechod z léčby jedním opioidem na léčbu opioidem druhým. V této souvislosti byla vyslovena obava, že by buprenorfin jako parciální agonista m-opioidních receptorů mohl blokovat analgetický účinek morfinu při převádění z léčby buprenorfinem na léčbu morfinem. Jak se ukázalo, obava je neopodstatněná a přechod z buprenorfinu na morfin nebo naopak lze uskutečňovat bez nebezpečí pro nemocné [3]. Je však nezbytné určit přibližné ekvianalgetické dávky. Twycross [54] doporučoval pro sublingvální buprenorfin převodní koeficient 60 (tedy v miligramech 60krát větší denní dávka perorálního morfinu než sublingválního buprenorfinu) pro zachování uspokojivé analgezie a přijatelných nežádoucích účinků, ale koeficient 100 v situaci, kdy je potřeba zesílit analgezii dosud navozovanou buprenorfinem.
Transdermální buprenorfin lze zařadit do rejstříku opioidů vhodných k tzv. rotaci [45, 42]. Pokud přecházíme z léčby některým ze slabých opioidů na léčbu buprenorfinem, měla by být první dávka TTS buprenorfinu co nejnižší. Pokud přecházíme na léčbu buprenorfinem z podávání některého ze silných opioidů (tedy v úrovni 3. stupně analgetické léčby), pak musíme dávku přizpůsobit dávce dosavadního opioidu tak, abychom pokud možno hned na začátku docílili srovnatelného nebo lepšího analgetického účinku.
Přepočítávání dávek opioidů se zpravidla děje pomocí morfinového ekvivalentu. Na základě předchozích zkušeností se sublingválním buprenorfinem bylo dávkování buprenorfinu k morfinu stanoveno v poměru 1 : 60 až 1 : 100. Pro TTS fentanyl byl stanoven poměr 1 : 100, tedy TTS fentanyl v mg/den x 100 = p.o. morfin v mg/den [20].
Nové zkušenosti ukazují, že buprenorfin a fentanyl jsou ekvianalgetické a že přepočtecí poměr k morfinu by měl být totožný pro obě látky – tedy 1 : 100 (tab. 2).
Podobné výsledky přinesla randomizovaná placebem kontrolovaná dvojitě zaslepená studie s dobrovolníky, kteří dostávali infuze s fentanylem, s buprenorfinem, s kombinací obou látek nebo s placebem [53]. Na modelu bolesti vyvolané transkutánní elektrickou stimulací prokázal buprenorfin a fentanyl dávkově srovnatelný analgetický účinek. Nástup analgetického účinku buprenorfinu byl o něco málo pomalejší, ale analgezie přetrvávala déle. Buprenorfin prokázal rovněž zřetelný antihyperalgický účinek, který přesáhl účinek analgetický. Zdá se tedy, že buprenorfin je účinnější, než se dříve předpokládalo. V nedávné retrospektivní studii zaměřené na srovnání předepisovaných dávek TTS buprenorfinu a fentanylu u velkého množství nemocných ve 400 praxích ve Spolkové republice Německo autoři zjistili, že převodní poměr dávkování buprenorfinu k morfinu 1 : 110 až 1 : 115 odpovídá podstatně více běžné praxi než poměr 1 : 75 [46]. Tyto výsledky naznačují, že by měly být korigovány dosud používané převodní tabulky. Oprava by však měla být provedena na podkladě přesně provedených kontrolovaných studií. Dávkování je však vždy nutno individuálně přizpůsobit danému pacientovi. Nově definovaná denní dávka transdermálního buprenorfinu je 1,2 mg.
Retrospektivní studie se 448 nemocnými s neonkologickou bolestí a se 446 pacienty s onkologickou bolestí léčenými nejméně po dobu 3 měsíců transdermálním fentanylem nebo transdermálním buprenorfinem prokázala statisticky významnější nárůst potřebné analgetické dávky TTS fentanylu oproti TTS buprenorfinu v průběhu sledované periody. Autoři usuzují, že tolerance k analgetickému účinku se vyvíjí rychleji u TTS fentanylu, což může vést v průběhu času k horší kontrole bolesti, nárůstu nežádoucích účinků a ceny léčby [47].
Při přerušení či ukončení léčby transdermálním buprenorfinem je potřeba vzít v úvahu pomalou disociaci látky z receptorů a s tím související pomalý pokles plazmatické koncentrace buprenorfinu. Analgetický účinek tak přetrvává řadu hodin po sejmutí náplasti. Nový opioid by neměl být podán v prvních 12–24 hodinách po sejmutí náplasti. Jedinou výjimkou je transdermální fentanyl, jehož plazmatická hladina se bude po první aplikaci rovněž pozvolna zvyšovat v době, kdy pomalu klesá hladina buprenorfinu po sejmutí náplasti.
Léčba epizod průlomové bolesti
Při používání jakéhokoli opioidu s pomalým uvolňováním bývá vhodné současně vybavit pacienta rychle nastupující formou opioidu s krátkodobým účinkem, a to zejména v průběhu počáteční titrační fáze. Optimální je, pokud lze použít rychle účinkující formu téhož opioidu. Proto je preparátem první volby pro průlomovou bolest při léčbě TTS buprenorfinem sublingvální buprenorfin. Ten však není v ČR v současnosti dostupný. Dávka sublingválního buprenorfinu pro průlomovou bolest by měla být šestinou až desetinou denní náplasťové dávky. Např. při dávce 70 mg/ hod, tedy 1,6 mg/24 hod., by měla být jednorázová dávka sublingválního buprenorfinu 0,2 mg.
Není-li k dispozici sublingvální buprenorfin, lze použít morfin nebo fentanyl ve formách s rychlým uvolňováním (rychle uvolňovaný fentanyl není v ČR rovněž k dispozici). S dobrými výsledky lze použít rovněž tramadol, při použití nejmenších buprenorfinových náplastí (35 mg/ hod) jej podáváme v dávkovacím rozmezí 25–50 mg [44].
Prevence a léčba nežádoucích účinků
I když má buprenorfin menší potenciál indukce fyzické závislosti než morfin, symptomy z odnětí se po chronickém užívání objevují.
Transdermání buprenorfin byl v dosavadních studiích dobře snášen. Pokud se nežádoucí účinky vyskytly, byly v randomizovaných studiích označeny za mírné až střední v 65 % a za závažné v necelých 25 %. Ve studii s dlouhodobým následným sledováním pacientů byly uvedeny jako mírné až střední ve 48,7 %, jako závažné ve 44 %. V této studii udalo systémové vedlejší účinky 45,6 % nemocných, ale pouze 20 % účinků bylo spojeno se studovanou látkou [43].
Nežádoucí účinky se mohou vyskytnout v souvislosti s náplastí (místní projevy typu erytému a pruritu), v souvislosti s buprenorfinem (systémové účinky typické pro opioidy) i v souvislosti se základním onemocněním. Nežádoucí účinky se častěji vyskytovaly u onkologicky nemocných (46,6 %) než u neonkologických pacientů (34,2 %).
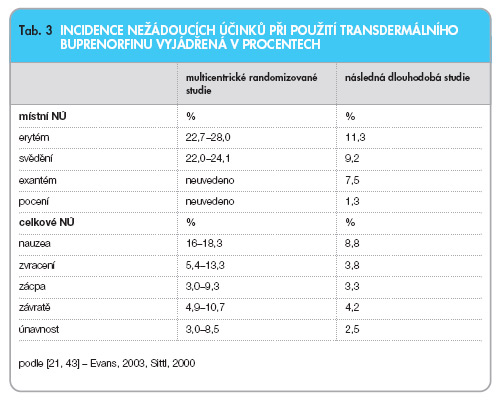
Nejčastějšími systémovými nežádoucími účinky jsou projevy gastrointestinální a centrálně nervové [43]. S postupem času se procento většiny celkových nežádoucích účinků snižuje (tab. 3).
Při použití nejmenších náplastí (35 mg/ hod) je procento celkových nežádoucích účinků (38 %) srovnatelné s placebem. Při vyšších dávkách (52,5 a 70 mg/hod) byl zaznamenáván 45–50% výskyt nežádoucích účinků. Nejčastějšími centrálními nežádoucími účinky jsou nauzea, závratě, únavnost. Při dlouhodobém sledování je procento celkových nežádoucích účinků nižší v souvislosti s rozvojem tolerance k nim v průběhu času [11, 31, 32, 45, 48].
Jako profylaxi nevolnosti a zvracení lze použít antiemetika z řad antagonistů dopaminových, histaminových (H1), serotoninových (5-HT3) i acetylcholinových receptorů, a rovněž kortikosteroidy. Antiemetickou profylaxi je potřebné nasadit ještě před nástupem nauzey (čili při nalepení nebo krátce po nalepení první náplasti) a dávkovat ji dostatečně vysoko. Profylaxe by měla probíhat v prvních 7–10 dnech po zahájení léčby TTS buprenorfinem. Poté by měl být stav zhodnocen, a pokud to situace dovolí, lze antiemetika postupně vysadit. Druhou variantou je použití antiemetik terapeuticky, tedy až v době po nástupu příznaků. I antiemetika mají nežádoucí účinky, proto je používejme pouze tam, kde jsou skutečně indikována. V případě refrakterního zvracení lze krátkodobě ordinovat i kortikosteroidy, zejména dexamethason [29].
Zácpa je častým nežádoucím jevem spojeným s léčbou opioidy a pro pacienty je značně obtěžující. V průběhu času na ni nevzniká významná tolerance. Buprenorfin sám o sobě má potenciál vzniku zácpy nižší při podávání jakoukoli cestou [4]. Zkušenosti s podáváním TTS buprenorfinu to potvrzují. Přesto je nezbytné výskyt zácpy u každého pacienta sledovat a v případě potřeby předepisovat projímadla.
Riziko rozvoje analgetické tolerance či dechové deprese je při léčbě buprenorfinem velmi nízké.
Ve všech randomizovaných studiích byly přibližně u jedné třetiny pacientů konstatovány místní kožní reakce po sejmutí náplasti, ať už se jednalo o účinnou látku nebo o placebo. Místní reakce jsou spíše způsobeny materiálem vlastní náplasti nebo adhezivní substance. Nejčastěji se jedná o zarudnutí a svědění, zpravidla přechodné, mírné či střední intenzity. Při dlouhodobých sledováních bývá procento uváděných kožních reakcí nižší – kolem 10 %. Většina kožních příznaků ustoupí do 24 hodin po sejmutí náplasti [11, 32, 45, 48].
Vyskytne-li se kožní reakce, je prvním opatřením změna místa nalepení. Pokud to nestačí, lze použít ochranné krémy a masti. Při závažnějších reakcích lze použít antihistaminika, případně i kortikosteroidy. Tyto preparáty mohou být použity i profylakticky u pacientů s výrazně citlivou kůží.
Osoby se známou přecitlivělostí na buprenorfin, s anamnézou kontaktní dermatitidy nebo alergie na náplasti by neměly být transdermálním buprenorfinem léčeny. U pacientů s přecitlivělou kůží je vhodné aplikovat náplasti v místech, kde je kůže silnější – např. na stehnech, pažích. Vždy je nezbytné při každém lepení další náplasti změnit místo aplikace. Na předchozí místo se lze vrátit až po nejméně 9–12denní přestávce.
Náplasti by měly být snímány opatrně a pozvolna, tedy nikoli prudkým trhnutím. Ochlupená místa je potřeba ostříhat, nikoli oholit. Náplasti pochopitelně nelepíme na oblasti poškozené kůže.
Pacienty musíme poučit, že nemají chodit do sauny či horké lázně. Výrazné zevní horko vede ke zvýšení kožního krevního průtoku, a tím k rychlejšímu vstřebávání buprenorfinu s následným nekontrolovaným zvýšením plazmatické hladiny. Z podobných důvodů je nutné vyhýbat se ohřívacím poduškám, silnému slunečnímu svitu, infračerveným zářičům. Opatrní musíme být u pacientů s horečkou, u nichž se rovněž zvyšuje vstřebávání účinné látky kůží. Přes výše uvedená omezení mohou pacienti bez obav provozovat většinu běžných aktivit včetně sprchování a koupání. Pacienti si na život s náplastmi brzy zvykají [44].
Závěr
Transdermální buprenorfin výrazně rozšířil paletu možností neinvazivní dlouhodobé opioidní léčby u pacientů se závažnými bolestmi onkologického i neonkologického původu. Jeho vlastnosti umožňují v případě potřeby zapojení do režimu rotace opioidů. Transdermální forma buprenorfinu vedla k výrazné renesanci použití tohoto analgetika. Pětileté (v ČR tříleté) klinické zkušenosti s transdermálním buprenorfinem prokázaly jak kvalitní analgetickou účinnost, tak dobrou snášenlivost u široké škály pacientů i indikací.
Seznam použité literatury
- [1] Anonymus. FDA safety-related drug labeling changes. February 2002. Available at: http: //www.fda.gov/medwatch/SAFETY/2002/Feb02.htm.
- [2] Anonymus. Transtec: souhrn údajů o přípravku. Datum poslední revize 29. 3. 2006.
- [3] Atkinson RE, Schofield P, Mellor P. The efficacy in sequential use of buprenorphine and morphine in advanced cancer pain. In: Doyle D (ed). Opioids in the Treatment of Cancer Pain. London: Royal Society of Medicine 1990: 81–87.
- [4] Bach V, Kamp-Jensen M, Jensen NH, Eriksen J. Buprenorphine and sustained release morphine – effect and side-effects in chronic use. The Pain Clinic 1991; 4: 87–93.
- [5] Baster TJ, Gibbs JM, Richardson T. The respiratory effects of buprenorphine. N Z Med J 1976; 84: 325.
- [6] Barutell C and The Opioid Study Group of the Spanish Pain Society. Buprenorphine and tramadol. Rev Soc Esp Dolor 2004; Suppl V: 31–40.
- [7] Benson HAE, Prankerd RJ. Optimisation of drug delivery 4: transdermal drug delivery. Aust J Hosp Pharm 1997; 27: 441–448.
- [8] Bentley KW, Hardy DG, Meek B. Novel analgesics and molecular rearrangements in the morphine-thebaine group. II. Alcohols derived from 6, 14-endoetheno- and 6, 14-endoethenotetrahydro-thebaine. J Am Chem Soc 1967; 89: 3273–3280.
- [9] Berner B, John VA. Pharmacokinetic characterisation of transdermal delivery systems. Clin Pharmacokinet 1994; 26: 121–134.
- [10] Böger RH. Renal impairment: a challenge for opioid treatment? The role of buprenorphine. Palliative Medicine 2006; 20: 17–23.
- [11] Böhme K, Likar R. Efficacy and tolerability of a new opioid analgesic formulation, buprenorphine transdermal therapeutic system (TDS), in the treatment of patients with chronic pain. A randomized, double-blind, placebo-controlled study. The Pain Clinic 2003; 15: 193–202.
- [12] Budd K. High dose buprenorphine for postoperative analgesia. Anaesthesia 1981; 36: 900–903.
- [13] Budd K. Experience with partial agonists in the treatment of cancer pain. In: Doyle D (ed). Opioids in the Treatment of Cancer Pain. International Congress and Symposium Series No. 146. London: Royal Society of Medicine 1990: 51–55.
- [14] Budd K. Buprenorphine and the transdermal system: the ideal match in pain management. Int J Clin Pract Suppl 2003; Suppl 133: 9–14.
- [15] Camba MA and The Opioid Study Group of the Spanish Pain Society. Transdermal buprenorphine for the management of nociceptive chronic pain. Rev Soc Esp Dolor 2004; Suppl V: 22–30.
- [16] Caplan RA, Southam M. Transdermal drug delivery and its application to pain control. In: Benedetti C (ed). Advances in Pain Research and Therapy. New York: Raven Press 1990; 14: 233–240.
- [17] Cowan A, Lewis JW, MacFarlane IR. Agonist and antagonist properties of buprenorphine, a new antinociceptive agent. Br J Pharmacol 1977; 60: 537–545.
- [18] Dahan A. Opoiod-induced respiratory effects: new data on buprenorphine. Palliative Medicine 2006; 20: 3–8.
- [19] Doležal R. Transdermální léčba. Co nás čeká v budoucnosti. Přednáška na III. symposiu o bolesti v Brně, duben 2005.
- [20] Donner B, Zenz M, Tryba M, et al. Direct conversion from oral morphine to transdermal fentanyl: a multicenter study in patiens with cancer pain. Pain 1996; 64: 527–534.
- [21] Evans HC, Easthope SE. Transdermal buprenorphine. Drugs 2003; 63: 1999–2010.
- [22] Filitz J, Sittl R, Griessinger N, et al. Pharmacokinetics of transdermal buprenorphine (Transtec®) in patiens with renal insufficiency. Eur J Palliat Care. Abstracts of the 9th Congress of the European Association for Palliative Care. Aachen 2005, Abstract 364.
- [23] Gonzales-Escalada JR and The Opioid Study Group of the Spanish Pain Society. Use of buprenorphine and oral morphine in patiens with chronic pain. Rev Soc Esp Dolor 2004; Suppl V: 3–10.
- [24] Griessinger N, Sittl R, Likar R. Transdermal buprenorphine in clinical practice – a post-marketing surveillance study in 13 179 patients. Curr Med Res Opin 2005; 21: 1147–1156.
- [25] Heel RC, Brogden RN, Speight TM, Avery GS. Buprenorphine: a review of its pharmacological properties and therapeutic efficacy. Drugs 1979; 17: 81–119.
- [26] Hovell BC. Comparison of buprenorphine, pethidine and pentazocine for the relief of pain after operation. Br J Anaesth 1977; 49: 913.
- [27] Jasinski DR, Pevnick JS, Griffith JD. Human pharmacology and abuse potential of the analgesic buprenorphine: a potential agent for treating narcotic addiction. Arch Gen Psychiatry 1978; 35: 501–516.
- [28] Leander JD. Buprenorphine is a potent -opioid receptor antagonist in pigeons and mice. Eur J Pharmacol 1988; 151: 457–461.
- [29] Lee Y, Lin YS, Chen YH. The effect of dexame-thasone upon PCA-related nausea and vomiting. Anesthesiology 2002; 57: 75–79.
- [30] Lewis JW. Buprenorphine. Drug Alcohol Depend 1985; 14: 363–372.
- [31] Likar R. Transdermal buprenorphine in the management of persistent pain – safety aspects. Therapeutics and Clinical Risk Management 2006; 2: 115–125.
- [32] Likar R, Griessinger N, Sajdak A, Sittl R. Transdermal buprenorphine for treatment of chronic tumor and non-tumor pain (in German). Wien Med Wchschr 2003; 153: 317–322.
- [33] McCormack K. Signal transduction in neuropathic pain, with special emphasis on the analgesic role of opioids – Part II: Moving basic science towards a new pharmacotherapy. Pain Reviews 1999; 6: 99–131.
- [34] Michel E, Zernikow B. Buprenorphineinsatz bei Kindern. Schmerz 2006; 20: 40–50.
- [35] Muriel C, Falde I, Mico JA, et al. Results of an open, uncontrolled, prospective, observational, multi-center clinical study on the effectiveness and safety of transdermal buprenorphine in patiens with moderate to severe chronic pain. Clin Ther 2005; 27: 451–462.
- [36] Muriel C and The Opioid Study Group of the Spanish Pain Society. Assessment of buprenorphine transdermal patch in patiens with cancer pain. Rev Soc Esp Dolor 2004; Suppl V: 41–48.
- [37] Prausnitz M, Mitragotri S, Langer R. Current status and future potential of transdermal drug delivery. Nature Reviews 2004; 3: 115–124.
- [38] Rance MJ, Shillingford JS. The role of the gut in the metabolism of strong analgesics. Biochem Pharmacol 1976; 25: 735–741.
- [39] Reidenberg B, El-Tahtawy A, Munera C, et al. Absolute bioavailability of a novel buprenorphine transdermal system (BTDS) applied for 7 days (abstract). J Clin Pharmacol 2001; 41: 1026.
- [40] Reidenberg B, El-Tahtawy A, Munera C, et al. Daily pharmacokinetic performance of a buprenorphine transdermal system (BTDS) for up tu 7 days (abstract). J Clin Pharmacol 2001b; 41: 1027.
- [41] Rodriguez-Lopez MJ and The Opioid Study Group of the Spanish Pain Society. Transdermal buprenorphine in the management of nociceptive chronic pain. Rev Soc Esp Dolor 2004; Suppl V: 11–21.
- [42] Schriek P. Treatment of cancer-related pain with transdermal buprenorphine: a report of three cases. Support Care Cancer 2004; 12: 882–884.
- [43] Sittl R. Buprenorphine transdermal patch: clinical expert report. Germany: Grünenthal GmbH 2000.
- [44] Sittl R. Transdermal buprenorphine in clinical practice. In: Budd K, Raffa RB (eds). Buprenorphine – The Unique Opioid Analgesic. Pharmacology and Clinical Application. Georg Thieme Verlag Stuttgart, 2005: 92–101.
- [45] Sittl R, Griessinger N, Likar R. Analgesic efficacy and tolerability of transdermal buprenorphine in patiens with inadequately controlled chronic pain related to cancer and other disorders: a multicenter, randomized, double-blind, placebo-controlled trial. Clin Ther 2003; 25: 150–168.
- [46] Sittl R, Likar R, Poulsen-Nautrup B. Equipotent doses of transdermal fentanyl and transdermal buprenorphine in patiens with cancer and noncancer pain: results of a retrospective cohort study. Clin Ther 2005; 27: 225–237.
- [47] Sittl R, Nuijten M, Poulsen-Nautrup B. Changes in the prescribed daily doses of transdermal fentanyl and transdermal buprenorphine during treatment of patiens with cancer and noncancer pain in Germany: results of a retrospective cohort study. Clin Ther 2005b; 27: 1022–1031.
- [48] Sorge J, Sittl R. Transdermal buprenorphine in the treatment of chronic pain: results of a phase III, multicenter, randomized, double-blind, placebo-controlled study. Clin Ther 2004; 26: 1808–1820.
- [49] Ševčík P. Buprenorphinum. Remedia 2003; 13: 360–370.
- [50] Ševčík P, Vorlíček J. Transdermální fentanyl – nová léková forma podávání opioidů. Remedia 1998; 8: 289–293.
- [51] Terlinden R. Pupillometry data as pharmacodynamic parameter from a pharmacokinetic study on single appliccation of buprenorphine transdermal system (TDS) (data on file). Aachen: Grünenthal GmbH, 2000.
- [52] Terlinden R, Stadler T. Pharmacokinetic study on single application of buprenorphine transdermal system (TDS) (data on file). Aachen: Grünenthal GmbH, 2000.
- [53] Tröster A, Singler B, Sittl R, et al. Quantification of analgesic and antihyperalgesic effects of buprenorphine and fentanyl in healthy volunteers. Eur J Palliat Care. Abstracts of the 9th Congress of the European Association for Palliative Care. Aachen 2005, Abstract 363.
- [54] Twycross RG. Opioid analgesics in cancer pain: current practice and controversies. Cancer Surveys 1998; 7: 29–53.
- [55] Walsh SL, Preston KL, Stitzer ML, et al. Clinical pharmacology of buprenorphine: ceiling efects at high doses. Clin Pharmacol Ther 1994; 55: 569–580.
- [56] Zaki PA, Keith DE, Brine GA, et al. Ligand-induced changes in surface -opioid receptor number: relationship to G protein activation? J Pharmacol Exp Ther 2000; 292: 1127–1134.