Alemtuzumab
Alemtuzumab je monoklonální protilátka proti molekule CD52 přítomné na imunitních buňkách, převážně lymfocytech. V roce 2001 byl alemtuzumab zaregistrován pro použití u chronické B-lymfocytární leukemie, nově byla tato látka úspěšně zkoušena u relabující-remitující roztroušené sklerózy (RS), a to proti standardní léčbě první linie (interferon beta-1a s.c.) u pacientů dosud neléčených i u pacientů, kteří dostatečně neodpovídají na standardní léčbu. Alemtuzumab má mohutný protizánětlivý účinek, snižuje počty relapsů, zpomaluje progresi onemocnění, snižuje počty nových a zvětšujících se T2 hyperintenzních lézí, počty gadolinium vychytávajících lézí při zobrazení magnetickou rezonancí a zpomaluje nárůst mozkové atrofie. Nežádoucí účinky zahrnují infuzní reakce, lehce zvýšené množství běžných infekcí a možnost vzniku dalších autoimunit (tyreopatie, trombocytopenie, nefropatie). Pro bezpečnost pacienta je proto zaveden monitorovací program na 4 roky po posledním podání alemtuzumabu. Výhodou alemtuzumabu je dlouhodobý účinek vznikající přenastavením imunitního systému – podává se dvakrát v ročních cyklech a pak pouze při obnovené aktivitě choroby, u řady pacientů vede k několikaleté remisi onemocnění RS.
Farmakologická skupina
Alemtuzumab (ATC kód: L01XC04; plánovaná změna ATC kódu od roku 2015: L04AA34) náleží podle registrace Evropské lékové agentury (EMA) v indikaci roztroušené sklerózy v roce 2013 do indikační skupiny číslo 59 imunopreparáty. Alemtuzumab patří do skupiny humanizovaných monoklonálních protilátek [1].
Chemické a fyzikální vlastnosti
Alemtuzumab je genetickým inženýrstvím připravená humanizovaná monoklonální protilátka typu IgG1 proti povrchovému antigenu CD52. Její molekulová hmotnost je 150 kD. Humanizovaná protilátka byla připravena vložením šesti oblastí determinujících komplementaritu (CDRs) z myší monoklonální protilátky IgG2a do molekuly humánního IgG1. Molekula alemtuzumabu se skládá ze dvou lehkých řetězců o 214 aminokyselinách s molekulovou hmotností 24 kD a ze dvou větších řetězců o 450 aminokyselinách s molekulovou hmotností 49 kD spojených dvěma disulfidickými můstky mezi lehkou a těžkou částí a dvěma disulfidickými můstky mezi oběma těžkými řetězci tak, že vzniká molekula ve tvaru písmene Y, typická pro třídu IgG1. Každá molekula také obsahuje celkem 12 disulfidických můstků v rámci řetězců [2, 3].
Alemtuzumab je dodáván jako sterilní, čirý, bezbarvý či slabě nažloutlý koncentrovaný roztok o objemu 1,2 ml, který musí být naředěn před intravenózním podáním ve 100 ml buď fyziologického roztoku chloridu sodného (0,9 %) nebo izotonického roztoku glukózy (5 %). Roztok neobsahuje žádné antimikrobiální konzervační látky, proto by se měl naředěný podat okamžitě. Pokud to není možné, výrobce doporučuje uchovávat jej po otevření maximálně 8 hodin při teplotě 2–8 °C; stabilita byla prokázána po dobu 24 hodin od otevření či rekonstituce („in-use“ stability). Roztok je třeba chránit před světlem. Exspirace je 36 měsíců za podmínek uchovávání v chladu (2–8 °C) a ochrany před světlem a mrazem [3].
Mechanismus účinku, farmakodynamika
Povrchový antigen CD52 je relativně krátký peptid složený z 12 aminokyselin, který je navázán na glykosylfosfatidylinositol na povrchu lymfocytů, méně monocytů, makrofágů a NK (natural killers, přirození zabíječi) buněk. Progenitorové kmenové buňky kostní dřeně, plazmatické buňky a neutrofily na povrchu antigen CD52 neexprimují (nebo zcela minimálně); CD52 je přítomen také na epiteliálních buňkách distálního epididymis a na spermiích. Funkce CD52 není dosud zcela objasněna. Jedna z teorií říká, že tento antigen díky rozsáhlé glykosylaci, vysokému počtu jednotek na povrchu buňky a negativnímu náboji brání adhezi buněk, neboť lymfocyty a spermie jsou buňky, které „cestují k cíli“ [4]. Novější studie prokázala vyšší frekvenci antigenu CD52 na aktivovaných lymfocytech, které uvolněním antigenu CD52 z povrchu inhibují ostatní typy T lymfocytů vazbou na receptor Siglec-10 (sialic acid-binding immunoglobulin-like lectins-10). Aktivace receptoru Siglec-10 brání fosforylaci TCR (T-cell antigen receptor) k receptoru asociovanými tyrozinkinázami Zap70 a LCK a tím brání aktivaci T lymfocytů [5].
Alemtu![Obr. 1 Mechanismus účinku alemtuzumabu; volně podle [38] – Havrdová, et al., 2013.](https://www.remedia.cz/photo-a-29790---.jpg) zumab je monoklonální protilátka, která se specificky váže na povrchový antigen CD52. Alemtuzumab opsonizuje buňky exprimující povrchový antigen CD52 a indukuje jejich smrt prostřednictvím komplementem zprostředkované buněčné lýzy (complement-mediated cell lysis, CMCL) nebo cytotoxické reakce závislé na protilátkách (antibody-dependent cellular cytotoxicity, ADCC), viz obr. 1 [2]. Je stále otázkou, který z mechanismů se uplatňuje více. Studie na transgenních myších s humánním povrchovým antigenem CD52 upřednostňuje ADCC, neboť odstraněním neutrofilů a NK buněk pomocí protilátek proti růstovým faktorům těchto buněk došlo ke značnému snížení účinku alemtuzumabu, zatímco odstranění komplementu faktorem z jedu kobry nemělo na účinek žádný vliv. Pokud se podal alemtuzumab bez manipulace s ADCC/CMCL, byl pozorován obdobný úbytek lymfocytů a přechodné zvýšení hladiny cytokinů jako u člověka. Výrazně méně než v periferní krvi byly zasaženy lymfocyty v lymfatických orgánech, což by mohlo vysvětlit pozorovanou relativně nízkou četnost infekcí [6]. Na druhou stranu má logiku i názorový proud, který se domnívá, že díky přechodnému snížení počtu NK buněk, na jejichž povrchu je také (i když v malé míře) antigen CD52 exprimován, hraje hlavní roli v procesu cytotoxicity alemtuzumabu komplement [7].
zumab je monoklonální protilátka, která se specificky váže na povrchový antigen CD52. Alemtuzumab opsonizuje buňky exprimující povrchový antigen CD52 a indukuje jejich smrt prostřednictvím komplementem zprostředkované buněčné lýzy (complement-mediated cell lysis, CMCL) nebo cytotoxické reakce závislé na protilátkách (antibody-dependent cellular cytotoxicity, ADCC), viz obr. 1 [2]. Je stále otázkou, který z mechanismů se uplatňuje více. Studie na transgenních myších s humánním povrchovým antigenem CD52 upřednostňuje ADCC, neboť odstraněním neutrofilů a NK buněk pomocí protilátek proti růstovým faktorům těchto buněk došlo ke značnému snížení účinku alemtuzumabu, zatímco odstranění komplementu faktorem z jedu kobry nemělo na účinek žádný vliv. Pokud se podal alemtuzumab bez manipulace s ADCC/CMCL, byl pozorován obdobný úbytek lymfocytů a přechodné zvýšení hladiny cytokinů jako u člověka. Výrazně méně než v periferní krvi byly zasaženy lymfocyty v lymfatických orgánech, což by mohlo vysvětlit pozorovanou relativně nízkou četnost infekcí [6]. Na druhou stranu má logiku i názorový proud, který se domnívá, že díky přechodnému snížení počtu NK buněk, na jejichž povrchu je také (i když v malé míře) antigen CD52 exprimován, hraje hlavní roli v procesu cytotoxicity alemtuzumabu komplement [7].
Přesný mechanismus účinku alemtuzumabu není znám, obecně se však soudí, že účinek na roztroušenou sklerózu je dán přenastavením imunitního systému. Po podání dochází k rychlému snížení počtu T a B lymfocytů v krvi, zatímco počet lymfocytů v lymfoidních orgánech je ovlivněn méně (pravděpodobně z důvodu kombinace faktorů – dávka, dávkovací schéma a nižší aktivita CMCL a ADCC v těchto orgánech). Buňky nespecifické imunity jsou ovlivněny minimálně.
Studie in vitro prokázaly citlivost různých myeloidních a lymfoidních buněk na alemtuzumabem zprostředkovanou CMCL i ADCC, jež korelovala s koncentrací povrchového antigenu CD52. Alemtuzumab neměl signifikantní vliv na počet monocytů, bazofilů, dendritických buněk; efekt na snížení NK buněk byl malý. Studie in vivo probíhaly na transgenních myších s humánním antigenem CD52. Sledováno bylo především snížení počtu lymfocytů. Během 24 hodin od podání alemtuzumabu bylo dosaženo snížení počtu T a B lymfocytů [2]
Zatím nej![Graf 1 Průměrné hodnoty počtu různých typů leukocytů po podání alemtuzumabu ve studii CARE-MS II; podle [9] – Coles, et al., 2012. Referenční rozmezí pro vybrané hematologické hodnoty: neutrofily 1,8–7 × 109/l; lymfocyty 1,0–4,8 × 109/l; monocyty 0,1–0,8 × 109/l; eozinofily 0–0,45 × 109/l; bazofily 0–0,2 × 109/l.](https://www.remedia.cz/photo-a-29791---.jpg) podrobnější měření počtu leukocytů po podání alemtuzumabu bylo prováděno v rámci studií fáze III – CARE-MS I a CARE-MS II [8, 9]. Průměrný počet různých typů leukocytů v průběhu dvouletého sledování ve studii CARE-MS II je zobrazen v grafu 1. Po podání alemtuzumabu (5 infuzí po 12 mg/den v pěti dnech v prvním roce a 3 infuze po 12 mg/den v druhém roce) došlo při první návštěvě po jednom měsíci od podání k výraznému snížení počtu lymfocytů pod spodní hranici normálu. Ovlivnění neutrofilů, monocytů, eozinofilů a bazofilů bylo přechodné a nevýznamné. Návrat počtu B lymfocytů do normálních hodnot byl pozorován zhruba po šesti měsících, T lymfocyty se obnovovaly výrazně pomaleji a dosáhly spodní hodnoty normálního rozmezí za zhruba jeden rok [10]. Vliv na jednotlivé řady lymfocytů byl ve studiích CARE-MS zkoumán a publikován ve formě abstraktů. Počet B lymfocytů po podání alemtuzumabu prudce klesl, návrat k normálním hodnotám byl provázen relativně větším zastoupením nezralých B lymfocytů po třech měsících od podání léčby. V řadě T lymfocytů došlo ke změně procentuálního zastoupení jednotlivých typů. Prudký pokles počtu T lymfocytů provázel relativní nárůst zastoupení paměťových a regulačních T lymfocytů na úkor progenitorů T lymfocytů, a to jak u pomocných, tak u cytotoxických T lymfocytů. Po 12 měsících od ukončení léčby bylo stále vyšší relativní zastoupení regulačních a paměťových pomocných T lymfocytů [11, 12]. Léčba alemtuzumabem byla v jiné studii asociována s dlouhodobým poklesem produkce prozánětlivých cytokinů IL-17 a IL-22 produkovaných Th17 lymfocyty [13].
podrobnější měření počtu leukocytů po podání alemtuzumabu bylo prováděno v rámci studií fáze III – CARE-MS I a CARE-MS II [8, 9]. Průměrný počet různých typů leukocytů v průběhu dvouletého sledování ve studii CARE-MS II je zobrazen v grafu 1. Po podání alemtuzumabu (5 infuzí po 12 mg/den v pěti dnech v prvním roce a 3 infuze po 12 mg/den v druhém roce) došlo při první návštěvě po jednom měsíci od podání k výraznému snížení počtu lymfocytů pod spodní hranici normálu. Ovlivnění neutrofilů, monocytů, eozinofilů a bazofilů bylo přechodné a nevýznamné. Návrat počtu B lymfocytů do normálních hodnot byl pozorován zhruba po šesti měsících, T lymfocyty se obnovovaly výrazně pomaleji a dosáhly spodní hodnoty normálního rozmezí za zhruba jeden rok [10]. Vliv na jednotlivé řady lymfocytů byl ve studiích CARE-MS zkoumán a publikován ve formě abstraktů. Počet B lymfocytů po podání alemtuzumabu prudce klesl, návrat k normálním hodnotám byl provázen relativně větším zastoupením nezralých B lymfocytů po třech měsících od podání léčby. V řadě T lymfocytů došlo ke změně procentuálního zastoupení jednotlivých typů. Prudký pokles počtu T lymfocytů provázel relativní nárůst zastoupení paměťových a regulačních T lymfocytů na úkor progenitorů T lymfocytů, a to jak u pomocných, tak u cytotoxických T lymfocytů. Po 12 měsících od ukončení léčby bylo stále vyšší relativní zastoupení regulačních a paměťových pomocných T lymfocytů [11, 12]. Léčba alemtuzumabem byla v jiné studii asociována s dlouhodobým poklesem produkce prozánětlivých cytokinů IL-17 a IL-22 produkovaných Th17 lymfocyty [13].
Lze tedy shrnout, že alemtuzumab uplatňuje imunomodulační účinky prostřednictvím deplece a repopulace lymfocytů, včetně alterací v počtu, proporcích a vlastnostech některých podskupin lymfocytů po léčbě, zvýšeného zastoupení podskupin regulačních T buněk, zvýšeného zastoupení paměťových T a B lymfocytů, přechodných účinků na složky vrozené imunity (tj. neutrofily, makrofágy, NK buňky) [3]. Ke zlepšení klinického skóre by mohly přispět „restartované“ T lymfocyty, které v CNS uvolňují neurotrofiny (brain-derived neurotrophic factor nebo ciliary neurotrophic factor), jež přispívají k remyelinizaci nervové tkáně [14].
Obnova počtu T lymfocytů probíhá spíše proliferací periferních lymfocytů, které unikly zániku (homeostatická proliferace), než tvorbou nových T lymfocytů v thymu. Tento fakt může vést ke zvýšenému riziku vzniku autoimunitních komplikací (tyreopatie, nefropatie nebo trombocytopenická purpura), neboť periferní expanze vede ke zvýšenému riziku tvorby autoreaktivních klonů T lymfocytů [15].Z výsledků malé studie nevyplývá, že by alemtuzumab ovlivňoval imunologickou odpověď po podání určitých vakcín. Zachována byla humorální imunologická paměť a schopnost humorální odezvy na vakcíny proti záškrtu, tetanu, poliomyelitidě, hemofilu B, meningokokům C a pneumokokům [16]. Nicméně podle Souhrnu údajů o přípravku (SPC) je možné provést poslední vakcinaci minimálně 6 týdnů před podáním alemtuzumabu a je vhodné před zahájením léčby zkontrolovat protilátky proti VZV (varicella-zoster virus), při jejich negativitě pacienta včas přeočkovat [3].
U většiny pacientů (85,2 %, 691/811) léčených alemtuzumabem v dávce 12 mg/den
ve studiích fáze III se vyskytly protilátky proti alemtuzumabu. Přestože u pacientů s titrem protilátek proti alemtuzumabu bylo dosaženo menšího snížení počtu lymfocytů (0,21 × 109/l Ab+ pacienti vs. 0,08 × 109/l Ab– pacienti), bylo EMA konstatováno, že výskyt protilátek proti alemtuzumabu by neměl mít klinicky významný dopad, neboť původní hladiny lymfocytů se pohybovaly v rozmezí 1–4 × 109/l [2].
Farmakokinetické vlastnosti
Farmakokinetické vlastnosti alemtuzumabu byly hodnoceny na souboru 216 pacientů s RS zařazených do studií fáze II a III. Biologická dostupnost alemtuzumabu je 100 %, neboť je podáván nitrožilní infuzí.Sérové koncentrace alemtuzumabu stoupaly s každou další dávkou léčebného cyklu. Podání dávky 12 mg/den vedlo k maximální plazmatické koncentraci (cmax) 3014 ng/ml v den 5 od začátku podávání v prvním cyklu a 2276 ng/ml v den 3 od začátku podávání ve druhém cyklu [2, 17].Distribuce alemtuzumabu je nejlépe charakterizována dvoukompartmentovým modelem. Centrální distribuční objem V1 je proporční k hmotnosti a rovná se přibližně objemu extracelulární tekutiny (14,1 l), periferní distribuční objem je 16,2 l [2]. Eliminace alemtuzumabu může probíhat více cestami, jejichž poměrné zastoupení není známo. 1. Alemtuzumab se specificky váže na antigen CD52. Komplex antigen-protilátka může být internalizován do buňky (povrchový antigen CD52) nebo pohlcen fagocyty a rozložen v lyzozomech (solubilní antigen CD52). 2. Imunoglobuliny obecně (včetně alemtuzumabu) jsou eliminovány prostřednictvím buněk retikuloendotelového systému. Váží se konstantní Fc částí molekuly na Fc-γ receptory fagocytujících buněk, jsou těmito buňkami internalizovány a následně rozloženy na malé peptidy a aminokyseliny. 3. Protilátky mohou obdobně jako ostatní bílkoviny vstupovat také do buněk všech tkání prostřednictvím endocytózy. Před rychlou degradací v lyzozomech jsou imunoglobuliny chráněny vazbou na neonatální FcRn receptor, který způsobuje jejich exocytózu a zpomaluje tak eliminaci protilátek [18–20].
Funkční poločas alemtuzumabu se blížil 4–5 dnům a byl srovnatelný mezi jednotlivými cykly vedoucími k nízkým nebo nedetekovatelným sérovým koncentracím během asi 30 dnů po každém léčebném cyklu. Clearance alemtuzumabu se pohybovala v rozmezí 0,012–0,096 l/h v závislosti na dávce a výskytu protilátek proti alemtuzumabu [2].
Speciální populace
Nebyly provedeny studie interakcí s jinými léčivy ani studie na speciálních populacích (děti, starší pacienti, pacienti s poruchou funkce ledvin, jater, speciální studie s ohledem na rasovou příslušnost apod.) [2, 3].
Klinické zkušenosti
Alemtuzumab byl původně vyvinut pro léčbu chronické B-lymfocytární leukemie (B-cell chronic lymphocytic leukemia, B-CLL) a byl schválen pro toto užití FDA (Food and Drug Administration) a EMA v roce 2001. Dávkování pro tuto indikaci je podstatně vyšší (30 mg/den 3krát týdně po dobu 12 týdnů) než pro léčbu RS.Iniciální klinická studie u pacientů s RS (28 pacientů, 18měsíční sledování) se soustředila na pacienty se sekundárně progresivní chorobou. Přes efektivní potlačení zánětu více než polovina pacientů dále progredovala nebo u nich pokračovala atrofie mozkové tkáně [21]. Toto sledování vedlo k hypotéze, že ačkoli se axonální degenerace objevuje u sekundární progrese i v nepřítomnosti zánětu, je způsobena předchozí zánětlivou aktivitou nemoci. Zájem se proto přesunul k léčbě pacientů v časnější fázi nemoci. Tito pacienti byli studováni v klinických studiích fáze II a III.
Klinická studie fáze II
CAMMS223 byla randomizovaná studie se zaslepeným hodnocením, která srovnávala alemtuzumab a subkutánně podávaný interferon beta-1a (IFNβ-1a) v dávce 44 μg 3krát týdně [22]. Pacienti měli časnou aktivní formu RS, definovanou pomocí McDonaldových kritérií z roku 2001 dvěma a více relapsy v předchozích dvou letech a alespoň jednou gadolinium vychytávající lézí, s EDSS (Expanded Disability Status Scale, škála umožňující popis stavu pacienta s RS) nejvýše stupně 3, se začátkem symptomů RS nejdéle tři roky před vstupem do studie a s žádnou předchozí imunoterapií kromě steroidů. Celkem 334 pacientů bylo randomizováno do tří ramen studie: k podávání alemtuzumabu v dávce 12 mg/den nebo 24 mg/den i.v. po dobu 5 dnů na začátku studie a po 12 měsících po 3 dny nebo k podávání IFNβ-1a 44 μg 3krát týdně.
Alemtuzumab byl podáván intravenózně pět po sobě následujících dnů a po tři dny o 12 měsíců později. Třetí cyklus léčby alemtuzumabem byl podáván ve 24. měsíci studie na základě rozhodnutí ošetřujícího lékaře, pokud počet CD4+ T lymfocytů přesáhl 100 × 106 buněk/l. Všichni pacienti dostali profylaktickou terapii k omezení reakcí spojených s infuzemi: methylprednisolon 1 g/den první tři dny infuzí při každém cyklu, antihistaminika a antipyretika dle potřeby. Skoro tři roky poté, co byla studie zahájena, bylo podávání alemtuzumabu ukončeno, protože se objevily 3 případy imunitní trombocytopenie včetně jednoho fatálního případu. Hodnocení účinnosti a bezpečnosti samozřejmě pokračovalo.
Primárními cíli studie byla doba do trvalé akumulace disability (SAD; ≥ 1,5bodové zvýšení na škále EDSS u pacientů s úvodním skóre 0 a ≥ 1bodové zvýšení u pacientů s původním skóre ≥ 1,0) potvrzené za šest měsíců a roční počet relapsů. Z celkového počtu pacientů randomizovaných do skupiny s alemtuzumabem jich 97 % dostalo první cyklus léčby, 93 % dostalo druhý cyklus a 21 % i třetí cyklus léčby alemtuzumabem. Riziko trvalé disability bylo sníženo při léčbě alemtuzumabem v dávce 12 mg oproti léčbě IFNβ o 75 % (p < 0,001) a v dávce 24 mg o 67 % (p = 0,003). Při léčbě alemtuzumabem 12 mg mělo 77,6 % pacientů stabilní nebo zlepšené skóre EDSS po třech letech ve srovnání se začátkem studie (zlepšení EDSS o 0,32; p = 0,006). U pacientů léčených IFNβ došlo ke zhoršení o 0,38 stupně na škále EDSS (p = 0,003). Roční počet relapsů byl 0,11 (konfidenční interval – 95% CI: 0,08–0,16) při léčbě alemtuzumabem 12 mg a 0,08 (95% CI: 0,05–0,12) při léčbě alemtuzumabem 24 mg, v rameni s IFNβ byl roční počet relapsů 0,36 (95% CI: 0,29–0,44). Ve srovnání s IFNβ byla relativní redukce relapsů při dávce 12 mg a 24 mg alemtuzumabu 69 % a 79 % (obě větve p < 0,001).
Post hoc analýza ukázala, že po třech letech se 73 % pacientů léčených alemtuzumabem 12 mg nacházelo v dlouhodobé klinické remisi. Ta byla definována jako nepřítomnost relapsů a trvalé akumulace disability potvrzené po šesti měsících. Tohoto výsledku dosáhlo 43 % pacientů léčených IFNβ (p < 0,0001) [23]. Více pacientů léčených alemtuzumabem dosáhlo také během tří let zmírnění disability. Toto hodnocení bylo provedeno u pacientů, kteří měli úvodní skóre EDSS ≥ 2,0 a u nichž došlo ke snížení o nejméně 1 stupeň EDSS potvrzenému po šesti měsících. Zlepšení bylo dosaženo u 45 % pacientů léčených alemtuzumabem oproti zlepšení dosaženému u 27 % pacientů léčených IFNβ (p = 0,01).
Během tří let došlo při léčbě alemtuzumabem v dávkách 12 mg a 24 mg k redukci objemu T2 hyperintenzních lézí o 18,2 % a 13,5 % (medián), což se statisticky nelišilo od redukce vyvolané léčbou IFNβ (–13,3 %) [22]. Medián změny mozkového objemu za celé tři roky byl –1,8 % při léčbě IFNβ, –0,9 % při léčbě alemtuzumabem 12 mg (p = 0,16 vs. IFNβ s.c.) a 0 % při léčbě alemtuzumabem 24 mg (p = 0,04 vs. IFNβ s.c.).
Klinické studie fáze III
Ke srovnávání alemtuzumabu a IFNβ-1a s.c. (The Comparison of Alemtuzumab and Rebif® Efficacy in Multiple Sclerosis, CARE-MS) byly navrženy dvě dvouleté, randomizované, multicentrické a mezinárodní studie porovnávající dvě účinné látky proti sobě [8, 9]. Ačkoli obě zahrnuly pacienty s remitující RS podle McDonaldových kritérií z roku 2005 [24] 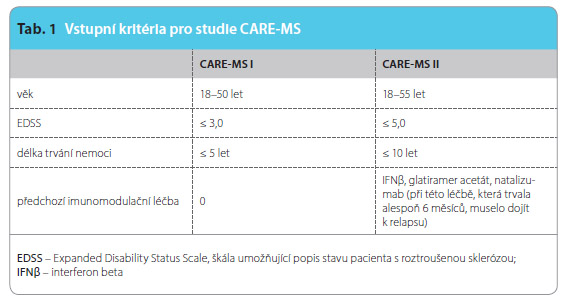 a s aktivním onemocněním (definovaným jako nejméně dva relapsy v předchozích dvou letech a nejméně jeden relaps v posledním roce), lišily se historií předchozí léčby a délkou trvání nemoci, viz tab. 1.
a s aktivním onemocněním (definovaným jako nejméně dva relapsy v předchozích dvou letech a nejméně jeden relaps v posledním roce), lišily se historií předchozí léčby a délkou trvání nemoci, viz tab. 1.
Pacienti byli randomizovaně rozděleni v poměru 2 : 1 na skupinu léčenou alemtuzumabem nebo IFNβ s.c. Do studie CARE-MS II bylo iniciálně zařazeno i rameno s dávkou 24 mg alemtuzumabu, které však bylo záhy zrušeno a pacienti byli zařazeni do ramene s 12 mg alemtuzumabu. Léčebný režim byl v obou studiích stejný jako ve studii fáze II včetně premedikace podávané ke zmírnění infuzních reakcí. Třetí cyklus nebyl v základních studiích povolen. Efektivní dvojité zaslepení nebylo kvůli známým nežádoucím účinkům léků možné, proto byl zaslepen hodnotitel EDSS. Jako primární cíl studie byl sledován počet relapsů a doba do dosažení trvalé disability potvrzené po šesti měsících. Jako je tomu nyní už ve všech studiích, i zde byl sledován cíl dlouhodobé remise definované kromě absence relapsů a progrese onemocnění také nepřítomností gadolinium vychytávajících lézí a nových nebo zvětšujících se T2 lézí.
Charakteristiky pacientů vstupujících do obou studií uvádí tab. 2.
V obou studiích se alemtuzumab ukázal jako účinnější než IFNβ-1a v redukci relapsů, viz tab. 3. Ve snížení rizika trvalé disability byl alemtuzumab účinnější ve studii CARE-MS II (při podávání alemtuzumabu progredovalo 13 % pacientů,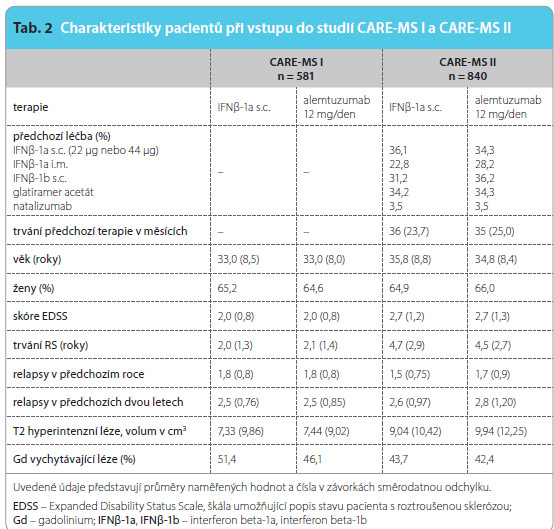 při podávání IFNβ 20 % pacientů). Ve studii CARE-MS I byl pozorován tentýž trend, ale progredovalo pouze 11 % pacientů při léčbě IFNβ-1a namísto očekávaných 20 %, což byla kalkulace statistické síly podle studie fáze II (ve skupině alemtuzumabu progredovalo v CARE-MS I 8 % pacientů). Při léčbě alemtuzumabem dosáhlo stavu bez klinické i radiologické aktivity nemoci 38,6 % pacientů (vs. 26,7 % při léčbě IFNβ-1a) ve studii CARE-MS I
při podávání IFNβ 20 % pacientů). Ve studii CARE-MS I byl pozorován tentýž trend, ale progredovalo pouze 11 % pacientů při léčbě IFNβ-1a namísto očekávaných 20 %, což byla kalkulace statistické síly podle studie fáze II (ve skupině alemtuzumabu progredovalo v CARE-MS I 8 % pacientů). Při léčbě alemtuzumabem dosáhlo stavu bez klinické i radiologické aktivity nemoci 38,6 % pacientů (vs. 26,7 % při léčbě IFNβ-1a) ve studii CARE-MS I
a 32,2 % (vs. 13,6 %) ve studii CARE-MS II.Volum T2 lézí se ve studii CARE-MS II zmenšil o 1,2 % při léčbě alemtuzumabem i IFNβ, gadolinium vychytávající léze na konci druhého roku studie mělo 23 % pacientů ze skupiny 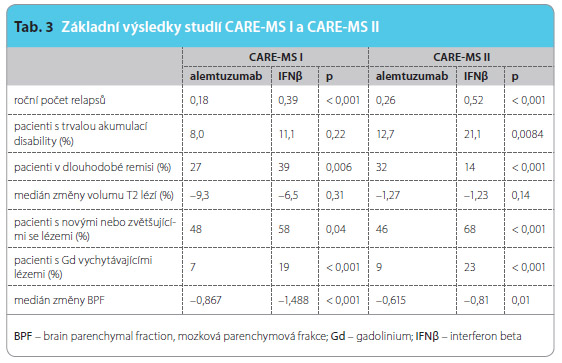 IFNβ a 9 % pacientů ze skupiny alemtuzumabu, nové a zvětšující se T2 hyperintenzní léze mělo 68 % pacientů při léčbě IFNβ a 46 % při léčbě alemtuzumabem. Změna mozkové parenchymové frakce činila za dva roky studie 0,81 % při léčbě IFNβ a 0,61 % při léčbě alemtuzumabem, ve studii CARE-MS I byl tento rozdíl výraznější (–1,488 při podávání IFNβ, –0,867 při podávání alemtuzumabu).
IFNβ a 9 % pacientů ze skupiny alemtuzumabu, nové a zvětšující se T2 hyperintenzní léze mělo 68 % pacientů při léčbě IFNβ a 46 % při léčbě alemtuzumabem. Změna mozkové parenchymové frakce činila za dva roky studie 0,81 % při léčbě IFNβ a 0,61 % při léčbě alemtuzumabem, ve studii CARE-MS I byl tento rozdíl výraznější (–1,488 při podávání IFNβ, –0,867 při podávání alemtuzumabu).
Extenze a dlouhodobá účinnost
Všichni pacienti, kteří ukončili fázi II a III, jsou dále sledováni v probíhající extenzi studií (NCT00930553). Z 334 pacientů původně randomizovaných ve studii CAMMS223 se jich 198 (72 s léčbou alemtuzumabem v dávce 12 mg/den, 79 s léčbou alemtuzumabem 24 mg/den a 47 s léčbou IFNβ) účastnilo extenze a 183 pacientů (67, 74, 42) dokončilo měsíc 60 ve studii [25]. Jak již bylo zmíněno, data ze skupiny léčené 24 mg alemtuzumabu nejsou probírána, protože nejde o schválené dávkování [3]. Další cyklus byl podáván po nejméně 12 měsících od posledního podání a sestával ze 3 dnů s dávkováním 12 mg alemtuzumabu s premedikací methylprednisolonem. Většina pacientů však tento další cyklus nepotřebovala. Medián sledování byl 57,3 měsíce (nejdelší sledování trvalo 80,6 měsíce) [25]. Další cyklus léčby byl nabídnut pouze pacientům, kteří byli původně randomizováni k léčbě alemtuzumabem. V pětiletém sledování potřebovalo další cyklus léčby pouze 9 nemocných, po 60. měsíci pak 41 pacientů. Riziko trvalé akumulace disability bylo po pěti letech při léčbě alemtuzumabem v dávce 12 mg/den oproti léčbě IFNβ sníženo o 69 % (p = 0,0005); skóre EDSS se zlepšilo nebo bylo stabilní u 74 % pacientů ze skupiny s léčbou alemtuzumabem oproti 54 % pacientů léčených IFNβ (p = 0,014). Ve srovnání s léčbou IFNβ byl počet relapsů za 60 měsíců studie snížen při léčbě alemtuzumabem o 66 % (p < 0,0001).
U pacientů ze studií CARE-MS I a CARE--MS II jsou k dispozici data ze třetího roku těchto klinických sledování. Pacientům původně léčeným IFNβ byl nabídnut alemtuzumab. Do studie vstoupilo 376 pacientů ze studie CARE-
-MS I a 393 pacientů ze studie CARE-MS II [26]. Pacienti původně léčení alemtuzumabem měli možnost být znovu přeléčeni v případě aktivity choroby (relaps nebo nová či zvětšující se léze na MR); 80 % pacientů další cyklus léčby nepotřebovalo, méně než 3 % pacientů původně léčených alemtuzumabem přešla v tomto prvním roce extenze na užívání jiné léčby modifikující onemocnění.Léčebný účinek alemtuzumabu v prvním roce extenze přetrvával, roční počet relapsů byl 0,24 a 0,25 pro CARE-MS I a CARE-MS II [27]. Průměrné skóre EDSS na začátku extenze bylo 1,8 a 2,5 a na konci 1,9 a 2,6. U tří čtvrtin pacientů zůstalo skóre EDSS ve třetím roce stabilní nebo zlepšené; 67 % pacientů ze studie CARE-MS I a 55 % ze studie CARE-MS II nemělo relaps ve třetím roce sledování.
Zařazení do současné palety léčiv
Alemtuzumab je nevhodný pro pacienty s neaktivní RS. Nebyl prokázán účinek u pacientů s progresivním stadiem nemoci. Klinické studie byly zaměřeny jak na pacienty dosud neléčené, tak na pacienty s nedostatečným účinkem léků první volby (eventuálně druhé volby – natalizumab). Použití u neléčených pacientů lze očekávat v případě velmi aktivní nemoci s nepříznivými prognostickými markery, kde by léčba první linie představovala pouze nebezpečí z prodlení. Ve druhé linii je pro pacienty s remitující RS k dispozici fingolimod a natalizumab. U pacientů s přítomností JC viru (JCV, virus z rodu Polyomavirus) v organismu (asi 60 % populace) představuje natalizumab po dvou letech podávání vysoce rizikovou léčbu a přechod na terapii fingolimodem bývá často nedostatečně účinný. Zde se alemtuzumab nabízí a je otázkou, zda nepřevládne jeho podávání u JCV-pozitivních pacientů rovnou jako léčba druhé volby.
Protože při podávání jak fingolimodu, tak natalizumabu je problematické těhotenství (u fingolimodu pro nutnou dvouměsíční přestávku v léčbě před koncepcí, kdy může dojít k atace; u natalizumabu pro možný rebound fenomén v těhotenství i po něm), představuje podávání alemtuzumabu s možností otěhotnět za čtyři měsíce po posledním podání další léčebnou variantu. Více než u kteréhokoli ze jmenovaných léků je zde nutná compliance pacienta, který musí souhlasit se 4letým monitorovacím plánem po posledním podání alemtuzumabu.
Indikace
Podle SPC je alemtuzumab indikován pro léčbu pacientů s relabující-remitující formou RS v aktivním stadiu onemocnění definovaném klinickými příznaky nebo MR parametry [3].
Kontraindikace
Léčba alemtuzumabem je kontraindikována u pacientů, kteří trpí přecitlivělostí na kteroukoli ze složek přípravku, a u nemocných s infekcí virem lidské imunodeficience (HIV).
Bezpečnost
Ve studiích fáze II a III prokázal alemtuzumab přijatelnou tolerabilitu. Nežádoucí účinky hlásilo ve studii CARE-MS I celkem 96 % pacientů ze skupiny léčené alemtuzumabem (a 92 % ze skupiny s léčbou IFNβ), ve studii CARE-MS II to bylo 98 % pacientů léčených alemtuzumabem (a 95 % ze skupiny s léčbou IFNβ) [8, 9].
Většina nežádoucích účinků byla mírných či středně těžkých. Pro nežádoucí účinky ve studii CARE-MS I ukončilo léčbu 1 % a 6 % pacientů, ve studii CARE-MS II ukončilo léčbu 3 % a 7 % pacientů. Závažné nežádoucí účinky se vyskytly ve studii CARE-MS I u 18 % a 14 % pacientů (z toho se v 5 % a 7 % jednalo o relapsy RS) a ve studii CARE-MS II u 20 % a 22 % pacientů (z toho se jednalo v 8 % a 12 % o relapsy). Ve studii fáze II došlo ke dvěma úmrtím – na kardiovaskulární příhodu a idiopatickou trombocytopenickou purpuru, ve studiích fáze III došlo ke třem úmrtím (čtvrté úmrtí nastalo v důsledku sepse po skončení studie) – dvakrát šlo o automobilovou nehodu, jednou o aspirační pneumonii při kmenovém relapsu.
Reakce spojené s infuzí
Nejčastějšími nežádoucími účinky byly reakce spojené s infuzí (infusion-associated reaction, IAR), tedy jakékoli nežádoucí reakce, které se vyskytnou do 24 hodin od podání alemtuzumabu. Infuzní reakce postihovaly ve všech studiích přes 85 % pacientů a byly nejvýraznější při prvním cyklu léčby (při druhém se vyskytly v 69 % případů a při třetím v 63 % případů). Infuzní reakce zřejmě souvisejí s uvolněním cytokinů v důsledku lýzy cílových buněk. Reakce zahrnují bolest hlavy, zrudnutí, zvýšenou teplotu, nauzeu, kopřivku, svědění, nespavost, únavu, zimnici a dušnost. Neobjevil se žádný případ anafylaxe.
Infekce
Dalším častým nežádoucím účinkem byly infekce, které se vyskytovaly častěji ve skupině alemtuzumabu než ve skupině IFNβ (CAMMS223: 66 % vs. 47 %; CARE-MS I: 67 % vs. 45 %; CARE-MS II: 77 % vs. 66 %). Závažné infekce byly též četnější při léčbě alemtuzumabem než při léčbě IFNβ (CAMMS223: 2,8 % vs. 1,9 %; CARE-MS I: 2 % vs. 1 %; CARE-MS II: 4 % vs. 1 % pacientů). Infekce byly většinou lehké či středně těžké, obvykle šlo o infekce horních cest dýchacích a močových cest. Herpetické infekce (herpes simplex a herpes zoster) se vyskytovaly častěji při léčbě alemtuzumabem, jejich výskyt se však významně snížil po zavedení profylaxe aciklovirem v průběhu studie.
Sedmileté sledování ve studii CAMMS223 ukázalo, že výskyt infekcí se nezvyšuje s každým dalším cyklem léčby alemtuzumabem. Několik případů progresivní multifokální leukoencefalopatie (PML) bylo hlášeno u pacientů léčených alemtuzumabem pro rejekci štěpu nebo pro chronickou lymfatickou leukemii [28, 29]. Tito pacienti byli intenzivně léčeni imunosupresivy včetně fludarabinu, cyklofosfamidu, vinkristinu, takrolimu a králičího anti-thymocytárního globulinu.
Autoimunitní nežádoucí účinky
Nejzávažnější riziko spojené s léčbou alemtuzumabem představují autoimunitní nežádoucí účinky. Předpokládá se, že jsou následkem lymfocytární repopulace po léčbě – způsobu, jakým probíhá; T lymfocyty repopulují dvěma způsoby: „homeostatickou“ proliferací zralých lymfocytů, které unikly depleci, a tvorbou nových T lymfocytů v thymu z prekurzorů pocházejících z kostní dřeně. Homeostatická proliferace převládá u pacientů, kteří později vyvinou autoimunitní nežádoucí účinky. Naopak u pacientů, kteří autoimunitu nevyvinou, dochází k relativně větší tvorbě nových T lymfocytů v thymu. Klonální diverzita je u nich větší, zatímco autoimunita je spojena s omezenou lymfocytární diverzitou. Práce na myším modelu autoimunity ukázaly, že cytokinem zodpovědným za homeostatickou proliferaci je interleukin 21 (IL-21) [30]. To vedlo ke zkoumání IL-21 jako potencionálního biomarkeru, který by mohl předpovědět vývoj budoucího autoimunitního nežádoucího účinku.Po léčbě alemtuzumabem se nejčastěji objevuje autoimunita štítné žlázy, ale také imunitní trombocytopenie a onemocnění bazální membrány glomerulů. Tyto nežádoucí účinky daly vznik aktivnímu monitorovacímu plánu při léčbě pacientů alemtuzumabem.
Autoimunita štítné žlázy
V dlouhodobém sledování pacientů ze studie CAMMS223 (medián sledování 57,3 měsíce) se autoimunita štítné žlázy vyskytla u 39 % pacientů léčených 12 mg alemtuzumabu [31]. V 65,8 % případů šlo o Gravesovu chorobu (hypertyreoidismus), ve 20,5 % o hypotyreoidismus, ve 12,3 % o subakutní tyreoiditidu. Začátek obtíží byl 6 až 61 měsíců po prvním léčebném cyklu. Nejvyšší incidence se objevila ve třetím roce léčby, pak klesala [25]. Poruchy funkce štítné žlázy odpovídaly na konvenční terapii (blokátory funkce štítné žlázy, radioaktivní jod, hormony štítné žlázy, chirurgická léčba). Celých 85 % pacientů, kteří vyvinuli autoimunitu štítné žlázy, nemělo před léčbou pozitivní protilátky proti tyreoidální peroxidáze, zatímco v době dysfunkce byly u 70 % pacientů nalezeny protilátky proti receptoru pro tyreoidální stimulační hormon.
Ve studiích CARE-MS byl výskyt autoimunit štítné žlázy podobný. Na konci základních studií byla dysfunkce štítné žlázy přítomna u 17,3 % pacientů ze skupiny alemtuzumabu a u 5,7 % pacientů ze skupiny IFNβ. U 0,8 % pacientů léčených alemtuzumabem byla tato dysfunkce hodnocena jako závažný nežádoucí účinek. Čtyřleté sledování ukázalo, že incidence poruchy byla největší ve třetím roce, kdy dosáhla 20,9 %, ve čtvrtém roce klesla na 12,4 %. Celkem se během čtyř let vyskytla autoimunita štítné žlázy u 36 % pacientů, u 3,8 % šlo o závažný nežádoucí účinek. Nejvíce se vyskytovala hyperfunkce štítné žlázy, hypofunkce, struma a tyreoiditida.
Závažná imunitní trombocytopenie
Alemtuzumab může vyvolat závažnou imunitní trombocytopenii (ITP), která odpovídá na konvenční terapii a má dlouhou remisi [32]. Nejzávažnější případ se objevil ve studii CAMMS223, kdy pacient zemřel na intrakraniální krvácení. To vedlo k zavedení plánu ke zvládání rizik, který zahrnuje edukaci lékaře i pacienta, vyšetření kompletního krevního obrazu každý měsíc a aktivní vyhledávání symptomů každý měsíc. Během klinických studií byla ITP definována jako normální krevní obraz s normální hodnotou hemoglobinu a počtem leukocytů kromě snížení počtu destiček na 50–100 × 109/l bez shlukování při dvou či více následných odběrech s odstupem nejméně jednoho měsíce (nebo s počtem nižším než 50 × 109/l bez shlukování při dvou či více odběrech v jakémkoli časovém odstupu, bez přítomnosti splenomegalie). Včetně extenzí se ve studiích objevila ITP u 30 z 1486 pacientů. Dalších 21 pacientů nesplnilo kritéria protokolu pro ITP, ale počet jejich destiček se pohyboval pod normální hranicí. ITP se projevila v průměru za 16 měsíců po prvním podání alemtuzumabu (1–34 měsíců). Většina pacientů měla dobrou terapeutickou odpověď na kortikosteroidy, intravenózní imunoglobuliny nebo transfuzi destiček. Další použité terapie zahrnovaly rituximab (4 pacienti), splenektomii (1 pacient) a 2 případy se upravily spontánně.
Nefropatie
Dalším autoimunitním nežádoucím účinkem je nefropatie. V pilotních studiích vyvinuli dva pacienti protilátky proti glomerulární bazální membráně s nutností renální transplantace [33]. Ve fázích II a III se objevily 4 případy glomerulonefritidy (na 1486 pacientů léčených alemtuzumabem) se začátkem obtíží v rozmezí 4. a 39. měsíce po poslední dávce alemtuzumabu. Všechny případy odpovídaly na léčbu furosemidem nebo plazmaferézami, cyklofosfamidem a steroidy [34].
Lékové interakce
Lékové interakce alemtuzumabu nebyly formálně studovány. Léčba IFNβ a glatiramer acetátem byla ve studiích ukončena 28 dnů před podáním alemtuzumabu.
Ovlivnění pozornosti
Nebyla provedena žádná studie účinků alemtuzumabu na schopnost řídit a obsluhovat stroje. V rámci infuzní reakce po podání alemtuzumabu se může vyskytnout závrať. Medikace použitá k ovlivnění infuzních reakcí (antihistaminika) může vyvolat útlum pozornosti.
Fertilita a těhotenství
Molekula CD52 je přítomna na buňkách epididymis, semenných váčků, na spermiích a v semenné tekutině, čímž teoreticky vzniká riziko pro mužskou fertilitu. Vyvíjející se spermie ale CD52 neexprimuje. Ačkoli zralá spermie CD52 exprimuje, v semenné tekutině je dostatečná přítomnost molekuly CD52 pro kompetici s vazbou na alemtuzumab, takže ovlivnění spermií je málo pravděpodobné. Studie, jíž se zúčastnilo 13 mužů zařazených do studií CARE-MS, tento předpoklad potvrdila [35]. Před zahájením studie, po jednom, třech a šesti měsících nebyly patrné žádné defekty v motilitě, počtu ani morfologii spermií.
V souvislosti s použitím alemtuzumabu u těhotných žen zařadila EMA tento přípravek do kategorie C (neexistují žádné studie vlivu alemtuzumabu na vyvíjející se plod). Je známo, že molekula IgG prochází placentární bariérou, alemtuzumab může placentární bariérou prostupovat také a tím může potenciálně ovlivnit plod. Ženám užívajícím alemtuzumab je doporučeno používání antikoncepce v době podávání léku a čtyři měsíce po ukončení léčby [3]. Přestože ve studiích byla požadována kontracepce, došlo u 78 žen k 99 těhotenstvím (do listopadu 2012). Z nich se narodilo 51 živých dětí, umělé ukončení těhotenství bylo indikováno v 11 případech (ve 3 případech pro vývojovou vadu – cystický hygrom a hypoplastické srdce, těhotenství s prázdným gestačním váčkem a podezření na extrauterinní těhotenství), došlo ke 20 spontánním potratům, k jednomu porodu mrtvého dítěte a u 16 případů není znám výsledek.
Dávkování
První cyklus léčby sestává z podávání 12 mg alemtuzumabu 4hodinovou infuzí denně po dobu 5 dnů s premedikací první 3 dny 1 g methylprednsolonu, dále dle potřeby s podáním antipyretik a antihistaminik při každé infuzi alemtuzumabu. Druhý cyklus je 3denní ve stejném režimu za 12 měsíců. Další 3denní cyklus lze podat nejdříve za dalších 12 měsíců při prokázané aktivitě nemoci. Od prvního dne každého cyklu až do 28. dne po ukončení cyklu se podává profylakticky 400 mg acikloviru denně p.o.
Monitorování pacienta léčeného alemtuzumabem
Podle SPC je alemtuzumab indikován pro léčbu relabující-remitující RS jak u pacientů s předchozí zkušeností s léčbou a její nedostatečnou účinností, tak u pacientů zatím neléčených. Ačkoli je alemtuzumab spojen s bezpečnostními riziky, jsou tato rizika zvladatelná a ovlivnitelná u většiny pacientů pomocí monitorovacího plánu, viz tab. 4. 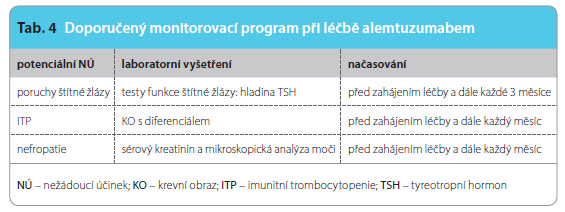 Neochota pacienta spolupracovat podle tohoto plánu je vylučovacím kritériem pro léčbu, protože by mohlo dojít k ohrožení pacienta. Pacient musí být plně informován o rizicích i o monitorovacím programu před zahájením léčby a musí si být vědom, že v monitorování se bude 4 roky po skončení léčby pokračovat, i kdyby nedošlo k žádnému dalšímu přeléčení a nebyla přítomna žádná aktivita choroby.Zkušenost z klinických studií jasně ukázala, že monitorovací program je schopen včas detekovat autoimunitní nežádoucí účinky, což je základním předpokladem jejich včasné léčby. Předpokládáme, že v detekci autoimunitních komplikací bude jako pomoc pro kliniky brzy k dispozici vhodný test na měření hladiny IL-21 [36]. Účinek léku byl v klinických studiích posuzován jednak klinickým vyšetřením a sledováním počtu atak, jednak pomocí MR. Standardizované vyšetření MR je tak vhodným ukazatelem účinku léčby a aktivity nemoci a mělo by být nástrojem sledování i v běžné klinické praxi.
Neochota pacienta spolupracovat podle tohoto plánu je vylučovacím kritériem pro léčbu, protože by mohlo dojít k ohrožení pacienta. Pacient musí být plně informován o rizicích i o monitorovacím programu před zahájením léčby a musí si být vědom, že v monitorování se bude 4 roky po skončení léčby pokračovat, i kdyby nedošlo k žádnému dalšímu přeléčení a nebyla přítomna žádná aktivita choroby.Zkušenost z klinických studií jasně ukázala, že monitorovací program je schopen včas detekovat autoimunitní nežádoucí účinky, což je základním předpokladem jejich včasné léčby. Předpokládáme, že v detekci autoimunitních komplikací bude jako pomoc pro kliniky brzy k dispozici vhodný test na měření hladiny IL-21 [36]. Účinek léku byl v klinických studiích posuzován jednak klinickým vyšetřením a sledováním počtu atak, jednak pomocí MR. Standardizované vyšetření MR je tak vhodným ukazatelem účinku léčby a aktivity nemoci a mělo by být nástrojem sledování i v běžné klinické praxi.
Závěr
Alemtuzumab přináší do léčby pacientů s RS novou kvalitu – možnost dlouhodobé remise po aplikaci dvou cyklů léčby. Samozřejmě před podáním léku je třeba dobře zvážit možný přínos i možná rizika pro individuálního pacien-
ta. Monitorace klinického efektu i nežádoucích účinků je podmínkou efektivního využití další monoklonální protilátky v managementu léčby RS. Rozšiřuje se tak možnost dosáhnout dnešního cíle v léčbě RS – dlouhodobé klinické i MR remise, stavu „disease free“ [37].
Práce byla podpořena programem PRVOUK-P26/LF1/4.
Seznam použité literatury
- [1] WHO Collaborating Centre for Drug Statistics Methodology. Sekce: ATC -> List of new ATC/DDDs and alterations -> Alterations in ATC/DDD. Dostupné na: http://www.whocc.no/atc/lists_of_new_atc_ddds_and_altera/alterations_in_atc_ddd/ Navštíveno 1. 6. 2014.
- [2] European Public Assessment Report. EMA. Dostupné na: www.ema.europa.eu Navštíveno 1. 6. 2014.
- [3] Summary of Product Characteristics (SPC). Lemtrada. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/003718/WC500150521.pdf Navštíveno 1. 6. 2014.
- [4] Hale G, Waldmann H. From Laboratory to Clinic: The Story of CAMPATH-1. Diagnostic and Therapeutic Antibodies. Series: Methods in Molecular Medicine Volume: 40 Pub. Humana Press 2000: 243–266.
- [5] Bandala-Sanchez E, Zhang Y, Reinwald S, et al. T cell regulation mediated by interaction of soluble CD52 with the inhibitory receptor Siglec-10. Nat Immunol 2013; 14: 741–748.
- [6] Hu Y, Turner MJ, Shields J, et al. Investigation of the mechanism of action of alemtuzumab in a human CD52 transgenic mouse model. Immunology 2009; 128: 260–270.
- [7] Bielekova B, Becker BL. Monoclonal antibodies in MS: mechanisms of action. Neurology 2010; 74 (Suppl 1): S31–40.
- [8] Cohen JA, Coles AJ, Arnold DL, et al. CARE-MS I investigators. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012; 380: 1819–1828.
- [9] Coles AJ, Twyman CL, Arnold DL, et al. CARE-MS II investigators. Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012; 380: 1829–1839.
- [10] Kasper LH, Arnold DL, Coles AJ, et al. Lymphocyte subset dynamics following alemtuzumab treatment in the CARE-MS II study. ECTRIMS; October 2-5, 2013; Copenhagen, Denmark. Poster P531. Dostupné na: http://congrex.insideguidance.com/ectrims/2013/images_large/Event531 Navštíveno 1. 6. 2014.
- [11] Hartung HP, Arnold DL, Cohen J, et al. Lymphocyte subset dynamics following alemtuzumab treatment in the CARE-MS I study. ECTRIMS; October 10-13, 2012; Lyon, France. Dostupné na: http://registration.akm.ch/einsicht.php?XNABSTRACT_ID=157471&XNSPRACHE_ID=2&XNKONGRESS_ID=171&XNMASKEN_ID=900 Navštíveno 1. 6. 2014.
- [12] Kovarova I, Arnold DL, Cohen JA, et al. Alemtuzumab pharmacokinetics and pharmacodynamics in Comparison of Alemtuzumab and Rebif® Efficacy in Multiple Sclerosis I. Presented at the 23rd Meeting of the European Neurological Society. June 8-11, 2013: Prague, Czech Republic.
- [13] Helliwell CL, Thompson SAJ, Jones J, et al. Alemtuzumab (Campath-1H) treatment for multiple sclerosis reduces pro-inflammatory cytokine secretion from peripheral blood mononuclear cells [abstract]. J Neurol Neurosurg Psychiatry 2009; 80 (11).
- [14] Jones JL, Anderson JM, Phuah CL, et al. Improvement in disability after alemtuzumab treatment of multiple sclerosis is associated with neuroprotective autoimmunity. Brain 2010; 133: 2232–2247.
- [15] Jones JL, Thompson SA, Loh P, et al. Human autoimmunity after lymphocyte depletion is caused by homeostatic T-cell proliferation. Proc Natl Acad Sci USA 2013; 110: 20200–20205.
- [16] McCarthy CL, Tuohy O, Compston DA, et al. Immune competence after alemtuzumab treatment of multiple sclerosis. Neurology 2013; 81: 872–876.
- [17] Garnock-Jones KP. Alemtuzumab: a review of its use in patients with relapsing multiple sclerosis. Drugs 2014; 74: 489–504.
- [18] Tabrizi MA, Tseng CM, Roskos LK. Elimination mechanisms of therapeutic monoclonal antibodies. Drug Discov Today 2006; 11: 81–88.
- [19] Wang W, Balthasar JP. Monoclonal Antibody Pharmacokinetics and Pharmacodynamics. Clin Pharmacol Therap 2008; 84: 548–558.
- [20] Keizer RJ, Huitema AD, Schellens JH, Beijnen JH. Clinical pharmacokinetics of therapeutic monoclonal antibodies. Clin Pharmacokinet 2010; 49: 493–507.
- [21] Coles AJ, Wing mg, Molyneux P, et al. Monoclonal antibody treatment exposes three mechanisms underlying the clinical course of multiple sclerosis. Ann Neurol 1999; 46: 296–304.
- [22] CAMMS223 Trial Investigators, Coles AJ, Compston DA, Selmaj KW, et al. Alemtuzumab vs. interferon beta-1a in early multiple sclerosis. N Engl J Med 2008; 359: 1786–1801.
- [23] Coles AJ, Fox E, Vladic A, et al. Alemtuzumab versus interferon β-1a in early relapsing-remitting multiple sclerosis: post-hoc and subset analyses of clinical efficacy outcomes. Lancet Neurol 2011; 10: 338–348.
- [24] Polman CH, Reingold SC, Edan G, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. Ann Neurol 2005; 58: 840–846.
- [25] Coles AJ, Fox E, Vladic A, et al. Alemtuzumab more effective than interferon β-1a at 5-year follow-up of CAMMS223 clinical trial. Neurology 2012; 78: 1069–1078.
- [26] Broadley SA, Arnold DL, Coles AJ, et al. Durable effect of alemtuzumab on relapse outcomes in patients with relapsing-remitting multiple sclerosis: CARE-MS three-year follow-up. 6th Pan Asian Committee for Treatment and Research in Multiple Sclerosis; November 6–8, 2013; Kyoto, Japan.
- [27] Havrdova E, Arnold DL, Cohen JA, et al. Alemtuzumab has durable efficacy in relapsing-remitting multiple sclerosis patients: CARE-MS extension [abstract plus poster]. In: The 7th World Congress on Controversies in Neurology; April 11–14, 2013; Istanbul, Turkey.
- [28] Waggoner J, Martinu T, Palmer SM. Progressive multifocal leukoencephalopathy following heightened immunosuppression after lung transplant: A case report. J Heart Lung Transplant 2009; 28: 395–398.
- [29] Isidoro L, Pires P, Rito L, Cordeiro G. Progressive multifocal leukoencephalopathy in a patient with chronic lymphocytic leukaemia treated with alemtuzumab. BMJ Case Rep 2014; doi: 10.1136/bcr-2013-201781.
- [30] King C, Ilic A, Koelsch K, Sarvetnick N. Homeostatic expansion of T cells during immune insufficiency generates autoimmunity. Cell 2004; 117: 265–277.
- [31] Daniels GH, Vladic A, Brinar V, et al. Alemtuzumab-related thyroid dysfunction in a phase 2 trial of patients with relapsing-remitting multiple sclerosis. J Clin Endocrinol Metab 2014; 99: 80–89.
- [32] Cuker A, Coles AJ, Sullivan H, et al. A distinctive form of immune thrombocytopenia in a phase 2 study of alemtuzumab for the treatment of relapsing-remitting multiple sclerosis. Blood 2011; 118: 6299–6305.
- [33] Meyer, D, Coles, A, Oyuela, P, et al. Case report of anti-glomerular basement membrane disease following alemtuzumab treatment of relapsing–remitting multiple sclerosis. Mult Scler Rel Disord 2013; 2: 60–63.
- [34] Wynn DR, Arnold DL, Coles AJ, et al. Detection, incidence, and management of glomerulonephritis in the alemtuzumab clinical development program. 29th Congress ECTRIMS; October 2-5, 2013; Copenhagen, Denmark.
- [35] Margolin DH, Rizzo M, Smith G, et al. Alemtuzumab treatment has no adverse impact on sperm quality, quantity, or motility: A CARE-MS substudy. 21st World Congress of Neurology; September 21-26, 2013; Vienna, Austria.
- [36] Azzopardi L, Thompson SA, Harding KE, et al. Predicting autoimmunity after alemtuzumab treatment of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014; 85: 795–798.
- [37] Havrdova E, Galetta S, Hutchinson M, et al. Effect of natalizumab on clinical and radiological disease activity in multiple sclerosis: a retrospective analysis of the Natalizumab Safety and Efficacy in Relapsing--Remitting Multiple Sclerosis (AFFIRM) study. Lancet Neurol 2009; 8: 254–260.
- [38] Havrdová E, et al. Roztroušená skleróza. Praha, Mladá fronta, 2013.