Alirocumab
Souhrn:
Inhibitory PCSK9 (proproteinové konvertázy subtilisin/kexinového typu 9) jsou slibnou léčebnou strategií, díky níž dochází ke snížení koncentrace aterogenního lipoproteinu o nízké hustotě (low density lipoprotein, LDL) i cholesterolu v něm obsaženého. Alirocumab je jedním ze dvou inhibitorů PCSK9 uvolněných do klinické praxe. Alirocumab je rekombinantní technikou získaná specifická protilátka proti PCSK9. Vazba protilátky s izoenzymem PCSK9 zabrání vytvoření komplexu PCSK9 s receptorem pro LDL a umožní tak další recirkulaci receptoru pro LDL. Zvýšení nabídky receptoru pro LDL na buněčných membránách zvýší internalizaci LDL do buněk a vede k poklesu koncentrace LDL cholesterolu. Doloženo je příznivé působení alirocumabu na aterogenní lipoproteiny (pokles koncentrace LDL cholesterolu o více než 50 %) jak v monoterapii, tak v kombinaci se statiny či s jinými hypolipidemiky. Analýza dat menší studie nasvědčuje tomu, že hypolipidemický účinek je sledován též poklesem vaskulárního rizika, zejména snížením výskytu koronárních příhod. Velké prognostické studie probíhají a výsledky se očekávají v nejbližších letech. Dominantní indikací alirocumabu jsou nemocní s familiární hypercholesterolemií či další nemocní s velmi vysokým rizikovým skóre.k.
Key words: alirocumab – PCSK9 inhibitors – LDL – hypolipidemics – cardiovascular risk.
Summary:
PCSK9 inhibitors (inhibitors of proprotein convertase subtilisin/kexin type 9) offer a promising treatment strategy decreasing the concentrations of both atherogenic low density lipoprotein (LDL) and cholesterol contained within LDL. Alirocumab is one of two PCSK9 inhibitors that entered clinical practice so far.
Alirocumab is a specific antibody against PCSK9, manufactured using recombinant technique. When the antibody binds to the PCSK9 isoenzyme, no complex encompassing PCSK9 and LDL receptor can be formed, thus enabling further recirculation of the LDL receptor. Increasing the amount of LDL receptors available on the cell membranes leads to higher internalization of LDL within cells and to lowering of LDL cholesterol concentration. It has been shown that alirocumab exerts favorable effect on atherogenic lipoproteins (i.e. decrease of concentrations of LDL cholesterol by more than 50%) both in monotherapy and in combination with statins or other hypolipidemics. Analysis of data obtained in a smaller trial indicates that the hypolipidemic effect is also associated with a decrease of vascular risk, especially with a drop in coronary ischemic events rate. Large prognostic trials are under way, their results being awaited within the years to come. Alirocumab should be mainly prescribed to patients with familiar hypercholesterolemia or to other patients with a very high risk score.
Farmakologická skupina
Alirocumab (alirokumab) je inhibitor proproteinové konvertázy subtilisin/kexinového typu 9
(proprotein convertase subtilisin/kexin ty-
pe 9, PCSK9) na bázi humánní monoklonální protilátky. Vlastní monoklonální protilátka (třídy IgG1) je plně humánní, získaná rekombinantní DNA technologií. Po farmakologické stránce patří alirocumab do skupiny hypolipidemik, podskupiny inhibitorů PCSK9.
Mechanismus účinku
Proproteinové konvertázy jsou rodinou serinových proteáz, které konvertují neaktivní proproteiny na proteiny biologicky aktivní (zejména enzymy, cytokiny, hormony, membránové proteiny či glykoproteiny). Vlastní aktivace proproteinu je dosaženo zpravidla odštěpením části řetězce a odhalením jeho biologicky účinného místa. Druhá část původního názvu – subtilisin/kexin like – označuje strukturální podobnost s enzymy bakteriální stěny (subtilisiny) či s enzymy stěny kvasinek (kexiny). Číslovka 9 znamená, že se jedná o poslední z devíti izoenzymů. Rodina proproteinových konvertáz hraje významnější úlohu, než je jen řízení metabolismu aterogenních lipoproteinů; uplatňují se např. v metabolismu glycidů, v ukládání triglyceridů do tukové tkáně, v kontrole krevního tlaku, ve vývoji a funkci CNS, v onkogenezi či v imunitních procesech [1].
Alirocumab je humánní monoklonální protilátka selektivně vázající a inaktivující izoenzym PCSK9. Hypolipidemický účinek je cílen na snížení koncentrace LDL cholesterolu (cholesterolu obsaženého v aterogenním lipoproteinu o nízké hustotě). Mechanismus účinku spočívá ve stimulaci vychytávání lipoproteinu o nízké hustotě (low density lipoprotein, LDL) v cílových tkáních, tj. zejména v játrech a ve steroidogenních orgánech. Transport cholesterolu do buněk, tedy internalizaci LDL, zajišťuje vazba apolipoproteinu B100 (apoB100) na membránový receptor vázající LDL (LDL R). Hustota osazení membrán receptorem (membránová exprese) reguluje rychlost clearance tohoto lipoproteinu. Po internalizaci LDL dojde v buněčn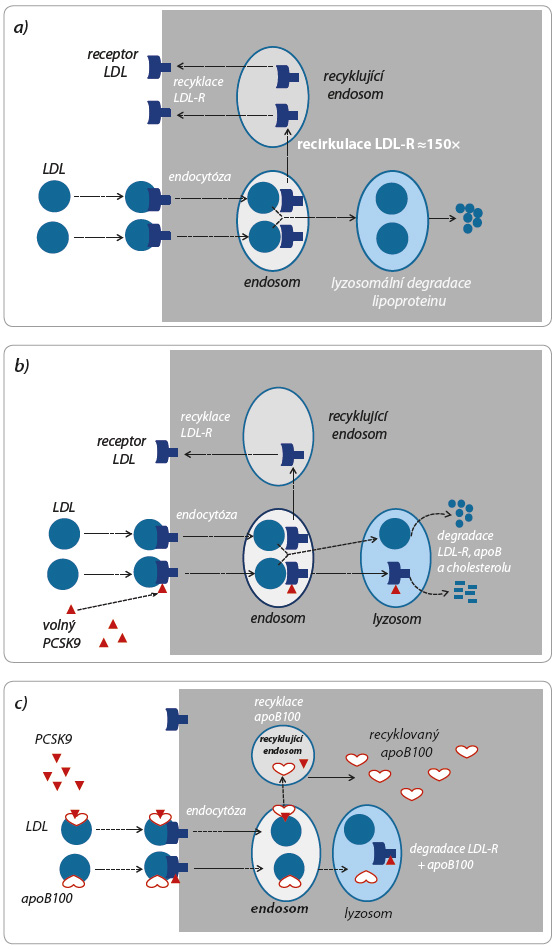 ém endosomu k odloučení vlastní lipidové části od LDL R a od apoB100. Cholesterol a ostatní lipidy jsou využity v buňce, naopak obě proteinové části jsou zachovány pro opětovné použití, LDL R např. recirkuluje 100× až 200× (obr. 1). Vlastní recyklace obou proteinových částí je pod kontrolou specifického proteinu – PCSK9. Volný izoenzym PCSK9 se váže na LDL R a zabrání jeho recyklaci, tj. komplex PCSK9/LDL R podléhá lyzosomální degradaci. Snížená nabídka LDL R na buněčných membránách tak zpomalí vychytávání LDL ve tkáních, koncentrace aterogenního lipoproteinu LDL roste. Naopak blokáda PCSK9 (navázáním na protilátku – alirocumab) významně zvýší recirkulaci LDL R, hustota receptoru na membráně stoupá a je stimulováno vychytávání LDL ve tkáních. Spolu s poklesem koncentrace lipoproteinu LDL logicky klesá i plazmatická koncentrace cholesterolu v těchto částicích. Tak se snižuje aterogenní potenciál. Tento účinek se zřejmě rozhodující měrou podílí na hypolipidemickém a antiaterogenním působení alirocumabu [2,3]. Není však účinkem jediným.
ém endosomu k odloučení vlastní lipidové části od LDL R a od apoB100. Cholesterol a ostatní lipidy jsou využity v buňce, naopak obě proteinové části jsou zachovány pro opětovné použití, LDL R např. recirkuluje 100× až 200× (obr. 1). Vlastní recyklace obou proteinových částí je pod kontrolou specifického proteinu – PCSK9. Volný izoenzym PCSK9 se váže na LDL R a zabrání jeho recyklaci, tj. komplex PCSK9/LDL R podléhá lyzosomální degradaci. Snížená nabídka LDL R na buněčných membránách tak zpomalí vychytávání LDL ve tkáních, koncentrace aterogenního lipoproteinu LDL roste. Naopak blokáda PCSK9 (navázáním na protilátku – alirocumab) významně zvýší recirkulaci LDL R, hustota receptoru na membráně stoupá a je stimulováno vychytávání LDL ve tkáních. Spolu s poklesem koncentrace lipoproteinu LDL logicky klesá i plazmatická koncentrace cholesterolu v těchto částicích. Tak se snižuje aterogenní potenciál. Tento účinek se zřejmě rozhodující měrou podílí na hypolipidemickém a antiaterogenním působení alirocumabu [2,3]. Není však účinkem jediným.
Paralelně s kontrolou nabídky LDL R reguluje PCSK9 též nabídku apoB100, jediného apolipoproteinu LDL. Zde však komplex apoB100/PCSK9 není signálem pro lyzosomální degradaci, ale naopak pro další recirkulaci [4]. Na úrovni LDL R tak PCSK9 působí jako „polibek smrti“, na úrovni apoB100 jako „polibek života“.
Nejasným zůstává mechanismus, jakým je snižována koncentrace aterogenního a trombogenního Lp(a), internalizace pomocí LDL R je ve srovnání s LDL menší a nevysvětluje významný pokles jeho koncentrace po inhibici PCSK9.
Pro plné pochopení účinku PCSK9 v metabolismu LDL je nutno osvětlit jeho „autoregulační“ funkci. Izoenzym PCSK9 se váže jak na LDL R, tak na apolipoprotein B100. V plazmě je izoenzym PCSK9 z velké části vázán na cirkulující LDL, konkrétně na apoB100. Vazba PCSK9 na LDL zabrání jeho vazbě na receptor (LDL R). Při vyšší koncentraci LDL je vázáno více izoenzymu PCSK9 a nabídka jeho volné frakce pro vazbu na LDL R se snižuje. Receptor LDL tak déle recirkuluje, jeho koncentrace na membránách stoupá a zvyšuje se internalizace LDL. Snížení nabídky LDL v plazmě zvýší podíl volného PCSK9, a umožní tak vazbu tohoto izoenzymu na LDL R, který je zvýšeně degradován. Změna poměru volného a vázaného izoenzymu PCSK9 jemně reguluje recirkulaci LDL R a tím i plazmatickou koncentraci LDL. Inhibice PCSK9 na bázi specifické monoklonální protilátky tak umožňuje zvýšit přesun LDL do tkání a snížit jeho plazmatickou koncentraci. Tato strategie patří z hlediska poklesu hodnot LDL k nejúčinnějším.
Na rozdíl od ostatních léčebných postupů cílených na snížení koncentrace LDL cholesterolu (tj. dieta, inhibice absorpce cholesterolu v enterocytu, blokáda syntézy cholesterolu či zvýšení katabolismu cholesterolu), které vedou ke snížení nabídky cholesterolu a k určité depleci cholesterolu v tkáních, nedochází ke snížení saturace tkání cholesterolem. Oba postupy – snížení nabídky cholesterolu (tj. dieta, ezetimib, statiny) a zvýšení vychytávání cholesterolu v tkáních (inhibitory PCSK9) – tak lze s výhodou kombinovat.
Farmakodynamické vlastnosti
Dominantním účinkem alirocumabu stejně jako ostatních inhibitorů PCSK9 je snížení koncentrace cholesterolu v LDL. V rozmezí schválených a užívaných dávek (75–150 mg jedenkrát za 2 týdny) byl doložen pokles koncentrace LDL cholesterolu asi o 50 % při nižším dávkování a asi o 60 % při dávkování vyšším. Nebyl zjištěn významný rozdíl v účinku u pacientů s heterozygotní formou familiární hypercholesterolemie a u nemocných s ostatními typy hypercholesterolemie; u nemocných s homozygotní formou familiární hypercholesterolemie nebyl alirocumab testován. Obdobně nebyl zás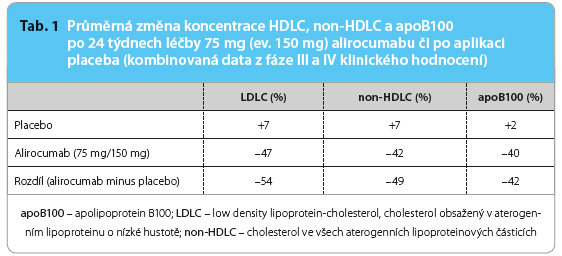 adní rozdíl v účinku při bazální léčbě jinými hypolipidemiky (statiny a ezetimibem) proti účinku v monoterapii, resp. při léčbě střednědobé (kolem 12 týdnů) a dlouhodobé (až 78 týdnů). Koncentrace celkového cholesterolu klesla při léčbě alirocumabem asi o 40–45 %. Významný ukazatel informující o koncentraci cholesterolu ve všech aterogenních lipoproteinech – non HDL cholesterol – se snížil obdobně jako koncentrace LDL cholesterolu o 40–50 % [5]. Snížení koncentrace LDL cholesterolu je dáno nižší koncentrací LDL, nikoliv tím, že by klesla velikost částic tohoto lipoproteinu či se snížil obsah cholesterolu v nich. Vzhledem k tomu, že každá částice LDL má jen jednu molekulu apoB, koncentrace apoB nás věrně informuje o aktuální koncentraci tohoto lipoproteinu. Paralelní pokles koncentrace LDL cholesterolu (o 47 %) i apoB (o 40 %) dokládá, že skutečně dochází ke snížení počtu LDL částic v plazmě, a nikoliv jen ke snížení obsahu cholesterolu v nich (tab. 1).
adní rozdíl v účinku při bazální léčbě jinými hypolipidemiky (statiny a ezetimibem) proti účinku v monoterapii, resp. při léčbě střednědobé (kolem 12 týdnů) a dlouhodobé (až 78 týdnů). Koncentrace celkového cholesterolu klesla při léčbě alirocumabem asi o 40–45 %. Významný ukazatel informující o koncentraci cholesterolu ve všech aterogenních lipoproteinech – non HDL cholesterol – se snížil obdobně jako koncentrace LDL cholesterolu o 40–50 % [5]. Snížení koncentrace LDL cholesterolu je dáno nižší koncentrací LDL, nikoliv tím, že by klesla velikost částic tohoto lipoproteinu či se snížil obsah cholesterolu v nich. Vzhledem k tomu, že každá částice LDL má jen jednu molekulu apoB, koncentrace apoB nás věrně informuje o aktuální koncentraci tohoto lipoproteinu. Paralelní pokles koncentrace LDL cholesterolu (o 47 %) i apoB (o 40 %) dokládá, že skutečně dochází ke snížení počtu LDL částic v plazmě, a nikoliv jen ke snížení obsahu cholesterolu v nich (tab. 1).
Přínosem je též snížení hodnot vysoce aterogenního a trombogenního lipoproteinu (a)
označovaného jako Lp(a), jeho koncentrace se snížila při léčbě o 20–30 %. Ostatní hypolipidemika tento lipoprotein významně neovlivňují, pokles při léčbě alirocumabem byl významný.
V neposlední řadě byl doložen též mírný účinek na vzestup hodnot HDL cholesterolu (high density lipoprotein cholesterol, cholesterol s lipoproteinem o vysoké hustotě), ten se pohyboval v rozmezí 5–10 % [5].
Farmakokinetické vlastnosti
Alirocumab jako makromolekulární protilátka má řadu vlastností odlišných od klasických makromolekulárních léčiv. Vedle mimořádně vysoké specificity zaměřené na cílovou strukturu a vedle výhradně extracelulárního účinku je významná pouze jeho parenterální aplikace. Eliminace tohoto typu monoklonálních protilátek je dána vazbou na antigen (fagocytózou či endocytózou) v retikuloendotelovém systému či proteolýzou volné protilátky. Díky tomu, že se v absorpci a při eliminaci neuplatňují transportní pumpy a oxidázy cytochromu P450 (CYP), neobjevují se klasické lékové interakce na bázi ovlivnění farmakokinetiky. Rovněž není významná závislost účinku na řadě farmakogenetických vlastností, na renálních či jaterních funkcích. Specifické je též dlouhé působení v řádu týdnů. Díky své biologické povaze však monoklonální protilátky mohou indukovat tvorbu protilátek proti vlastnímu proteinovému komplexu (imunogenicita).
Po podkožním podání se alirocumab dobře vstřebává, jeho biologická dostupnost se pohybuje kolem 85 % (tab. 2). K nástupu účinku dochází za 4–8 hodin, vrcholové plazmatické koncentrace je dosaženo za 3–7 dnů, maximální účinek (stanovený poklesem hodnoty LDL cholesterolu) je možno očekávat za dva týdny po aplikaci. Ustálená koncentrace se objevuje po podání 2–3 dávek (à 2 týdny) a je přibližně dvojnásobná proti koncentraci při jednorázové aplikaci [6].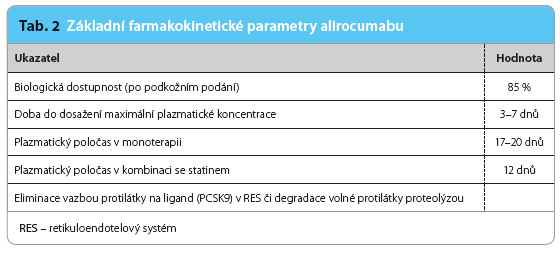
Alirocumab zůstává v intravaskulárním kompartmentu, prochází placentární bariérou, distribuce do mateřského mléka není známa. Eliminace probíhá dvojí cestou – vazbou na PCSK9 s rychlejším vychytáváním v retikuloendotelovém systému (převažuje při malých koncentracích alirocumabu) či pomalejší proteolytickou degradací volného alirocumabu na malé peptidy a aminokyseliny (převažuje při vysoké koncentraci alirocumabu).
V rozmezí doporučených dávek je biologický poločas plazmatické eliminace dlouhý 17–20 dnů. Současné podávání statinů zkracuje poločas asi o 30 %, tj. na 12 dnů. Příčinou je zvýšení koncentrace PCSK9 při poklesu nabídky cholesterolu indukovaném hypolipidemikem. Větší podíl vázané monoklonální protilátky (alirocumabu) k ligandu (PCSK9) vede k její rychlejší eliminaci z cirkulace. Mírné až středně těžké hepatální či renální selhání farmakokinetiku neovlivňuje.
Účinek alirocumabu může být snížen indukcí neutralizačních protilátek. U některých nemocných s tímto typem protilátek došlo ke krátkodobému (týdny trvajícímu) poklesu účinku, ojediněle byl tento pokles déletrvající. Vývoj neutralizačních protilátek se objevuje u 5–10 % nemocných, zpravidla kolem 12. týdne léčby, bývá přechodný (méně než
4 týdny), jen u některých nemocných (u méně než 1 %) může být přechodně snížen hypolipidemický účinek. Pokles účinku je omezen na dobu několika týdnů, jen zcela ojediněle trval delší dobu [7]. Přítomnost neutralizačních protilátek nezvýšila výskyt lokálních či celkových alergických komplikací, nesnížila se tedy bezpečnost léčby. Dlouhodobý (několikaletý) účinek alirocumabu při přítomnosti neutralizačních protilátek není znám.
Indikace a klinické zkušenosti
Účinnost a bezpečnost alirocumabu byla prověřována ve studiích fáze III a IV klinického hodnocení, program byl nazván ODYSSEY. Ve 14 studiích fáze III byl prověřován účinek na lipidové spektrum (zejména na LDL cholesterol) v různých léčebných režimech (v monoterapii, v kombinaci s ostatními hypolipidemiky – se statiny a s ezetimibem), u různé populace (u pacientů s heterozygotní formou familiární hypercholesterolemie, u nefamiliární hypercholesterolemie apod.) a po různě dlouhou dobu (12–78 týdnů). Jak bylo uvedeno v části věnované farmakodynamice, výsledky těchto studií doložily velmi dobrou účinnost alirocumabu – pokles koncentrace LDL cholesterolu o 50–60 %, pokles koncentrace non HDL cholesterolu o 40–50 %, pokles koncentrace apoB asi o 40 % a mírný vzestup koncentrace HDL cholesterolu o 5–10 %.
V současné době pokračuje hodnocení dlouhodobé účinnosti a bezpečnosti ve dvojitě zaslepené studii ODYSSEY OUTCOMES. Ta je navržena k prospektivnímu sledování kardiovaskulárního přínosu léčby. Do studie je zařazeno zhruba 18 000 nemocných po koronární příhodě. K hypolipidemické léčbě vedené lege artis je v intervenční větvi přidán alirocumab, předpokládaná délka léčby je až 60 měsíců [8].
I když jsou data z prognostické studie očekávána v roce 2018, již nyní máme určité dílčí údaje o účinku alirocumabu na kardiovaskulární riziko. Poskytla je post hoc analýza studie ODYSSEY LONG TERM [9]. Tato dvojitě zaslepená, placebem kontrolovaná studie fáze III byla koncipována k prověření dlouhodobé, nejméně rok trvající, léčby 150 mg alirocumabu aplikovaného jedenkrát za dva týdny. Nejednalo se tedy o studii prognostickou. Zařazeno bylo téměř 2,5 tisíce nemocných s hypercholesterolemií ohrožených vysokým kardiovaskulárním rizikem, bazální léčba zahrnovala maximálně tolerovanou dávku statinu (ev. v kombinaci s ezetimibem). Prespecifikovaná interim analýza provedená po 12–18 měsících léčby ukázala 57% snížení koncentrace LDL cholesterolu v aktivní větvi a její 4% vzestup ve větvi kontrolní, výsledek byl statisticky vysoce významný (p < 0,0001). Nejčastějšími nežádoucími účinky (s výskytem u ≥ 5 % pacientů) byly drobné infekce horních cest dýchacích, ty se však objevily ve zcela stejném procentu ve skupině kontrolní. Lokální reakce v místě vpichu se vyskytly u 6 % léčených alirocumabem a ve 4 % ve skupině s placebem.
V post hoc analýze byl sledován též výskyt velkých vaskulárních příhod (kardiovaskulární mortalita, infarkt myokardu, iktus či nestabilní angina pectoris vyžadující hospitalizaci). Ty se objevily u 1,7 % nemocných při aktivní léčbě a u 3,3 % ve skupině kontrolní (tab. 3). Téměř 50% pokles počtu příhod byl sice významný, nicméně je nutné jej verifikovat, studie nebyla robustní a počet cílových událostí nebyl dostatečný.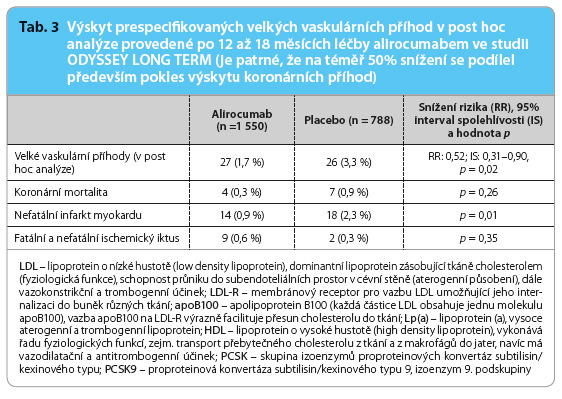
Na základě předložených dat byl alirocumab schválen k užití v léčbě dospělých pacientů s primární hypercholesterolemií (s heterozygotní familiární hypercholesterolemií a s nefamiliární hypercholesterolemií) nebo se smíšenou dyslipidemií jako doplněk k dietním opatřením:
- v kombinaci se statinem nebo se statinem a s jinou hypolipidemickou léčbou u pacientů, u kterých nelze dostáhnout cílových hodnot LDL cholesterolu maximální tolerovanou dávkou statinů,nebo
- samostatně či v kombinaci s jinou hypolipidemickou léčbou u pacientů, kteří netolerují statiny nebo u kterých je podávání statinů kontraindikováno.
Zařazení do současné palety léčiv
Alirocumab je jedním ze dvou inhibitorů PCSK9 uvolněných k léčbě dyslipidemie, druhým léčivem je evolocumab. Oba inhibitory mají stejný mechanismus účinku, oba jsou na bázi humánní monoklonální protilátky anti PCSK9, oba mají obdobné farmakokinetické i farmakodynamické vlastnosti. Pokles koncentrací LDL cholesterolu, non HDL cholesterolu a dalších lipoproteinů je srovnatelný. Účinek na pokles výskytu kardiovaskulárních příhod je rovněž porovnatelný, byť doklad u obou přípravků byl podán jen v menších studiích a na výsledky prognostických studií ještě čekáme. Při vzájemném porovnání nenajdeme zásadní rozdíly, odlišnosti jsou prakticky dvě. V dávkovacím schématu – alirocumab aplikujeme jednou za dva týdny, evolocumab je možno podávat jednou za dva či za čtyři týdny. Druhým rozdílem je, že účinnost evolocumabu na pokles koncentrace LDL cholesterolu byla prověřována také u homozygotních nemocných s familiární hypercholesterolemií, účinnost alirocumabu byla zjišťována pouze u pacientů heterozygotních. Tyto rozdíly však nejsou zásadní a není důvod pro preferenci jednoho z nich.
V rámci skupiny hypolipidemik jsou v indikaci snížení kardiovaskulárního rizika lékem první volby statiny, při nedosažení cílové hodnoty LDL cholesterolu pak kombinace statinů s ezetimibem. Tuto strategii je možno považovat za zlatý standard. Při této duální léčbě docílíme poklesu koncentrace LDL cholesterolu o více než 50 %, tedy hodnoty srovnatelné s účinkem alirocumabu. V mechanismu působení však existuje několik zcela zásadních rozdílů. Předně inhibitory PCSK9 jsou určeny do kombinace s hypolipidemiky základní řady, tj. se statiny, resp. s kombinací statin/ezetimib, účinek na pokles koncentrace aterogenních lipidů je aditivní, a tak dosáhneme více než 80% snížení. Pouze při intoleranci či při kontraindikaci statinů či ezetimibu jsou vhodné inhibitory PCSK9 mimo vlastní kombinaci. Důvodem preference základní řady hypolipidemik je především vysoká cena alirocumabu (či evolocumabu) i skutečnost, že zatím nemáme validní mortalitní a morbiditní data získaná při dlouhodobé léčbě inhibitory PCSK9.
Druhým rozdílem je lepší tolerance i bezpečnost alirocumabu v porovnání se statiny. Léčba není spojena s myalgiemi/m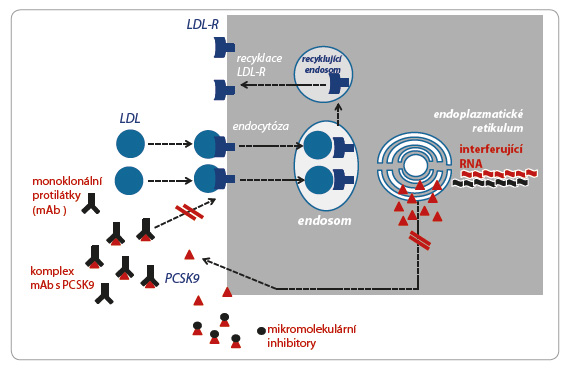 yopatiemi, neobjevuje se zvýšené riziko onemocnění diabetem ani příznaky dané sníženou tvorbou steroidních hormonů (zejména sexuálně účinných). Strategie cílená na zvýšení nabídky LDL R totiž nevede k poklesu nabídky cholesterolu ve tkáních, jako je tomu např. při léčbě ostatními hypolipidemiky.
yopatiemi, neobjevuje se zvýšené riziko onemocnění diabetem ani příznaky dané sníženou tvorbou steroidních hormonů (zejména sexuálně účinných). Strategie cílená na zvýšení nabídky LDL R totiž nevede k poklesu nabídky cholesterolu ve tkáních, jako je tomu např. při léčbě ostatními hypolipidemiky.
V poslední fázi klinického hodnocení se nachází humanizovaná protilátka proti PCSK9 – bococizumab. Zatím byl doložen významný hypolipidemický účinek a dobrá tolerance, data o účinku na pokles kardiovaskulárního rizika ještě nejsou k dispozici. Časnějšími fázemi hodnocení procházejí mikromolekulární inhibitory PCSK9 a interferující kyselina ribonukleová (RNA) snižující syntézu izoenzymu (obr. 2).
Nežádoucí účinky
Alirocumab je velmi dobře tolerován. Při analýze dat z celého programu ODYSSEY se výskyt celkových příznaků typických pro ostatní monoklonální protilátky (infekce horních cest dýchacích či infekce močové, alergické příhody, průjmy apod.) či nežádoucích příznaků typických pro jiná hypolipidemika (myalgie či zvýšený výskyt diabetu) neobjevoval častěji nežli při podávání placeba. Nutnost podkožní aplikace monoklonální protilátky však vedla k častějšímu výskytu lokálních nežádoucích účinků v porovnání s placebem (7,2 % vs. 5,1 %). Ty byly typu zarudnutí, svědění, drobného otoku až bolestivosti v místě vpichu, celkem tedy nezávažného charakteru.
V nejrozsáhlejší studii, kde byl alirocumab podáván déle než rok, se lokální příznaky objevovaly asi o čtvrtinu častěji (ale statisticky nevýznamně) při léčbě alirocumabem v porovnání s placebem (5,9 % vs. 4,2 %). Obdobně nevýznamně vyšší byl výskyt neurokognitivních poruch (1,2 % vs. 0,5 %) či oftalmologických potíží (2,9 % vs. 1,9 %). Pouze myalgie se v této jediné studii vyskytovaly častěji (5,4 % vs. 2,9 %), v ostatních studiích vyšší výskyt myalgií pozorován nebyl [9].
Samostatně byl sledován výskyt diabetu, jehož incidence při léčbě statiny mírně stoupá. Analýza deseti studií fáze III (trvající až 2 roky) neukázala vzestup glykemie nalačno či vzestup hodnot glykovaného hemoglobinu (HbA1c) během léčby [10].
Díky antigenicitě monoklonálních protilátek se při tomto typu biologické léčby setkáváme s výskytem protilátek proti vlastnímu léčivu. Při nízkém titru, který je přechodně přítomen asi u 5 % léčených alirocumabem, nedochází k neutralizaci účinku, nemění se účinnost léčby. Přítomnost protilátek však zvyšuje výskyt lokální reakce v místě vpichu – svědění, celkové reakce nebyly popsány. Asi u jednoho procenta léčených je titr protilátek vyšší a může dojít k přechodnému (týdny trvajícímu) poklesu hypolipidemického účinku. Klinický význam neutralizačních protilátek není velký.
Kontraindikace
Kontraindikací léčby alirocumabem je významná přecitlivělost na vlastní protilátku či na jiné komponenty. Doklady o zkřížené alergické reaktivitě s obdobnou humánní protilátkou proti PCSK9 – evolocumabem – nejsou, vzhledem k podobnostem struktury je však nelze vyloučit.
Výskyt neutralizačních protilátek není považován za kontraindikaci, lokální alergická reakce (svědění, mírný otok, zarudnutí) rovněž ne.
V preklinických studiích nebyla pozorována ani embryotoxicita, ani vliv na genetický materiál. S aplikací alirocumabu v graviditě zkušenosti nejsou. Podání v těhotenství proto přísně zvažujeme podle kardiovaskulárního rizika matky. Přestup protilátek třídy IgG do mateřského mléka je významný v době tvorby mleziva. Proto na počátku kojení alirocumab nepodáváme či se kojení vyhneme. V pozdějším období kojení je přestup alirocumabu do mléka menší, nicméně vliv na novorozence v tomto období není stanoven [11].
Lékové interakce
Jak je uvedeno výše, eliminace alirocumabu je dvojího typu – rychlejší je závislá na vazbě alirocumabu s PCSK9, kdy je komplex eliminován v retikuloendotelovém systému. Vyšší hodnoty izoenzymu PCSK9, s nimiž se setkáváme při léčbě jinými hypolipidemiky (statiny, ezetimibem či fibráty), tak urychlují plazmatickou eliminaci a snižují expozici alirocumabu o 20–40 %. Klinický význam však toto snížení nemá, hypolipidemický účinek se významně nemění.
Vzhledem k tomu, že monoklonální protilátky neovlivňují aktivitu metabolických a transportních systémů, nehrozí riziko lékových interakcí s klasickými léčivy.
Dávkování
Alirocumab je aplikován v podkožních injekcích v základní dávce 75 mg vždy po dvou týdnech či v dávce dvojnásobné, tj. 150 mg, opět jedenkrát za dva týdny. Vyšší dávkování je indikováno při nedostatečném účinku základní dávky (určeném po 4–8 týdnech léčby) či v případě nutnosti dosažení maximálního účinku při velmi vysokých hodnotách LDL cholesterolu a při vysokém kardiovaskulárním riziku. Dávkování je jednotné u různých populací, tj. senioři, nemocní s renálním či s hepatálním selháním nevyžadují snížení dávky [11].
Alirocumab je dodáván v předplněných injekcích určených k autoaplikaci. Injekční stříkačky skladujeme při teplotě 2–8 °C. Před vlastním podáním je nutné ohřát stříkačku na pokojovou teplotu, poté alirocumab neprodleně podáme. Vhodnými místy pro injekční aplikaci jsou stehna, břicho, ev×. předloktí. Místa vpichu postupně měníme. Po zacvičení nečiní autoaplikace nemocným potíže, je však nutno pacienty instruovat a výkon prakticky vyzkoušet pod odborným dohledem.
Seznam použité literatury
- [1] Seidah NG, Chrétien M, Day R. The family of subtilisin/kexin like pro‑protein and pro‑hormone convertases: divergent or shared functions. Biochimie 1994; 76: 197–209.
- [2] Farnier M. An evaluation of alirocumab for the treatment of hypercholesterolemia. Expert Rev Cardiovasc Ther 2015; 13: 1307–1323.
- [3] Lagace TA. PCSK9 and LDLR degradation: regulatory mechanisms in circulation and in cells. Curr Opin Lipidol 2014; 25: 387–393.
- [4] Sun H, Samarghandi A, Zhang N, et al. Proprotein Convertase Subtilisin/Kexin Type 9 Interacts With Apolipoprotein B and Prevents Its Intracellular Degradation, Irrespective of the Low‑Density Lipoprotein Receptor. Arterioscler Thromb Vasc Biol 2012; 32: 1585–1595.
- [5] White CM. Therapeutic Potential and Critical Analysis of the PCSK9 Monoclonal Antibodies Evolocumab and Alirocumab. Ann Pharmacother 2015; 49: 1327–1335.
- [6] Lunven C, Paehler T, Poitiers F, et al. A randomized study of the relative pharmacokinetics, pharmacodynamics, and safety of alirocumab, a fully human monoclonal antibody to PCSK9, after single subcutaneous administration at three different injection sites in healthy subjects. Cardiovasc Ther 2014; 32: 297–301.
- [7] Kastelein JJP, Ginsberg HN, Langslet G, et al. ODYSSEY FH I and FH II: 78 week results with alirocumab treatment in 735 patients with heterozygous familial hypercholesterolaemia. Eur Heart J 2015; 36: 2996–3003.
- [8] https://clinicaltrials.gov/ct2/show/NCT01663402
- [9] Robinson JG, Farnier M, Krempf M, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372: 1489–1499.
- [10] Colhoun HM, Ginsberg HN, Robinson JG, et al. No effect of PCSK9 inhibitor alirocumab on the incidence of diabetes in a pooled analysis from 10 ODYSSEY Phase 3 studies. Eur Heart J 2016; Jul 26. pii: ehw292. [Epub ahead of print]
- [11] SPC Praluent, viz: http://www.ema.europa.eu/docs/cs_CZ/ document_library/EPAR_‑_Product_Information/human/003882/WC500194521.pdf