Aliskiren/hydrochlorothiazid – fixní kombinace
Fixní kombinace aliskirenu (v dávce 150 mg a 300 mg) s hydrochlorothiazidem (v dávce 12,5 mg a 25 mg) je určena k léčbě arteriální hypertenze. Aliskiren je přímým inhibitorem katalytické aktivity reninu, který neovlivňuje hormonální aktivitu. Hydrochlorothiazid patří ke klasickým thiazidovým diuretikům. Vzájemná kombinace je výhodná z řady důvodů – je potencován antihypertenzní účinek a naopak je potlačen výskyt nežádoucích účinků (zejména riziko hypokalemie a inzulinorezistence při podávání hydrochlorothiazidu). Z hlediska tolerance patří tato kombinace k nejlépe snášeným antihypertenzivům. Rovněž riziko lékových interakcí obou složek je velmi nízké. Po stránce účinnosti a bezpečnosti se nám dostává do ruky antihypertenzivum splňující nejvyšší požadavky.
βFarmakologická skupina
Chemické a fyzikální vlastnosti
Aliskiren je podáván jako sůl – hemifumarát; chemický vzorec je (2S,4S,5S,7S)-N-(2-karbamoyl-2-methylpropyl)-5-amino-4-hydroxy-2,7-diisopropyl-8-[4-methoxy-3-(3-methoxypropoxy)fenyl]-octanamid hemifumarát. Aliskiren hemifumarát je mírně nažloutlý krystalický prášek, který je díky výrazné hydrofilii velmi dobře rozpustný ve vodě a v tělních tekutinách. Hydrochloro-thiazid je chemicky 6-chloro-3,4-dihydro-2H-1,2,4-benzothiadiazin-7-sulfonamid 1,1-dioxid. Hydrochlorothiazid je bílý krystalický prášek výrazně solubilní ve vodě a tělních tekutinách ( obr. 1 ).
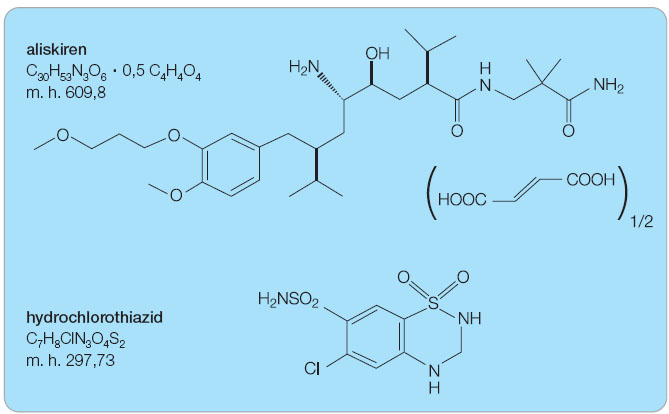 Sumární vzorec:
Sumární vzorec:
aliskiren C 30 H 53 N 3 O 6 . 0,5 C 4 H 4 O 4
hydrochlorothiazid C 7 H 8 ClN 3 O 4 S 2
Molekulová hmotnost:
aliskiren 609,8
hydrochlorothiazid 297,73
Mechanismus účinku, farmakodynamika
Aliskiren
Aliskiren je přímým inhibitorem katalytické aktivity reninu – tedy reninu jako
proteázy
konvertující angiotenzinogen na angiotenzin I.
Neinhibuje však působení reninu jako
hormonu stimulujícího (pro)reninový receptor.
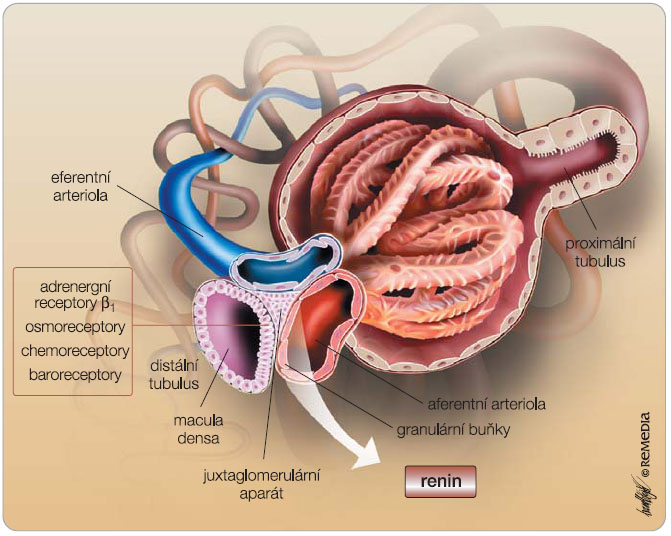 Renin je syntetizován jako proenzym –
prorenin . Ten je aktivován striktně v juxtaglomerulárním aparátu odštěpením části aminokyselinového řetězce a renin je vyplaven do oběhu. Aspartyl-proteáza renin je klíčovým působkem v systému renin–angiotenzin–aldosteron (RAA), jeho uvolnění z juxtaglomerulárního aparátu je pod vlivem adrenergního receptoru β 1 , osmoreceptorů reagujících na pokles osmotického tlaku, baroreceptorů sledujících tlak ve vas afferens a chemoreceptorů kontrolujících zejména hladinu natria a kalia ( obr. 2 ). Tímto mechanismem, trvale monitorujícím důležité veličiny pro udržení krevního tlaku a homeostázy, je umožněno suchozemským organismům přežívat mimo vodní prostředí. Na systém RAA nelze však pohlížet pouze jako na systém kontrolující krevní tlak; je nutno si uvědomit, že ve fylogenezi kontrolovaly tyto defenzivní mechanismy i ostatní pochody důležité pro přežití, tedy vedle udržení cirkulace rovněž stimulovaly hemostázu a reparační procesy. Proto nepřekvapí účast tak důležitého systému, jako je osa RAA, též v pochodech modifikujících zánětlivé děje a primární či sekundární hemostázu.
Renin je syntetizován jako proenzym –
prorenin . Ten je aktivován striktně v juxtaglomerulárním aparátu odštěpením části aminokyselinového řetězce a renin je vyplaven do oběhu. Aspartyl-proteáza renin je klíčovým působkem v systému renin–angiotenzin–aldosteron (RAA), jeho uvolnění z juxtaglomerulárního aparátu je pod vlivem adrenergního receptoru β 1 , osmoreceptorů reagujících na pokles osmotického tlaku, baroreceptorů sledujících tlak ve vas afferens a chemoreceptorů kontrolujících zejména hladinu natria a kalia ( obr. 2 ). Tímto mechanismem, trvale monitorujícím důležité veličiny pro udržení krevního tlaku a homeostázy, je umožněno suchozemským organismům přežívat mimo vodní prostředí. Na systém RAA nelze však pohlížet pouze jako na systém kontrolující krevní tlak; je nutno si uvědomit, že ve fylogenezi kontrolovaly tyto defenzivní mechanismy i ostatní pochody důležité pro přežití, tedy vedle udržení cirkulace rovněž stimulovaly hemostázu a reparační procesy. Proto nepřekvapí účast tak důležitého systému, jako je osa RAA, též v pochodech modifikujících zánětlivé děje a primární či sekundární hemostázu.
Pro pochopení rozdílů v různých přístupech tlumících systém RAA je potřeba rekapitulovat základní mechanismy spřažené do jednoho funkčního celku kontroly vnitřního prostředí a krevního tlaku.
Po uvolnění reninu z juxtaglomerulárního aparátu přetrvává renin částečně v cirkulaci, částečně difunduje do intersticia či se váže na specifický (pro)reninový receptor. Jak v cirkulaci, tak ve tkáni působí jako proteáza konvertující angiotenzinogen na inaktivní dekapeptid angiotenzin I (AI). Ten je zejména v plicní cirkulaci aktivován dipeptidyl-karbopeptidázou – angiotenzin konvertujícím enzymem (ACE) – na hlavní aktivní působek angiotenzin II (AII). Ten potom stimuluje hlavní receptor AT 1 , lokalizovaný zejména v cévní stěně, v renálním tubulárním systému, v CNS a v kůře nadledvin. V rezistenčním tepenném řečišti a ve vas efferens ledvin stimuluje vazokonstrikci, v renálním tubulárním systému jak přímo, tak zejména zprostředkovaně vyplavením aldosteronu směnu natria za kalium s retencí sodíkových iontů a naopak vyplavením iontů draslíku či stimulací centra žízně zvyšuje příjem tekutin. Takovýto robustní systém musí být pro zajištění rovnováhy kontrolován. Proto jsou v endotelu po stimulaci exprimovány též receptory typu AT 2 a AT 4 . Jejich stimulace má převážně natriuretický a vazodilatační efekt.
Paralelně je angiotenzin I (i vlastní angiotenzin II) konvertován též na jiné vazoaktivní peptidy, jako je angiotenzin III a IV nebo
angiotenzin 1–7 (A1–7). Též tyto působky mají vlastní biologickou úlohu a účastní se nejen kontroly homeostázy a krevního tlaku, ale i reparačních a hemostatických pochodů. Významný je zejména A1–7, který tvoří paralelní systém stojící v protiváze proti výkonnému systému postavenému na angiotenzinu I a navozuje stimulací specifického receptoru MAS v ledvině a v cévách vazodilataci, natriurézu a diurézu.
Třetím systémem zajišťujícím rovnováhu osy RAA je systém kininový. Terminální efektor bradykinin má významný vazodilatační a natriuretický účinek a díky stimulaci NO syntázy upravuje dysfunkci endotelu. Jeho spojení se systémem RAA je dáno klíčovým enzymem – ACE. Ten nejen aktivuje angiotenzin II, ale též degraduje bradykinin na inaktivní působky. Podobně ACE degraduje důležitý tetrapeptid N-acetyl-Ser-Asp-Lys-Pro (Ac-SDKP), významně tlumící zánětlivé a proliferační pochody. Útlum degradace po blokádě ACE tak může příznivě ovlivnit přestavbu cévní stěny či degenerativní pochody v myokardu.
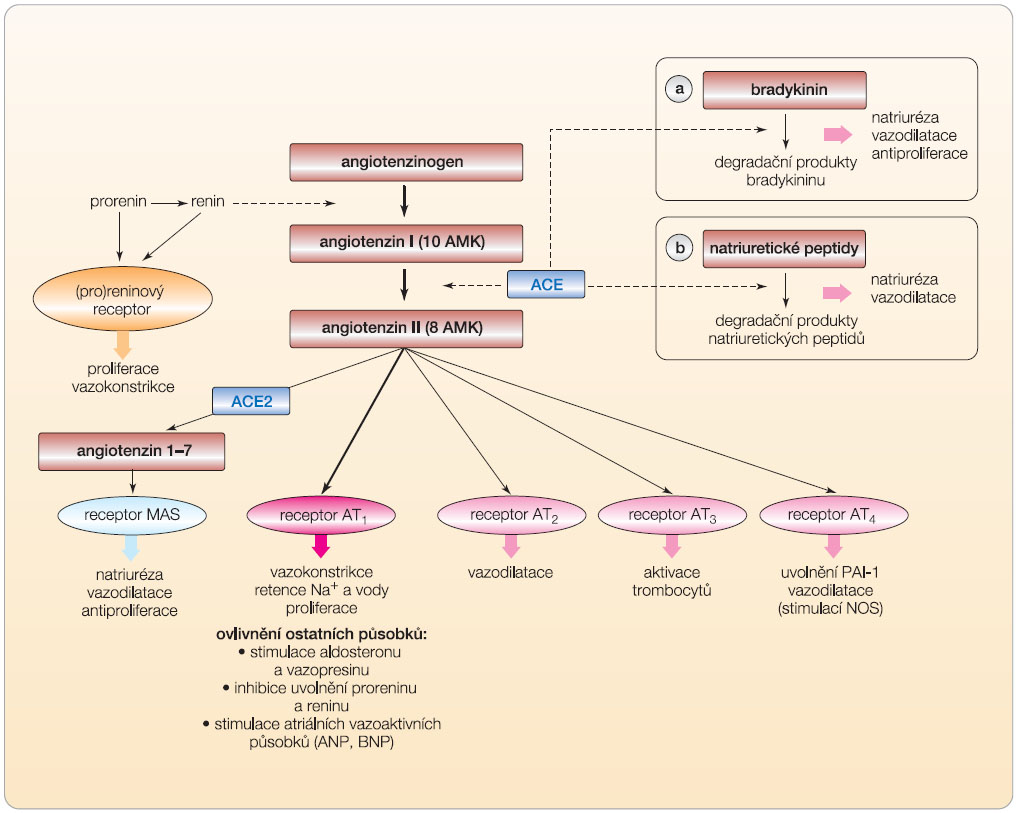 Konečně posledním systémem, který je nutno uvést, jsou natriuretické vazodilatační peptidy typu A, B nebo C. Také ty jsou stimulovány – obdobně jako bradykinin – hypotenzí, hyponatremií a hypokalemií, navíc však angiotenzinem II a dilatací srdečních oddílů. Degradovány jsou, opět jako kininy, angiotenzin konvertujícím enzymem a řadou nespecifických peptidáz. I tento systém hraje významnou úlohu v kontrole účinku angiotenzinu II a aldosteronu. Souhrnně systém RAA a systémy s ním sdružené znázorňuje obr. 3a , 3b
Konečně posledním systémem, který je nutno uvést, jsou natriuretické vazodilatační peptidy typu A, B nebo C. Také ty jsou stimulovány – obdobně jako bradykinin – hypotenzí, hyponatremií a hypokalemií, navíc však angiotenzinem II a dilatací srdečních oddílů. Degradovány jsou, opět jako kininy, angiotenzin konvertujícím enzymem a řadou nespecifických peptidáz. I tento systém hraje významnou úlohu v kontrole účinku angiotenzinu II a aldosteronu. Souhrnně systém RAA a systémy s ním sdružené znázorňuje obr. 3a , 3b
. Obecně se dá říci, že řada fyziologických pochodů (stimulace receptorů AT 2 a AT 4 angiotenzinem II, stimulace receptoru MAS angiotenzinem 1–7, uvolnění atriálních natriuretických peptidů či zvýšení nabídky bradykininu a tetrapeptidu Ac-SDKP) stojí v protiváze k základnímu systému – angiotenzinu II a stimulaci receptoru AT 1 .
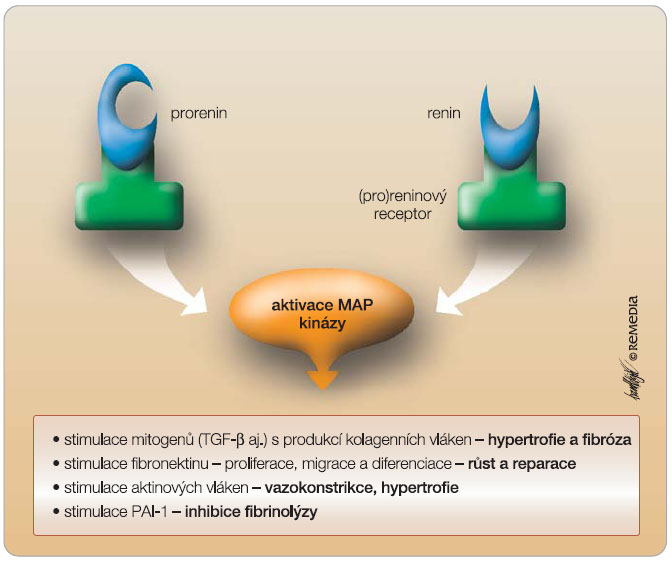 Konečně, aby byl obraz úplný, renin není jen proteázou, ale též
hormonem
v pravém slova smyslu. Po uvolnění cirkuluje a váže se – spolu se svým katalyticky inaktivním prekurzorem proreninem – na
(pro)reninový receptor
. Stimulace tohoto receptoru, lokalizovaného v subendoteliálním prostoru cév (zejména mesangia glomerulů a věnčitých cév), vede k aktivaci řady působků s výslednou vazokonstrikcí, proliferací hladké svaloviny a kolagenu, k útlumu syntézy NO, inhibici fibrinolýzy – tedy k pochodům vedoucím k reparaci tkáně na straně jedné či k přestavbě a hypertrofii cévní stěny, degeneraci glomerulů, hypertrofii srdečních komor, endoteliální dysfunkci a k trombotickým komplikacím na straně druhé ( obr. 4 ). Vazba reninu na (pro)reninový receptor též několikanásobně zvýší katalytickou aktivitu reninu, tedy konverzi angiotenzinogenu na AI. Také volný prorenin se může vázat na (pro)reninové receptory, tento pochod aktivuje jeho enzymatickou aktivitu [1, 2].
Konečně, aby byl obraz úplný, renin není jen proteázou, ale též
hormonem
v pravém slova smyslu. Po uvolnění cirkuluje a váže se – spolu se svým katalyticky inaktivním prekurzorem proreninem – na
(pro)reninový receptor
. Stimulace tohoto receptoru, lokalizovaného v subendoteliálním prostoru cév (zejména mesangia glomerulů a věnčitých cév), vede k aktivaci řady působků s výslednou vazokonstrikcí, proliferací hladké svaloviny a kolagenu, k útlumu syntézy NO, inhibici fibrinolýzy – tedy k pochodům vedoucím k reparaci tkáně na straně jedné či k přestavbě a hypertrofii cévní stěny, degeneraci glomerulů, hypertrofii srdečních komor, endoteliální dysfunkci a k trombotickým komplikacím na straně druhé ( obr. 4 ). Vazba reninu na (pro)reninový receptor též několikanásobně zvýší katalytickou aktivitu reninu, tedy konverzi angiotenzinogenu na AI. Také volný prorenin se může vázat na (pro)reninové receptory, tento pochod aktivuje jeho enzymatickou aktivitu [1, 2].
Všechny způsoby blokády osy RAA zvyšují koncentraci reninu, nicméně při podávání přímých inhibitorů reninu je vzestup významně nejvyšší. Předpokládá se, že tato skutečnost má klinický dopad – vyšší koncentrace reninu zpětnou vazbou vede k down-regulaci (pro)reninových receptorů, a tak je aktivita této větve systému výrazněji utlumena [3].
Při vývoji kardiovaskulárních chorob je významné, že při hypertenzi, diabetu, fibrilaci síní, srdečním selhání, ischemii apod. je systém RAA hyperaktivován. Jednak dochází ke zvýšení aktivity reninu po jeho vyplavení a též zvýšená koncentrace proreninu po jeho vazbě na (pro)reninové receptory odstartuje jeho katalytickou aktivitu. Z tohoto hlediska je u plejády kardiovaskulárních onemocnění potřeba hyperaktivovanou osu RAA účinně tlumit. Nabízejí se různé možnosti útlumu – inhibice konverze AI na AII snížením aktivity ACE, blokáda receptoru AT 1 sartany či inhibice katalytické aktivity reninu aliskirenem.
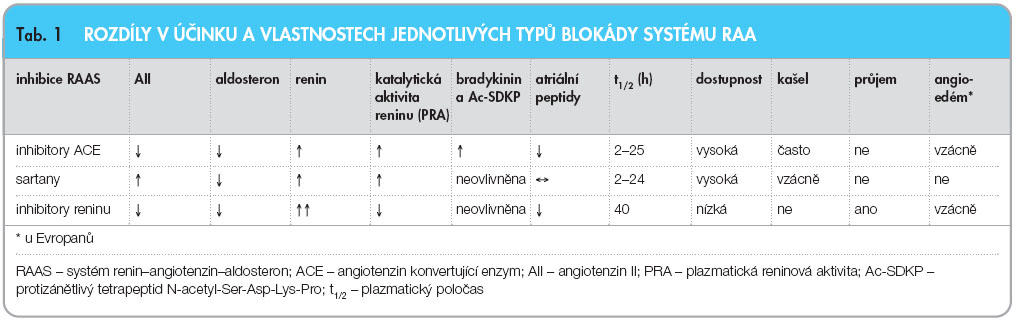 Jak bylo předesláno, komplexní znalost regulačních pochodů v rámci osy RAA vysvětluje, že různé přístupy blokády hlavní větve systému, tj. zamezení aktivace receptoru AT
Jak bylo předesláno, komplexní znalost regulačních pochodů v rámci osy RAA vysvětluje, že různé přístupy blokády hlavní větve systému, tj. zamezení aktivace receptoru AT
1 , vedou – v důsledku rozdílů v ovlivnění paralelních větví systému – k odlišným farmakodynamickým účinkům, tedy k rozdílnému klinickému efektu. Konkrétně inhibice ACE vede k hyperaktivaci reninu, ke zvýšení nabídky bradykininu, snížení aktivace receptoru MAS a samozřejmě ke snížení stimulace receptoru AT 1 . Blokáda angiotenzinových receptorů AT 1 sartany pak opět hyperaktivuje renin (snížením aktivity zpětné vazby), zvýšená hladina AII stimuluje receptory AT 2 a AT 4 , zvyšuje se nabídka A1–7 a stimulace receptorů MAS, ale není významně ovlivněna nabídka bradykininu. A konečně inhibicí reninu aliskirenem dosáhneme útlumu všech zúčastěných receptorů, není ovlivněn bradykinin a opět, díky absenci zpětné vazby, je vyplaven renin. Jeho vysoká hladina stimuluje sice (pro)reninové receptory, katalytická aktivita je však účinně inhibována. Rozdíly jsou uvedeny souhrnně v tab. 1 .
Farmakodynamické vlastnosti jsou v jádře společné všem typům inhibitorů osy RAA. Na antihypertenzním efektu aliskirenu se uplatní jak vazodilatace , tak pokles cirkulujícího objemu při natriuréze a diuréze.Renální dilatace vas efferens vede k poklesu intraglomerulárního tlaku, ke snížení renálního filtračního tlaku a k poklesu glomerulární filtrace, výsledkem je nefroprotekcena úrovni glomerulu za cenu mírného snížení renální filtrační funkce. Tubulární renální funkce jsou ovlivněny na úrovni zvýšené natriurézy i diurézy a zvýšené reabsorpce (retence) kalia. Efekt je zprostředkován jak přímo, tak nepřímo působením aldosteronu na mineralokortikoidní receptory. Na výsledném poklesu retence tekutinse jistě spolupodílí i inhibice antidiuretického hormonu a zmírnění pocitu žízně. Zvýšení citlivosti k inzulinuje důsledkem poklesu inhibiční aktivity receptoru AT1na inzulin-senzitivní glukózový transportér 4 (GLUT-4) a zvýšení utilizace glukózy ve svalstvu. Pokles sympatikotonie je pravděpodobně výsledkem snížené stimulace na úrovni kůry mozkové. Nejméně objasněna je antiproliferační aktivitana úrovni cév, myokardu a ledvin. Jistě se podílí snížení aktivity mineralokortikoidních receptorů v cévní stěně, v srdci a v ledvinách.
Hydrochlorothiazid
Thiazidová diuretika, a tedy i hydrochlorothiazid, blokují elektroneutrální reabsorpci NaCl v distálním tubulu ledvin. Mechanismus účinku spočívá v blokádě NaCl ko-transportéru (přímou vazbou na protein kanálu) v distálním renálním tubulu se zvýšením vylučování NaCl. Zvýšená nálož sodíku ve sběrném tubulu vede k jeho zvýšené reabsorpci směnou za draslík a následně k vyšší exkreci iontů kalia. Výsledkem může být deplece kalia. Obdobně může dojít ke zvýšenému vylučování hořčíku. Na rozdíl od kličkových diuretik thiazidová diuretika snižují exkreci kalcia, mechanismus spočívá zřejmě v pasivním transportu Ca2+ v proximálním tubulu. Zvýšení kalcemie je však dáno nejen sníženou exkrecí, ale též zvýšenou resorpcí kalcia ve střevě při blokádě NaCl ko-transportéru ve střevním epitelu. Tento mechanismus účinku může být výhodný u hyperkalciurie, zejména při urolitiáze a u nemocných s osteoporózou, kdy je popsána zvýšená demineralizace kosti.
Ne zcela objasněným mechanismem snižuje hydrochlorothiazid citlivost k inzulinu a zvyšuje tak glykemii. Jednou z možností je hyperaktivace osy RAA, kdy stimulace receptoru AT
1 tlumí syntézu glukózového transportéru GLUT-4 a snížení utilizace glukózy ve svalstvu. Druhým mechanismem by mohlo být přímé působení na K ATP kanál, který kontroluje membránový potenciál a sekreci inzulinu.
Výsledným farmakodynamickým účinkem hydrochlorothiazidu je natriuréza, kaliuréza a diuréza, snížení kalciurie a zvýšení glykemiespolu s poklesem odpovědi na inzulin . Hlavním terapeutickým dopadem je snížení krevního tlaku, snížení retence natria a vody, deplece kalia, pokles kalciurie a určitá inzulinorezistence. Antihypertenzní účinek je výrazně vyšší při vysokém výchozím tlaku, u normotonika je vliv na pokles tlaku malý. Při snížení renálních funkcí diuretický a antihypertenzní účinek hydrochlorothiazidu selhává. Při kombinaci s kličkovým diuretikem je diuretický účinek výrazně potencován (supraaditivní efekt).
Farmakokinetické vlastnosti
Aliskiren
 Po perorálním podání se aliskiren velmi rychle vstřebává, nástup účinku je možno pozorovat do hodiny, maximální koncentrace v plazmě je dosaženo za 1–3 hodiny. Biologická dostupnost aliskirenu je nízká, pohybuje se mezi 2–3 %, většina léčiva je eliminována zpět do lumina střeva transportním systémem glykoproteinu P (P-gp). Potrava s vysokým obsahem tuku snižuje nevýznamně jak maximální koncentraci (na 80–85 %), tak expozici (na 60–70 %) proti stavu užití nalačno. V plazmě je aliskiren jen z malé části vázán na bílkoviny. Aliskiren má dlouhou dobu působení, eliminační poločas se pohybuje mezi 34 až 41 hodinami, rovnovážného stavu je docíleno za 6–7 dnů. Vylučován je zejména v nezměněné formě (> 90 %) játry do stolice, na bioeliminaci se opět podílí P-gp. Pouze nepatrná část je metabolizována CYP3A4. Zdá se, že eliminační systémy v játrech a ve střevě, konkrétně transportní systém P-gp, mohou být při užití vyšších dávek aliskirenu saturovány, expozice (AUC) aliskirenu se totiž zvyšuje více, než odpovídá zvýšení dávky. Vedle zvýšení dostupnosti léčiva při lepší resorpci ve střevě by se na zvýšení expozice mohla podílet i zpomalená eliminace hepatocyty do kanalikulárního systému žlučových cest. Není pravděpodobné, že by tento nelineární vztah mezi dávkou a účinkem byl klinicky významný, při zvýšení dávky o 100 % se expozice zvýší o 130–160 %. U nemocných od sedmé věkové dekády se mírně snižuje bioeliminace aliskirenu, expozice se zvyšuje asi o polovinu. Renální či hepatální insuficience neovlivňuje expozici aliskirenu a není nutno upravovat dávkování [4].
Po perorálním podání se aliskiren velmi rychle vstřebává, nástup účinku je možno pozorovat do hodiny, maximální koncentrace v plazmě je dosaženo za 1–3 hodiny. Biologická dostupnost aliskirenu je nízká, pohybuje se mezi 2–3 %, většina léčiva je eliminována zpět do lumina střeva transportním systémem glykoproteinu P (P-gp). Potrava s vysokým obsahem tuku snižuje nevýznamně jak maximální koncentraci (na 80–85 %), tak expozici (na 60–70 %) proti stavu užití nalačno. V plazmě je aliskiren jen z malé části vázán na bílkoviny. Aliskiren má dlouhou dobu působení, eliminační poločas se pohybuje mezi 34 až 41 hodinami, rovnovážného stavu je docíleno za 6–7 dnů. Vylučován je zejména v nezměněné formě (> 90 %) játry do stolice, na bioeliminaci se opět podílí P-gp. Pouze nepatrná část je metabolizována CYP3A4. Zdá se, že eliminační systémy v játrech a ve střevě, konkrétně transportní systém P-gp, mohou být při užití vyšších dávek aliskirenu saturovány, expozice (AUC) aliskirenu se totiž zvyšuje více, než odpovídá zvýšení dávky. Vedle zvýšení dostupnosti léčiva při lepší resorpci ve střevě by se na zvýšení expozice mohla podílet i zpomalená eliminace hepatocyty do kanalikulárního systému žlučových cest. Není pravděpodobné, že by tento nelineární vztah mezi dávkou a účinkem byl klinicky významný, při zvýšení dávky o 100 % se expozice zvýší o 130–160 %. U nemocných od sedmé věkové dekády se mírně snižuje bioeliminace aliskirenu, expozice se zvyšuje asi o polovinu. Renální či hepatální insuficience neovlivňuje expozici aliskirenu a není nutno upravovat dávkování [4].
Hydrochlorothiazid
Po perorálním podání se hydrochloro-thiazid středně rychle vstřebává, nástup účinku je možno očekávat za 2 hodiny, maximální efekt se objevuje zpravidla za 4–6 hodin, trvá asi 6–12 hodin, resp. při chronické léčbě až 24 hodin. Plazmatický poločas se po užití jedné dávky zpravidla pohybuje mezi 6–9 hodinami, po opakovaném podání se prodlužuje na 8–15 hodin, některé studie však prokazují i poločas výrazně kratší – jen 2–3 hodiny. Biologická dostupnost se pohybuje mezi 60–80 %. Resorpce není významně ovlivněna současným podáním potravy. Hydrochlorothiazid se vylučuje v 95 % nezměněn do moči, prochází placentární bariérou a vylučuje se v malém procentu do mateřského mléka. V účinku hydrochorothiazidu existují významné interindividuální rozdíly, někdo odpovídá výborně na dávku 12,5 mg, jiný vyžaduje léčbu dávkou vyšší než 25 mg denně. Podobné rozdíly, jako jsou v intenzitě, jsou popsány i v délce působení [4].
Klinické zkušenosti
Problematice zkušeností s monoterapií aliskirenem byl věnován lékový profil prof. Miroslava Součka a kol. Aliskiren [5]. Shrneme-li, pak řadou klinických studií bylo doloženo, že při podávání aliskirenu v rozmezí dávek 75–600 mg denně je při monoterapii přítomen významný antihypertenzní účinek oproti placebu, srovnatelný či mírně vyšší účinek v porovnání s blokátory receptorů AT 1 losartanem, valsartanem či irbesartanem, vyšší či srovnatelný antihypertenzní účinek ve srovnání s inhibitory ACE lisinoprilem či ramiprilem, srovnatelný antihypertenzní účinek v porovnání s amlodipinem či s hydrochlorothiazidem [6–15]. Nejvýznamnějším přínosem aliskirenu byla optimální kontrola hypertenze v posledním období před podáním další, zpravidla ranní dávky. Pokrytí ranního vzestupu tlaku bylo aliskirenem kontrolováno – oproti testovaným sartanům i inhibitorům ACE – spolehlivěji.
V kombinaci s amlodipinem byl doložen aditivní účinek, v kombinaci s inhibitory osy RAA, tj. s inhibitiory ACE (ramipril) či se sartany (valsartan a irbesartan), byl doložen menší než aditivní účinek, nicméně antihypertenzní efekt byl větší než při podávání kombinace inhibitoru ACE se sartanem [9, 10, 12, 14]. Výskyt nežádoucích účinků při podávání aliskirenu je velmi nízký, s výjimkou dyspeptických potíží a průjmu, eventuálně závratí či slabosti při poklesu tlaku byly nežádoucí účinky méně časté ve srovnání s placebem.
Řada klinických studií dokumentovala též organoprotektivní účinek – jak nefroprotektivní, tak kardioprotektivní [16–20]. Nicméně indikaci nefroprotekce, kardioprotekce či léčbu srdečního selhání kombinační přípravek aliskiren/hydrochlorothiazid nemá, proto ani není potřebné tuto otázku rozebírat, opět je možno odkázat na lékový profil prof. Součka [5].
Fixní kombinace by optimálně měla mít řadu vlastností: měla by potencovat léčebný účinek obou složek, tedy aditivní či supraaditivní efekt, a měla by snižovat výskyt nežádoucích účinků obou složek. Dále by obě účinné látky měly mít srovnatelnou dobu účinku, zejména dávkování. Pro fixní kombinaci aliskiren/hydrochlorothiazid toto pravidlo platí beze zbytku.
V předregistrační studii srovnávající u téměř tří tisíc hypertoniků účinek a toleranci různých dávek aliskirenu (75 mg, 150 mg či 300 mg) a hydrochlorothiazidu (6,25 mg, 12,5 mg či 25 mg) v 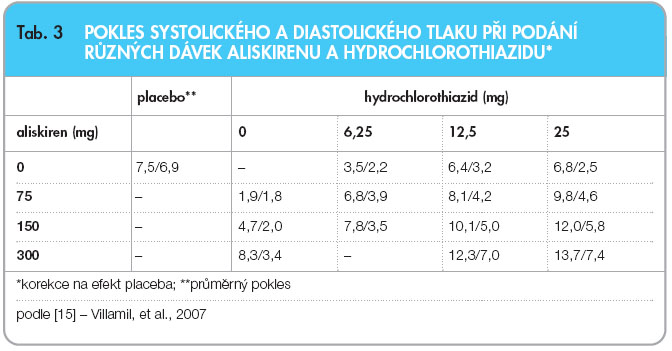 monoterapii a v kombinaci byl doložen výborný aditivní antihypertenzní efekt (pokles krevního tlaku při podávání kombinace vyšších dávek činil 21,2/14,3 mm Hg) [15]. Výsledky poklesu TK při kombinaci jednotlivých dávek (po korekci na účinek placeba) viz tab. 3
.
Kombinační léčba vedla k výrazně lepší kontrole hypertenze u léčených než monoterapie ( graf 1 ) [25]. Účinek byl dokumentován po dobu celého dávkovacího intervalu, tedy po 24 hodin.
monoterapii a v kombinaci byl doložen výborný aditivní antihypertenzní efekt (pokles krevního tlaku při podávání kombinace vyšších dávek činil 21,2/14,3 mm Hg) [15]. Výsledky poklesu TK při kombinaci jednotlivých dávek (po korekci na účinek placeba) viz tab. 3
.
Kombinační léčba vedla k výrazně lepší kontrole hypertenze u léčených než monoterapie ( graf 1 ) [25]. Účinek byl dokumentován po dobu celého dávkovacího intervalu, tedy po 24 hodin.
![Graf 1 Pravděpodobnost poklesu systolického tlaku krve (sTK) pod hranici 140 mm Hg při podávání placeba, při monoterapii aliskirenem, monoterapii hydrochlorothiazidem či při kombinované léčbě v závislosti na vstupním systolickém TK. Např. při vstupní hodnotě sTK 160 mm Hg dosáhneme kombinační léčbou jeho poklesu na méně než 140 mm Hg u 80 % nemocných, při monoterapii je tento pokles systolického TK zaznamenán u 40–50 % nemocných a při podávání placeba u 20 % nemocných; podle [25] – RxList, 2010.](https://www.remedia.cz/photo-a-28111---.jpg) Klinicky významný je vzájemně se doplňující vliv na hospodaření draslíkem: aliskiren zvyšuje pozitivní bilanci kalia, naopak hydrochlorothiazid ji snižuje, výsledným účinkem bývá vyrovnaná bilance. Podobný efekt pozorujeme u citlivosti k inzulinu – aliskiren zlepšuje senzitivitu a eliminuje tak inzulinorezistenci navozenou hydrochloro-thiazidem. Negativní efekt hydrochlorothiazidu na kaliovou depleci a poruchu glukózové tolerance je tak aliskirenem eliminován či alespoň výrazně omezen. Současné podávání aliskirenu s hydrochlorothiazidem vede k poklesu nežádoucích účinků spojených s podáváním thiazidových diuretik, tedy k
Klinicky významný je vzájemně se doplňující vliv na hospodaření draslíkem: aliskiren zvyšuje pozitivní bilanci kalia, naopak hydrochlorothiazid ji snižuje, výsledným účinkem bývá vyrovnaná bilance. Podobný efekt pozorujeme u citlivosti k inzulinu – aliskiren zlepšuje senzitivitu a eliminuje tak inzulinorezistenci navozenou hydrochloro-thiazidem. Negativní efekt hydrochlorothiazidu na kaliovou depleci a poruchu glukózové tolerance je tak aliskirenem eliminován či alespoň výrazně omezen. Současné podávání aliskirenu s hydrochlorothiazidem vede k poklesu nežádoucích účinků spojených s podáváním thiazidových diuretik, tedy k
poklesu výskytu hypokalemie či deplece kalia i ke snížení výskytu negativních metabolických změn (zejména snížené odpovědi na inzulin).
Při sledování plazmatické reninové aktivity (PRA) byl doložen výrazný vzestup PRA při monoterapii hydrochlorothiazidem (o 72 %) a naopak pokles při léčbě aliskirenem (o 65 %), při léčbě kombinací byl pozorován výsledný významný pokles aktivity. Na základě dat bylo možno konstatovat velmi dobrý klinický účinek kombinace na pokles krevního tlaku, výrazný nárůst počtu hypertoniků s dobře kontrolovanou hypertenzí a pokles výskytu nežádoucích účinků běžně pozorovaných při léčbě hydrochlorothiazidem, zejména hypokalemie. Inhibice reninu navíc eliminovala negativní aktivaci osy RAA navozenou diuretikem.
Zařazení do současné palety léčiv
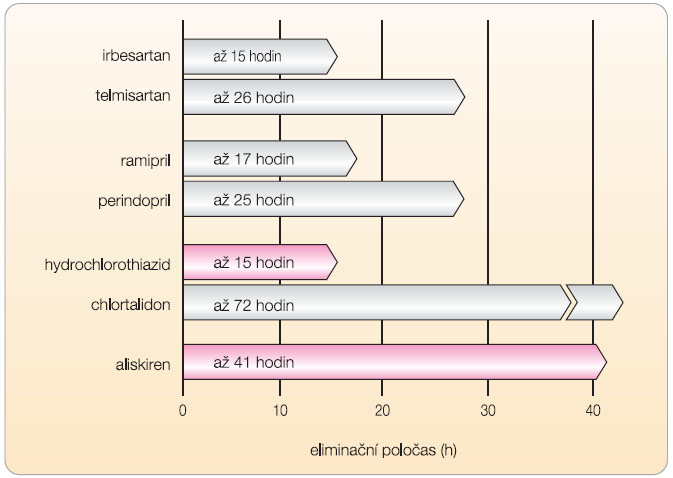 Fixní kombinace aliskirenu s hydrochlorothiazidem představuje účinné a dobře tolerované
antihypertenzivum . Jeho předností je vedle silného antihypertenzního účinku zejména dobrá snášenlivost a příznivý metabolický efekt. Aliskiren je v léčbě hypertenze výhodný zejména pro stabilní účinek daný dlouhým eliminačním poločasem, který je ve skupině antihypertenziv inhibujících osu RAA nejdelší ( obr. 5 ). Ve srovnání s inhibitory ACE není inhibice reninových receptorů zatížena kašlem a též riziko angioedému je prakticky eliminováno. V porovnání s antagonisty receptorů AT 1 , sartany, je tolerance srovnatelná a též antihypertenzní efekt je obdobný. Jediný rozdíl je možné spatřovat v kratší době účinku většiny sartanů (s výjimkou telmisartanu). Také srovnání fixních kombinací inhibitorů ACE a thiazidových diuretik vyznívá ve prospěch kombinace thiazidu s aliskirenem – je zřejmá lepší snášenlivost; v porovnání s obdobnou kombinací u sartanů lze konstatovat srovnatelný efekt.
Fixní kombinace aliskirenu s hydrochlorothiazidem představuje účinné a dobře tolerované
antihypertenzivum . Jeho předností je vedle silného antihypertenzního účinku zejména dobrá snášenlivost a příznivý metabolický efekt. Aliskiren je v léčbě hypertenze výhodný zejména pro stabilní účinek daný dlouhým eliminačním poločasem, který je ve skupině antihypertenziv inhibujících osu RAA nejdelší ( obr. 5 ). Ve srovnání s inhibitory ACE není inhibice reninových receptorů zatížena kašlem a též riziko angioedému je prakticky eliminováno. V porovnání s antagonisty receptorů AT 1 , sartany, je tolerance srovnatelná a též antihypertenzní efekt je obdobný. Jediný rozdíl je možné spatřovat v kratší době účinku většiny sartanů (s výjimkou telmisartanu). Také srovnání fixních kombinací inhibitorů ACE a thiazidových diuretik vyznívá ve prospěch kombinace thiazidu s aliskirenem – je zřejmá lepší snášenlivost; v porovnání s obdobnou kombinací u sartanů lze konstatovat srovnatelný efekt.
Hydrochlorothiazid je ve srovnání s ostatními antihypertenzivy jistě velmi účinný v poklesu krevního tlaku, určitou nevýhodou je negativní metabolický účinek. Ten však je současným podáváním inhibitorů systému RAA prakticky eliminován. Ve fixní kombinaci s aliskirenem tak není nutno obávat se negativního dopadu na metabolismus glycidů. Srovnáme-li hydrochlorothiazid s jinými diuretiky určenými k léčbě hypertenze, pak v našich podmínkách připadá v úvahu pouze chlortalidon. Obě diuretika mají srovnatelný antihypertenzní efekt, chlortalidon se liší jen lepší kontrolou hypertenze na konci dávkovacího intervalu [21]. U fixní kombinace, kde aliskiren má velmi dlouhou dobu účinku, se však tato skutečnost neuplatní.
Indikace
Kontraindikace
U pacientů s renálním selháním (s glomerulární filtrací < 0,5 ml/s/1,73 m2) je užívání hydrochlorothiazidu kontraindikováno, a proto nepodáváme ani fixní kombinaci. Hypokalemie a hyperkalemie, je-li refrakterní, rovněž patří mezi kontraindikace. Samozřejmou kontraindikací je významná hypotenze a volumová deplece. Obdobně nepodáváme kombinaci aliskiren/hydrochlorothiazid nemocným s těžkým jaterním selháním s poruchou eliminační funkce.
Léčba je kontraindikována též při hypersenzitivitě na základní substance či aditiva nebo při anamnéze angioedému při léčbě aliskirenem. Opatrně podáváme při anamnéze angioedému při léčbě inhibitory ACE či sartany nebo u osob s esenciálním angioedémem. Vzhledem k tomu, že struktura hydrochlorothiazidu vychází ze sulfonamidů, hrozí vysoké riziko alergie u osob s alergickou reakcí na sulfonamidy.
Specifickou skupinou s kontraindikací kombinace jsou gravidní a kojící. Inhibice osy RAA je kontraindikována zejména během 2. a 3. trimestru pro teratogenní vliv na vývoj ledvin a vývodných cest močových. Nicméně riziko poruchy plodu je též v prvém trimestru gravidity. Proto je léčba aliskirenem/hydrochlorothiazidem kontraindikována po celou dobu gravidity i u žen usilujících o těhotenství. Během laktace přechází malá část aliskirenu i hydrochlorothiazidu do mateřského mléka, proto v období kojení není léčba aliskirenem/hydrochlorothiazidem vhodná.
Vzhledem k tomu, že aliskiren je eliminován transportním systémem P-gp, je komedikace se silnými inhibitory P-gp , konkrétně s ciklosporinem, podle výrobce kontraindikována. Při léčbě touto kombinací byl popsán vzestup maximální koncentrace aliskirenu na dvoj- až trojnásobek a expozice stoupla pětinásobně. Při současném podávání středně silných inhibitorů, jako jsou antiarytmika amiodaron a chinidin, azolová antimykotika itrakonazol a ketokonazol, virostatika nelfinavir, ritonavir a saquinavir, statiny atorvastatin a simvastatin, sartany telmisartan a kandesartan, non-thienopyridinové blokátory kalciového kanálu verapamil a diltiazem, či inhibitorů z jiných skupin léčiv, např. dipyridamol, erythromycin, karvedilol, metadon, pethidin, progesteron, spironolakton, tamoxifen, z potravin pak grapefruitová či obecně citrusová šťáva, je nutná určitá opatrnost pro riziko zvýšení účinku, lze očekávat vzestup expozice o 50–100 %. Riziko však není vysoké, i při užití vyšších dávek aliskirenu se pohybujeme na horní hranici účinku a ani při výrazném zvýšení expozice se již antihypertenzní efekt zásadně nezvyšuje. S klinicky významnějším rizikem se setkáváme naopak při podávání induktorů P-gp (dexamethason, fenobarbital, klotrimazol, morfin, rifampicin či třezalka), zde hrozí riziko selhání účinku při poklesu expozice léčivu při snížení jeho dostupnosti a urychlení jeho eliminace.
Nežádoucí účinky
Bezpečnost kombinace aliskiren/hydrochlorothiazid byla sledována v 9 studiích u téměř 4 tisíc nemocných, řada studií byla dlouhodobých. Bylo možno konstatovat velmi dobrou snášenlivost léčby a pouze průjmy se objevily častěji než při podávání placeba, tj. u 1,3 % nemocných. Nicméně průjmy měly velmi benigní charakter a nevedly zpravidla k přerušení léčby.
Poruchy hospodaření draslíkem byly rovněž vzácné, hyperkalemie se objevila stejně často jako při podávání placeba, výskyt hypokalemie byl rovněž vzácný, referován je s frekvencí nižší než 1 % nemocných.
Lékové interakce
Interakce na úrovni ovlivnění farmakokinetických vlastností
Aliskiren není substrátem, induktorem, ani inhibitorem izoenzymů systému CYP, proto na této úrovni není riziko lékových interakcí. Bioeliminace aliskirenu je zajištěna ve střevě a v játrech transportním systémem P-gp. Ve střevě eliminace snižuje dostupnost aliskirenu na několik málo procent, při inhibici systému proto hrozí riziko významného zvýšení expozice léku při zásadním zvýšení dostupnosti. Z těchto důvodů při komedikaci s inhibitory P-gp (antiarytmika amiodaron a chinidin, antimykotika itrakonazol a ketokonazol, virostatika nelfinavir, ritonavir a saquinavir či z jiných skupin léčiv, např. ciklosporin, atorvastatin, simvastatin, dipyridamol, erythromycin, karvedilol, metadon, progesteron, pethidin, spironolakton, tamoxifen, verapamil či grapefruit) hrozí riziko předávkování. Naopak inhibice P-gp (např. dexamethasonem, fenobarbitalem, klotrimazolem, morfinem, rifampicinem či třezalkou) vede ke snížení expozice [22]. Testováno bylo i ovlivnění expozice tradičních substrátů P-gp (digoxin aj.) aliskirenem, nebyla prokázána žádná významná interakce [23].
Rovněž hydrochlorothiazid není metabolizován oxidázami CYP a na rozdíl od aliskirenu se v jeho eliminaci nezapojuje žádný ze základních transportních systémů s výjimkou tubulárního transportního proteinu – rOAT
1 (renal organic anion transporter). Nicméně ani na této úrovni nejsou popsány lékové interakce. Opakované testování interakcí hydrochlorothiazidu s různými antihypertenzivy na úrovni farmakokinetických vlastností vždy uzavírá, že nebyla nalezena významná léková interakce, hydrochlorothiazid lze tak bez obav kombinovat s nejrůznějšími antihypertenzivy. Při vzájemné kombinaci aliskirenu a hydrochlorothiazidu není ovlivněna kinetika žádné z obou složek [24]. Ani hydrochlorothiazid nemění kinetiku aliskirenu, ani aliskiren kinetiku hydrochlorothiazidu.
Interakce na úrovni ovlivnění farmakodynamických vlastností
Při podávání léčiv stejných skupin – antihypertenziv, vazodilatancií či diuretik – lze očekávat potenciaci antihypertenzního, vazodilatačního či diuretického účinku. Významná potenciace diuretického efektu je běžná při současném podávání thiazidových a kličkových diuretik, v praxi je možno počítat s velmi výrazným posílením účinku hydrochlorothiazidu a furosemidu. V praxi je důležité riziko vzniku hypokalemie a deplece kalia navozené diuretiky. Riziko je sice aliskirenem sníženo, nicméně monitorování kalemie je v úvodu léčby nutné. Hypokalemie může zvýšit toxicitu digoxinu a řady antiarytmik.
Dávkování
Úvodní doporučená dávka je 150 mg aliskirenu a 12,5 mg hydrochlorothiazidu. Při nedostatečném efektu můžeme jednu či obě složky zdvojnásobit. Další zvyšování dávky aliskirenu nad 300 mg denně není vhodné, není již přítomen aditivní antihypertenzní efekt. Stejně tak není vhodné zvyšovat dávku hydrochlorothiazidu nad 25 mg denně, podávání vyšších dávek je spojeno s neúměrným vzestupem rizika nežádoucích účinků, zejména deplece kalia a metabolických změn (inzulinorezistence a dyslipidemie). U seniorů lze užít kombinaci aliskiren/hydrochlorothiazid bez nutnosti redukce dávky. U dětí není léčba indikována pro nedostatek zkušeností.
Fixní kombinaci aliskiren/hydrochlorothiazid je možno podávat u nemocných s mírnou či středně závažnou renální nedostatečností bez nutnosti úpravy dávky. U renálního selhání (s glomerulární filtrací < 0,5 ml/s/1,73 m2) je užívání hydrochlorothiazidu kontraindikováno, a proto ani fixní kombinaci nepodáváme. Významná hypokalemie či hyperkalemie by měla být před započetím léčby upravena, objeví-li se v průběhu léčby, pak je možno léčbu přerušit či dávku upravit. Mírná hepatopatie není kontraindikací léčby, dávku nemusíme snižovat. Naopak při těžké hepatopatii se známkami hrubě postižené eliminační funkce preparát s fixní kombinací aliskiren/hydrochlorothiazid nepodáváme.
Předávkování
Nejčastějším projevem předávkování byla hypotenze, často symptomatická. K úpravě stačilo snížit dávku či léčbu přerušit, vzácně bylo nutno doplnit objem tekutin. Výskyt hypokalemie a hyponatremie řešíme saturací iontů, eventuálně můžeme zvýšit bilanci kalia inhibitory aldosteronových receptorů.
Balení
Seznam použité literatury
- [1] Chrysant SG. Current Status of Dual Renin Angiotensin Aldosterone System Blockade for the Treatment of Cardiovascular Diseases. Am J Cardiol 2010; 105: 849–852.
- [2] Cousin C, Bracquart D, Contrepas A, Nguyen G. Potential role of the (pro)renin receptor in cardiovascular and kidney diseases. J Nephrol 2010; 23: 508–513.
- [3] Danser AH. The increase in renin during renin inhibition: does it result in harmful effects by the (pro)renin receptor? Hypertens Res 2010; 33: 4–10.
- [4] EMA: Summary of product characteristics Rasilez HCT, revize 21. 6. 2010. http://www.ema.europa. eu/ Accessed 15. 8. 2010.
- [5] Souček M, Fráňa P, Plachý M, Řiháček I. Aliskiren. Remedia 2008; 18: 266–272.
- [6] Oh BH, Mitchell J, Herron JR, et al. Aliskiren, an oral renin inhibitor, provides dose-dependent efficacy and sustained 24-hour blood pressure control in patients with hypertension. J Am Coll Cardiol 2007; 49: 1157–1163.
- [7] Stanton A, Jensen C, Nussberger J, O'Brien E. Blood pressure lowering in essential hypertension with an oral renin inhibitor, aliskiren. Hypertension 2003; 42: 1137–1143.
- [8] Gradman AH, Schmieder RE, Lins RL, et al. Aliskiren, a novel orally effective renin inhibitor, provides dose-dependent antihypertensive efficacy and placebo-like tolerability in hypertensive patients. Circulation 2005; 111: 1012–1018.
- [9] Pool JL, Schmieder RE, Azizi M, et al. Aliskiren, an orally effective renin inhibitor, provides antihypertensive efficacy alone and in combination with valsartan. Am J Hypertens 2007; 20: 11–20.
- [10] Oparil S, Yarows SA, Patel S, et al. Efficacy and safety of combined use of aliskiren and valsartan in patients with hypertension: a randomised, double-blind trial. Lancet 2007; 370: 221–229.
- [11] Strasser RH, Puig JG, Farsang C, et al. A comparison of the tolerability of the direct renin inhibitor aliskiren and lisinopril in patients with severe hypertension. J Hum Hypertens 2007; 21: 780–787.
- [12] Uresin Y, Taylor A, Kilo C, et al. Aliskiren, a novel renin inhibitor, has greater BP lowering than ramipril and additional BP lowering when combined with ramipril in patients with diabetes and hypertension. J Hypertens 2006; 24(Suppl 4): S82. Abstract P4.269.
- [13] Jordan J, Engeli S, Boye SW, et al. Direct renin inhibition with aliskiren in obese patients with arterial hypertension. Hypertension 2007; 49: 1047–1055.
- [14] Drummond W, Munger MA, Rafique Essop M, et al. Antihypertensive efficacy of the oral direct renin inhibitor aliskiren as add-on therapy in patients not responding to amlodipine monotherapy. J Clin Hypertens 2007; 9: 742–750.
- [15] Villamil A, Chrysant SG, Calhoun D, et al. Renin inhibition with aliskiren provides additive anti-hypertensive efficacy when used in combination with hydrochlorothiazide. J Hypertens 2007; 25: 217–226.
- [16] Freel EM, Tsorlalis IK, Lewsey JD, et al. Aldosterone status associated with inzulin resistance in patients with heart failure–data from the ALOFT study. Heart 2009; 95: 1920–1924.
- [17] Solomon SD, Appelbaum E, Manning WJ, et al. Aliskiren in Left Ventricular Hypertrophy (ALLAY) Trial Investigators. Effect of the direct Renin inhibitor aliskiren, the Angiotensin receptor blocker losartan, or both on left ventricular mass in patients with hypertension and left ventricular hypertrophy. Circulation 2009; 119: 530–537.
- [18] Parving HH, Brenner BM, McMurray JJ, et al. Aliskiren Trial in Type 2 Diabetes Using Cardio-Renal Endpoints (ALTITUDE): rationale and study design. Nephrol Dial Transplant 2009; 24: 1663–1671.
- [19] Parving HH, Persson F, Lewis JB, et al. AVOID Study Investigators. Aliskiren combined with losartan in type 2 diabetes and nephropathy. N Engl J Med 2008; 358: 2433–2446.
- [20] McMurray JJ, Pitt B, Latini R, et al. Aliskiren Observation of Heart Failure Treatment (ALOFT) Investigators. Effects of the oral direct renin inhibitor aliskiren in patients with symptomatic heart failure. Circ Heart Fail 2008; 1: 17–24.
- [21] Ernst ME, Carter BL, Goerdt CJ, et al. Comparative antihypertensive effects of hydrochlorothiazide and chlorthalidone on ambulatory and office blood pressure. Hypertension 2006; 47: 352–358.
- [22] Flockhart DA. Drug Interactions: Cytochrome P450 Drug Interaction Table. Indiana University School of Medicine (2007). http: //medicine.iupui. edu/clinpharm/ddis/table.asp. Accessed 15. 8. 2010.
- [23] Vaidyanathan S, Camenisch G, Schuetz H, et al. Pharmacokinetics of the oral direct renin inhibitor aliskiren in combination with digoxin, atorvastatin, and ketoconazole in healthy subjects: the role of P-glycoprotein in the disposition of aliskiren. J Clin Pharmacol 2008; 48: 1323–1338.
- [24] Vaidyanathan S, Valencia J, Kemp C, et al. Lack of pharmacokinetic interactions of aliskiren, a novel direct renin inhibitor for the treatment of hypertension, with the antihypertensives amlodipine, valsartan, hydrochlorothiazide (HCTZ) and ramipril in healthy volunteers. Int J Clin Pract 2006; 60: 1343–1356.
- [25] RxList The Internet Drug Index. Tekturna HCT Drug Description. http://www.rxlist.com/tekturna-hct-drug.htm# Accessed 15. 8. 2010.