Aprepitant
Aprepitant, inhibitor působení substance P na NK1-receptory (neurokininové receptory 1), má silný antiemetický účinek u pacientů léčených emetogenní chemoterapií. Významným přínosem je především jeho vliv na zvracení v oddálené fázi po cytostatické léčbě, který je signifikantně vyšší oproti všem dosud používaným antiemetikům. Vzhledem k odlišnému mechanismu účinku s výhodou doplňuje antiemetickou kombinaci blokátorů 5HT3-receptorů s kortikosteroidy. Trojkombinace těchto léčiv je dnes doporučeným způsobem profylaxe u každého pacienta s vysoce emetogenní chemoterapií. Navíc přibývá dokladů o účinnosti aprepitantu i u středně emetogenní chemoterapie, zejména při mnohočetných cyklech této léčby, a u nemocných se selháním standardní profylaxe v předchozích cyklech.
Při hodnocení vlivu aprepitantu na celkový výsledek onkologické léčby včetně kvality života nemocného je jeho zařazení do antiemetické profylaxe u středně a vysoce emetogenní chemoterapie považováno za nákladově efektivní postup.
Farmakologická skupina
Aprepitant je vysoce selektivní nepeptidový antagonista neurokininových receptorů 1 (NK1-receptorů); ATC kód je A04AD12. Je prvním komerčně dostupným léčivem této nové třídy antiemetik.
Chemické a fyzikální vlastnosti
 Aprepitant je chemicky 5-[[(2R,3S)-2-[(1R)-1-[3,5-bis(trifluoromethyl)fenyl]ethoxy]-3-(4-fluorofenyl)-4-morfolinyl]
Aprepitant je chemicky 5-[[(2R,3S)-2-[(1R)-1-[3,5-bis(trifluoromethyl)fenyl]ethoxy]-3-(4-fluorofenyl)-4-morfolinyl]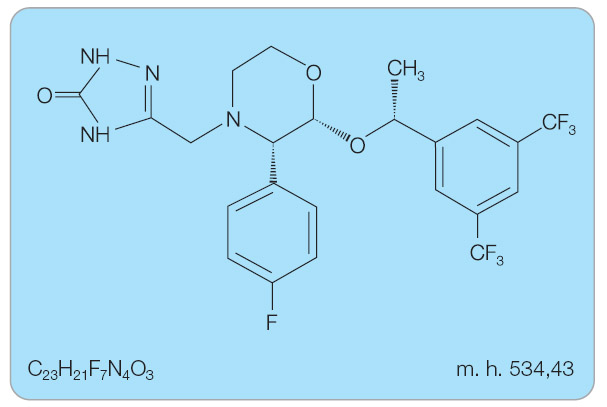 methyl]-1,2-dihydro-3H-1,2,4-triazol-3-on (obr. 1).
methyl]-1,2-dihydro-3H-1,2,4-triazol-3-on (obr. 1).
Sumární vzorec: C23H21F7N4O3
Molekulová hmotnost: 534,43
Aprepitant je bílá až šedobílá krystalická látka téměř nerozpustná ve vodě, těžce rozpustná v ethanolu a izopropylacetátu a mírně rozpustná v acetonitrilu [1].
Mechanismus účinku a farmakodynamika
Aprepitant má schopnost pronikat do mozku, kde antagonizuje první ze tří podtypů NK-receptorů, NK1-receptory. Tyto receptory jsou hojně exprimovány v mozkovém kmeni v oblastech, které regulují reflex pro zvracení, zejména v area postrema na spodině IV. komory mozkové a v nucleus tractus solitarii v prodloužené míše. Area postrema postrádá specifickou hematoencefalickou bariéru, a proto detekuje emetogenní humorální podněty nejen z mozkomíšního moku, ale i z krve (chemorecepční spouštěcí zóna). NK1-receptory jsou přítomny také periferně na vagových zakončeních v oblasti dolního jícnového svěrače.
Přednostním agonistou NK1-receptorů je substance P, mediátor ze skupiny tachykininů. Experimentální práce na zvířatech ukázaly, že blokáda NK1-receptorů selektivními nepeptidovými antagonisty má antiemetický účinek proti různým periferním i centrálním emetogenním podnětům, včetně podávání cytostatik. Zdá se, že podmínkou účinku je průnik blokátoru do centrálního nervového systému.
Ve srovnání s antagonisty 5HT3-receptorů (setrony) pokrývá blokáda NK1-receptorů širší spektrum podnětů pro zvracení, včetně zvracení po radioterapii, morfinu nebo při kinetóze [2]. Zatímco serotoninový mechanismus se uplatňuje především prvních 8–12 hodin po podání cisplatiny (časné akutní zvracení), je zvracení za touto časovou hranicí zprostředkováno již především substancí P, která může být konečným neurotransmiterem emetogenní cesty. Substance P má pravděpodobně větší vliv při vzniku zvracení než při vzniku nevolnosti, která je zprostředkována především centrálně a zahrnuje mozkovou kůru [3].
Substance P má však v organismu vedle zprostředkování emeze četné další funkce, takže její blokáda může mít také účinky anxiolytické nebo antidepresivní a v experimentu in vitro může dokonce tlumit nádorový růst [4].
Farmakokinetické vlastnosti
Aprepitant je u nás dnes dostupný pouze v perorální formě. Průměrná absolutní biologická dostupnost z dávky 125 mg podané nalačno činila u skupiny 25 zdravých dobrovolníků 59 %, zatímco při podání nižší dávky – 80 mg – byla vyšší a činila 67 % [5]. Biologická dostupnost byla o něco vyšší u mužů (při dávce 125 mg byl rozdíl signifikantní), podle autorů však tato skutečnost nemá klinický význam.
Vliv stravy byl testován po standardní snídani (vejce, toust, máslo, šunka), kterou pacienti snědli přibližně 15 minut před přijetím léku. Průměrný poměr plochy pod křivkou (AUC0-∞) po jídle/nalačno byl 1,2 (90% interval spolehlivosti 1,10–1,30) při dávce 125 mg a 1,09 (1,0–1,18) při dávce 80 mg, což znamená statisticky významně vyšší hodnoty po jídle. Podobné rozdíly byly zjištěny pro maximální plazmatické koncentrace, a to poměr cmax po jídle/ nalačno 1,25 (1,11–1,41) u dávky 125 mg a 1,14 (1,01–1,28) u dávky 80 mg. Protože tyto rozdíly jsou menší než dvojnásobné, které by vyžadovaly specifické instrukce pro příjem léku ve vztahu k příjmu stravy, není vliv současně přijaté stravy na vstřebávání aprepitantu klinicky důležitý [5]. Více než 95 % léčiva je po resorpci vázáno na bílkoviny plazmy.
Farmakokinetika aprepitantu je nelineární, což znamená, že s narůstající dávkou klesá plazmatická clearance, nejspíše v důsledku nasycení metabolismu cestou cytochromu P-450 izoenzymu 3A4 (CYP3A4). Větší plocha pod křivkou tedy odráží nejen biologickou dostupnost, ale také pokles hodnoty plazmatické clearance po podání vyšší dávky.
Průměrné hodnoty maximální plazmatické koncentrace cmax se v závislosti na podané dávce a v závislosti na vztahu k příjmu stravy pohybovaly v rozmezí 0,66–1,25 mg/ml, průměrný čas dosažení maximální plazmatické koncentrace tmax činil ve všech případech 4,0 hodiny. Distribuční objem v ustáleném stavu byl v rozmezí 62–70 litrů, plazmatická clearance 62–90 ml/min a plazmatický poločas eliminace činil 10,3–11,6 hodiny (tab. 1). 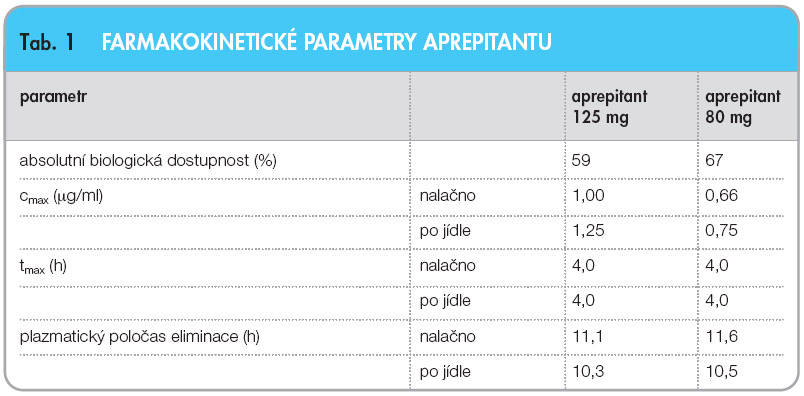 Plazmatický farmakokinetický profil (AUC0-∞, cmax, tmax) 3denního režimu doporučeného pro klinickou praxi se udržoval na stabilních hodnotách po celou dobu tří dnů. Plazmatický poločas po třetí podané dávce byl 8,6 hodiny.
Plazmatický farmakokinetický profil (AUC0-∞, cmax, tmax) 3denního režimu doporučeného pro klinickou praxi se udržoval na stabilních hodnotách po celou dobu tří dnů. Plazmatický poločas po třetí podané dávce byl 8,6 hodiny.
Aprepitant je z velké části metabolizován, a to především oxidací, primárně cestou CYP3A4 za vzniku několika slabých metabolitů. Nebyl prokázán metabolismus pomocí CYP2D6.
Klinické zkušenosti
Dvě velké randomizované dvojitě slepé klinické studie fáze III, publikované v roce 2003, potvrdily antiemetickou účinnost aprepitantu u vysoce emetogenní chemoterapie.
V první z nich bylo hodnoceno celkem 521 nemocných se solidními nádory, kteří byli poprvé léčeni cytostatickým režimem obsahujícím cisplatinu v dávce vyšší než 70 mg/m2 [6]. Všichni nemocní dostávali před chemoterapií intravenózně ondansetron 32 mg spolu s dexamethasonem a po tři následující dny pak perorálně podávaný dexamethason. Intervenční skupina nemocných byla navíc léčena aprepitantem v dávkování první den 125 mg hodinu před chemoterapií a dva následující dny po 80 mg vždy ráno. Vzhledem ke známé interakci s aprepitantem byla dávka dexamethasonu v intervenční skupině snížena první den z 20 mg na 12 mg a další 3 dny z 8 mg podávaných 2krát denně na 8 mg 1krát denně.
Režim s aprepitantem byl ve srovnání s kontrolním režimem signifikantně účinnější v úplné odpovědi (žádné zvracení ani nutnost použití dalších antiemetik), a to jak při hodnocení celého intervalu pěti dnů po chemoterapii (72,7 % vs. 52,3 % nemocných bez zvracení či potřeby antiemetik), tak i zvlášť v akutní a oddálené fázi, ve všech případech s p < 0,001. Čas do prvního zvracení byl signifikantně delší ve skupině s aprepitantem (p < 0,001), přičemž obě skupiny se začaly ve výskytu zvracení signifikantně odlišovat až za 12–16 hodin po podání chemoterapie. Při hodnocení vlivu zvracení na běžnou denní aktivitu nemocného podle dotazníku FLIE (Functional Living Index-Emesis) bylo zjištěno, že podíl nemocných s minimálním nebo nepřítomným narušením aktivity byl signifikantně vyšší u nemocných s režimem obsahujícím aprepitant než s režimem standardním (74,0 % vs. 64,3 %) [6].
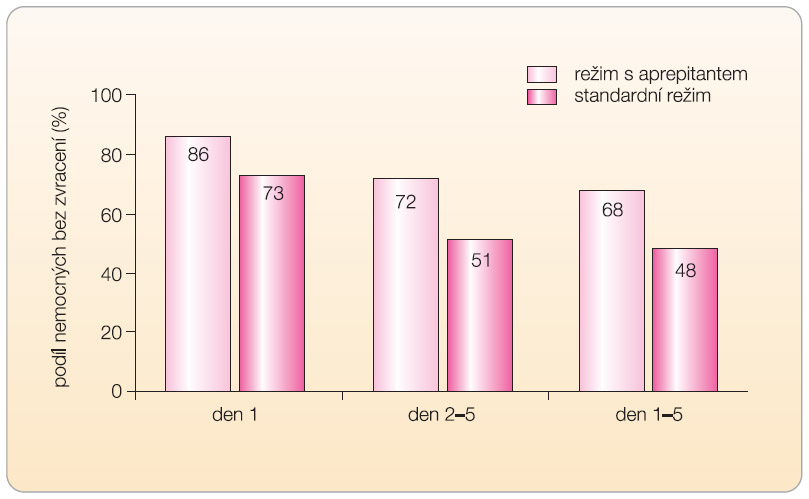 Ve druhé podobně uspořádané klinické studii fáze III, která byla provedena v osmi latinskoamerických zemích, bylo při hodnocení 523 nemocných dosaženo kompletní odpovědi po celých 5 dnů po chemoterapii u 62,7 % jedinců s profylaxí obsahující aprepitant, avšak pouze u 43,3 % nemocných se standardní profylaxí, p < 0,001 [7]. Podíl nemocných s minimálním nebo žádným narušením běžné denní aktivity podle testu FLIE byl opět vyšší ve skupině s aprepitantem proti kontrolní skupině se standardní léčbou (74,7 % vs. 63,5 %).
Ve druhé podobně uspořádané klinické studii fáze III, která byla provedena v osmi latinskoamerických zemích, bylo při hodnocení 523 nemocných dosaženo kompletní odpovědi po celých 5 dnů po chemoterapii u 62,7 % jedinců s profylaxí obsahující aprepitant, avšak pouze u 43,3 % nemocných se standardní profylaxí, p < 0,001 [7]. Podíl nemocných s minimálním nebo žádným narušením běžné denní aktivity podle testu FLIE byl opět vyšší ve skupině s aprepitantem proti kontrolní skupině se standardní léčbou (74,7 % vs. 63,5 %).
Kombinovaná analýza obou uvedených podobně uspořádaných studií s vysoce emetogenní chemoterapií s celkovým počtem 1043 hodnocených pacientů (520 nemocných s aprepitantem, 523 nemocných se standardním antiemetickým režimem) 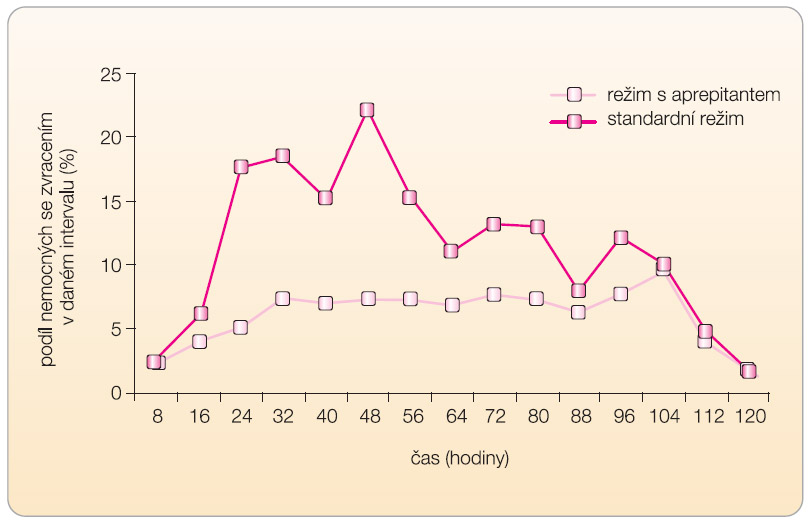 ukázala, že antiemetický režim s aprepitantem je o 20 procentních bodů účinnější než samotná kombinace ondansetronu s dexamethasonem (68 % vs. 48 % nemocných s kompletní odpovědí, p < 0,001), viz graf 1 [8]. Výskyt zvracení byl v této kombinované analýze hodnocen v časových intervalech, a to první den ve čtyřhodinových a další dny v osmihodinových odstupech. Prvních 16 hodin od zahájení chemoterapie nebyl rozdíl mezi oběma léčenými skupinami významný, poté však narůstal výskyt zvracení v kontrolní skupině až k maximu 21 % za 48 hodin po zahájení chemoterapie, zatímco u pacientů léčených aprepitantem setrvával výskyt zvracení na hodnotách kolem 7 % (graf 2).
ukázala, že antiemetický režim s aprepitantem je o 20 procentních bodů účinnější než samotná kombinace ondansetronu s dexamethasonem (68 % vs. 48 % nemocných s kompletní odpovědí, p < 0,001), viz graf 1 [8]. Výskyt zvracení byl v této kombinované analýze hodnocen v časových intervalech, a to první den ve čtyřhodinových a další dny v osmihodinových odstupech. Prvních 16 hodin od zahájení chemoterapie nebyl rozdíl mezi oběma léčenými skupinami významný, poté však narůstal výskyt zvracení v kontrolní skupině až k maximu 21 % za 48 hodin po zahájení chemoterapie, zatímco u pacientů léčených aprepitantem setrvával výskyt zvracení na hodnotách kolem 7 % (graf 2).
Výskyt oddáleného zvracení byl u nemocných léčených aprepitantem významně nižší bez ohledu na výskyt zvracení akutního, což dokumentuje přímý vliv aprepitantu na oddálené zvracení, a nikoliv jen přenesený efekt, který by mohl být způsoben redukcí akutního zvracení. Celkový počet emetických epizod u nemocných, kteří zvraceli, byl v obou léčebných skupinách u 65 % pacientů 1–5 a 35 % nemocných mělo více než 5 emetických epizod.
Teprve kombinovaná analýza obou studií prokázala statisticky významně nižší výskyt nevolnosti po aprepitantu, efekt, který nebyl signifikantní v jednotlivých studiích. Zcela bez výskytu nevolnosti bylo 48 % vs. 42 % nemocných, zatímco podíl nemocných bez významné nevolnosti činil 72 % vs. 65 % (v obou případech p < 0,05) [8].
Signifikantní efekt aprepitantu byl patrný také v podskupinách podle pohlaví (z 1043 pacientů v obou uvedených studií bylo 42 % žen). Přínos aprepitantu proti standardnímu antiemetickému režimu byl u žen větší (66 % kompletní odpovědi proti 41 %) než u mužů (69 % versus 53 %) a tento rozdíl byl výraznější pro oddálené než pro akutní zvracení [9]. Autoři uzavírají, že aprepitant zmírňuje rozdílně nevolnost a zvracení po chemoterapii u žen a u mužů, což může naznačovat větší úlohu substance P při zprostředkování zvracení u žen než u mužů.
Další práce na stejném souboru nemocných obou studií fáze III dodatečně zhodnotila efekt aprepitantu v podskupině nejrizikovějších pacientů, kteří spolu s cisplatinou dostávali další emetogenní cytostatika, cyklofosfamid nebo doxorubicin. Rozdíl v kompletní odpovědi byl u těchto nejrizikovějších nemocných ještě výraznější (59 % po režimu s aprepitantem vs. 26 % po standardním antiemetickém režimu) než v celém souboru [10].
Jiná studie srovnávala trojkombinaci s aprepitantem (ondansetron pouze první den, dexamethason 4 dny v redukované dávce vzhledem k současné léčbě aprepitantem) proti čtyřdenní kombinaci ondansetronu s dexamethasonem u pacientů s vysoce emetogenní chemoterapií obsahující cisplatinu v dávce vyšší než 70 mg/m2. V souboru 484 nemocných byla kompletní odpověď významně častější po léčebném režimu s aprepitantem než po standardní léčbě (72 % vs. 60,6 %; p = 0,003). Rozdíl byl výraznější při hodnocení samotného zvracení, a to více v oddálené než v akutní fázi. Výskyt nevolnosti byl pouze nesignifikantně nižší ve skupině s aprepitantem [11].
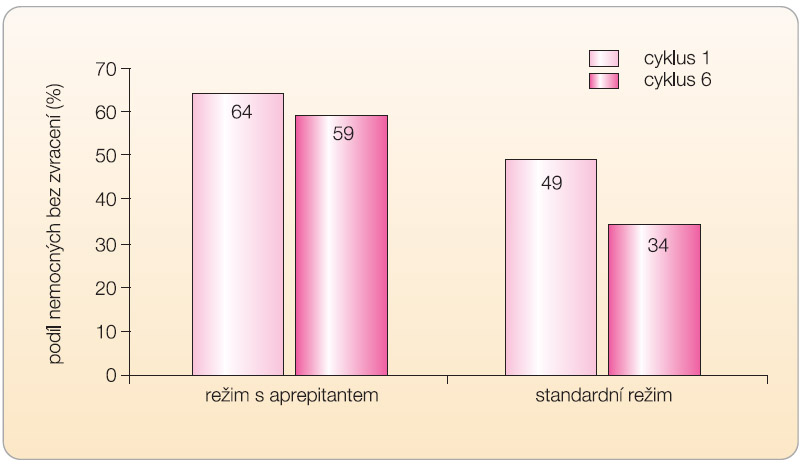 Antiemetický efekt aprepitantu při opakované chemoterapii byl hodnocen klinickou studií u 202 pacientů poprvé léčených různými režimy s cisplatinou v dávce nejméně 70 mg/m2 [12]. Všichni nemocní dostávali první den každého cyklu chemoterapie ondansetron 32 mg i.v. a perorální dexamethason 20 mg, 2.–5. den cyklu dexamethason v dávce 8 mg ráno. Plánovaných 6 cyklů chemoterapie dokončilo 27 nemocných (33 %) ve větvi s aprepitantem v dnes doporučeném dávkování a 33 nemocných (38 %) se standardní antiemetickou profylaxí (třetí skupina nemocných dostávala aprepitant ve vyšší dávce, která dnes již není užívána). Pokles účinnosti antiemetické profylaxe v posledních dvou cyklech chemoterapie oproti cyklu 1 byl větší u skupiny nemocných se standardní medikací než u skupiny s aprepitantem (graf 3).
Antiemetický efekt aprepitantu při opakované chemoterapii byl hodnocen klinickou studií u 202 pacientů poprvé léčených různými režimy s cisplatinou v dávce nejméně 70 mg/m2 [12]. Všichni nemocní dostávali první den každého cyklu chemoterapie ondansetron 32 mg i.v. a perorální dexamethason 20 mg, 2.–5. den cyklu dexamethason v dávce 8 mg ráno. Plánovaných 6 cyklů chemoterapie dokončilo 27 nemocných (33 %) ve větvi s aprepitantem v dnes doporučeném dávkování a 33 nemocných (38 %) se standardní antiemetickou profylaxí (třetí skupina nemocných dostávala aprepitant ve vyšší dávce, která dnes již není užívána). Pokles účinnosti antiemetické profylaxe v posledních dvou cyklech chemoterapie oproti cyklu 1 byl větší u skupiny nemocných se standardní medikací než u skupiny s aprepitantem (graf 3).
Efekt aprepitantu u středně emetogenní chemoterapie hodnotila velká klinická studie u homogenního souboru 857 žen s karcinomem prsu léčených kombinací doxorubicinu s cyklofosfamidem [13]. Aprepitant ve standardním třídenním dávkování podávaný první den spolu s ondansetronem 2krát 8 mg a dexamethasonem 12 mg byl srovnáván s třídenní profylaxí ondansetronem 2krát 8 mg, která byla doplněna první den dexamethasonem v dávce 20 mg. Úplné odpovědi (žádné zvracení ani potřeba dalších antiemetik) po dobu 5 dnů od začátku prvního cyklu chemoterapie bylo dosaženo u 51 % pacientek s režimem obsahujícím aprepitant proti pouze 42 % nemocných se standardní profylaxí (p = 0,015). Rozdíl v čase do prvního zvracení byl patrný již za 6 hodin od začátku chemoterapie a dále se postupně zvětšoval až do konce pětidenního sledování. Podíl nemocných s minimálním nebo nepřítomným narušením aktivity podle testu FLIE byl signifikantně vyšší u nemocných s režimem obsahujícím aprepitant než s režimem standardním (85,7 % vs. 71,8 %; p < 0,001).
Tentýž soubor byl za stejných podmínek sledován až do čtvrtého cyklu léčby, který dokončilo 75,1 % pacientek (celkem zhodnoceno 2971 cyklů chemoterapie). Rozdíl mezi oběma režimy se udržoval po všechny 4 cykly a byl zvláště výrazný v podílu pacientek, které vůbec nezvracely (v 1. cyklu 75,7 % vs. 58,7 %, ve 4. cyklu 62,9 % vs. 38,8 %, tedy zvýšení rozdílu ze 17 na 24 procentních bodů) [14].
Aprepitant podávaný v kombinaci s palonosetronem a dexamethasonem v profylaxi nevolnosti a zvracení po středně emetogenní chemoterapii měl v klinické studii fáze II velmi dobrý efekt s úplnou odpovědí u 78 % pacientů, přičemž 52 % nemocných nemělo žádnou nevolnost po dobu 5 dnů (což jsou lepší výsledky než ve velké studii fáze III po kombinaci aprepitantu s ondansetronem a pouze jednodenním podáváním dexamethasonu) [15]. Kombinace aprepitantu s palonosetronem je dobře tolerována a nevyžaduje žádnou úpravu dávkování léčiv.
Malá nerandomizovaná klinická studie fáze II ukázala velmi dobrý efekt aprepitantu u nemocných refrakterních na standardní antiemetickou profylaxi [16]. U 35 nemocných s retrospektivně zjištěnou nedostatečně účinnou profylaxí v předcházejícím cyklu chemoterapie byl v následujícím cyklu aprepitant přidán ke stávající kombinaci granisetronu s dexamethasonem (perorálně první den 125 mg, každý další den chemoterapie a 2 dny po jejím skončení vždy 80 mg denně). Podíl nemocných bez zvracení se zvýšil z 8,8 % na 76,5 %, podíl nemocných bez významné nevolnosti z 0 % na 53 %.
Zařazení do současné palety léčiv
Aprepitant svým odlišným mechanismem působení a zejména vyšší účinností proti oddálenému zvracení významně zlepšuje účinek až dosud používané antiemetické medikace.
Proto je při vysoce emetogenní chemoterapii dnes již standardním přístupem podání trojkombinace blokátoru 5HT3-receptoru s dexamethasonem a aprepitantem [17, 18]. Zvláštní výhodu má přidání aprepitantu do antiemetické kombinace při vysokodávkové chemoterapii před transplantací krvetvorných buněk, včetně režimů s celotělovým ozářením.
Četné nové práce poukazují na zlepšení efektu antiemetické profylaxe i u středně emetogenní chemoterapie, zejména při cytostatické kombinaci antracyklinu s cyklofosfamidem, ale i při podání těchto léčiv samostatně nebo při léčbě karboplatinou či vyšší dávkou methotrexátu. Aprepitant je proto dnes indikován také u vybraných pacientů se středně emetogenní chemoterapií [19]. Přitom je třeba počítat s faktem, že při opakovaných cyklech chemoterapie se výskyt nevolnosti a zvracení postupně zvyšuje i při optimální profylaxi [16]. Pravděpodobnost akutního zvracení v následujícím cyklu chemoterapie se zvyšuje, pokud se nepodaří předejít oddálenému zvracení v předchozím cyklu. Lepší kontrola oddáleného zvracení v předchozích cyklech chemoterapie působí mechanismem pozitivní zpětné vazby na udržení antiemetické účinnosti v dalších cyklech léčby [12]. Aprepitant je proto doporučen profylakticky, přináší však efekt i u nemocných se selháním standardní antiemetické medikace.
Zvláštní výhodou aprepitantu může být profylaxe oddáleného zvracení u nemocných s kontraindikací nebo nevhodností podání kortikosteroidů. Takovým pacientem může být špatně kompenzovaný diabetik nebo nemocný s vředovou chorobou gastroduodena.
Indikace
Dle platného Souhrnu údajů o přípravku je aprepitant podáván jako prevence akutní a pozdní nevolnosti a zvracení v souvislosti s vysoce emetogenní protinádorovou chemoterapií založenou na bázi cisplatiny. Další indikací je prevence nevolnosti a zvracení v souvislosti se středně emetogenní protinádorovou chemoterapií. Aprepitant se podává jako součást kombinované terapie společně s kortikosteroidem a antagonistou 5HT3-receptoru [20].
Kontraindikace
Kontraindikací pro podání aprepitantu je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku přípravku. Dále se aprepitant nesmí podávat současně s pimozidem, terfenadinem, astemizolem ani cisapridem. Je třeba si uvědomit, že aprepitant je inhibitor izoenzymu 3A4 cytochromu P-450 (CYP3A4) a společné podání s výše uvedenými látkami by mohlo mít za následek zvýšení plazmatických koncentrací těchto léčiv, což by případně mohlo vyvolat závažné nebo život ohrožující reakce [20].
Nežádoucí účinky
 Tolerance aprepitantu byla ve všech velkých klinických studiích dobrá, většina popsaných nežádoucích účinků měla pouze mírnou nebo střední intenzitu a nevedla k předčasnému přerušení léčby. Vzhledem k současnému podávání několika léčiv bylo jako příčinu potíží obtížné odlišit chemoterapii nebo setronová antiemetika či další medikaci.
Tolerance aprepitantu byla ve všech velkých klinických studiích dobrá, většina popsaných nežádoucích účinků měla pouze mírnou nebo střední intenzitu a nevedla k předčasnému přerušení léčby. Vzhledem k současnému podávání několika léčiv bylo jako příčinu potíží obtížné odlišit chemoterapii nebo setronová antiemetika či další medikaci.
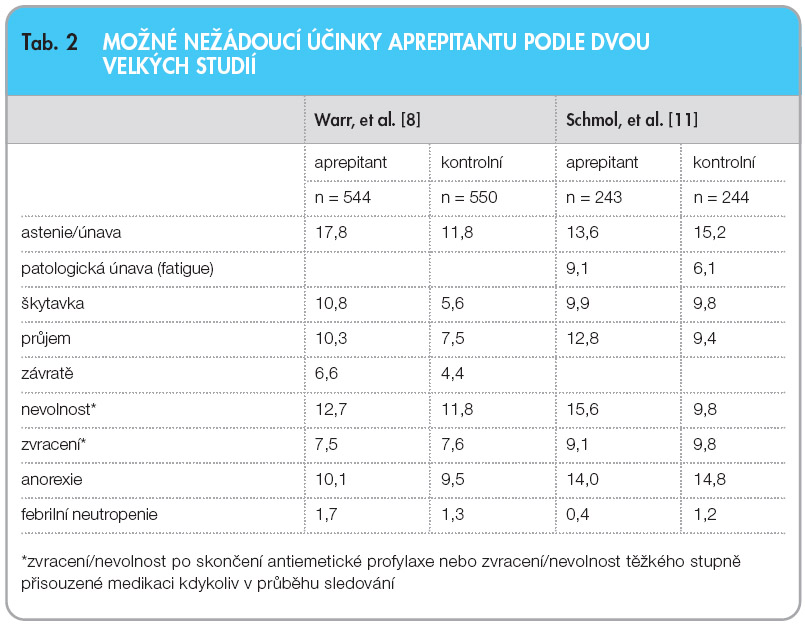
Z možných nežádoucích účinků se ve velkých studiích fáze III ve skupině nemocných s aprepitantem proti skupině kontrolní vyskytovala častěji celková slabost nebo únava, škytavka a nevolnost po pátém dnu od začátku chemoterapie (tab. 2). Nebyl zjištěn významný rozdíl ve výskytu febrilní neutropenie, jaký byl zaznamenán v jedné z dřívějších menších studií.
U žen se středně emetogenní chemoterapií byl zjištěn vyšší výskyt zácpy (18 % vs. 12 %) a dyspepsie (8,4 % vs. 4,9 %) ve skupině léčené aprepitantem oproti skupině se standardní antiemetickou profylaxí [13].
Interakce
Aprepitant je substrátem a současně středně silným inhibitorem izoenzymu CYP3A4. Proto může zvýšit hladiny léčiv, která jsou metabolizována stejnou cestou. Tento efekt je větší u perorálních než u intravenózně podaných léčiv [3].
Významná je interakce s kortikosteroidy, u nichž aprepitant ve standardním dávkování způsobuje významné (2,2násobné) zvýšení plochy pod křivkou. Clearance intravenózního dexamethasonu byla při současném perorálním podání 125 mg aprepitantu snížena o 47,5 % [21]. Dávku kortikosteroidů je proto při současném podání aprepitantu doporučeno snížit, a to při perorální léčbě o 50 %, při intravenózní o 25 %. Také hladina benzodiazepinů může být aprepitantem zvýšena, i když při jejich dlouhodobém podávání není tento efekt výrazný.
Na druhé straně je účinek warfarinu při současném užívání aprepitantu snížen.
Z opačného pohledu mohou být hladiny samotného aprepitantu zvýšeny při léčbě silnými inhibitory CYP3A4, jako jsou klarithromycin nebo itrakonazol; vyšší hladiny aprepitantu však v těchto případech nebyly provázeny žádnými nežádoucími účinky. Naopak snížení hladin aprepitantu bylo popsáno při užívání rifampicinu a karbamazepinu.
Většina klinických studií neshledala žádné důkazy pro interakce aprepitantu s cytostatiky [3, 14]. Bylo však publikováno několik případů neurotoxicity ifosfamidu při současné léčbě aprepitantem. Jedna malá retrospektivní studie 45 pacientů léčených ifosfamidem shledala vyšší výskyt neurotoxicity, pokud byl současně podáván aprepitant (25 % vs. 10 %, p = 0,17). I když rozdíl nebyl statisticky významný, doporučují autoři brát toto riziko v úvahu [22].
Farmakokinetické ani klinické studie nenasvědčují klinicky významným interakcím mezi aprepitantem a cyklofosfamidem. Metabolismus prostřednictvím CYP3A4 zahrnuje jak aktivaci cyklofosfamidu, tak inaktivaci jeho aktivních metabolitů. Studie s cyklofosfamidem podávaným ve vysokých dávkách spolu s aprepitantem neprokázaly významné rozdíly v ploše pod křivkou ve srovnání s historickými kontrolami. Také v případě antracyklinů a docetaxelu nebyly prokázány žádné významné interakce [19].
Aprepitant rovněž nemá žádný vliv na hladiny setronů.
Těhotenství a kojení
Během těhotenství by neměl být aprepitant podáván, pokud to není nezbytně nutné; jeho potenciální reprodukční toxicita nebyla úplně objasněna. Není známo, zda se aprepitant vylučuje do mateřského mléka; proto se kojení během jeho podávání nedoporučuje [20].
Dávkování a způsob podání
Dnes doporučený třídenní režim užívání aprepitantu vychází ze studií fáze II, které zkoušely různá dávkování – od jednodenního až po pětidenní. Podávání aprepitantu déle než tři dny u jednodenní léčby vysoce emetogenní chemoterapií již dále nezvyšovalo antiemetický účinek [6]. Standardní profylaktický režim proto obsahuje podání jedné tablety o síle 125 mg hodinu před zahájením chemoterapie a následující dva dny ráno vždy jednu tabletu o síle 80 mg. Stejný režim včetně dávky je dobře tolerován i dětmi ve věku 11–19 roků [23]. Jedno balení dnes dostupného léku obsahuje právě tři tablety uvedené síly.
U vícedenní emetogenní chemoterapie byl aprepitant použit v prodlouženém režimu po dobu 5–7 dnů tak, že po poslední dávce cytostatik byl podáván ještě dva následující dny. Tolerance prodlouženého podání byla srovnatelná se standardním třídenním dávkováním, a to při zachovalé účinnosti po celou dobu chemoterapie a pěti následujících dnů [24].
Aprepitant byl také s úspěchem vyzkoušen ve vysoké jednorázové perorální dávce 285 mg v kombinaci s perorálním dexamethasonem 20 mg a intravenózním palonosetronem u nemocných se středně emetogenní chemoterapií [25].
Při poruše orgánových funkcí není nutná úprava dávkování. Týká se to mírné až středně těžké jaterní insuficience, pro těžký stupeň jaterního selhání (Childovo-Pughovo skóre > 9) však údaje chybí. Úprava dávkování není potřebná ani při renální insuficienci, a to včetně terminálního selhávání nebo dialyzační léčby. Věk ani pohlaví také nevyžadují žádné přizpůsobení dávky [3].
Farmakoekonomika
Úplná odpověď na podání trojkombinace antiemetik s aprepitantem po vysoce emetogenní chemoterapii je o 20 % častější než odpověď na dosud používanou kombinaci antagonistů serotoninu s dexamethasonem. Průměrný pacient tak získává 15 hodin perfektního zdraví během pěti dnů po zahájení chemoterapie navíc [26]. Podle kalkulace německých autorů se 42 % nákladů na samotný aprepitant vrátí v podobě nižší spotřeby medikace k léčbě průlomového zvracení včetně nižší potřeby rehospitalizace. Po přepočtu na získaný rok života v dobré kvalitě (Quality-Adjusted Life Year, QALY) byly náklady na aprepitant zhodnoceny jako efektivní. Přitom však nebyl započítán dlouhodobý příznivý vliv účinnější antiemetické medikace na morbiditu a mortalitu pacientů s nádorovým onemocněním, pokud tato medikace umožní podat plnou dávku chemoterapie bez odkladů.
Balení
Aprepitant je v Evropské unii i ve Spojených státech amerických registrován pod názvem Emend (tab. 3).
Závěr
Aprepitant, blokátor NK1-receptorů, představuje významný přínos k profylaxi a léčbě zvracení, zejména v oddálené fázi po podání chemoterapie. Odlišným mechanismem účinku zvyšuje efekt až dosud používané kombinace 5HT3-blokátorů s dexamethasonem, při níž po emetogenní chemoterapii zvrací v akutní fázi 20–30 % a v oddálené fázi dokonce 40–80 % léčených.
V poslední době přibývá dokladů o tom, že aprepitant je účinný i u pacientů léčených méně emetogenní chemoterapií. Je zřejmé, že aprepitant by mohl být užitečný také při nevolnosti a zvracení po opioidech, po radioterapii a u refrakterní nevolnosti a při zvracení bez vztahu k chemoterapii [3].
Seznam použité literatury
- [1] EMEND prescribing information. http://www. emend. com/aprepitant/emend/consumer/product_information/pi/index.jsp
- [2] Bleiberg H. A new class of antiemetics: the NK-1 receptor antagonists. Curr Opin Oncol 2000; 12: 284–288.
- [3] Prommer E. Aprepitant (EMEND): The role of substance P in nausea and vomiting. J Pain Palliat Care Pharm 2005; 19: 31–39.
- [4] Mun~oz M, Rosso M. The NK-1 receptor antagonist aprepitant as a broad spectrum antitumor drug. Invest New Drugs 2009, v tisku.
- [5] Majumdar AK, Howard L, Goldberg MR, et al. Pharmacokinetics of aprepitant after single and multiple oral doses in healthy volunteers. J Clin Pharmacol 2006; 46: 291–300.
- [6] Hesketh PJ, Grunberg SM, Gralla RJ, et al. The oral neurokinin-1 antagonist aprepitant for the chemotherapy-induced nausea and vomiting: a multinational, randomized, double-blind, placebo-controlled trial in patients receiving high-dose cisplatin-the Aprepitant Protocol 052 Study Group. J Clin Oncol 2003; 21: 4112–4119.
- [7] Polli-Bigeli S, Rodrigues-Pereira J, Carides AD, et al. Addition of the neurokinin 1 receptor antagonist aprepitant to standard antiemetic therapy improves control of chemotherapy-induced nausea and vomiting. Cancer 2003; 97: 3090–3098.
- [8] Warr DG, Grunberg SM, Gralla RJ, et al. The oral NK1 antagonist aprepitant for the prevention of acute and delayed chemotherapy-induced nausea and vomiting: Pooled data from 2 randomised, double-blind, placebo controlled trials. Eur J Cancer 2005; 41: 1278–1285.
- [9] Hesketh PJ, Grunberg SM, Herrstedt J, et al. Combined data from two phase III trials of the NK1 antagonist aprepitant plus a 5-HT3 antagonist and a corticosteroid for prevention of chemotherapy-induced nausea and vomiting: effect of gender on treatment response. Support Care Cancer 2006; 14: 354–360.
- [10] Gralla RJ, deWit R, Herrstedt J, et al. Antiemetic efficacy of the neurokinin-1 antagonist, aprepitant, plus a 5-HT3 antagonist and a corticosteroid in patients receiving anthracyclines or cyclophosphamide in addition to high-dose cisplatin. Analysis of combined data from two phase III randomized clinical trials. Cancer 2005; 104: 864–868.
- [11] Schmoll HJ, Aapro MS, Poli-Bigelli S, et al. Comparison of an aprepitant regimen with a multiple-day ondansetron regimen, both with dexamethasone, for antiemetic efficacy in high-dose cisplatin treatment. Ann Oncol 2006; 1–7.
- [12] deWit R, Herrstedt J, Rapoport B, et al. Addition of the oral NK1 antagonist aprepitant to standard antiemetics provides protection against nausea and vomiting during multiple cycles of cisplatin-based chemotherapy. J Clin Oncol 2003; 21: 4105–4111.
- [13] Warr DG, Hesketh PJ, Gralla RJ, et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy. J Clin Oncol 2005; 23: 2822–2830.
- [14] Herrstedt J, Muss HB, Warr DG, PJ et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and emesis over multiple cycles of moderately emetogenic chemotherapy. Cancer 2005; 104: 1548–1555.
- [15] Grote T, Hajdenberg J, Cartmell A, et al. Combination therapy for chemotherapy-induced nausea and vomiting in patients receiving moderately emetogenic chemotherapy: palonosetron, dexametasone, and aprepitant. A phase II, open label study. J Support Oncol 2006; 4: 403–408.
- [16] Oechsle K, Műller MR, Hartmann JT, et al. Aprepitant as salvage therapy in patients with chemotherapy-induced nausea and emesis refractory to prophylaxis with 5-HT3 antagonists and dexamethasone. Onkologie 2006; 29: 557–561.
- [17] Kris MG, Hesketh PJ, Somerfield MR, et al. American Society of Clinical Oncology guideline for antiemetics in oncology: Update 2006. J Clin Oncol 2006; 24: 2932–2947.
- [18] Antiemesis, version I.2008. National Comprehensive Cancer Network Clinical Practice Guidelines in Oncology. www.nccn.org
- [19] Warr D. The neurokinin1 receptor antagonist aprepitant as an antiemetic for moderately emetogenic chemotherapy. Expert Opin Pharmacoter 2006; 7: 1653–1658.
- [20] EMEND Souhrn údajů o přípravku, datum revize textu 23. října 2008. AISLP verze 2009.1 – 1.1.2009.
- [21] Nakade S, Ohno T, Kitagawa J, et al. Population pharmacokinetics of aprepitant and dexamethasone in the prevention of chemotherapy-induced nausea and vomiting. Cancer Chemother Pharmacol 2008; 63: 75–83.
- [22] Howell JE, Szabatura AH, Hatfield SA, Nesbit SA. Characterization of the occurence of ifosfamide-induced neurotoxicity with concomitant aprepitant. J Oncol Pharm Pract 2008; 14: 157–162.
- [23] Adamson PC, Bagatell R, Boklan J, et al. Aprepitant in adolescent patients for prevention of chemotherapy-induced nausea and vomiting: a randomized, double-blind, placebo controlled study of efficacy and tolerability. Pediatr Blood Cancer 2009; 52: 242–247.
- [24] Jordan K, Kinitz I, Voigt W, et al. Safety and efficacy of a triple antiemetic combination with the NK-1 antagonist aprepitant in highly and moderately emetogenic multiple-day chemotherapy. Eur J Cancer 2009, v tisku.
- [25] Grunberg SM, Dugan M, Muss H, et al. Effectiveness of a single-day three-drug regimen of dexamethasone, palonosetron, and aprepitant for the prevention of acute and delayed nausea and vomiting caused by moderately emetogenic chemotherapy. Support Care Cancer, v tisku.
- [26] Lordick F, Ehlken B, Ihbe-Heffinger A, et al. Health outcome and cost-effectiveness of aprepitant in outpatients receiving antiemetic prophylaxis for highly emetogenic chemotherapy in Germany. Eur J Cancer 2007; 43: 299–307.