Bimekizumab
Psoriáza je zánětlivé neinfekční autoimunitní onemocnění, které postihuje především kůži, ale manifestuje se často také v oblasti nehtů, kloubů a bývá asociováno s dalšími chorobami [1]. Z tohoto důvodu ji považujeme za systémové onemocnění. Psoriáza má chronický průběh s různorodým klinickým obrazem, projevuje se opakovanými exacerbacemi a nemocným významně snižuje kvalitu života.
Psoriáza je zánětlivé neinfekční
autoimunitní onemocnění, které postihuje především kůži, ale
manifestuje se často také v oblasti nehtů, kloubů a bývá
asociováno s dalšími chorobami [1]. Z tohoto důvodu ji
považujeme za systémové onemocnění. Psoriáza má chronický
průběh s různorodým klinickým obrazem, projevuje se
opakovanými exacerbacemi a nemocným významně snižuje
kvalitu života.
Léčba psoriázy se odvíjí od její závažnosti, věku nemocného i přítomných komorbidit. Zavedení biologické léčby znamenalo významný pokrok v terapii a naději pro pacienty se závažným průběhem onemocnění. Vědecký výzkum neustále pokračuje a s lepšími znalostmi patofyziologie nemoci cílí nové přípravky na podstatu onemocnění a probíhající patologické děje.
Mezi klíčové prozánětlivé cytokiny, které se uplatňují v patogenezi psoriázy, patří interleukin 17 (IL-17), který je zapojen do indukce a zprostředkování zánětlivé odpovědi [2,3]. Je produkován pomocnými T lymfocyty po jejich stimulaci. Po vazbě na receptor se spouští řada signálních drah, které vedou k produkci prozánětlivých chemokinů a řady dalších biologicky aktivních látek.
Inhibice IL 17 se proto stala v léčbě psoriázy žádaným léčebným cílem. Interleukin 17 představuje rodinu cytokinů, která se skládá z minimálně šesti strukturně obdobných cytokinů (IL 17A–F) [4,5]. Za biologicky nejaktivnější je považován IL 17A, nicméně ani role IL 17F není zanedbatelná [6] a u pacientů s psoriázou byla zjištěna nadměrná exprese IL 17F. Interleukiny 17A a 17F se navíc vážou na stejný receptorový komplex (IL 17RA/RC). Proto se zdá, že by duální inhibice IL 17A a IL 17F mohla poskytnout lepší kontrolu nad nemocí [4,5]. Prvním registrovaným přípravkem s tímto mechanismem účinku je bimekizumab [7].
Farmakologická skupina
Bimekizumab je humanizovaná monoklonální protilátka IgG1, která inhibuje signalizaci zprostředkovanou IL 17A a 17F. Dle ATC klasifikace je bimekizumab řazen mezi Imunosupresiva – Inhibitory interleukinu (L04AC21).
Indikace
Bimekizumab je indikován k léčbě středně těžké až těžké formy ložiskové psoriázy u dospělých, u nichž je indikována systémová léčba [7].
Dávkování
Doporučená dávka bimekizumabu u dospělých pacientů s psoriázou je 320 mg v týdnech 0, 4, 8, 12 a 16 a dále v intervalu 8 týdnů. Předplněná stříkačka obsahuje 160 mg bimekizumabu, proto se podávají dvě injekce. Pokud po 16 týdnech léčby nedojde ke zlepšení stavu, je doporučeno zvážit ukončení terapie [7].
Přípravek je určen k podání dospělým pacientům, u nemocných starších 65 let není dle farmakokinetických parametrů potřeba žádná úprava dávkování. Rovněž není dle dostupných údajů potřeba úprava dávkování z hlediska pohlaví nebo rasy.
Naproti tomu bylo ale doloženo snížení expozice bimekizumabu s rostoucí tělesnou hmotností. Odpověď na léčbu zde může zlepšit úprava dávkování. U obézních pacientů s tělesnou hmotností ≥ 120 kg, u nichž nebylo dosaženo kompletní odpovědi po prvních 16 týdnech léčby, je proto doporučeno zkrácení intervalu následných aplikací na čtyři týdny namísto obvyklých osmi týdnů [7].
Z povahy léčivé látky (monoklonální protilátka IgG) a jejího metabolismu se nepředpokládají významné rozdíly v expozici bimekizumabu v důsledku porušené funkce ledvin nebo jater, proto se ani u těchto pacientů úprava dávkování nevyžaduje.
Způsob podání
Bimekizumab se podává jako subkutánní injekce, aplikuje se obvykle do stehna, břicha nebo do horní části paže. Místa vpichu je doporučeno střídat. Injekce by neměla být aplikována přímo do ložisek psoriázy, citlivé, erytematózní nebo zatvrdlé kůže.
Přípravek je dostupný jako předplněná injekční stříkačka nebo předplněné pero. Před aplikací se nesmí protřepávat. Pacienti si mohou po zaškolení přípravek aplikovat sami [7].
Zahájení léčby
Před zahájením léčby bimekizumabem by měla být u pacienta vyšetřena přítomnost tuberkulózy (TBC) a u pacientů s anamnézou latentní nebo aktivní formy TBC by se měla zvážit její léčba.
Stejně tak by mělo být zváženo dokončení očkování v souladu s aktuálním vakcinačním doporučením. V průběhu léčby nemají být aplikovány živé vakcíny, pouze inaktivované.
Léčba bimekizumabem by neměla být zahajována v případě klinicky významné aktivní infekce, a pokud se infekce objeví během léčby a nereaguje adekvátně na terapii, měla by být léčba bimekizumabem přerušena [7].
Mechanismus účinku
Bimekizumab je humanizovaná
monoklonální protilátka IgG1/κ, která se selektivně
váže na cytokiny IL 17A a IL 17F a neutralizuje
jejich biologické funkce (obr. 1). Tento nový mechanismus
účinku umožňuje rozsáhlejší potlačení zánětlivého procesu
s výraznějším snížením genové exprese, migrace
zánětlivých buněk a produkce prozánětlivých cytokinů než
izolovaná blokáda IL 17A [8].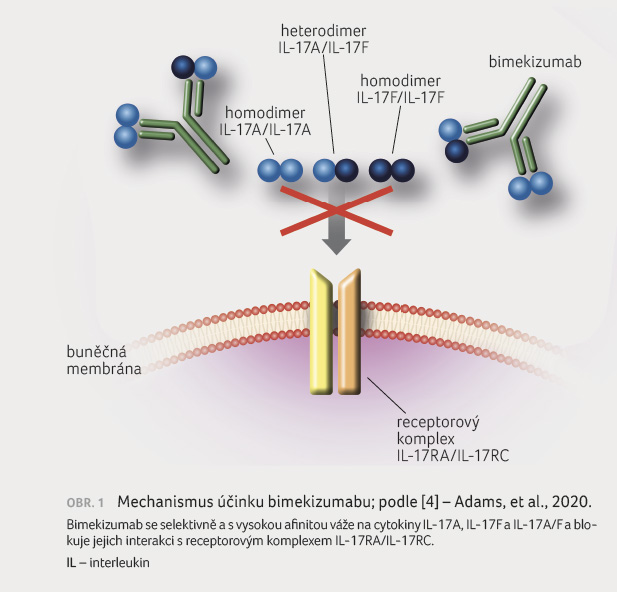
Interleukiny 17A a 17F představují dva nejvíce homologní cytokiny, které sdílejí podobné regulace. Jsou sekretovány aktivovanými Th17 lymfocyty ve formě homodimerů, které se skládají ze dvou IL 17A nebo IL 17F, nebo ve formě heterodimeru IL 17A/IL 17F. Všechny tyto formy jsou biologicky aktivní, jejich prostřednictvím T lymfocyty regulují zánětlivé reakce organismu [9]. Bimekizumab představuje divalentní léčivo (má dvě vazebná místa) s duální specifitou (váže jak IL 17A, tak IL 17F) [5].
Jak již bylo uvedeno, zvýšené koncentrace IL 17A a IL 17F se podílejí na patogenezi psoriázy. Duální inhibice těchto prozánětlivých cytokinů bimekizumabem vede v případě psoriázy k normalizaci kožního zánětu a následně ke zmírnění klinických příznaků spojených s psoriázou [7]. Jejich zásadní role byla doložena rovněž u psoriatické artritidy a spondyloartritidy, dalších imunitně zprostředkovaných zánětlivých onemocnění. Efekt bimekizumabu je klinicky hodnocen i v těchto indikacích a dosavadní výsledky studií jsou slibné, nicméně schválen byl zatím pouze pro terapii psoriázy.
Farmakokinetické vlastnosti
Populační farmakokinetický/farmakodynamický model demonstroval, že dávka 320 mg bimekizumabu aplikovaná každé čtyři týdny je přiměřená v počátečním léčebném období; pro udržovací období je pro většinu pacientů se středně těžkou až těžkou formou ložiskové psoriázy vhodná dávka 320 mg podávaná s odstupem osmi týdnů [7]. Vyšší koncentrace bimekizumabu je asociována s lepší odpovědí na léčbu. Bylo doloženo, že se zvyšující se tělesnou hmotností expozice bimekizumabu klesá (u pacienta s tělesnou hmotností ≥ 120 kg se předpokládá minimálně o 30 % nižší než u pacienta s tělesnou hmotností 90 kg), proto může být u některých pacientů vhodné upravit dávkování (viz výše).
V případě podání jednorázové subkutánní dávky 320 mg bimekizumabu bylo mediánu maximální plazmatické koncentrace (25 µg/ml) dosaženo 3.–4. den po aplikaci. U zdravých jedinců byl bimekizumab absorbován s průměrnou absolutní biologickou dostupností 70,1 %. Při dávkovacím intervalu v odstupu čtyř týdnů je ustáleného stavu dosaženo zhruba po 16 týdnech. Stejně tak je při přechodu z dávkovacího režimu po čtyřech týdnech (při dosažení ustáleného stavu) na režim podávání každých osm týdnů dosaženo ustáleného stavu přibližně po 16 týdnech.
Medián distribučního objemu v ustáleném stavu činil u pacientů s psoriázou 11,2 l. Co se týče biotransformace, předpokládá se, stejně jako u endogenních imunoglobulinů, postupný rozklad monoklonální protilátky na peptidy a aminokyseliny. Medián zdánlivé clearance (Cl/F) bimekizumabu se pohybuje kolem 0,337 l/den a průměrný terminální eliminační poločas byl u pacientů s ložiskovou psoriázou v klinických studiích 23 dní. Hodnoty zdánlivé clearance u pacientů starších 65 let byly obdobné jako u mladších osob [7].
Klinické zkušenosti
Výsledky klinického hodnocení fáze III potvrdily vysokou míru účinnosti bimekizumabu pozorovanou v předchozích studiích [10]. Celkem byly provedeny čtyři studie fáze III s cílem porovnat podávání bimekizumabu s placebem a ustekinumabem (BE VIVID), placebem (BE READY), adalimumabem (BE SURE) a sekukinumabem (BE RADIANT). Tato klinická hodnocení prokázala superioritu bimekizumabu oproti placebu, ustekinumabu (inhibitor IL 12/23), adalimumabu (inhibitor TNF) i sekukinumabu (inhibitor IL 17A) [8,11].
Ve všech studiích fáze III byl bimekizumab také dobře tolerován, s bezpečnostním profilem podobným ostatním testovaným biologickým lékům, s výjimkou vyšší frekvence orální kandidózy [10,12].
Studie BE VIVID
BE VIVID (NCT0337013316) byla multicentrická, randomizovaná, dvojitě zaslepená studie fáze III s aktivním komparátorem a kontrolovaná placebem. Probíhala na 105 místech v 11 zemích Asie, Austrálie, Evropy a Severní Ameriky [13]. Zahrnuti byli dospělí pacienti se středně těžkou až těžkou ložiskovou psoriázou (PASI [Psoriasis Area and Severity Index] ≥ 12, ≥ 10 % plochy tělesného povrchu postižené psoriázou a skóre IGA [Investigator’s Global Assessment ≥ 3 na pětibodové škále).
Klinické hodnocení sledovalo celkem 567 pacientů po dobu 52 týdnů. Nemocní byli randomizováni v poměru 4 : 2 : 1 k léčbě bimekizumabem v dávce 320 mg aplikované každé 4 týdny (n = 321), ustekinumabem v dávce 45 mg nebo 90 mg (základní dávkování závislé na hmotnosti) v týdnech 0 a 4, poté každých 12 týdnů (n = 163) nebo k podávání placeba každé 4 týdny (n = 83). V 16. týdnu přešli pacienti dostávající placebo na léčbu bimekizumabem (320 mg každé 4 týdny). Všechny studijní medikace byly aplikovány jako dvě subkutánní injekce.
Jako primární cílové ukazatele byly zvoleny podíl pacientů s 90% zlepšením PASI (PASI 90) a podíl pacientů se skóre IGA 0 nebo 1 („čistá“ nebo „téměř čistá“ kůže) v týdnu 16.
V týdnu 16 dosáhlo PASI 90 85 %
(273 z 321) pacientů ve skupině s bimekizumabem
oproti 50 % (81 ze 163) pacientů ve skupině
s ustekinumabem a 5 % (4 z 83) pacientů ve skupině
s placebem. V týdnu 16 byla odpověď dle skóre IGA 0–1
zaznamenána u 270 (84 %) pacientů ve skupině
s bimekizumabem oproti 87 (53 %) pacientů ve skupině
s ustekinumabem a čtyřem (5 %) pacientům ve skupině
s placebem (p < 0,0001 pro obě srovnání).
V 52. týdnu sledování dosáhli pacienti léčení
bimekizumabem významně vyšší míry odpovědi na léčbu
v porovnání s ustekinumabem (graf 1).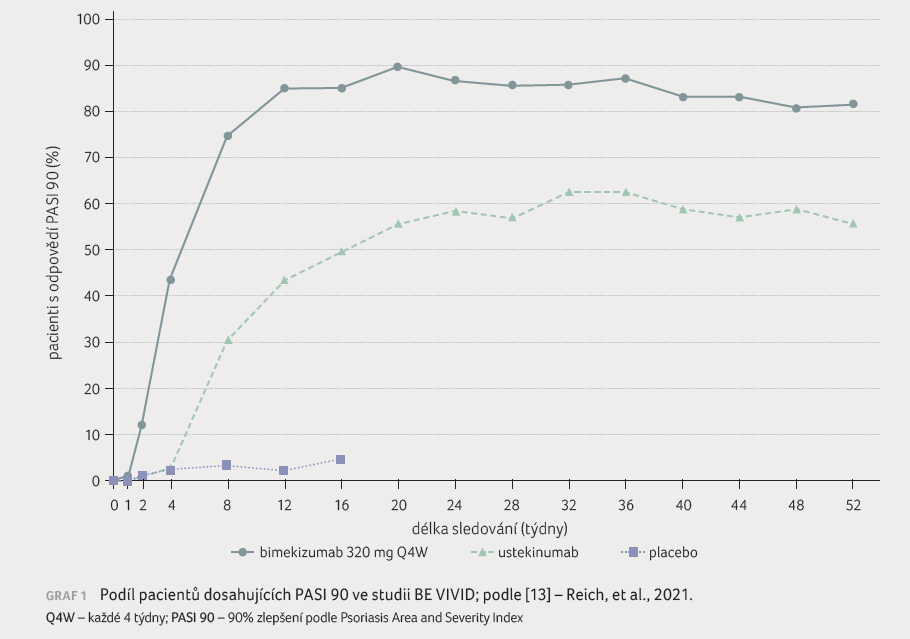
Během 52 týdnů byly závažné nežádoucí účinky související s léčbou hlášeny u 6 % (24 z 395) pacientů ve skupině s bimekizumabem (včetně těch, kteří přešli ze skupiny placeba v týdnu 16) a u 8 % (13 ze 163) pacientů ve skupině s ustekinumabem.
Studie BE READY
BE READY (NCT0341099217) [14] byla multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III, která probíhala na 77 místech v devíti zemích Asie, Austrálie, Evropy a Severní Ameriky. BE READY zkoumala účinnost a bezpečnost podávání bimekizumabu u dospělých pacientů se středně těžkou až těžkou ložiskovou psoriázou po dobu 56 týdnů. Zařazeno bylo celkem 435 pacientů, kteří byli randomizováni v poměru 4 : 1 do skupiny s bimekizumabem (320 mg aplikovaných každé 4 týdny) nebo do skupiny s placebem. Jako (ko)primární cílové ukazatele byly opět zvoleny podíl pacientů s PASI 90 a se skóre IGA 0 nebo 1 v týdnu 16.
Klinické hodnocení sledovalo také efekt odnětí léčby a dvě dávkovací schémata udržovací léčby. Z tohoto důvodu byli pacienti léčení bimekizumabem, kteří v týdnu 16 dosáhli PASI 90, přerozděleni v poměru 1 : 1 : 1 k podávání 320 mg bimekizumabu každé 4 týdny, každých 8 týdnů nebo k aplikaci placeba a v období 16.–56. týdne dále sledováni.
Léčba bimekizumabem prokázala vysokou míru odpovědi, která přetrvávala po celou dobu sledování v obou dávkovacích schématech. V 16. týdnu dosáhlo PASI 90 dokonce 91 % (317 z 349) pacientů užívajících bimekizumab 320 mg každé 4 týdny ve srovnání s 1 % (1 z 86) pacientů užívajících placebo, skóre IGA 0 nebo 1 bylo doloženo u 93 % (323 z 349) pacientů užívajících bimekizumab 320 mg každé 4 týdny oproti 1 % (1 z 86) pacientů z placebové skupiny.
Efekt léčby, resp. jejího odnětí
v rámci 40týdenního období, kdy byli pacienti s odpovědí
PASI 90 v 16. týdnu znovu randomizováni, popisuje graf 2. Medián doby do relapsu, který byl definován jako
ztráta odpovědi PASI 75 (75% zlepšení PASI), byl přibližně 32
týdnů po poslední dávce bimekizumabu. Při znovuzahájení
léčby bimekizumabem dosáhlo odpovědi PASI 90 opět 88,1 %
pacientů [7].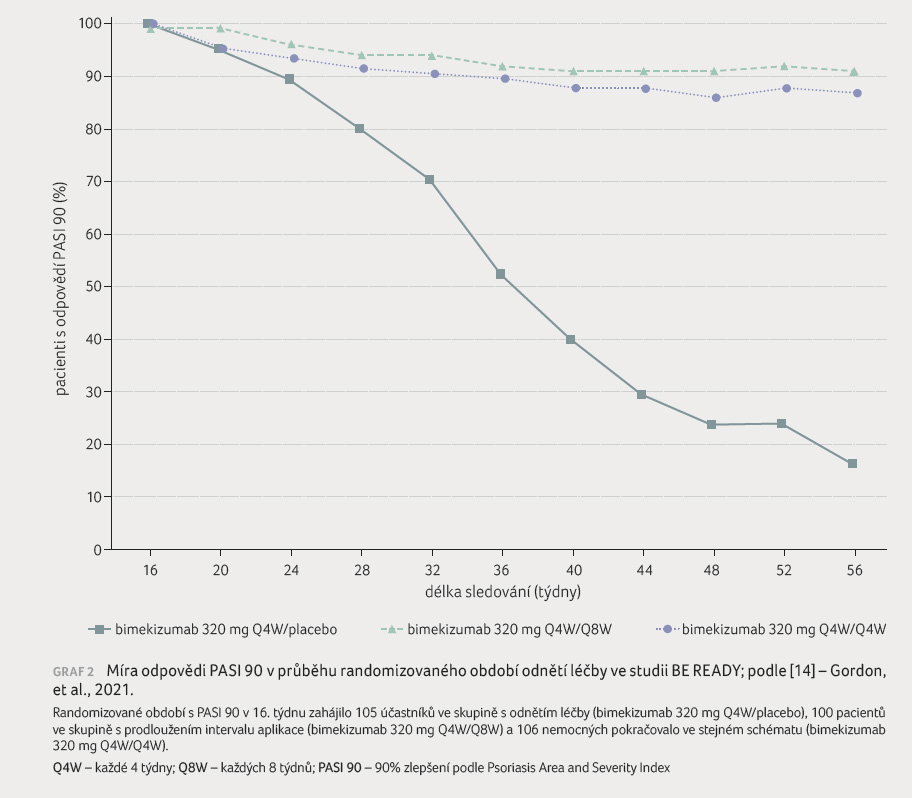
Nežádoucí účinky související s léčbou byly v počátečním léčebném období (do 16. týdne) hlášeny u 61 % (213 z 349) pacientů užívajících bimekizumab 320 mg každé 4 týdny a u 41 % (35 z 86) pacientů užívajících placebo. Od týdne 16 do týdne 56 byly nežádoucí účinky související s léčbou zaznamenány u 74 % (78 ze 106) pacientů užívajících bimekizumab 320 mg každé 4 týdny, u 77 % (77 ze 100) pacientů užívajících bimekizumab 320 mg každých 8 týdnů a u 69 % (72 ze 105) pacientů užívajících placebo.
Studie BE SURE
BE SURE (NCT0341274718) [15], multicentrická 56týdenní dvojitě zaslepená studie fáze III, porovnávala účinnost bimekizumabu s adalimumabem u 478 pacientů se středně těžkou až těžkou ložiskovou psoriázou. Pacienti byli randomizováni v poměru 1 : 1 : 1 k subkutánnímu podávání bimekizumabu v dávce 320 mg každé 4 týdny po dobu 56 týdnů (n = 158); bimekizumabu v dávce 320 mg každé 4 týdny po dobu 16 týdnů a poté 16.–56. týden v intervalu 8 týdnů (n = 161); nebo k aplikaci subkutánního adalimumabu v dávce 40 mg každé 2 týdny po dobu 24 týdnů následovaného bimekizumabem v dávce 320 mg každé 4 týdny do týdne 56 (n = 159). Jako primární cílové ukazatele hodnocené v týdnu 16 byly zvoleny opět podíl pacientů s PASI 90, dále odpověď PASI v rozmezí 0–72 dle závažnosti onemocnění a podíl pacientů se skóre IGA 0 nebo 1.
V týdnu 16 bylo odpovědi PASI 90 dosaženo u 275 z 319 (86,2 %) pacientů, kteří dostávali bimekizumab (obě dávkovací schémata dohromady) a u 75 ze 159 (47,2 %) pacientů, kteří dostávali adalimumab. Skóre IGA 0 nebo 1 bylo zaznamenáno u 272 z 319 (85,3 %) pacientů, kteří dostávali bimekizumab, a u 91 ze 159 (57,2 %) pacientů, kteří dostávali adalimumab. Vývoj dosažení odpovědi PASI 90 v průběhu 56 týdnů sledování zaznamenává graf 3. Ve prospěch bimekizumabu dopadly i výsledky srovnání dalších parametrů účinnosti v průběhu sledování.
Co se týče bezpečnosti, nežádoucí
příhody se do 24. týdne vyskytly u 112 ze 158
(70,9 %) pacientů přiřazených k podávání bimekizumabu
s aplikací každé 4 týdny, u 116 ze 161 (72,0 %)
pacientů ve skupině s bimekizumabem podávaným každé 4
týdny a poté každých 8 týdnů a u 111 ze 159
(69,8 %) nemocných ze skupiny adalimumabu. U pacientů
léčených bimekizumabem se v tomto období častěji
vyskytovaly orální kandidóza a průjem. K přerušení
léčby kvůli nežádoucím účinkům došlo u tří ze 158
pacientů (1,9 %) ze skupiny bimekizumabu podávaného každé
4 týdny, u šesti ze 161 (3,7 %) pacientů
s bimekizumabem podávaným každé 4 týdny a poté
každých 8 týdnů a u pěti ze 159 (3,1 %)
pacientů přiřazených k podávání adalimumabu.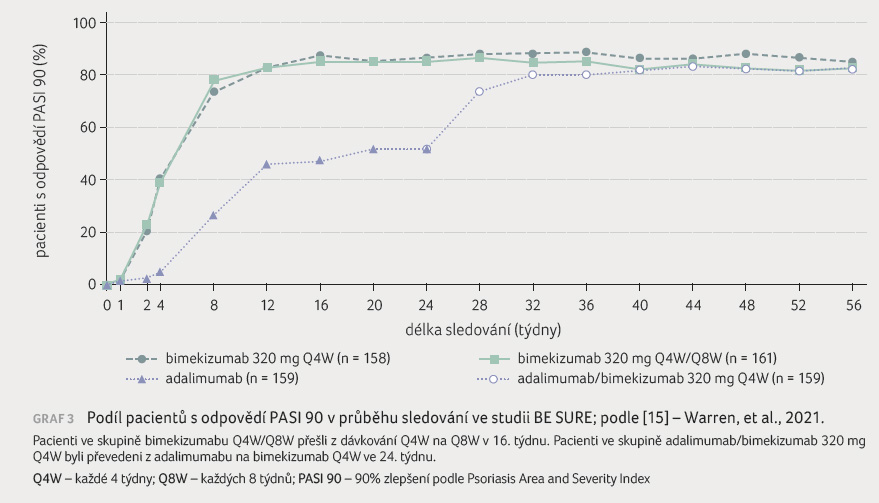
Ve 24.–56. týdnu hodnocení se nežádoucí příhody vyskytly u 101 ze 152 (66,4 %) pacientů s léčbou bimekizumabem podávaným každé 4 týdny, u 104 ze 149 (69,8 %) pacientů s bimekizumabem aplikovaným každé 4 týdny a poté každých 8 týdnů a u 111 ze 149 (74,5 %) pacientů přiřazených do skupiny adalimumabu, kteří v týdnu 24 přešli na podávání bimekizumabu s aplikací v intervalu 4 týdnů.
V průběhu 56týdenního sledování se vyskytlo 76 případů orální kandidózy u pacientů léčených bimekizumabem, přičemž 36 z nich bylo hodnoceno jako středně těžké a dva jako závažné; žádný z případů orální kandidózy nevedl k přerušení účasti ve studii. Z ostatních sledovaných nežádoucích příhod nebyly u pacientů léčených bimekizumabem zaznamenány žádné případy závažných nežádoucích kardiovaskulárních příhod, domnělých sebevražedných myšlenek nebo chování, zánětlivého onemocnění střev, závažných reakcí z přecitlivělosti nebo aktivní TBC. Výskyt závažných infekcí byl ve všech léčebných skupinách podobný.
Studie BE RADIANT
Do studie fáze IIIb BE RADIANT (NCT0341986) [12] bylo zařazeno celkem 743 dospělých pacientů se středně těžkou až těžkou ložiskovou psoriázou. Nemocní byli randomizováni v poměru 1 : 1 do skupiny léčené bimekizumabem podávaným v dávce 320 mg každé 4 týdny (n = 373) a do skupiny s léčbou sekukinumabem podávaným v dávce 300 mg týdně první 4 týdny a následně každé 4 týdny (n = 370). V týdnu 16 podstoupili pacienti užívající bimekizumab rerandomizaci v poměru 1 : 2, aby do týdne 48 dostávali udržovací dávku každé 4 týdny nebo každých 8 týdnů. Jako primární cílový ukazatel byla stanovena 100% redukce skóre PASI (PASI 100) od počáteční hodnoty v 16. týdnu.
V 16. týdnu dosáhlo PASI 100 celkem 230 (61,7 %) pacientů ve skupině s bimekizumabem a 181 (48,9 %) pacientů ve skupině se sekukinumabem. Bimekizumab se ukázal jako non inferiorní a superiorní oproti sekukinumabu (p < 0,001 pro non inferioritu a superioritu). Ve 48. týdnu léčby mělo odpověď PASI 100 celkem 250 (67,0 %) pacientů léčených bimekizumabem a 171 (46,2 %) pacientů léčených sekukinumabem.
Podávání bimekizumabu bylo asociováno s výskytem orální kandidózy (převážně mírné nebo středně závažné). Ve skupině s léčbou bimekizumabem se vyskytla u 72 (19,3 %) pacientů oproti 11 (3,0 %) pacientům ve skupině s léčbou sekukinumabem.
Kontraindikace
Kontraindikacemi léčby bimekizumabem jsou hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku a klinicky významná aktivní infekce.
Při podávání bimekizumabu byly hlášeny nové případy nebo exacerbace zánětlivého střevního onemocnění, proto se léčba bimekizumabem nedoporučuje rovněž u pacientů se zánětlivým onemocněním střev. V případě, že se u pacienta vyskytnou známky a příznaky zánětlivého střevního onemocnění nebo dojde k exacerbaci již existujícího zánětlivého střevního onemocnění, je třeba podávání bimekizumabu přerušit [7].
Nežádoucí účinky
Klinická hodnocení fáze III, v nichž
byl bimekizumab porovnáván s placebem, ustekinumabem,
adalimumabem a sekukinumabem, nepřinesla žádné neočekávané
bezpečnostní signály. Nejčastěji hlášenými nežádoucími
účinky ve studiích byly infekce horních cest dýchacích
(14,5 %, nejčastěji nazofaryngitida) a orální kandidóza
(7,3 %), což odpovídá mechanismu účinku [7]. Přehledně uvádí
seznam nežádoucích účinků tabulka 1.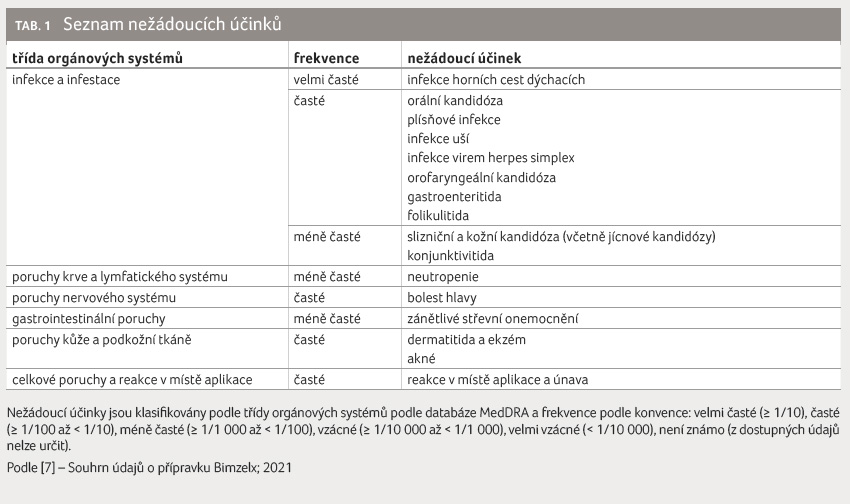
Většina infekcí sestávala z nezávažných mírných až středně závažných infekcí horních cest dýchacích. Během celého léčebného období klinického hodnocení fáze III byly infekce hlášeny u 63,2 % pacientů léčených bimekizumabem (120,4/100 pacientoroků). Závažné infekce byly hlášeny u 1,5 % pacientů léčených bimekizumabem (1,6/100 pacientoroků).
Neutropenie pozorovaná během celého klinického hodnocení fáze III byla ve většině případů přechodná a nevyžadovala ukončení léčby. Neutropenie stupně 3/4 byla pozorována u 1 % pacientů [7].
Přibližně 45 % pacientů léčených bimekizumabem při doporučeném režimu dávkování (320 mg každé 4 týdny až do 16. týdne a poté 320 mg každých 8 týdnů) vyvinulo protilátky proti bimekizumabu. U přibližně 34 % pacientů (16 % všech pacientů léčených bimekizumabem) se jednalo o protilátky klasifikované jako neutralizující. S jejich tvorbou nicméně nebyl spojen žádný důkaz o změněné klinické odpovědi nebo snášenlivosti [7].
Z hlediska věku byl během klinického hodnocení u pacientů ve věkové skupině ≥ 65 let zaznamenán vyšší výskyt orální kandidózy, dermatitidy a ekzému, proto se během léčby bimekizumabem jeví u starších pacientů výskyt těchto nežádoucích účinků jako pravděpodobnější [7].
Interakce
Studie interakcí nebyly provedeny.
Bylo doloženo, že zvýšené koncentrace cytokinů během chronického zánětu potlačují aktivitu cytochromů P450 (CYP450) [16]. Zánět modulující aktivitu CYP450 tak může ovlivnit farmakokinetiku léčiv. Z tohoto důvodu nelze vyloučit, že léčba vedoucí k potlačení zánětu a normalizaci aktivity CYP450 neovlivní nepřímo expozici přípravkům, které jsou cestou CYP450 metabolizovány. U léčiv s úzkým terapeutickým indexem (např. warfarin) je proto doporučováno zvážit terapeutické monitorování [7].
Těhotenství a kojení
Podávání bimekizumabu v těhotenství se z preventivních důvodů nedoporučuje. Studie na zvířatech nenaznačují přímé ani nepřímé škodlivé účinky na těhotenství, embryonální/fetální vývoj, porod nebo postnatální vývoj, ale údaje o podávání bimekizumabu těhotným ženám jsou omezené. Ženy ve fertilním věku musejí během léčby a ještě nejméně 17 týdnů po ukončení léčby používat účinnou antikoncepci.
Není známo, jestli se bimekizumab vylučuje do lidského mateřského mléka, proto nelze vyloučit riziko pro kojence. Vždy je na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku nutné rozhodnout, zda přerušit kojení, nebo ukončit/přerušit léčbu [7].
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Takeshita J, Grewal S, Langan SM, et al. Psoriasis and comorbid diseases: Epidemiology. J Am Acad Dermatol 2017; 76: 377–390.
- [2] Johansen C, Usher PA, Kjellerup RB, et al. Characterization of the interleukin‑17 isoforms and receptors in lesional psoriatic skin. Br J Dermatol 2009; 160: 319–324.
- [3] Martin DA, Towne JE, Kricorian G, et al. The emerging role of IL‑17 in the pathogenesis of psoriasis: preclinical and clinical findings. J Invest Dermatol 2013; 133: 17–26.
- [4] Adams R, Maroof A, Baker T, et al. Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL‑17A and IL‑17F. Front Immunol 2020. Dostupné na: https://doi.org/10.3389/fimmu.2020.01894
- [5] Iznardo H. Puig L. Dual inhibition of IL‑17A and IL‑17F in psoriatic disease. Ther Adv Chronic Dis 2021; 12: 1–16.
- [6] Ishigame H, Kakuta S, Nagai T, et al. Differential Roles of Interleukin‑17A and ‑17F in Host Defense against Mucoepithelial Bacterial Infection and Allergic Responses. Immunity 2009; 30: 108–119.
- [7] Souhrn údajů o přípravku Bimzelx. Dostupné na: https://www.sukl.cz (navštíveno 2. 5. 2022)
- [8] Adams R, Maroof A, Baker T, et al. Bimekizumab, a novel humanized IgG1 antibody that neutralizes both IL‑17A and IL‑17F. Front Immunol 2020; 11: 1894.
- [9] Chang SH, Dong C. A novel heterodimeric cytokine consisting of IL‑17 and IL‑17F regulates inflammatory responses. Cell Res 2007; 17: 435–440.
- [10] Freitas E, Blauvelt A, Torres T. Bimekizumab for the Treatment of Psoriasis. Drugs 2021; 81: 1751–1762.
- [11] Freitas E, Torres T. Bimekizumab: the new drug in the biologics armamentarium for psoriasis. Drugs Context 2021; 10: 2021‑4‑1.
- [12] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021; 385: 142–152.
- [13] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487–498.
- [14] Gordon KB, Foley P, Krueger JG, et al. Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double‑blind, placebo‑controlled, randomised withdrawal phase 3 trial. Lancet 2021; 397: 475–486.
- [15] Warren RB, Blauvelt A, Bagel J, et al. Bimekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med 2021; 385: 130–141.
- [16] Lenoir C, Rollason V, Desmeules JA, Samer CF. Influence of Inflammation on Cytochromes P450 Activity in Adults: A Systematic Review of the Literature. Front Pharmacol 2021; 12: 733935.