Boceprevir
Boceprevir je novým přímo působícím antivirotikem, inhibitorem HCV NS3 proteázy, a je určen k léčbě dospělých pacientů s chronickou hepatitidou C infikovaných genotypem viru 1. Článek uvádí základní údaje o mechanismu účinku léku a jeho farmakokinetických vlastnostech. Shrnuty jsou dosavadní zkušenosti ze studií fáze III získané jak od dosud neléčených pacientů, tak od pacientů, u kterých předchozí léčba peginterferonem α a ribavirinem selhala. Výsledky studií jednoznačně prokazují významně vyšší účinnost u nemocných léčených trojkombinací s boceprevirem u obou výše zmíněných skupin pacientů. Dále je diskutován bezpečnostní profil léku, hlavní nežádoucí účinky a lékové interakce. Vzhledem k rozdílům v délce léčby podle dosažené virologické odpovědi jsou rovněž prezentována léčebná schémata pro vybrané skupiny pacientů.
Úvod
V posledních deseti letech bylo standardem léčby chronické HCV (hepatitis C virus) infekce podávání kombinace peginterferonu α (PEG-IFN-α) a ribavirinu (RBV) [1]. Díky detailní znalosti virové kinetiky ve smyslu rychlosti poklesu viremie po zahájení léčby bylo možno předpovídat úspěšnost léčby, u některých pacientů pak bylo možné léčbu zkrátit na 24 týdnů [2]. U většiny pacientů s genotypem 1 však zůstala 48týdenní léčba PEG-IFN-α a RBV standardní terapií, s úspěšností 40–45 % [3, 4].
Kombinace PEG-IFN-α a RBV (PEG-IFN/RBV) vede k eradikaci HCV infekce přibližně u poloviny léčených nemocných, hůře léčitelní jsou zejména pacienti s genotypem 1, jehož prevalence mezi HCV infikovanými pacienty v České republice dosahuje bohužel 90 %. Za kompletní eradikaci viru se považuje trvale negativní viremie (nedetekovatelná ribonukleová kyselina viru – HCV RNA) docílená léčbou, setrvalost virologické odpovědi se hodnotí 24 týdnů po léčbě, vyléčení je proto označováno jako dosažení setrvalé virologické odpovědi (SVR) [1, 5].
Přelomem v éře léčby PEG-IFN/RBV se stal objev skupiny jednonukleotidových polymorfismů (SNP) v oblasti genu pro interleukin 28B na 19. chromozomu, který kóduje interferon λ3 (IL-28B). Genotyp nejčastěji zmiňovaného a klinicky užívaného SNP rs 12979860 je v současnosti nejsilnějším prediktivním faktorem dosažení SVR známým ještě před léčbou, zejména u pacientů infikovaných genotypem HCV 1. Díky schopnosti predikce SVR (69 % SVR u pacientů s genotypem CC, 27–33 % u pacientů s genotypy CT a TT léčených PEG-IFN/RBV) se stalo vyšetření genotypu IL-28B důležitým pro plánování léčby, zejména u obtížně léčitelných nemocných [6, 7].
Významným pokrokem v léčbě HCV infekce je zavedení přímo působících antivirotik (DAA, direct-acting antivirals) do léčebných protokolů. Pokroky v pochopení struktury viru a jeho replikace umožnily vývoj molekul, které přímo inhibují enzymy viru HCV nezbytné pro jeho replikaci. Zatímco PEG-IFN-α a RBV mají pouze nespecifický protivirový účinek, DAA působí přímo na kódující proteiny viru, jako jsou serinová proteáza NS3/4A, NS5B RNA-dependentní RNA polymeráza a NS4B a NS3 helikázové proteiny. Dva první inhibitory serinové proteázy, boceprevir (BOC) a telaprevir, byly v roce 2011 registrovány k léčbě HCV infekce u pacientů infikovaných genotypem 1 v USA a zemích EU.
Farmakologická skupina
Jak již bylo zmíněno, BOC řadíme mezi přímo působící antivirotika (DAA), ATC kód J05AE.
Mechanismus účinku, farmakodynamika
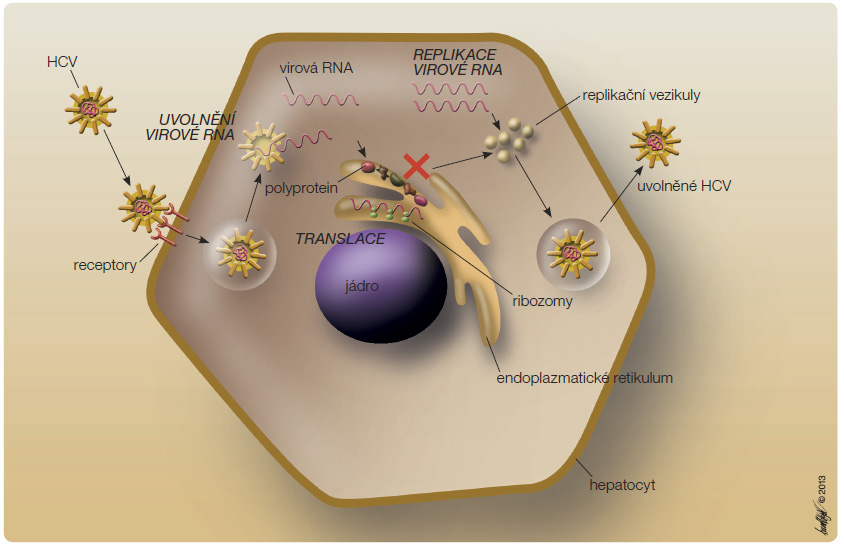 BOC je inhibitor HCV NS3 proteázy. Váže se kovalentně, ale reverzibilně na její aktivní místo pomocí α-ketoamidové funkční skupiny, tím přerušuje štěpení polyproteinu a tak inhibuje virový replikační proces (obr. 1) [8, 9]. Kombinovaná terapie BOC + PEG-IFN-α + RBV tak působí přímo proti replikaci HCV a zároveň stimuluje hostitelskou imunitní reakci proti viru.
BOC je inhibitor HCV NS3 proteázy. Váže se kovalentně, ale reverzibilně na její aktivní místo pomocí α-ketoamidové funkční skupiny, tím přerušuje štěpení polyproteinu a tak inhibuje virový replikační proces (obr. 1) [8, 9]. Kombinovaná terapie BOC + PEG-IFN-α + RBV tak působí přímo proti replikaci HCV a zároveň stimuluje hostitelskou imunitní reakci proti viru.
Farmakokinetické vlastnosti
Po perorálním podání spolu s jídlem se BOC u zdravých lidí absorboval s dosažením maximálních plazmatických koncentrací (tmax) v průměru za dvě hodiny. Ustáleného stavu (steady state) bylo při dávkování třikrát denně dosaženo po přibližně jednom dni. BOC by se měl užívat společně s jídlem, které zvýší jeho účinnost o přibližně 40–60 % v porovnání s užitím nalačno – a to bez ohledu na to, zda se podává s nízkotučným nebo vysokotučným jídlem, zda se užívá před jídlem, v jeho průběhu nebo po jídle. Ideální je užít BOC s hlavním jídlem, dostačující je však i malá svačina, jako např. ovoce nebo sušenky.
U zdravých subjektů, kterým byl podáván BOC třikrát denně samostatně, byla expozice BOC charakterizována AUC(0–t) 6147 ng·hod/ml, cmax 1913 ng/ml a cmin 90 ng/ml. Výsledky farmakokinetických studií byly u zdravých jedinců a jedinců s HCV infekcí podobné.
BOC má průměrný distribuční objem přibližně 772 l v ustáleném stavu. Vazba na lidské plazmatické proteiny je přibližně 75 % po podání jedné dávky léku (800 mg) [10].
BOC je metabolizován primárně aldoketoreduktázou a mění se na metabolity – redukované ketony, které nejsou proti HCV účinné [11]. BOC podléhá také v menší míře oxidativnímu metabolismu zprostředkovanému CYP3A4/5 [12].
Průměrný plazmatický poločas vylučování BOC (t1/2) je přibližně 3,4 hodiny. BOC je vylučován primárně játry, přibližně 79 % dávky je vyloučeno stolicí a 9 % močí.
U pacientů s jaterním poškozením nebyly shledány klinicky významné rozdíly farmakokinetických parametrů, rovněž u pacientů s jakýmkoliv stupněm poškození ledvin není nutná úprava dávkování. Rasa, věk ani pohlaví nemá vliv na farmakokinetiku BOC.
Klinické zkušenosti
Přidání BOC ke standardní dvojkombinaci zvýší počet SVR u dosud neléčených nemocných (tzv. naivní pacienti) na 70–80 % [13]. BOC je rovněž vysoce účinný u pacientů, u kterých předchozí standardní léčba PEG-IFN/RBV selhala (tzv. relapséři, non-respondenti).
Klinické studie fáze II a III, na jejichž základě byl BOC registrován, byly prováděny proti placebu v kombinaci se standardní léčbou PEG-IFN/RBV. Před registrací BOC k léčbě HCV infikovaných nemocných s genotypem 1 byly provedeny dvě klinické studie fáze III.
SPRINT-2 byla randomizovaná, placebem kontrolovaná studie s naivními pacienty, která srovnávala tzv. RGT (Response-Guided Therapy), kdy celková délka léčby závisí na dosažené virologické odpovědi v 8. týdnu léčby, s fixní 48týdenní léčbou [14]. Pacienti byli randomizováni do 48týdenní větve, která po tzv. lead-in fázi trvající 4 týdny pokračovala 44 týdnů léčbou trojkombinací BOC/PEG-IFN/RBV, nebo do větve RGT, kdy po 4 týdnech lead-in fáze n![Graf 1 Účinnost bocepreviru (dosažené setrvalé virologické odpovědi vyjádřené v procentech) v klinické studii fáze III SPRINT-2 dle genotypu IL-28B; podle [14] – Poordad, 2011. BPR RGT – boceprevir, peginterferon α a ribavirin: response guided therapy; B44PR48 – boceprevir, peginterferon α a ribavirin: fixní doba léčby 48 týdnů; n/N – počet pacientů se setrvalou virologickou odpovědí/celkový počet pacientů v této skupině; PR48 – peginterferon α a ribavirin: kontrolní větev, 48 týdnů léčby; SVR – setrvalá virologická odpověď](https://www.remedia.cz/photo-a-29084---.jpg) ásledovalo 24 týdnů léčby trojkombinací BOC/PEG-IFN/RBV. Pacienti, kteří v RGT větvi dosáhli rychlé virologické odpovědi (RVR; v tomto případě negativní viremie ve 4. týdnu po přidání BOC, celkově 8. týden léčby včetně lead-in fáze) a měli nedetekovatelnou HCV RNA až do týdne 24, byli léčeni celkem 28 týdnů (4 týdny PEG-IFN/RBV a 24 týdnů trojkombinací BOC/PEG-IFN/RBV). Pacienti, kteří dosáhli negativity HCV RNA za více než 4 týdny po přidání BOC, ale před týdnem 24, byli léčeni dalších 20 týdnů PEG-IFN/RBV, celkově tedy 48 týdnů. Frekvence SVR dosažených v RGT větvi byla shodná se SVR dosaženými pomocí 48týdenní terapie (70 % vs. 71 %). Pacienti, kteří dosáhli RVR, dosáhli SVR v 96 % případů při terapii trvající 28 týdnů. Pacienti, kteří RVR nedosáhli, ale přesto dosáhli negativní HCV RNA až po 8. týdnu léčby (4 týdny po přidání BOC), dosáhli v 70 % SVR, pokud byli léčeni 48 týdnů. Ze studie SPRINT-2 vyplývá, že délka léčby má být modifikována dle principů RGT, neboť přibližně 60 % léčených pacientů dosáhne negativní HCV RNA po 4 týdnech trojkombinační léčby BOC/PEG-IFN/RBV a zkrácená léčba tak pro ně může být přínosem (graf 1).
ásledovalo 24 týdnů léčby trojkombinací BOC/PEG-IFN/RBV. Pacienti, kteří v RGT větvi dosáhli rychlé virologické odpovědi (RVR; v tomto případě negativní viremie ve 4. týdnu po přidání BOC, celkově 8. týden léčby včetně lead-in fáze) a měli nedetekovatelnou HCV RNA až do týdne 24, byli léčeni celkem 28 týdnů (4 týdny PEG-IFN/RBV a 24 týdnů trojkombinací BOC/PEG-IFN/RBV). Pacienti, kteří dosáhli negativity HCV RNA za více než 4 týdny po přidání BOC, ale před týdnem 24, byli léčeni dalších 20 týdnů PEG-IFN/RBV, celkově tedy 48 týdnů. Frekvence SVR dosažených v RGT větvi byla shodná se SVR dosaženými pomocí 48týdenní terapie (70 % vs. 71 %). Pacienti, kteří dosáhli RVR, dosáhli SVR v 96 % případů při terapii trvající 28 týdnů. Pacienti, kteří RVR nedosáhli, ale přesto dosáhli negativní HCV RNA až po 8. týdnu léčby (4 týdny po přidání BOC), dosáhli v 70 % SVR, pokud byli léčeni 48 týdnů. Ze studie SPRINT-2 vyplývá, že délka léčby má být modifikována dle principů RGT, neboť přibližně 60 % léčených pacientů dosáhne negativní HCV RNA po 4 týdnech trojkombinační léčby BOC/PEG-IFN/RBV a zkrácená léčba tak pro ně může být přínosem (graf 1).
![Graf 2 Účinnost bocepreviru (dosažené setrvalé virologické odpovědi vyjádřené v procentech) v klinické studii fáze III RESPOND-2 dle genotypu IL-28B; podle [15] – Bacon, et al., 2011. BPR RGT – boceprevir, peginterferon α a ribavirin: response guided therapy; B44PR48 – boceprevir, peginterferon α a ribavirin: fixní doba léčby 48 týdnů; n/N – počet pacientů se setrvalou virologickou odpovědí/celkový počet pacientů v této skupině; PR48 – peginterferon α a ribavirin: kontrolní větev, 48 týdnů léčby; SVR – setrvalá virologická odpověď](https://www.remedia.cz/photo-a-29085---.jpg) Randomizovaná, placebem kontrolovaná studie RESPOND-2 sledovala účinnost léčby BOC v kombinaci s PEG-IFN/RBV u pacientů dříve léčených (relapsérů a parciálních respondentů) s cílem zhodnotit efektivitu RGT u této skupiny nemocných [15]. Ačkoliv pacienti, kteří byli v předchozí léčbě označeni jako non-respondenti, nebyli do studie zařazeni, významnou část tvořili ti, kteří v lead-in fázi dosáhli poklesu viremie < 1 log10 oproti výchozí viremii, a chovali se tedy jako non-respondenti. Pacienti byli randomizováni buď do fixní větve trvající 48 týdnů (4 týdny lead-in fáze, 44 týdnů BOC/PEG-IFN/RBV) nebo do větve RGT (dle dosažené virologické odpovědi v průběhu léčby). Pacienti v RGT větvi po 4týdenní lead-in fázi dostávali 32 týdnů trojkombinaci BOC/PEG-IFN/RBV. Pacienti, kteří dosáhli RVR (negativní HCV RNA 4 týdny od přidání BOC, 8 týdnů od začátku léčby) a měli negativní HCV RNA až do 24. týdne, byli léčeni celkem 36 týdnů (4 týdny lead-in, 32 týdnů BOC/PEG-IFN/RBV). Pacienti, u kterých byla zjištěna negativita HCV RNA později než za 4 týdny po přidání BOC, byli léčeni ještě dalších 12 týdnů PEG-IFN/RBV, celková doba léčby tedy činila 48 týdnů (4 týdny lead-in, 32 týdnů BOC/PEG-IFN/RBV a 12 týdnů PEG-IFN/RBV). Non-respondenti v předchozí léčbě dosáhli SVR v 72 % případů. Pacienti, kteří reagovali na PEG-IFN-α a měli během lead-in fáze pokles HCV RNA oproti výchozí viremii > 1 log10, dosáhli SVR v 76 %. Pacienti, u kterých byl pokles HCV RNA v průběhu lead-in fáze < 1 log10, dosáhli SVR v 32 %. Ve studii nebyl zaznamenán signifikantní rozdíl v účinnosti léčby při fixním trvání terapie oproti RGT přístupu. Pacienti, kteří při RGT dosáhli RVR, dosáhli SVR v 88 % případů i při zkrácené léčbě. Pacienti, kteří RVR nedosáhli, ale dosáhli HCV RNA negativity po 8. týdnu léčby, dosáhli SVR v 75 % případů, pokud byli léčeni 48 týdnů. Studie RESPOND-2 prokázala, že i dříve neúspěšně léčení pacienti mohou být léčeni podle dosažené virologické odpovědi (RGT), viz graf 2.
Randomizovaná, placebem kontrolovaná studie RESPOND-2 sledovala účinnost léčby BOC v kombinaci s PEG-IFN/RBV u pacientů dříve léčených (relapsérů a parciálních respondentů) s cílem zhodnotit efektivitu RGT u této skupiny nemocných [15]. Ačkoliv pacienti, kteří byli v předchozí léčbě označeni jako non-respondenti, nebyli do studie zařazeni, významnou část tvořili ti, kteří v lead-in fázi dosáhli poklesu viremie < 1 log10 oproti výchozí viremii, a chovali se tedy jako non-respondenti. Pacienti byli randomizováni buď do fixní větve trvající 48 týdnů (4 týdny lead-in fáze, 44 týdnů BOC/PEG-IFN/RBV) nebo do větve RGT (dle dosažené virologické odpovědi v průběhu léčby). Pacienti v RGT větvi po 4týdenní lead-in fázi dostávali 32 týdnů trojkombinaci BOC/PEG-IFN/RBV. Pacienti, kteří dosáhli RVR (negativní HCV RNA 4 týdny od přidání BOC, 8 týdnů od začátku léčby) a měli negativní HCV RNA až do 24. týdne, byli léčeni celkem 36 týdnů (4 týdny lead-in, 32 týdnů BOC/PEG-IFN/RBV). Pacienti, u kterých byla zjištěna negativita HCV RNA později než za 4 týdny po přidání BOC, byli léčeni ještě dalších 12 týdnů PEG-IFN/RBV, celková doba léčby tedy činila 48 týdnů (4 týdny lead-in, 32 týdnů BOC/PEG-IFN/RBV a 12 týdnů PEG-IFN/RBV). Non-respondenti v předchozí léčbě dosáhli SVR v 72 % případů. Pacienti, kteří reagovali na PEG-IFN-α a měli během lead-in fáze pokles HCV RNA oproti výchozí viremii > 1 log10, dosáhli SVR v 76 %. Pacienti, u kterých byl pokles HCV RNA v průběhu lead-in fáze < 1 log10, dosáhli SVR v 32 %. Ve studii nebyl zaznamenán signifikantní rozdíl v účinnosti léčby při fixním trvání terapie oproti RGT přístupu. Pacienti, kteří při RGT dosáhli RVR, dosáhli SVR v 88 % případů i při zkrácené léčbě. Pacienti, kteří RVR nedosáhli, ale dosáhli HCV RNA negativity po 8. týdnu léčby, dosáhli SVR v 75 % případů, pokud byli léčeni 48 týdnů. Studie RESPOND-2 prokázala, že i dříve neúspěšně léčení pacienti mohou být léčeni podle dosažené virologické odpovědi (RGT), viz graf 2.
Zařazení do současné palety léčiv
Dostupnost BOC a telapreviru, v současnosti jediných registrovaných DAA, je zcela zásadním pokrokem v léčbě chronické HCV infekce. Účinnost telapreviru a BOC proti sobě dosud přímo srovnávána nebyla, proto není v současné době možné říci, zda je jeden z nich účinnější. Srovnáním výsledků různých studií, vždy s lehce rozdílným uspořádáním, nalézáme u obou léků srovnatelnou účinnost [14–16].
Indikace
BOC je indikován k léčbě pacientů s chronickou hepatitidou C infikovaných genotypem viru 1 vždy v kombinaci s PEG-IFN-α a RBV, u dospělých pacientů s kompenzovaným jaterním onemocněním dříve neléčených (naivních) i u těch, u kterých selhala předchozí léčba dvojkombinací PEG-IFN/RBV [10].
Kontraindikace
BOC je kontraindikován u pacientů s hypersenzitivitou na léčivou látku nebo na kteroukoli pomocnou látku přípravku. BOC je kontraindikován u pacientů s autoimunní hepatitidou a u pacientů, kterým jsou současně podávány léky vysoce závislé na vylučování CYP3A4/5 a jejichž vyšší plazmatické koncentrace souvisejí se závažnými nebo život ohrožujícími stavy, jako je například perorálně podávaný midazolam a triazolam, bepridil, pimozid, lumefantrin, halofantrin, inhibitory tyrozinkinázy a námelové alkaloidy (dihydroergotamin, ergonovin, ergotamin, metylergonovin), viz rovněž odstavec Lékové interakce. Léčba BOC je kontraindikována také u pacientů, kteří mají kontraindikaci k dvojkombinační léčbě PEG-IFN/RBV [10].
Nežádoucí účinky
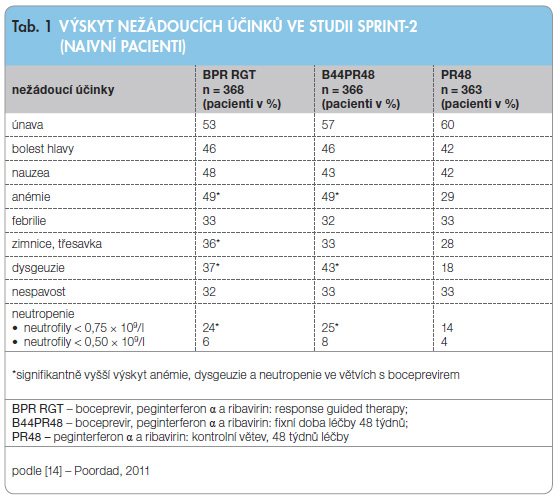 Nejčastějšími nežádoucími účinky popsanými ve studiích fáze III [14, 15] kombinované protivirové léčby s BOC byly anémie a dysgeuzie (porucha chuti – v tomto případě pocit kovové chuti v ústech s pocitem suchosti sliznic), ostatní nežádoucí účinky a jejich výskyt ve studii SPRINT-1 jsou prezentovány v tab. 1.
Nejčastějšími nežádoucími účinky popsanými ve studiích fáze III [14, 15] kombinované protivirové léčby s BOC byly anémie a dysgeuzie (porucha chuti – v tomto případě pocit kovové chuti v ústech s pocitem suchosti sliznic), ostatní nežádoucí účinky a jejich výskyt ve studii SPRINT-1 jsou prezentovány v tab. 1.
Výskyt anémie byl hlášen při léčbě již v týdnu 4, přidání BOC k dvojkombinaci PEG-IFN/RBV bylo spojeno s dalším poklesem koncentrace hemoglobinu, a to přibližně o 10 g/l oproti standardní léčbě dvojkombinací PEG-IFN/RBV. Přestože výskyt anémie byl velmi častý, ukončení léčby z důvodu závažné anémie bylo vzácné (v jednotlivých větvích studie SPRINT-2: BOC/PEG-IFN/RBV RGT – 6 pacientů; BOC44/PEG-IFN/RBV fixní 48týdenní léčba – 7 pacientů; PEG-IFN/RBV kontrolní větev 48týdenní léčby – 4 pacienti).
Přestože ve studiích SPRINT-2 a RESPOND-2 dostávalo 43 % pacientů erytropoetin k léčbě anémie, nebyl zaznamenán signifikantní rozdíl v dosažených SVR u pacientů, kterým byl pro anémii podáván erytropoetin, a u pacientů, u nichž byla kvůli anémii redukována dávka RBV, jak rovněž dokládá studie Poordadova (stejný počet dosažených SVR – 71 % – jak ve skupině se sníženou dávkou RBV, tak ve skupině pacientů léčených erytropoetinem) [17].
Jako rizikové faktory pro vznik anémie byly identifikovány vyšší věk, ženské pohlaví, nízký body mass index, porucha renálních funkcí, přítomnost jaterní cirhózy, HIV koinfekce a nepříznivý genotyp ITPA.
Dysgeuzie byla signifikantně častější v obou studiích fáze III, není však obvykle důvodem k přerušení léčby. Zlepšení lze dosáhnout úpravou jídelníčku – dle zkušeností pacientů se dysgeuzie zlepšuje při konzumaci kyselých nápojů a potravin, pomáhá rovněž máta.
Počet pacientů s neutropenií byl vyšší ve skupinách užívajících BOC ve srovnání s pacienty, kteří užívali pouze PEG-IFN/RBV. Významná trombocytopenie byla vzácná (1 %), riziko vzniku trombocytopenie bylo vyšší u pacientů s biopticky verifikovanou cirhózou.
Lékové interakce
BOC je silným inhibitorem CYP3A4/5. Expozice léčivům metabolizovaným primárně CYP3A4/5 se může při podávání s BOC zvyšovat, což může zvýšit nebo prodloužit jejich léčebné i nežádoucí účinky. BOC neinhibuje ani neindukuje jiné enzymy cytochromu P450, je částečně metabolizován CYP3A4/5. Současné podávání s léky, které indukují nebo inhibují CYP3A4/5, může zvýšit nebo snížit účinek BOC [18, 19]. BOC je proto kontraindikován při současném podávání s léky, jejichž vylučování je vysoce závislé na CYP3A4/5 a jejichž plazmatické koncentrace souvisejí se závažnými a/nebo život ohrožujícími příhodami: tyto látky zahrnují např. perorálně podávaný midazolam a triazolam, bepridil, pimozid, lumefantrin, halofantrin, inhibitory tyrozinkinázy a námelové alkaloidy.
BOC je primárně metabolizován aldoketoreduktázou, ve studiích zkoumajících interakce léčiv vedené s inhibitory aldoketoreduktázy diflunisalem a ibuprofenem se však expozice BOC nezvýšila na klinicky významné hodnoty, BOC může být tedy podáv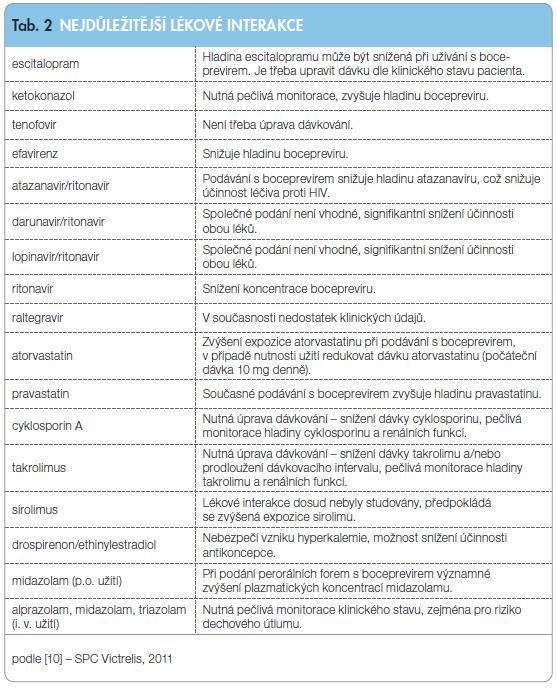 án spolu s inhibitory aldoketoreduktázy.
án spolu s inhibitory aldoketoreduktázy.
Současné podávání BOC s rifampicinem nebo antikonvulzivy, jako je fenytoin, fenobarbital nebo karbamazepin, může významně snížit plazmatickou expozici BOC, proto se podávání v kombinaci s těmito léky nedoporučuje.
Opatrnosti je rovněž třeba dbát u léků prodlužujících interval QT, jako jsou amiodaron, chinidin, methadon, pentamidin a některá neuroleptika. Klinicky nejvýznamnější lékové interakce jsou uvedeny v tab. 2 [10].
Těhotenství a kojení
BOC v kombinaci s PEG-IFN-α a RBV je kontraindikován u žen, které jsou těhotné, o použití BOC u těhotných žen nejsou žádné údaje. Léčení pacienti i pacientky a jejich partnerky a partneři musejí po dobu protivirové léčby trojkombinací BOC/PEG-IFN/RBV užívat dvě formy antikoncepce. Perorální hormonální antikoncepce může být neúčinná z důvodu možných lékových interakcí.
BOC a jeho metabolity se vylučují do mléka u potkanů, není známo, zda se BOC vylučuje do lidského mateřského mléka. Riziko pro novorozence nemůže být vyloučeno.
Údaje o účinku BOC na fertilitu u člověka nejsou dosud k dispozici [10].
Ovlivnění pozornosti
Léčba trojkombinací BOC/PEG-IFN/RBV může ovlivnit schopnost některých pacientů řídit motorová vozidla a obsluhovat stroje. Pacienti mají být informováni, že se u nich může vyskytnout zvýšená únava, závratě, synkopa, kolísání krevního tlaku a rozmazané vidění [10].
Dávkování a délka léčby
 Léčba BOC má být vedena lékařem, který má s léčbou pacientů s chronickou hepatitidou C zkušenosti. BOC musí být podáván výhradně v trojkombinaci s PEG-IFN-α a RBV. Oba jmenované léky se podávají v obvyklém dávkování pro pacienty s genotypem viru 1. Doporučená dávka BOC je 800 mg 3krát denně s jídlem (hlavní jídlo, nebo alespoň lehká svačina). Užití BOC bez jídla může být spojeno se ztrátou účinnosti kvůli suboptimální expozici (tab. 3).
Léčba BOC má být vedena lékařem, který má s léčbou pacientů s chronickou hepatitidou C zkušenosti. BOC musí být podáván výhradně v trojkombinaci s PEG-IFN-α a RBV. Oba jmenované léky se podávají v obvyklém dávkování pro pacienty s genotypem viru 1. Doporučená dávka BOC je 800 mg 3krát denně s jídlem (hlavní jídlo, nebo alespoň lehká svačina). Užití BOC bez jídla může být spojeno se ztrátou účinnosti kvůli suboptimální expozici (tab. 3).
Jestliže pacient vynechá dávku a do podání další zbývá dvě a více hodin, má pacient užít vynechanou dávku a vrátit se zpět ke svému obvyklému dávkovacímu schématu. Pokud do podání další dávky zbývají méně než dvě hodiny, má se zapomenutá dávka vynechat.
Snížení dávky BOC není doporučeno; pokud se objeví závažný nežádoucí účinek, který potenciálně souvisí s léčbou PEG-IFN-α nebo RBV, a ta je proto ukončena, má být ukončena i léčba BOC.
I přesto, že u pacientů s mírným, středně závažným i závažným jaterním poškozením není třeba úprava dávky BOC, léčba trojkombinací BOC/PEG-IFN/RBV je indikována pouze u nemocných s kompenzovanou jaterní cirhózou (stupeň A Childovy-Pughovy klasifikace).
Podávání BOC je obvykle zahajováno po čtyřech týdnech lead-in fáze, kdy se podává pouze dvojkombinační léčba PEG-IFN/RBV. Výhodou lead-in fáze je možnost zhodnocení pacientovy odpovědi na PEG-IFN-α, což napomáhá predikci možnosti dosažení SVR. Během čtyř týdnů lead-in fáze rovněž můžeme posoudit toleranci PEG-IFN-α a RBV, zejména pak rychlost rozvoje hematologických nežádoucích účinků (anémie, neutropenie), na konci lead-in fáze je možno upravit dávku RBV před přidáním BOC. Během lead-in fáze rovněž zhodnotíme compliance pacienta. Snížení viremie v lead-in fázi před přidáním BOC má za cíl snížit riziko vzniku rezistence.
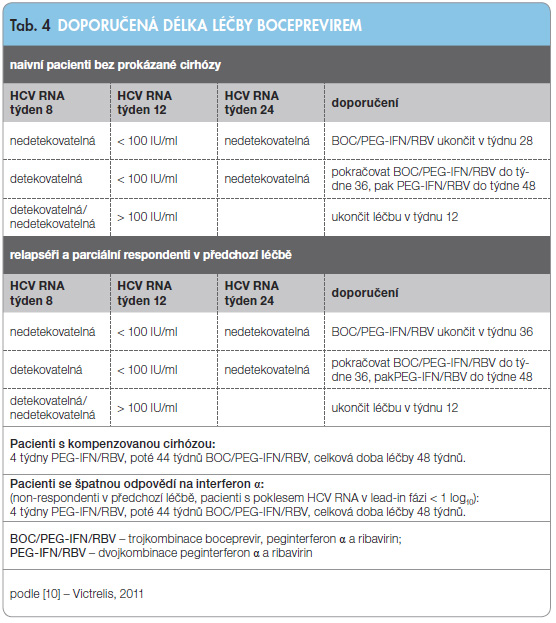 Pacienti s nedetekovatelnou viremií v 8. týdnu léčby (tzv. RVR), kteří mají nedetekovatelnou viremii i v týdnu 12 a 24, mohou být léčeni pouze po dobu 28 týdnů (4 týdny lead-in fáze + 24 týdnů BOC/PEG-IFN/RBV). Tito pacienti dosáhnou SVR ve více než 90 % případů. Naopak pacienti, kteří dosáhnou negativity HCV RNA za více než 4 týdny od přidání BOC, by měli být léčeni celkem 48 týdnů (4 týdny lead-in fáze + 32 týdnů BOC/PEG-IFN/RBV + 12 týdnů PEG-IFN/RBV). Tito nemocní dosáhnou SVR v 70 %. U pacientů s rezistencí k PEG-IFN-α (pokles HCV RNA během lead-in fáze < 1 log10), předchozích non-respondentů a pacientů s cirhózou by měl být BOC podáván v trojkombinaci s PEG-IFN/RBV 44 týdnů po čtyřech týdnech lead-in fáze. Léčba má být ukončena u pacientů s HCV RNA > 100 IU/ml v týdnu 12 a při jakékoliv detekovatelné viremii v týdnu 24 a dále. Přehled léčebných schémat je uveden v tab. 4.
Pacienti s nedetekovatelnou viremií v 8. týdnu léčby (tzv. RVR), kteří mají nedetekovatelnou viremii i v týdnu 12 a 24, mohou být léčeni pouze po dobu 28 týdnů (4 týdny lead-in fáze + 24 týdnů BOC/PEG-IFN/RBV). Tito pacienti dosáhnou SVR ve více než 90 % případů. Naopak pacienti, kteří dosáhnou negativity HCV RNA za více než 4 týdny od přidání BOC, by měli být léčeni celkem 48 týdnů (4 týdny lead-in fáze + 32 týdnů BOC/PEG-IFN/RBV + 12 týdnů PEG-IFN/RBV). Tito nemocní dosáhnou SVR v 70 %. U pacientů s rezistencí k PEG-IFN-α (pokles HCV RNA během lead-in fáze < 1 log10), předchozích non-respondentů a pacientů s cirhózou by měl být BOC podáván v trojkombinaci s PEG-IFN/RBV 44 týdnů po čtyřech týdnech lead-in fáze. Léčba má být ukončena u pacientů s HCV RNA > 100 IU/ml v týdnu 12 a při jakékoliv detekovatelné viremii v týdnu 24 a dále. Přehled léčebných schémat je uveden v tab. 4.
Stabilita
Při skladování v lékárně má být BOC uchováván v chladničce (2–8 °C) až do uplynutí doby použitelnosti, pacient může uchovávat BOC mimo chladničku při teplotě do 30 °C, a to po dobu maximálně 3 měsíců. BOC má být uchováván v původním blistru, aby byl chráněn proti vlhkosti.
Závěr
Přidání BOC do léčebných schémat HCV infekce představuje významný krok ke zvýšení účinnosti léčby u obtížně léčitelné skupiny pacientů s genotypem 1. U pacientů dosud neléčených umožňuje trojkombinace s BOC zkrátit celkové trvání léčby a zlepšit tak její toleranci.
Seznam použité literatury
- [1] EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011; 55: 245–264.
- [2] Zeuzem S, Buti M, Ferenci P, et al. Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006; 44: 97–103.
- [3] Manns MP, McHutchison JG, Gordon SC, et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001; 358: 958–965.
- [4] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [5] Ghany MG, Strader DB, Thomas DL, et al. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology 2009; 49: 1335–1374.
- [6] Ge D, Fellay J, Thompson AJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature 2009; 461: 399–401.
- [7] Thompson AJ, Muir AJ, Sulkowski MS, et al. Interleukin-28B polymorphism improves viral kinetics and is the strongest pretreatment predictor of sustained virologic response in genotype 1 hepatitis C virus. Gastroenterology 2010; 139: 120–129.
- [8] Moradpour D, Penin F, Rice CM. Replication of hepatitis C virus. Nat Rev Microbiol 2007; 5: 453–463.
- [9] Lin C, Kwong AD, Pern RB. Discovery and development of VX-950, a novel, covalent, and reversible inhibitor of hepatitis C virus NS3.4A serine protease. Infect Disord Drug Targets 2006; 6: 3–16.
- [10] Victrelis: Souhrn údajů o přípravku. dostupné na http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002332/WC500109786.pdf (citováno 20. prosince 2012).
- [11] Ghosal A, Yuan Y, Tong W, et al. Characterization of human liver enzymes involved in the biotransformation of boceprevir, a hepatitis C virus protease inhibitor. Drug Metab Dispos 2011; 39: 510–521.
- [12] Sarrazin C, Rouzier R, Wagner F, et al. SCH 503034, a novel hepatitis C virus protease inhibitor, plus pegylated interferon alpha-2b for genotype 1 nonresponders. Gastroenterology 2007; 132: 1270–1278.
- [13] Kwo PY, Lawitz EJ, McCone J, et al. Efficacy of boceprevir, an NS3 protease inhibitor, in combination with peginterferon alfa-2b and ribavirin in treatment-naive patients with genotype 1 hepatitis C infection (SPRINT-1): an open-label, randomised, multicentre phase 2 trial. Lancet 2010; 376: 705–716.
- [14] Poordad F, Mc Cone J Jr, Bacon BR, et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med 2011; 364: 1195–1206.
- [15] Bacon BR, Gordon SC, Lawitz E, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011; 364: 1207–1217.
- [16] Sherman KE, Flamm SL, Afdhal NH, et al. Response-guided telaprevir combination treatment for hepatitis C virus infection. N Engl J Med 2011; 365: 1014–1024.
- [17] Poordad F, Lewitz EJ, Reddy KR, et al. A randomized trial comparing ribavirin dose reduction versus erythropoietin for anemia management in previously untreated patients with chronic hepatitis C receiving boceprevir plus peginterferon/ribavirin. J Hepatol 2012; 56: A1419.
- [18] Hulskotte EG, Feng HP, Xuan F, et al. Pharmacokinetic Interactions Between the Hepatitis C Virus Protease Inhibitor Boceprevir and Ritonavir-Boosted HIV-1 Protease Inhibitors Atazanavir, Darunavir, and Lopinavir. Clin Infect Dis 2012, doi: 10.1093/cid/cis968.
- [19] Wilby KJ, Greanya ED, Ford JA, et al. A review of drug interactions with boceprevir and telaprevir: implications for HIV and transplant patients. Ann Hepatol 2012; 11: 179–185.