Cobimetinib – pokrok v léčbě melanomu
Souhrn:
Cobimetinib je nové léčivo ze skupiny inhibitorů MEK, který v kombinační terapii s vemurafenibem představuje možnou alternativu léčby pokročilého melanomu s prokázanou mutací BRAFV600E. V randomizované, dvojitě zaslepené, placebem kontrolované multicentrické studii fáze III přidání cobimetinibu k vemurafenibu v porovnání s monoterapií vemurafenibem u dosud neléčených pacientů s pokročilým melanomem nesoucím mutaci BRAFV600E vedlo ke statisticky významnému prodloužení doby bez progrese, doby celkového přežití a k signifikantnímu zvýšení četnosti léčebných odpovědí s výskytem zvladatelných nežádoucích účinků.
Key words: cobimetinib – vemurafenib – melanoma – BRAFV600 mutation.
Summary:
Cobimetinib is a new MEK inhibitor, which – in combination therapy with vemurafenib – is a possible alternative to the usual treatment of advanced melanoma with BRAFV600 mutation. In randomised, double‑blind, placebo controlled multicentre study, combination of cobimetinib and vemurafenib compared with placebo and vemurafenib in previously untreated patients with BRAFV600 mutant advanced melanoma significantly improved progression‑free survival, overall survival and objective response rate, with manageable side effects.
Úvod
Melanom patří mezi nejzhoubnější solidní nádory. První popis průběhu onemocnění publikoval v roce 1820 William Norris [1,2]. Incidence melanomu navzdory preventivním programům v České republice dlouhodobě stoupá. Očekává se, že v roce 2020 bude prevalence melanomu ve IV. stadiu kolem 800 nemocných [3].
V nedávné době došlo k velkému posunu vpřed v léčbě pokročilého melanomu jak v oblasti cílené léčby (vemurafenib, dabrafenib, trametinib), tak i na poli inovativní imunoterapie (ipilimumab, nivolumab, pembrolizumab). Cílená terapie se zaměřuje na farmakologickou inhibici signální dráhy mitogenem aktivované proteinkinázy (mitogen activated protein kinases, MAPK), která zahrnuje kinázy Ras/Raf/MEK/ERK, jež hrají důležitou roli v aktivitě melanomových buněk [4]. Jedním z nových léků, které přinesly zlepšení v léčbě pokročilého melanomu, je i cobimetinib.
Mechanismus účinku
Cobimetinib je reverzibilní, selektivní, alosterický perorální inhibitor, který blokuje dráhu MAPK tím, že cíleně působí na mitogenem aktivované proteinkinázy regulované extracelulárním signálem (mitogen activated extracellular signal regulated kinase) MEK 1 a MEK 2, což vede k inhibici fosforylace proteinkinázy regulované extracelulárním signálem (extracellular signal related kinase) ERK 1 a ERK 2. Z tohoto důvodu cobimetinib blokuje proliferaci buněk indukovanou dráhou MAPK prostřednictvím inhibice signalizačního uzlu MEK1/2 [5]. Inhibitory MEK se liší od ostatních tyrozinkinázových inhibitorů tím, že nekompetují o vazbu s adenosintrifosfátem, což vede k jejich značné specificitě [6].
V preklinických modelech se ukázalo, že kombinace cobimetinibu s vemurafenibem simultánně cíleně působí na proteinovou mutaci BRAFV600E a na proteiny MEK v buňkách melanomu. Kombinace těchto dvou léků tak inhibuje reaktivaci dráhy MAPK prostřednictvím MEK1/2, jež vede k silnější inhibici intracelulární signalizace a ke snížení proliferace nádorových buněk.
Indikace a dávkování
Cobimetinib (Cotellic) je v kombinaci s vemurafenibem indikován k léčbě dospělých pacientů s neresekovatelným nebo metastazujícím melanomem s pozitivní mutací BRAFV600E.
Na základě klinické studie fáze Ib (BRIM 7) byla jako bezpečná a dostatečně účinná stanovena dávka cobimetinibu 60 mg jednou denně [7]. Cobimetinib se užívá v 28denním cyklu. Jedna dávka se skládá ze tří 20mg tablet (60 mg) podávaných 1× denně po dobu 21 po sobě jdoucích dní (dny 1‒21, doba léčby), jež jsou následovány sedmidenní přestávkou v léčbě (dny 22‒28, přestávka v léčbě). Další léčebný cyklus cobimetinibu má začít po uplynutí sedmidenní přestávky v terapii. Cobimetinib se užívá v kombinaci s vemurafenibem v dávce 960 mg (4 tablety po 240 mg) 2× denně (odpovídá celkové denní dávce 1 920 mg). Vemurafenib se podává kontinuálně, bez sedmidenní přestávky. Kombinace cobimetinibu a vemurafenibu se užívá do progrese onemocnění nebo do rozvoje nepřijatelné toxicity.
Farmakologické vlastnosti
Cobimetinib vykazuje střední rychlost absorpce (tmax 2,4 hodiny). Jeho absolutní biologická dostupnost činí 45,9 %. Cobimetinib má lineární farmakokinetiku v rozmezí dávek zhruba 3,5‒100 mg. Intenzivně se metabolizuje a vylučuje stolicí. Absorbovaná frakce byla ~88 %, což naznačuje vysokou absorpci a metabolismus při prvním průchodu játry. Vzhledem k tomu, že jídlo nemění farmakokinetiku cobimetinibu, může být podáván s jídlem nebo bez něj. Oxidace prostřednictvím CYP3A a glukuronidace prostřednictvím UGT2B7 se jeví jako jeho hlavní metabolické dráhy. Biologický poločas cobimetinibu po perorálním podání je 43,6 hodiny, proto eliminace může trvat až dva týdny po ukončení léčby k dosažení úplného odstranění cobimetinibu ze systémové cirkulace [8].
Klinické studie
Fáze I
V klinické studii fáze Ib (BRIM 7) byla hodnocena bezpečnost, snášenlivost, farmakokinetika a účinnost cobimetinibu při jeho přidání k vemurafenibu pro léčbu pacientů s neresekovatelným nebo metastazujícím melanomem nesoucím mutaci BRAFV600E [7]. Do studie bylo zařazeno celkem 129 pacientů: z toho 66 pacientů po předchozí progresi při léčbě vemurafenibem v monoterapii a 63 pacientů bez předchozí léčby inhibitorem BRAF. Dvacet pacientů z uvedených 63 nemocných nepředléčených inhibitorem BRAF podstoupilo předcházející systémovou léčbu pokročilého melanomu, ve většině případů (80 %) imunoterapií. V průběhu studie byla postupně několikrát eskalována dávka a upravováno schéma léčby, až byla stanovena maximální tolerovaná dávka cobimetinibu 60 mg 1× denně po dobu 21 dní, s následnou sedmidenní přestávkou, v kombinaci s vemurafenibem 960 mg 2× denně kontinuálně. Při tomto dávkování byla léčba hodnocena jako bezpečná s dobře zvladatelnými nežádoucími účinky.
Z 66 nemocných po progresi při předchozí terapii vemurafenibem bylo u 15 % sledovaných dosaženo objektivní léčebné odpovědi (objective response rate, ORR), s mediánem doby přežití bez progrese (progression free survival, PFS) 2,8 měsíce. Z 63 nemocných bez předchozí terapie inhibitorem BRAF dosáhlo léčebné odpovědi 87 % pacientů, včetně 10 % kompletních odpovědí, s mediánem PFS 13,7 měsíce [7].
Fáze II
Klinické hodnocení fáze II nebylo provedeno. Vzhledem k úspěšným výsledkům výše uvedené studie fáze Ib (BRIM 7) byla zahájena rovnou klinická studie fáze III (coBRIM).
Fáze III
Studie coBRIM je randomizované,
dvojitě zaslepené, placebem kontrolované multicentrické sledování
fáze III zaměřené na hodnocení bezpečnosti a účinnosti
cobimetinibu v kombinaci s vemurafenibem ve srovnání
s placebem a vemurafenibem, které bylo provedeno u dříve
neléčených pacientů s neresekovatelným lokálně pokročilým
melanomem (stadium IIIC) nebo s metastazujícím melanomem
(stadium IV) s pozitivní mutací ![BHodnoty přežití bez progrese a celkového přežití ve studii coBRI M; upraveno podle [10] – Ascierto, et al., 2016.](https://www.remedia.cz/photo-a-31319---.jpg) BRAFV600E [9,10].
Do studie bylo zařazeno 495 dospělých pacientů
ve výkonnostním stavu dle škály ECOG (Eastern Cooperative
Oncology Group) 0‒1,
kteří byli randomizovaně rozděleni do skupiny 247 osob
léčených kombinací cobimetinibu 60 mg 1× denně ve dnech
1‒21 každého 28denního léčebného cyklu a 960 mg
vemurafenibu 2× denně ve dnech 1‒28 a do skupiny
248 pacientů, kteří užívali placebo 1× denně ve dnech
1‒21 každého 28denního léčebného cyklu a 960 mg
vemurafenibu 2× denně ve dnech 1‒28.
BRAFV600E [9,10].
Do studie bylo zařazeno 495 dospělých pacientů
ve výkonnostním stavu dle škály ECOG (Eastern Cooperative
Oncology Group) 0‒1,
kteří byli randomizovaně rozděleni do skupiny 247 osob
léčených kombinací cobimetinibu 60 mg 1× denně ve dnech
1‒21 každého 28denního léčebného cyklu a 960 mg
vemurafenibu 2× denně ve dnech 1‒28 a do skupiny
248 pacientů, kteří užívali placebo 1× denně ve dnech
1‒21 každého 28denního léčebného cyklu a 960 mg
vemurafenibu 2× denně ve dnech 1‒28.
Medián PFS činil 12,3 měsíce při léčbě cobimetinibem a vemurafenibem v porovnání se 7,2 měsíce u pacientů léčených placebem a vemurafenibem (graf 1a). Medián doby celkového přežití (overall survival, OS) byl 22,3 měsíce při terapii cobimetinibem a vemurafenibem v porovnání se 17,4 měsíce u osob léčených placebem a vemurafenibem (graf 1b). Také četnost ORR byla významně vyšší při terapii kombinací cobimetinibu a vemurafenibu v porovnání s placebem a vemurafenibem (68 % versus 45 %; p < 0,001), kompletní odpovědi bylo dosaženo u 10 % vs. 4 % pacientů [10].
Nežádoucí účinky
Ve výše uvedené studii fáze
III (coBRIM) byl výskyt nežádoucích účinků v obou
skupinách podobný (tab. 1)
[10]. Toxicita stupně 3 a 4 byla zaznamenána u 49 %,
resp. 13 % pacientů léčených kombinací cobimetinibu
a vemurafenibu v porovnání se 49 %, resp. 9 %
nemocných podstupujících monoterapii vemurafenibem. Nežádoucí
účinky vedly k přerušení léčby u 13 % versus
12 % pacientů. Nejčastějším nežádoucím účinkem při léčbě
cobimetinibem a vemurafenibem byly průjem, vyrážka, nauzea,
pyrexie, fotosenzitivní reakce, zvracení, zvýšení hodnot
aminotransferáz a kreatinfosfokinázy [11]. Nejčastějším
nežádoucím účinkem p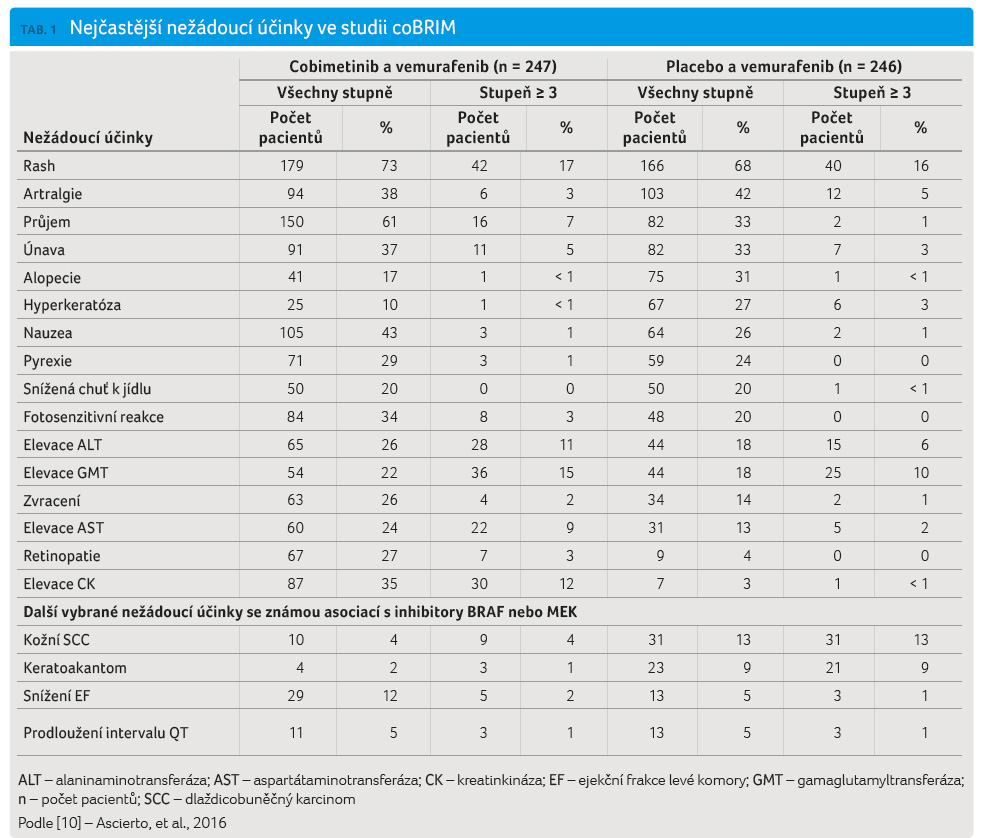 ři monoterapii vemurafenibem byly
artralgie, alopecie a hyperkeratóza. Únava byla pozorována se
stejnou frekvencí výskytu v obou skupinách [12]. U nemocných
s pokročilým melanomem neexistují žádné důkazy
o jakýchkoliv klinicky významných interakcích mezi
cobimetinibem a vemurafenibem, a proto nejsou doporučeny
žádné úpravy dávek [9,10].
ři monoterapii vemurafenibem byly
artralgie, alopecie a hyperkeratóza. Únava byla pozorována se
stejnou frekvencí výskytu v obou skupinách [12]. U nemocných
s pokročilým melanomem neexistují žádné důkazy
o jakýchkoliv klinicky významných interakcích mezi
cobimetinibem a vemurafenibem, a proto nejsou doporučeny
žádné úpravy dávek [9,10].
Současné postavení cobimetinibu v léčbě pokročilého melanomu
Současným standardem léčby nemocných s pokročilým melanomem je imunoterapie inhibitory kontrolních bodů imunitní reakce (anti CTLA 4 ipilimumab, anti PD 1 nivolumab a anti PD 1 pembrolizumab) a u nemocných s mutací BRAFV600E cílená terapie inhibitory BRAF (vemurafenib nebo dabrafenib), inhibitorem MEK trametinibem nebo kombinací inhibitorů BRAF a MEK (vemurafenib a cobimetinib nebo dabrafenib a trametinib) [13]. V klinickém zkoušení je kombinace dalších inhibitorů BRAF a MEK encorafenibu a binimetinibu ‒ studie COLUMBUS (NCT01909453) [14].
Dosažený výsledek OS pro vemurafenib a cobimetinib je konzistentní s výsledky dosaženými pro jinou kombinaci inhibitorů BRAF a MEK ‒ dabrafenib a trametinib [15]. Kombinace inhibitorů BRAF a MEK je účinnější než monoterapie inhibitorem BRAF. Imunoterapie je účinná bez ohledu na mutační stav genu BRAF. Aktivační mutace genu BRAF je přítomna u 40‒60 % pokročilých melanomů, v 80‒90 % se jedná o mutaci BRAFV600E [16]. Tato skupina pacientů má mnohem širší přístup k léčbě ‒ jak k moderní imunoterapii, tak k léčbě tyrozinkinázovými inhibitory. Pacienti s tzv. wild type BRAF mohou být léčeni pouze imunoterapií.
Cílenou léčbou, včetně kombinace vemurafenib a cobimetinib, je dosahováno vyššího počtu ORR (50 %) s rychlejším nástupem účinku patrným již po dvou týdnech, avšak s kratší dobou trvání v porovnání s imunoterapií inhibitory kontrolních bodů imunitní reakce. Účinek imunomodulační léčby se dostavuje až po delší době, u části pacientů jsou na rozdíl od cílené terapie zaznamenávány dlouhodobé odpovědi. V případě agresivního, rychle progredujícího symptomatického onemocnění je proto preferováno zahájit terapii nejprve cílenou léčbou.
Výhled
Při inhibici BRAF dochází ke zvýšení hustoty CD8+ tumor infiltrujících lymfocytů [17,18]. Dle preklinických studií mohou inhibitory BRAF příznivě ovlivnit účinnost následné imunoterapie [19]. V klinické studii fáze II (NCT02902029) je proto nyní hodnocena sekvence vemurafenib a cobimetinib s následnou imunoterapií inhibitorem PD L1 atezolizumabem. Obdobně v klinické studii fáze II (NCT02968303) je hodnocena sekvence vemurafenib a cobimetinib s následnou imunoterapií inhibitorem PD 1 nivolumabem a inhibitorem CTLA 4 ipilimumabem [14].
Slibnou možností by v budoucnu mohl být tzv. retreatment kombinovanou léčbou inhibitory BRAF a MEK. Na většinu tyrozinkinázových inhibitorů, používaných u jiných typů nádorů, se časem vyvine rezistence tím způsobem, že dojde k mutaci, která brání vazbě léku na terčovou strukturu. Takovýto typ rezistence je ireverzibilní. Mechanismus rezistence na kombinovanou léčbu inhibitory BRAF a MEK je však odlišný: vytváří se mutace upstreamově a downstreamově (podle hierarchie komponent v buněčném procesu) od BRAF nebo se aktivují alternativní signální dráhy. V experimentech na buněčných kulturách byla kombinovanou léčbou zabita většina buněk. Subpopulace, které přežily, se adaptovaly dediferenciací nebo zpomalením růstu. Tyto typy rezistencí jsou reverzibilní po několikatýdenním intervalu bez terapie inhibitory BRAF a MEK [20].
V otevřené, prospektivní klinické studii fáze II (NCT02296996), která zahrnovala 25 pacientů s pokročilým melanomem nesoucím mutaci BRAFV600E po progresi při předchozí léčbě inhibitorem BRAF se současnou léčbou inhibitorem MEK nebo bez ní, byla nemocným podávána kombinovaná léčba inhibitorem BRAF dabrafenibem a inhibitorem MEK trametinibem. Interval od ukončení předchozí terapie činil minimálně 12 týdnů, během nichž mohla být podávána imunoterapie. Bylo dosaženo částečné odpovědi u 32 % pacientů a stabilizace onemocnění u 40 % pacientů. K progresi došlo u šesti nemocných, kteří byli po předchozí léčbě kombinací dabrafenib a trametinib, a u dvou nemocných po předchozí monoterapii inhibitorem BRAF. Medián PFS činil 4,9 měsíce. Nežádoucí účinky byly obdobné jako při iniciální kombinované léčbě. Toxicita stupně 3 se vyskytla u 8 % pacientů, u žádného nemocného se nevyvinula toxicita stupně 4 nebo 5 [21].
V první polovině měsíce června 2017 probíhalo 25 klinických hodnocení s cobimetinibem v léčbě melanomu [14].
Závěr
Cobimetinib je nové léčivo ze skupiny inhibitorů MEK, který je v kombinační terapii s vemurafenibem možnou alternativou léčby metastatického melanomu s prokázanou mutací BRAFV600E. V randomizované, dvojitě zaslepené, placebem kontrolované multicentrické studii fáze III vedlo přidání cobimetinibu k vemurafenibu u dosud neléčených pacientů s pokročilým melanomem nesoucím mutaci BRAFV600E ke statisticky významnému prodloužení intervalu PFS, doby OS a k signifikantnímu zvýšení četnosti ORR, s výskytem zvladatelných nežádoucích účinků. V České republice je cobimetinib registrován, ale zatím nemá schválenu úhradu ze zdravotního pojištění. Specifický léčebný program byl ukončen. V současné době je možné cobimetinib používat pouze v rámci klinických studií.
Práce byla podpořena MZ ČR – RVO Thomayerova nemocnice – TN 0064190.
Seznam použité literatury
- [1] Norris W. Eight cases of melanosis with pathological and therapeutic remarks on that disease. London: Longman and Robarts, 1857, 16 s.
- [2] Petruželka L. Perspektivy v léčbě maligního melanomu. In Aktuální léčba maligního melanomu. Farmakoterapie 2015: 46–49.
- [3] Dušek L, Pavlík T, Májek O, et al. Estimating cancer incidence, prevalence, and the number of cancer patients treated with antitumor therapy in 2015 and 2020 – analysis of the Czech National Cancer Registry. Klin Onkol 2015; 28: 30–43.
- [4] Simeone E, Grimaldi AM, Festino L, et al. Combination treatment of patients with BRAF‑mutant melanoma: A new standard of care. BioDrugs 2017; 31: 51–61.
- [5] Grimaldi AM, Simeone E, Festino L, et al. MEK inhibitors in the treatment of metastatic melanoma and solid tumors. Am J Clin Dermatol 2017. doi: 10.1007/s40257‑017‑0292‑y. [Epub ahead of print]
- [6] Klener P Jr, Klener P. Principy systémové protinádorové léčby. Praha: Grada Publishing, 2013, 200 s.
- [7] Ribas A, Gonzalez R, Pavlick A, et al. Combination of vemurafenib and cobimetinib in patients with advanced BRAF(V600)‑mutated melanoma: a phase 1b study. Lancet Oncol 2014; 15: 954–965.
- [8] Cotellic (cobimetinib). Souhrn údajů o přípravku [aktualizováno 6. června 2017, navštíveno 15. června 2017]. Státní ústav pro kontrolu léčiv. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_Product_Information/human/003960/WC500198563.pdf
- [9] Larkin J, Ascierto PA, Dréno B, et al. Combined vemurafenib and cobimetinib in BRAF‑mutated melanoma. N Engl J Med 2014; 371: 1867–1876.
- [10] Ascierto PA, McArthur GA, Dréno B, et al. Cobimetinib combined with vemurafenib in advanced BRAF(V600)‑mutant melanoma (coBRIM): updated efficacy results from a randomised, double‑blind, phase 3 trial. Lancet Oncol 2016; 17: 1248–1260.
- [11] Dréno B, Ribas A, Larkin J, et al. Incidence, course, and management of toxicities associated with cobimetinib in combination with vemurafenib in the coBRIM study. Ann Oncol 2017; 28: 1137–1144.
- [12] Kopecký J, Kubeček O, Trojanová P, et al. Nežádoucí účinky novodobé léčby melanomu a jejich léčba/management. Klin Onkol 2014; 27: 393–400.
- [13] Modrá kniha České onkologické společnosti ČLS JEP, 23. aktualizované vyd. Brno: Masarykův onkologický ústav. Platnost od 1. 3. 2017.
- [14] http://clinicaltrials.gov/; klíčová slova: cobimetinib + melanoma
- [15] Daud A, Gill J, Kamra S, et al. Indirect treatment comparison of dabrafenib plus trametinib versus vemurafenib plus cobimetinib in previously untreated metastatic melanoma patients. J Hematol Oncol 2017; 10: 3.
- [16] Wellbrock C, Hurlstone A. BRAF as therapeutic target in melanoma. Biochem Pharmacol 2010; 80: 561–567.
- [17] Ilieva KM, Correa I, Josephs DH, et al. Effects of BRAF mutations and BRAF inhibition on immune responses to melanoma. Mol Cancer Ther 2014; 13: 2769–2783.
- [18] Wilmott JS, Long GV, Howle JR, et al. Selective BRAF inhibitors induce marked T‑cell infiltration into human metastatic melanoma. Clin Cancer Res 2012; 18: 1386–1394.
- [19] Liu C, Peng W, Xu C, et al. BRAF inhibition increases tumor infiltration by T cells and enhances the antitumor activity of adoptive immunotherapy in mice. Clin Cancer Res 2013; 19: 393–403.
- [20] Paulson KG, Thompson JA. A second chance for success with BRAF and MEK inhibitors in melanoma. Lancet Oncol 2017; 18: 418–419.
- [21] Schreuer M, Jansen Y, Planken S, et al. Combination of dabrafenib plus trametinib for BRAF and MEK inhibitor pretreated patients with advanced BRAFV600‑mutant melanoma: an open‑label, single arm, dual‑centre, phase 2 clinical trial. Lancet Oncol 2017; 18: 464–472.