Daclatasvir
Souhrn:
Daclatasvir je nové, přímo působící antivirotikum – inhibitor proteinu viru hepatitidy C NS5A, který je určen k léčbě dospělých pacientů s chronickou hepatitidou C. Článek uvádí základní farmakodynamické a farmakokinetické vlastnosti daclatasviru. Shrnuty jsou dosavadní zkušenosti ze studií fází II a III jak s dosud neléčenými pacienty, tak s pacienty, u kterých selhala předchozí léčba peginterferonem α a ribavirinem, včetně léčby trojkombinací s proteázovými inhibitory první generace. Výsledky studií prokazují vysokou účinnost daclatasviru při jeho použití s dalšími antivirotiky s rozdílným mechanismem účinku. Dále je diskutován bezpečnostní profil léčiva, hlavní nežádoucí účinky a lékové interakce.
Key words: daclatasvir, sofosbuvir, peginterferon α, ribavirin, HCV infection, antiviral therapy.
Summary:
Daclatasvir is a new, direct-acting antiviral, an inhibitor of HCV RNA NS5A protein. It is indicated for treatment of hepatitis C in adult patients with chronic hepatitis C. The paper describes basic pharmacodynamic and pharmacokinetic properties of daclatasvir and summarizes results of phase II and phase III clinical trials in treatment-naïve as well as in treatment-experienced patients, including those who failed triple therapy with first generation protease inhibi-tors. The study results prove high efficacy of daclatasvir when it is administered together with other antivirals with a different mechanism of action. The safety profile of daclatasvir, adverse events, and drug-drug interactions are also discussed.
Úvod
V posledních 14 letech byla standardem léčby chronické infekce virem hepatitidy C (HCV) u dosud neléčených (tzv. naivních) pacientů kombinace peginterferonu α (PEG‑IFNα) a ribavirinu (RBV) [1]. Detailní znalost virové kinetiky ve smyslu rychlosti poklesu viremie po zahájení léčby umožnila předpovídat úspěšnost léčby, u některých pacientů pak bylo možné léčbu zkrátit na 24 týdnů [2]. U většiny pacientů s genotypem 1 však zůstala v České republice 48týdenní léčba PEG‑IFNα a RBV standardní terapií až do roku 2014, s úspěšností léčby 40–45 % [3,4].
Kombinace PEG‑IFNα a RBV vedla k eradikaci infekce HCV přibližně u poloviny léčených nemocných, hůře léčitelní byli zejména pacienti s genotypem 1, jehož prevalence mezi pacienty infikovanými HCV v České republice je nyní stále vyšší než 60 % [5]. Za dosažení kompletní eradikace viru se považuje docílení trvale negativní viremie (hodnoceno stanovením sérové HCV RNA) léčbou. Setrvalost virologické odpovědi se hodnotí 24 týdnů po léčbě, vyléčení je proto označováno jako dosažení setrvalé virologické odpovědi (SVR, sustained virological response) [6].
Významným pokrokem v účinnosti léčby infekce HCV bylo zavedení přímo působících antivirotik (DAA, direct‑acting antivirals) do léčebných protokolů. Pokroky v pochopení struktury viru a jeho replikace umožnily vývoj molekul, které přímo inhibují enzymy HCV nezbytné pro jeho replikaci. Zatímco PEG‑IFNα a RBV mají pouze nespecifický protivirový účinek, DAA působí přímo na kódující proteiny viru, jako jsou serinová proteáza NS3/4A,RNA‑dependentní RNA polymeráza NS5B a nestrukturální protein 5A (NS5A). Dva první inhibitory serinové proteázy – boceprevir a telaprevir – byly v roce 2011 v Evropské unii registrovány k léčbě infekce HCV u pacientů infikovaných genotypem 1. Následoval sofosbuvir, simeprevir, daclatasvir a fixní kombinace ledipasviru se sofosbuvirem v roce 2014, a dále trojkombinace paritapreviru, ombitasviru a dasabuviru v roce 2015.
Použitím vysoce účinných DAA lze nyní u vybraných pacientů zkrátit léčbu HCV infekce na pouhých 12 týdnů, ale zejména vhodnou kombinací DAA s různými mechanismy účinku lze z terapeutického schématu zcela vyřadit interferon, který je zodpovědný za závažné nežádoucí účinky dosud používané léčby. Možnost bezinterferonové léčby tak nabízí šanci na vyléčení nemocným, u nichž byla dříve léčba infekce HCV kontraindikována nebo u nich předchozí léčba založená na interferonovém režimu selhala [6,7].
Farmakologická skupina
Daclatasvir řadíme mezi Antivirotika s přímým účinkem, ATC kód J05AX14.
Chemické a fyzikální vlastnosti
Molekulová hmotnost: 738,875 g/mol
Sumární vzorec: C40H50N8O6
Mechanismus účinku, farmakodynamika
Daclatasvir je inhibitor nestrukturálního multifunkčního proteinu NS5A, který je základní složkou replikačního komplexu HCV. Díky své důležité úloze v replikaci HCV byl NS5A vybrán za cíl inhibice replikace viru. Daclatasvir jako inhibitor NS5A brání jak replikaci virové RNA, tak kompletaci virionů (obr. 1). Inhibice NS5A vede již v pikomolárních koncentracích k signifikantnímu poklesu hodnot HCV RNA při stanovení v modelech in vitro. Inhibitor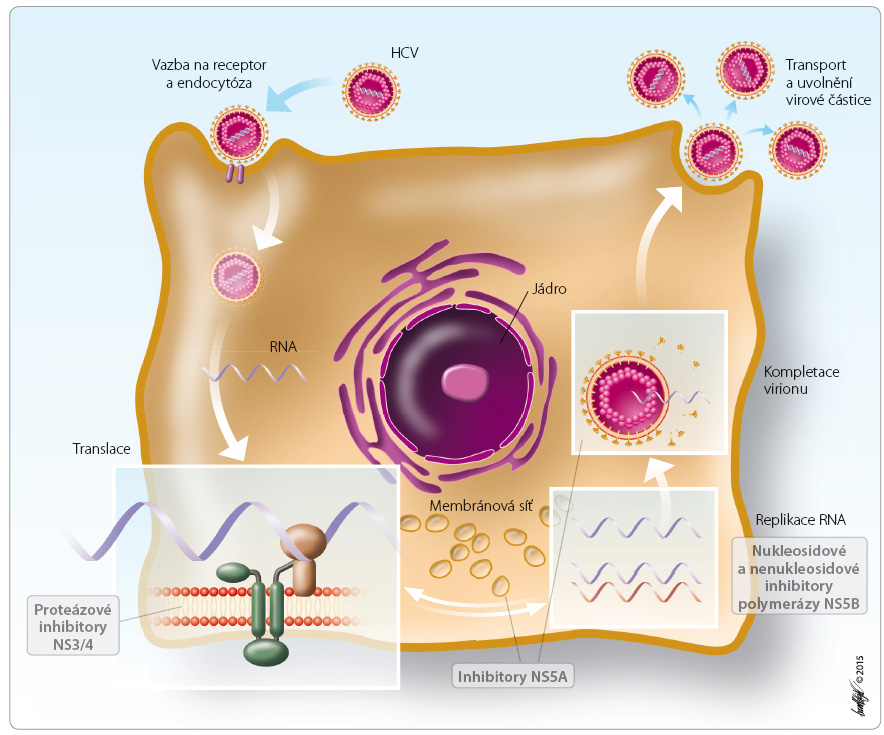 y NS5A jsou tzv. pangenotypové, působí vůči všem genotypům HCV. Přesný mechanismus účinku inhibitorů NS5A není dosud zcela objasněn, jedním z možných mechanismů je inhibice hyperfosforylace proteinu NS5A [8].
y NS5A jsou tzv. pangenotypové, působí vůči všem genotypům HCV. Přesný mechanismus účinku inhibitorů NS5A není dosud zcela objasněn, jedním z možných mechanismů je inhibice hyperfosforylace proteinu NS5A [8].
Daclatasvir je inhibitor replikace genotypů HCV 1a a 1b v kvantitativních rozborech replikonů na buněčné bázi s hodnotami střední účinné koncentrace (EC50 – koncentrace, která způsobí 50% snížení hodnot HCV RNA) 0,003–0,050 nM a 0,001–0,009 nM v závislosti na metodě analýzy. Hodnoty EC50 daclatasviru v replikonovém systému byly 0,003–1,25 nM pro genotypy 3a, 4a, 5a a 6a a 0,034–19 nM pro genotyp 2a, stejně jako 0,020 nM pro genotyp viru 2a (JFH‑1). Ve studiích s využitím buněčného replikonového systému HCV daclatasvir prokázal aditivní až synergistickou interakci s interferonem α, s inhibitory proteáz a s nukleosidovými i nenukleosidovými inhibitory polymerázy NS5B [9]. Nebyl pozorován žádný antagonismus protivirové aktivity ani žádná klinicky významná aktivita proti jiným RNA a DNA virům, včetně viru HIV, což potvrzuje, že daclatasvir je pro HCV vysoce selektivní.
Farmakokinetické vlastnosti
Farmakokinetické vlastnosti daclatasviru byly hodnoceny u zdravých dospělých a u pacientů s chronickou hepatitidou C. Po opakovaném podání perorálních dávek 60 mg jednou denně v kombinaci s PEG‑IFNα a RBV u dosud neléčených jedinců s HCV genotypu 1 byl geometrický průměr (CV%) maximální plazmatické koncentrace (cmax) daclatasviru 1 534 (58) ng/ml, celkové systémové expozice (plocha pod křivkou plazmatické koncentrace, AUC0–24h) 14 122 (70) ng·hod/ml a minimální plazmatická koncentrace (cmin) dosahovala 232 (83) ng/ml [10,11].
Daclatasvir se po opakovaném perorálním podání snadno absorbuje. Maximální plazmatické koncentrace je dosaženo mezi 1. a 2. hodinou; cmax, AUC a cmin daclatasviru se zvyšovaly téměř proporčně k dávce, ustáleného stavu bylo dosaženo po čtyřech dnech podávání jednou denně. Při podávání dávky 60 mg byla expozice daclatasviru mezi zdravými dobrovolníky a jedinci infikovanými HCV podobná. Studie in vitro i in vivo prokázaly, že daclatasvir je substrátem glykoproteinu P (P‑gp). Absolutní biologická dostupnost tabletové formy je 67 %. U zdravých subjektů snížilo podání tablety daclatasviru 60 mg po tučném jídle cmax a AUC daclatasviru o 28 % a o 23 % ve srovnání s podáním nalačno. Podání tablety daclatasviru 60 mg po lehkém jídle nevedlo ke snížení expozice daclatasviru.
V ustáleném stavu se daclatasvir váže u subjektů infikovaných HCV na proteiny přibližně z 99 %, nezávisle na podané dávce. U pacientů, kteří dostali 60 mg daclatasviru perorálně následovaných intravenózním podáním daclatasviru (13C,15N) v dávce 100 μg, byl distribuční objem za ustáleného stavu 47 l.
Daclatasvir je substrátem CYP3A, kdy CYP3A4 je hlavní izoformou CYP odpovědnou za metabolismus. Vylučování probíhá převážně stolicí (88 %; 53 % v nezměněné formě), minimálně pak močí (6,6 %, primárně v nezměněné formě).
Klinické zkušenosti
Daclatasvir v kombinaci s PEG‑IFNα a RBV
Randomizované, dvojitě zaslepené klinické studie AI444010 a AI444042 hodnotily účinnost a bezpečnost daclatasviru v kombinaci s PEG‑IFNα a RBV v léčbě naivních dospělých pacientů s HCV [11–13]. Všichni pacienti měli kompenzované jaterní onemocnění, do studií byli zařazeni i pacienti s jaterní cirhózou. Do studie AI444010 byli zařazeni pacienti s genotypem 1 a 4, do studie AI444042 pacienti s genotypem 4.
Ve studii AI444010 dostávali pacienti 60 mg daclatasviru jednou denně (n = 158) nebo placebo (n = 78) spolu s PEG‑IFNα a RBV až do 12. týdne léčby. Medián věku pacientů byl 50 let, 79 % z nich tvořili běloši, 92 % pacientů mělo HCV genotypu 1 (72 % – genotyp 1a, 20 % – genotyp 1b) a 8 % mělo HCV genotypu 4. Pouze 7 % zařazených pacientů mělo kompenzovanou cirhózu.
Pacienti ve větvi s daclatasvirem, u nichž ve 4. týdnu léčby byla HCV RNA pod mezí kvantifikace a v 10. týdnu léčby nedetekovatelná HCV RNA, byli následně randomizováni k užívání daclatasviru 60 mg plus PEG‑IFNα a RBV nebo k podávání placeba plus PEG‑IFNα a RBV po celkovou dobu 24 týdnů. Pacienti původně zařazení do skupiny s placebem a pacienti ve skupině užívající daclatasvir, kteří nedosáhli stanovení HCV RNA pod dolní hranicí kvantifikace ve 4. týdnu a měli nedekovatelnou HCV RNA v 10. týdnu, pokračovali v léčbě PEG‑IFNα a RBV, kterou dokončili po 48 týdnech.
Pacienti infikovaní genotypem 1 dosáhli SVR12 (negativní HCV RNA 12 týdnů po ukončení léčby) v 64 % případů (genotyp 1a – 54 % pacientů, genotyp 1b – 84 % pacientů) ve skupině léčené daclatasvirem plus PEG‑IFNα a RBV a v 36 % ve skupině léčené placebem plus PEG‑IFNα a RBV.
Ve studii AI444042 byl pacientům infikovaným genotypem 4 podáván po dobu 24 týdnů daclatasvir v dávce 60 mg jednou denně (n = 82) nebo placebo (n = 42) plus PEG‑IFNα a RBV. Medián věku pacientů byl 49 let, 77 % pacientů byli běloši. Deset procent zařazených pacientů mělo kompenzovanou cirhózu. Pacienti ve skupině léčené daclatasvirem, kteří nedosáhli nedetekovatelné HCV RNA v týdnech 4 i 12, a všichni pacienti léčení placebem pokračovali v léčbě kombinací PEG‑IFNα a RBV dalších 24 týdnů. Reakce na léčbu byla rychlá, v týdnu 4 dosáhlo snížení hodnot HCV RNA pod hranici kvantifikace 91 % pacientů léčených daclatasvirem; SVR12 docílilo celkem 82 % pacientů s genotypem 4 léčených daclatasvirem oproti 64 % pacientů, kteří byli zařazeni do větve s placebem. Virologické selhání bylo v průběhu léčby zaznamenáno u 10 % pacientů ve větvi s daclatasvirem, u 3 % pacientů došlo k relapsu po ukončení léčby (resp. u 36 % a 30 % pacientů ve větvi s placebem). Hodnoty SVR12 byly vyšší u pacientů s příznivým genotypem CC v genu IL28B než u osob s genotypem non‑CC IL28B a u pacientů s výchozí nízkou viremií (HCV RNA < 800 000 IU/ml).
Daclatasvir v kombinaci se sofosbuvirem
Účinnost a bezpečnost bezinterferonové kombinace daclatasviru se sofosbuvirem byla sledována ve studii AI444040 u 211 dospělých pacientů bez cirhózy [14]. Daclatasvir byl podáván v dávce 60 mg jednou denně spolu se sofosbuvirem 400 mg v jedné denní dávce, spolu s RBV nebo bez RBV u pacientů s infekcí HCV a s genotypy 1, 2 a 3. Skupina naivních pacientů s genotypem 1 zahrnovala 126 naivních pacientů a 41 nemocných, u kterých selhala předchozí terapie proteázovým inhibitorem boceprevirem nebo telaprevirem. Všichni pacienti s genotypem 2 (n = 26) a 3 (n = 18) byli naivní. Léčba trvala 12 týdnů u 82 naivních pacientů s genotypem 1 a 24 týdnů u pacientů dříve léčených. Medián věku pacientů ve studii byl 54 let, 83 % pacientů tvořili běloši. Většina pacientů (71 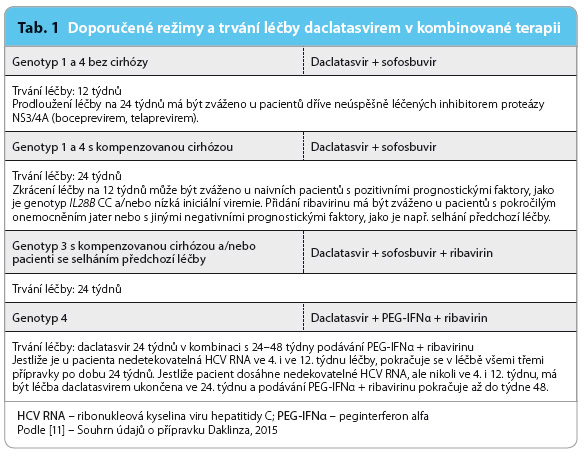 %) měla genotyp non‑CC IL28B; SVR12 dosáhlo 99 % pacientů s genotypem 1, 96 % pacientů s genotypem 2 a 89 % pacientů s genotypem 3. Odpověď na léčbu byla rychlá a nebyla ovlivněna subtypem genotypu HCV (1a/1b), genotypem IL28B nebo přidáním RBV do léčebného schématu. Naivní pacienti s genotypem 1 léčení 12 týdnů měli shodnou odpověď na léčbu jako pacienti léčení 24 týdnů (100 % v obou skupinách). Doporučené léčebné kombinace s daclatasvirem pro jednotlivé genotypy HCV jsou uvedeny v tab. 1.
%) měla genotyp non‑CC IL28B; SVR12 dosáhlo 99 % pacientů s genotypem 1, 96 % pacientů s genotypem 2 a 89 % pacientů s genotypem 3. Odpověď na léčbu byla rychlá a nebyla ovlivněna subtypem genotypu HCV (1a/1b), genotypem IL28B nebo přidáním RBV do léčebného schématu. Naivní pacienti s genotypem 1 léčení 12 týdnů měli shodnou odpověď na léčbu jako pacienti léčení 24 týdnů (100 % v obou skupinách). Doporučené léčebné kombinace s daclatasvirem pro jednotlivé genotypy HCV jsou uvedeny v tab. 1.
Zařazení do současné palety léčiv
Dostupnost daclatasviru spolu s dalšími DAA je zcela zásadním pokrokem v léčbě chronické HCV infekce. Daclatasvir lze užít nejen v režimu s PEG‑IFNα a RBV, ale zejména v kombinaci se sofosbuvirem v léčbě pacientů, u nichž je léčba PEG‑IFNα kontraindikována. Kombinace daclatasviru a sofosbuviru je rovněž vysoce účinná u nemocných, u nichž dříve selhala léčba trojkombinací PEG‑IFNα, RBV a proteázového inhibitoru 1. generace (boceprevir, telaprevir) [6,7,12–15].
Indikace
Daclatasvir je indikován k léčbě dospělých pacientů s chronickou hepatitidou C, vždy v kombinaci s dalšími léčivými přípravky (viz tab. 1), a to jak u pacientů naivních, tak u těch, u nichž selhala předchozí léčba včetně léčby trojkombinací s proteázovým inhibitorem.
Kontraindikace
Daclatasvir je kontraindikován v případě hypersenzitivity na účinnou látku. Současné podávání s léčivými přípravky, které jsou silnými induktory CYP3A4 a P‑gp, může vést k nižší expozici daclatasviru a ke ztrátě jeho účinnosti. Mezi tyto léčivé přípravky patří kromě jiných zejména fenytoin, carbamazepin, oxcarbazepin, phenobarbital, rifampicin, systémově podávaný dexamethason a přípravky obsahující třezalku tečkovanou (Hypericum perforatum) [11]. Kontraindikováno je podání daclatasviru v kombinaci se sofosbuvirem u pacientů, kteří užívají amiodaron.
Nežádoucí účinky
Bezpečnostní profil daclatasviru je založen na údajích z osmi klinických studií zahrnujících celkem 798 pacientů s chronickou hepatitidou C, kteří užívali daclatasvir v dávce 60 mg jednou denně v kombinaci s PEG‑IFNα a RBV (587 pacientů) nebo v kombinaci se sofosbuvirem (s RBV nebo bez RBV, 211 pacientů) [11–15]. Při užití kombinace daclatasviru se sofosbuvirem byly nejčastějšími nežádoucími účinky únava, bolest hlavy a nauzea. Při užití daclatasviru v kombinaci s PEG‑IFNα a RBV byly nejčastěji hlášenými nežádoucími účinky bolest hlavy, únava, svědění, nespavost, chřipkové příznaky (horečka, bolest svalů, bolest kloubů), suchá kůže, padání vlasů, vyrážka, podrážděnost, anémie, kašel, dušnost a průjem. Nejčastějšími nežádoucími účinky 3. stupně závažnosti (s frekvencí vyšší než 1 %) byly anémie, neutropenie a lymfopenie. Bezpečnostní profil daclatasviru v kombinaci s PEG‑IFNα a RBV byl shodný s bezpečnostním profilem dvojkombinace PEG‑IFNα a RBV, včetně skupiny pacientů s cirhózou.
Lékové interakce
Daclatasvir je substrátem CYP3A4 a P‑gp. Silné nebo středně silné induktory těchto enzymů mohou snížit plazmatickou koncentraci daclatasviru a oslabit tak jeho terapeutický účinek. Současné podávání se silnými induktory CYP3A4 a P‑gp je kontraindikováno (viz výše), úprava dávkování se doporučuje při podávání se středně silnými induktory nebo silnými inhibitory CYP3A4 a P‑gp. Silné inhibitory CYP3A4 mohou zvýšit plazmatickou koncentraci daclatasviru, proto se doporučuje úprava dávky.
Při současném podávání atazanaviru 300 mg potencovaného ritonavirem 100 mg je doporučeno podávat daclatasvir v dávce 30 mg jednou denně, stejně tak má být dávka daclatasviru snížena při užití clarithromycinu či ketoconazolu v denní dávce 400 mg. V případě současné léčby efavirenzem v dávce 600 mg denně má být dávka daclatasviru zvýšena na 90 mg za den (v jednom denním podání).
Možnost lékových interakcí má být ověřena při zahájení podávání jakékoliv medikace v průběhu léčby daclatasvirem, včetně volně prodejných léků [11].
Těhotenství a kojení
Údaje o podávání daclatasviru těhotným ženám nejsou k dispozici, studie u zvířat prokázaly embryotoxické a teratogenní účinky, potenciální riziko pro člověka není známo. Daclatasvir nesmí být užíván během těhotenství a u žen ve fertilním věku, které nepoužívají antikoncepci. Pokud se daclatasvir podává v kombinaci s PEG‑IFNα a RBV, platí stran těhotenství a kojení doporučení a upozornění pro tyto léčivé přípravky [11].
Není známo, zda je daclatasvir vylučován do mateřského mléka. Dostupné farmakodynamické a toxikologické údaje u zvířat prokázaly vylučování daclatasviru či jeho metabolitů do mléka, riziko pro novorozence tedy nelze vyloučit. Matky musí být poučeny, aby nekojily, jestliže užívají daclatasvir [11].
Ovlivnění pozornosti
U pacientů, jimž byl podáván daclatasvir v kombinaci se sofosbuvirem, byly během léčby hlášeny závratě; při podávání daclatasviru v kombinaci s PEG‑IFNα a RBV se vyskytly závratě, poruchy pozornosti, rozmazané vidění a snížená zraková ostrost [11].
Dávkování
Léčba daclatasvirem má být zahájena a vedena lékařem se zkušenostmi s léčbou hepatitidy C.
Doporučená dávka daclatasviru je 60 mg jednou denně, je možno ji užít s jídlem nebo bez jídla. Daclatasvir musí být podáván spolu s dalšími léčivými přípravky k léčbě HCV infekce. Úprava dávky z důvodu zvládnutí nežádoucích účinků se nedoporučuje. Jestliže dojde k přerušení podávání léčivých přípravků, které se používají v kombinované léčbě s daclatasvirem, nesmí být daclatasvir dále podáván v monoterapii [11].
Dávka daclatasviru má být snížena na 30 mg jednou denně, pokud je podáván spolu se silnými inhibitory CYP3A4. V případě podávání spolu se středně silnými induktory CYP3A4 (viz odstavec Lékové interakce) se má dávka zvýšit na 90 mg jednou denně.
U pacientů starších 65 let není nutná úprava denní dávky daclatasviru. Úprava dávky rovněž není nutná u pacientů s jakýmkoliv stupněm renální insuficience včetně pacientů chronicky dialyzovaných [16]. U pacientů s poruchou funkce jater mírného stupně (Childovo‑Pughovo skóre A, 5–6 bodů), se středně závažnou poruchou (Childovo‑Pughovo skóre B, 7–9 bodů) a u pacientů se závažnou poruchou funkce jater (Childovo‑Pughovo skóre C, 10 a více bodů) není třeba dávku daclatasviru upravovat [11].
Seznam použité literatury
- [1] European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011; 55: 245–264.
- [2] Zeuzem S, Buti M, Ferenci P, et al. Efficacy of 24 weeks treatment with peginterferon alfa 2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. J Hepatol 2006; 44: 97–103.
- [3] Manns MP, McHutchison JG, Gordon SC, et al. Peginterferon alfa 2b plus ribavirin compared with interferon alfa 2b plus ribavirin for initial treatment of chronic hepati-tis C: a randomised trial. Lancet 2001; 358: 958–965.
- [4] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa 2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347: 975–982.
- [5] Bruggmann P, Berg T, Ovrehus AL, et al. Historical epidemiology of hepatitis C virus (HCV) in selected countries. J Viral Hepat 2014; 21 (Suppl 1): 5–33.
- [6] European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2014. J Hepatol 2014; 61: 373–395.
- [7] AASLD Recommendations for Testing, Managing and Treating Hepatitis C, 2014, dostupné na http://www.hcvguidelines.org (navštíveno 15. 3. 2015)
- [8] Pawlotsky JM. NS5A inhibitors in the treatment of hepatitis C. J Hepatol 2013; 59: 375–382.
- [9] Pelosi LA, Voss S, Liu M, et al. Effect on hepatitis C virus replication of combinations of direct acting antivirals, including NS5A inhibitor daclatasvir. Antimicrob Agents Chemother 2012; 56: 5230–5239.
- [10] Eley T, Sevinsky H, Huang SP, et al. The pharmacokinetics of daclatasvir and asunaprevir administered in combination in studies in healthy subjects and patients infected with hepatitis C virus. Clin Drug Investig 2014; 34: 661–671.
- [11] Souhrn údajů o přípravku Daklinza, dostupné na http://www.daklinza.eu (navštíveno 20. 3. 2015).
- [12] Hézode C, Hirschfield GM, Ghesquiere W, et al. Daclatasvir plus peginterferon alfa and ribavirin for treatment naive chronic hepatitis C genotype 1 or 4 infection: a randomised study. Gut 2014; doi: 10.1136/gutjnl 2014 307498 [Epub ahead of print].
- [13] Hézode C, Altric L, Brown A, et al. Daclatasvir in Combination With Peginterferon Alfa 2a and Ribavirin for Treatment Naive Patients With HCV Genotype 4 Infection: Phase 3 COMMAND 4 Results. ID Week Philadelphia, 8–12 October 2014, Abstr. No. 819.
- [14] Sulkowski MS, Gardiner DF, Rodriguez Torres M, et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med 2014; 370: 211–221.
- [15] Nelson DR, Cooper JN, Lalezari JP, et al. All oral 12 week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY 3 phase III study. Hepatology 2015; 61: 1127–1135.
- [16] Garimella T, Wang R, Luo WL, et al. Single dose pharmacokinetics and safety of daclatasvir in subjects with renal function impairment. Antivir Ther 2015; doi: 10.3851/IMP2941 [Epub ahead of print].