Daptomycin
Daptomycin je antibiotikum z nové skupiny cyklických lipopeptidů. Má rychlý baktericidní účinek na některé grampozitivní koky, významná je jeho aktivita ke kmenům Staphylococcus aureus rezistentním k oxacilinu (MRSA). Má specifický mechanismus účinku, váže se na cytoplazmatickou membránu grampozitivních bakterií, bez průniku do jejich cytoplazmy. Účinkuje na bakterie bez ohledu na jejích růstový cyklus. Daptomycin účinkuje na citlivé bakterie v závislosti na koncentraci, rychle a baktericidně. Dlouhý postantibiotický efekt umožňuje jeho podání jednou denně.
Na základě výsledků studií je používán pro léčbu komplikovaných infekcí kůže a měkkých tkání a také pro léčbu pravostranné stafylokokové endokarditidy.
Úvod
Daptomycin, cyklické lipopeptidové antibiotikum z nové skupiny přirozeně produkovaných antibiotik, byl počátkem 80. let objeven pracovníky Lilly and Company jako fermentační produkt plísně Streptomyces roseosporus. Tato látka s rychlým baktericidním účinkem na některé grampozitivní bakterie, označená jako LY 146032, byla vyvíjena k nitrožilní léčbě, neboť její velká molekula vylučuje vstřebávání ze střeva. Klinické studie na pacientech, provedené v průběhu následujících deseti let, prokázaly účinnost daptomycinu při léčbě infekcí způsobených některými grampozitivními bakteriemi [1, 2]. Licenční celosvětová práva k vývoji daptomycinu získala ve druhé polovině devadesátých let společnost Cubist Pharmaceutical, která také provedla koncem devadesátých let další klinické studie [3]. Na základě výsledků těchto studií schválila americká instituce Food and Drug Administration (FDA) v roce 2003 použití daptomycinu pro léčbu komplikovaných infekcí kůže a měkkých tkání a v roce 2006 pro léčbu bakteriemií včetně pravostranné endokarditidy způsobené Staphylococcus aureus nebo kmeny tohoto druhu rezistentními k léku volby oxacilinu, jež jsou tradičně označovány jako MRSA (methicillin-resistant S. aureus) [4]. V roce 2005 registrovala evropská instituce EMA (European Medicinal Agency) daptomycin pro léčbu infekcí kůže a měkkých tkání způsobených stafylokoky a streptokoky a v roce 2006 také pro léčbu pravostranné endokarditidy způsobené stafylokoky [5]. V České republice byl daptomycin registrován v roce 2006.
Farmakologická skupina
Daptomycin je antibiotikum z nové skupiny cyklických lipopeptidů. Jeho ATC kód je J01XX09.
Chemické a fyzikální vlastnosti
Daptomycin je 13členný aminokyselinový cyklický lipopeptid s vedlejším desetičlenným uhlíkovým řetězcem. Jeho unikátní vlastnosti spočívají v současné přítomnosti lipofilní a hydrofilní oblasti. Chemický název daptomycinu je N-dekanoyl-L-tryptofyl-L-asparaginyl-L-aspartyl-L-threonylglycyl-L-ornithyl-L-aspartyl-D-alanyl-L-aspartylglycyl-D-seryl-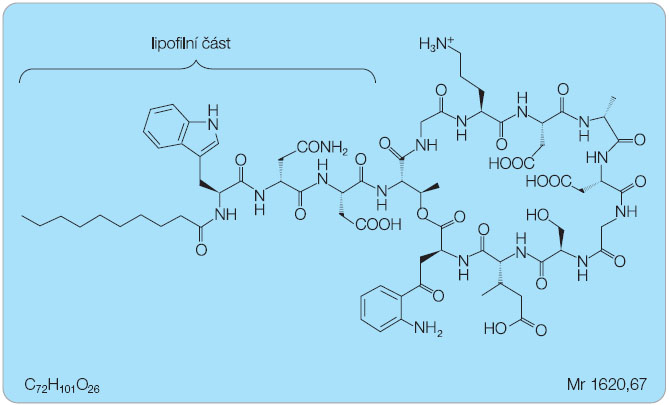 threo-3-methyl-L-glutamyl-3-anthraniloyl-L-alanin-e1-lakton (obr. 1).
threo-3-methyl-L-glutamyl-3-anthraniloyl-L-alanin-e1-lakton (obr. 1).
Sumární vzorec: C72H101O26
Relativní molekulová hmotnost: 1620,67
Farmakodynamika
Mechanismus účinku
Daptomycin se váže na cytoplazmatickou membránu grampozitivních bakterií, aniž proniká do jejich cytoplazmy [6, 7]. Vazba daptomycinu, po níž dochází k inaktivaci mnohočetných funkcí cytoplazmatické membrány, vyžaduje přítomnost iontů vápníku [8]. Unikátní mechanismus účinku daptomycinu způsobuje depolarizaci cytoplazmatické membrány, ukončení syntézy bílkovin, nukleových kyselin [9] a lipoteichoové kyseliny [6] a smrt bakteriální buňky v důsledku efluxu draslíku [9], viz obr. 2. Daptomycin účinkuje bez ohledu na růstový cyklus bakterií, čili působí i na ![Obr. 2 Schematické znázornění mechanismu účinku daptomycinu; volně podle [9] – Silverman, et al., 2003.](https://www.remedia.cz/photo-a-28240---.jpg) bakterie v klidovém stavu. Na rozdíl od tzv. stěnových antibiotik, ke kterým patří např. oxacilin nebo vankomycin, nezpůsobuje daptomycin bakteriální lýzu. Z bakteriální buňky usmrcené daptomycinem se tudíž uvolňuje jen minimum bakteriálních toxinů a jiných fragmentů do krevního oběhu pacienta, a proto je jeho protizánětlivá odpověď a produkce TNF (tumor necrosis factor) nižší [10].
bakterie v klidovém stavu. Na rozdíl od tzv. stěnových antibiotik, ke kterým patří např. oxacilin nebo vankomycin, nezpůsobuje daptomycin bakteriální lýzu. Z bakteriální buňky usmrcené daptomycinem se tudíž uvolňuje jen minimum bakteriálních toxinů a jiných fragmentů do krevního oběhu pacienta, a proto je jeho protizánětlivá odpověď a produkce TNF (tumor necrosis factor) nižší [10].
Antibakteriální aktivita
Daptomycin účinkuje na citlivé bakterie v závislosti na koncentraci, rychle a baktericidně. Má podobné spektrum účinku na bakterie jako vankomycin nebo teikoplanin, od nichž se odlišuje novým mechanismem účinku a baktericidní aktivitou závislou na koncentraci [8]. U kmenů stafylokoků a enterokoků, bez ohledu na jejich citlivost k oxacilinu nebo k vankomycinu, projevil daptomycin do 8 hodin baktericidní účinek, čili došlo k tisícinásobnému snížení původního počtu buněk těchto bakterií [11]. Obecně se předpokládá, že u baktericidně působících antibiotik je nízké riziko vzniku a selekce rezistence.
Postantibiotický účinek (PAE) daptomycinu je rovněž závislý na koncentraci, ve srovnání s penicilinem, vankomycinem a gentamicinem trvá déle a po celou dobu přetrvává v baktericidní aktivitě [12]. Byl pozorován až 6,8 hodiny trvající PAE na S. aureus a Enterococcus faecalis [8], podle jiné studie přetrvával PAE podle druhu bakterie v rozmezí 2,4–5,3 hodiny [12]. Dlouhý PAE umožňuje podávání daptomycinu jednou denně.
Daptomycin v klinicky dosažitelných koncentracích rychle proniká do biofilmu, který je vytvářen stafylokoky [13], a inhibuje jeho tvorbu u zhruba dvou třetin kmenů S. aureus bez ohledu na jejich citlivost k oxacilinu a vankomycinu [14]. Tato skutečnost je významná, neboť biofilm predisponuje vznik a selekci rezistence bakterií a je spojován s perzistencí infekce [15]. V modelu simulujícím farmakokinetiku u člověka s endokarditidou působil daptomycin v dávce 6 mg/kg/den po dobu 24 hodin baktericidně na kmeny S. aureus i MRSA, zatímco vankomycin v dávce 1,25 g podávané po 12 hodinách na tyto kmeny baktericidní účinek nevykazoval; pozorované snížení baktericidního účinku v průběhu prvních 24 hodin při podání kombinace daptomycinu s rifampicinem nebo gentamicinem vyžaduje další studie [16].
Mezi bakterie citlivé k daptomycinu patří většina grampozitivních druhů včetně multirezistentních kmenů těchto bakterií a některých sporulujících i nesporulujících anaerobů. Mezi téměř 22 tisíci kmeny z různých oblastí světa, jejichž citlivost k daptomycinu byla vyšetřena, byly zahrnuty různé druhy rodů Bacillus, Corynebacterium, Enterococcus, Lactobacillus, Listeria, Pediococcus, Staphylococcus, Streptococcus, Clostridium, Peptostreptococcus a Propionibacterium. Většina těchto bakterií byla inhibována koncentrací daptomycinu ≤ 1 mg/l [17]. Distribuce minimálních inhibičních koncentrací (MIC) daptomycinu u těchto bakterií byla unimodální a 90 % kmenů Staphylococcus spp. a Streptococcus spp. inhibovala koncentrace 0,5–1 mg/l. (MIC je nejnižší koncentrace antibiotika, která inhibuje viditelný růst mikroba.) Na gramnegativní bakterie a ostatní mikroby daptomycin nepůsobí.
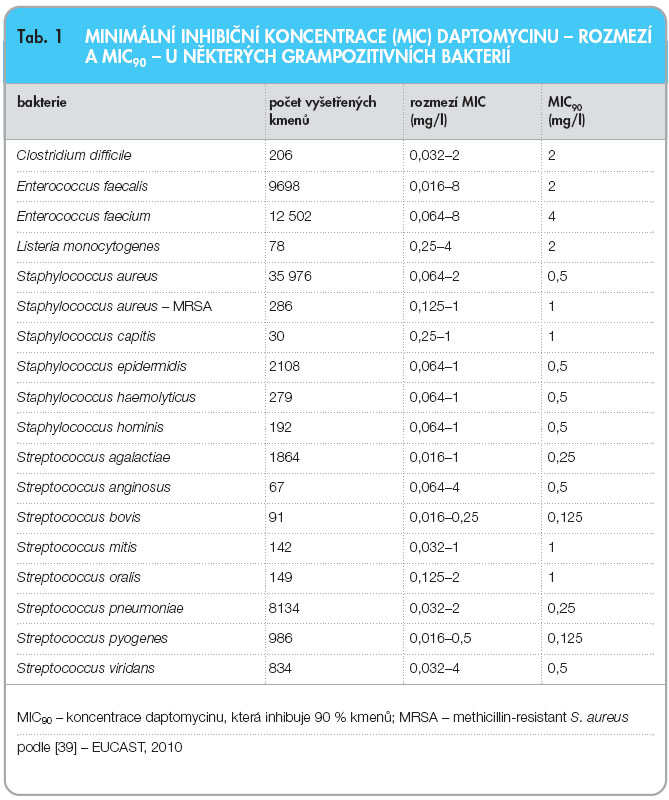 Daptomycin působí in vitro baktericidně také na kmeny MRSA k vankomycinu citlivé (MIC vankomycinu 2 mg/l) i intermediárně rezistentní (MIC vankomycinu 8 mg/l), označované jako VISA (vancomycin-intermediate S. aureus) [18]. Rozmezí MIC a koncentrace daptomycinu, které inhibují 90 % kmenů některých druhů bakterií, jsou uvedeny v tab. 1.
Daptomycin působí in vitro baktericidně také na kmeny MRSA k vankomycinu citlivé (MIC vankomycinu 2 mg/l) i intermediárně rezistentní (MIC vankomycinu 8 mg/l), označované jako VISA (vancomycin-intermediate S. aureus) [18]. Rozmezí MIC a koncentrace daptomycinu, které inhibují 90 % kmenů některých druhů bakterií, jsou uvedeny v tab. 1.
Výsledky surveillance antibiotické rezistence sledované v rámci EARS-Net (European Antimicrobial Resistance Surveillance Network) ukazují, že v mnoha zemích Evropy včetně ČR trvale vzrůstá počet invazivních infekcí způsobených tzv. problémovými grampozitivními bakteriemi S. aureus a Enterococcus faecium, rezistentními k lékům volby (oxacilinu, resp. vankomycinu) [19], pro něž by mohl být daptomycin alternativou.
Rezistence
Frekvence výskytu kmenů grampozitivních bakterií necitlivých k daptomycinu v důsledku spontánních mutací je nízká, např. u S. aureus se vyskytuje ve frekvenci < 10-10 [20]. Předpokládá se, že rezistence vzniká bodovými mutacemi na chromozomu bakterie, v jejichž důsledku dochází k substituci aminokyselin a vytváření atypických proteinů znemožňujících vazbu daptomycinu na cytoplazmatickou membránu [21]. Snížená citlivost k daptomycinu (zvýšená MIC v rozmezí 4–8 mg/l) byla pozorována zejména u některých kmenů MRSA se sníženou citlivostí k vankomycinu (VISA), vyskytla se však i u kmenů S. aureus citlivých k oxacilinu i k ostatním antibiotikům [22]. Kmeny VISA a h-VISA (vancomycin-heterointermediate S. aureus) mají silnou buněčnou stěnu vzniklou hyperprodukcí peptidoglykanu, která znemožňuje vankomycinu proniknout do buňky [23]. U některých kmenů VISA a h-VISA si sice daptomycin zachovává baktericidní aktivitu [24, 25]. Jsou však popsány případy vzestupu MIC daptomycinu během léčby tímto antibiotikem u infekcí způsobených kmeny S. aureus bez ohledu na jejich citlivost k oxacilinu nebo vankomycinu [26–28], zejména při prolongovaném podávání a u pacientů s komorbiditami a v přítomnosti subinhibičních koncentrací, které jsou obvyklé na endokardiálních vegetacích [27, 29, 30]. Podobně léčba daptomycinem selhala u některých infekcí způsobených jinými druhy bakterií, zejména enterokoky inherentně rezistentními k vankomycinu (Enterococcus durans) [31] nebo se získanou rezistencí k vankomycinu (Enterococcus faecalis, Enterococcus faecium) [32, 33]. Selhání daptomycinu při léčbě infekce způsobené multirezistentním kmenem Corynebacterium jeikeium vysoce rezistentním k daptomycinu (MIC > 256 mg/l) upozorňuje na nezbytnost rutinně vyšetřovat citlivosti k daptomycinu v laboratoři, zejména u izolátů bakterií z krve [34].
Metody vyšetření citlivosti a interpretace výsledků
Účinek daptomycinu in vitro značně ovlivňuje nízká koncentrace iontů vápníku [35], která falešně zvyšuje MIC tohoto antibiotika. Z toho důvodu musí kultivační půda, zvolená podle kultivačních nároků vyšetřované bakterie, obsahovat 50 mg/l iontů vápníku [36, 37]. Metodou volby je vyšetření MIC diluční mikrometodou v mikrotitračních destičkách. Pro vyšetřování stafylokoků se používá Mueller Hinton bujon (MHB), při vyšetření citlivosti streptokoků se MHB 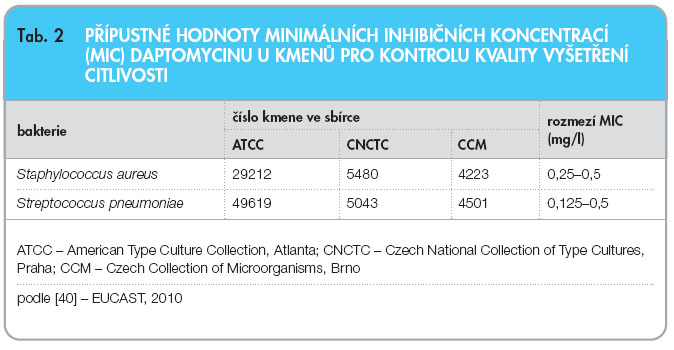 doplňuje 2,5–5 % lyzované koňské krve [36]. Četné diskrepance ve výsledcích, které se vyskytují při vyšetření citlivosti bakterií k daptomycinu v agaru, doposud znemožňují používat agarovou metodu vyšetření MIC i diskovou difuzní metodu [36, 37]. Je nutno zdůraznit dodržování postupu vyšetření citlivosti diluční mikrometodou podle doporučené metody [38–40], neboť výsledky MIC daptomycinu ovlivňuje koncentrace inokula [17].
doplňuje 2,5–5 % lyzované koňské krve [36]. Četné diskrepance ve výsledcích, které se vyskytují při vyšetření citlivosti bakterií k daptomycinu v agaru, doposud znemožňují používat agarovou metodu vyšetření MIC i diskovou difuzní metodu [36, 37]. Je nutno zdůraznit dodržování postupu vyšetření citlivosti diluční mikrometodou podle doporučené metody [38–40], neboť výsledky MIC daptomycinu ovlivňuje koncentrace inokula [17].
MIC daptomycinu u kontrolních kmenů je uvedena v tab. 2.
Hodnoty pro klinickou interpretaci výsledků vyšetření citlivosti bakterií k daptomycinu (zkráceně označené jako breakpointy) jsou k dispozici jen pro původce infekcí, u nichž byla potvrzena také klinická účinnost tohoto antibiotika. Tuto podmínku respektují obě mezinárodně uznávané instituce, americká CLSI (Clinical and Laboratory Standards Institute) [36] i evropská EUCAST (European Committee on Antimicrobial Susceptibility Testing) [37]. EUCAST i CLSI uvádějí shodně breakpoint ≤ 1 mg/l daptomycinu pro citlivé kmeny stafylokoků a streptokoků s výjimkou Streptococcus pneumoniae, neboť podle výsledků klinických studií daptomycin není účinný při léčbě pneumonie [36, 37]. EUCAST zatím považuje klinickou dokumentaci pro použití daptomycinu při léčbě infekcí způsobených enterokoky a některými dalšími grampozitivními kmeny za nedostatečnou a breakpoint pro tyto bakterie neuvádí [35, 37], zatímco breakpoint CLSI pro enterokoky je ≤ 4 mg/l [36]. V této souvislosti je nutno zdůraznit, že doposud celosvětově vzácně se vyskytující kmeny stafylokoků a streptokoků, které mají při vyšetření v laboratoři MIC daptomycinu vyšší než 1 mg/l, by měly být zasílány do Národní referenční laboratoře pro antibiotika SZÚ k další analýze.
Farmakokinetické vlastnosti
Daptomycin vykazuje in vitro rapidní, na koncentraci závislou baktericidní aktivitu proti senzitivním grampozitivním organismům. U zdravých jedinců byla po podání 30minutové intravenózní infuze či 2minutové intravenózní injekce zjištěna srovnatelná expozice (AUC a cmax). V modelech na zvířatech AUC/MIC a cmax/MIC koreluje s účinností a predikovaným usmrcením bakterií in vivo při jednorázových dávkách ekvivalentních lidským dávkám 4 mg/kg a 6 mg/kg jednou denně. Farmakokinetika daptomycinu je obecně lineární a nezávislá na čase při dávkách 4 až 12 mg/kg podávaných jako jednorázové denní dávky 30minutovou intravenózní infuzí po dobu až 14 dní zdravým dobrovolníkům. Koncentrací odpovídajících rovnovážnému stavu se dosahuje při třetí denní dávce [41–43]. Studie prováděné na zvířatech týkající se distribuce ve tkáních ukázaly, že daptomycin je po jednorázovém podání i opakovaném podávání přednostně distribuován do vysoce vaskularizovaných tkání a v menší míře prostupuje hematoencefalickou bariérou a placentární bariérou. Distribuční objem (Vd) daptomycinu v rovnovážném stavu byl přibližně 0,1 l/kg u zdravých dospělých dobrovolníků, v souladu s distribucí primárně v extracelulárním prostoru. Daptomycin je reverzibilně vázán na proteiny v lidské plazmě způsobem nezávislým na koncentraci. U zdravých 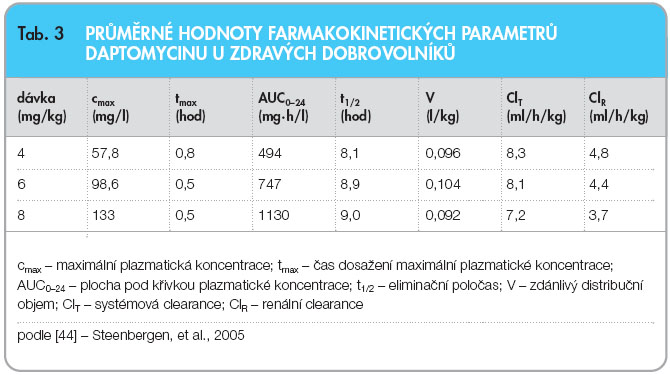 dobrovolníků a pacientů léčených daptomycinem činila vazba na proteiny v průměru asi 90 %, včetně osob s renální insuficiencí. Analýza vzorků plazmy od osob, kterým byla podána dávka daptomycinu 6 mg/kg, neprokázala žádnou stopu metabolismu, což svědčí o nízkém až žádném systémovém metabolismu, viz tab. 3 [5, 41, 44]. Dále nebyly v plazmě pozorovány žádné metabolity po podání radioaktivně značeného léku lidem na základě stanovení celkové radioaktivity a mikrobiologicky účinných koncentrací. Ze čtyř minoritních metabolitů detekovaných v moči jsou dva oxidativní metabolity fáze I přítomny v nízkých koncentracích. Daptomycin je vylučován primárně ledvinami. Současné podávání probenecidu a daptomycinu nemá žádný vliv na farmakokinetiku daptomycinu u lidí, což svědčí o minimální až žádné aktivní tubulární sekreci daptomycinu. Po nitrožilním podání je plazmatická clearance daptomycinu přibližně 7 až 9 ml/h/kg a renální clearance daptomycinu je 4 až 7 ml/h/kg [5, 41, 45, 46].
dobrovolníků a pacientů léčených daptomycinem činila vazba na proteiny v průměru asi 90 %, včetně osob s renální insuficiencí. Analýza vzorků plazmy od osob, kterým byla podána dávka daptomycinu 6 mg/kg, neprokázala žádnou stopu metabolismu, což svědčí o nízkém až žádném systémovém metabolismu, viz tab. 3 [5, 41, 44]. Dále nebyly v plazmě pozorovány žádné metabolity po podání radioaktivně značeného léku lidem na základě stanovení celkové radioaktivity a mikrobiologicky účinných koncentrací. Ze čtyř minoritních metabolitů detekovaných v moči jsou dva oxidativní metabolity fáze I přítomny v nízkých koncentracích. Daptomycin je vylučován primárně ledvinami. Současné podávání probenecidu a daptomycinu nemá žádný vliv na farmakokinetiku daptomycinu u lidí, což svědčí o minimální až žádné aktivní tubulární sekreci daptomycinu. Po nitrožilním podání je plazmatická clearance daptomycinu přibližně 7 až 9 ml/h/kg a renální clearance daptomycinu je 4 až 7 ml/h/kg [5, 41, 45, 46].
Ve studii hmotové bilance prováděné s využitím radioaktivně značeného materiálu bylo 78 % podané dávky izolováno z moči na základě celkové radioaktivity, zatímco nález nezměněného daptomycinu v moči byl přibližně 50 % dávky. Přibližně 5 % podaného radioaktivně značeného materiálu bylo vyloučeno stolicí.
Studie na zvířatech ukázaly, že po perorálním podání není daptomycin v žádném významnějším rozsahu absorbován [44].
Předběžné klinické zkušenosti
Daptomycin je většinou používán jako lék v sekundární linii, nejčastěji po předchozí léčbě vankomycinem. V USA bylo retrospektivně hodnoceno 1227 pacientů, u nichž byl kultivačně prokázán Staphylococcus aureus. Jako lék první volby byl daptomycin podán 250 pacientům (20 %), 977 pacientů (80 %) bylo daptomycinem léčeno po předchozí léčbě jiným antibiotikem. Čtvrtina pacientů byla starších 65 let. Iniciální průměrná dávka byla 5,1 mg/kg a byla vyšší u pacientů s endokarditidou (5,9 mg/kg) a nižší u nekomplikovaných kožních infekcí (4,4 mg/kg). Klinický úspěch, potvrzený u 1140 pacientů (93 %), byl zaznamenán shodně v obou skupinách bez ohledu na to, zda byl daptomycin podán jako první, nebo následné antibiotikum [47–51]. Od října 2006 bylo většinou v USA daptomycinem léčeno kolem 150 000 pacientů. Přibližně jedna třetina byla léčena ambulantně [45].
Nejvíce klinických studií bylo uskutečněno s pacienty se závažnými kožními infekcemi, dále u pacientů s endokarditidou a také u malého počtu pacientů s osteomyelitidou [45, 48, 49, 52, 53]. Podle výsledků dvou klinických studií organizovaných výrobcem není daptomycin účinný při léčbě pneumonie způsobené Streptococcus pneumoniae [45, 46].
Daptomycin v Evropě a v ČR
European Medicinal Agency (EMA) registrovala daptomycin v roce 2005 pro léčbu závažných infekcí kůže a měkkých tkání způsobených stafylokoky a streptokoky (kromě Streptococcus pneumoniae) a v roce 2006 povolila léčbu pravostranné endokarditidy způsobené Staphylococcus aureus, včetně bakteriemie sdružené s tímto onemocněním nebo s infekcí kůže nebo měkkých tkání [5, 46].
V České republice byl daptomycin registrován v lednu 2006.
Indikace
Daptomycin je účinný pouze proti grampozitivním bakteriím. Je doporučeno, aby rozhodnutí o použití daptomycinu bylo učiněno na základě antibakteriální citlivosti organismu a po konzultaci s antibiotickým střediskem. Je indikován k léčbě následujících infekcí u dospělých: komplikované kožní infekce a infekce měkkých tkání (cSSTI), pravostranná infekční endokarditida (RIE) vyvolaná Staphylococcus aureus, bakteriemie způsobená Staphylococcus aureus (SAB), pokud je doprovázena RIE nebo cSSTI [41, 45, 47, 49].
V případě smíšených infekcí, kde je podezření na gramnegativní bakterie a/nebo určité typy anaerobních bakterií, by měl být daptomycin podáván společně s vhodným(i) antibakteriálním(i) agens.
Kontraindikace
Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku tohoto přípravku.
Nežádoucí účinky
Daptomycin je dobře tolerován v dávce 4–6 mg/kg podávané jednou denně. V klinické studii se nežádoucí účinky různé závažnosti vyskytly u 94 (18 %) z 534 pacientů léčených daptomycinem a u 119 (21 %) z 558 pacientů, jimž byl podáván srovnávací přípravek. Léčba byla přerušena v obou skupinách ve 2,8 %. Nežádoucí účinky byly se stejnou četností zaznamenány jak u daptomycinu, tak u srovnávacích režimů. Nejčastějšími nežádoucími účinky (3–6 %) byly zácpa, nauzea a zvracení, průjem a vyrážka. Vzestup hladin kreatinkinázy (CK) byl pozorován u 15 pacientů (2,8 %), u dvou bylo nutné léčbu přerušit. K úpravě hladin CK došlo u všech pacientů do dvou týdnů po ukončení léčby. U pacientů s endokarditidou, resp. s bakteriemií, byl zjištěn zřetelně vyšší vzestup hladin CK při podávání daptomycinu než při podávání srovnávacího přípravku. Dalším významnějším nežádoucím účinkem ve skupině léčených daptomycinem byla periferní neuropatie, která se však častěji vyskytovala u pacientů léčených komparátorem [41].
Po uvedení na trh v rámci sledování přípravku byly zaznamenány ještě tyto nežádoucí účinky: poruchy imunitního systému (přecitlivělost projevující se ojedinělými spontánními projevy, jako je např. pulmonální eozinofilie, vezikobulózní vyrážka s postižením sliznice a pocit orofaryngeálního zduření). V klinických studiích byl daptomycin podán 2011 osobám. Během těchto studií dostávalo 1221 osob denní dávku 4 mg/kg, z toho bylo 1108 pacientů a 113 zdravých dobrovolníků; 460 osob dostávalo denní dávku 6 mg/kg, z toho bylo 304 pacientů a 156 zdravých dobrovolníků. U osob, kterým byl podáván daptomycin v průběhu léčby a dalšího sledování, byly nejčastěji zaznamenány tyto nežádoucí účinky: bolesti hlavy, nauzea, zvracení, průjem, mykotické infekce, vyrážka, reakce v místě infuze, zvýšená hladina kreatinfosfokinázy (CPK) a abnormální hodnoty jaterních enzymů: alaninaminotransferázy (ALT), aspartátaminotransferázy (AST), alkalické fosfatázy. Byla také popsána eozinofilní pneumonie indukovaná daptomycinem [41, 45, 54, 55].
V případě předávkování se doporučuje podpůrná léčebná péče. Daptomycin je z těla pomalu vylučován hemodialýzou (přibližně 15 % podané dávky je odstraněno za 4 hodiny) nebo peritoneální dialýzou (přibližně 11 % podané dávky je odstraněno za 48 hodin) [5, 46]. Kolitida související s antibiotiky a pseudomembránová kolitida byly zaznamenány téměř u všech antibakteriálních agens a jejich závažnost se může pohybovat v rozmezí od mírné až po život ohrožující. Proto je důležité brát tuto diagnózu v úvahu u pacientů s průjmem, který vznikl v průběhu léčby nebo brzy po jejím skončení.
Lékové interakce
Daptomycin není in vitro metabolizován jaterními mikrozomy a neinhibuje ani neindukuje cytochrom P-450. Vzhledem k tomu nebyly zaznamenány klinicky signifikantní farmakokinetické interakce při současném podávání tobramycinu, aztreonamu, warfarinu, gentamicinu nebo probenecidu. Při dávce 2 mg/kg tobramycinu byly popsány nevýznamné farmakokinetické změny. K potenciální interakci může však dojít při vzestupu koncentrace daptomycinu, pokud je podáván souběžně s léky, které snižují renální filtraci. Nebyla zaznamenána interakce mezi daptomycinem a simvastatinem, je ale nutné monitorovat hladiny CK častěji, pokud jsou oba přípravky podávány souběžně. Daptomycin je primárně vylučován renální filtrací, a tak mohou být plazmatické hladiny zvýšené při současném podávání s léčivými přípravky, které snižují renální filtraci (např. NSAID a inhibitory COX-2). Navíc existuje potenciál výskytu farmakodynamické interakce v průběhu současného podávání v důsledku aditivních renálních účinků. Proto se doporučuje obezřetnost, jestliže je daptomycin podáván současně s jakýmkoli dalším léčivým přípravkem, o němž je známo, že snižuje renální filtraci [41, 44, 45].
V průběhu sledování přípravku po jeho uvedení na trh byly zaznamenány případy interference mezi daptomycinem a určitým reagens, které se používá při některých testech protrombinového času/mezinárodně normalizovaného poměru (PT/INR). Možnost chybných výsledků lze minimalizovat odběrem vzorků pro stanovení PT nebo INR přibližně v době, kdy jsou koncentrace daptomycinu v plazmě minimální [5, 46].
Dávkování
Daptomycin se podává nitrožilně každých 24 hodin buď jednorázově intravenózní injekcí nebo infuzí. Obě metody podání daptomycinu, 2minutová intravenózní injekce a 30minutová intravenózní infuze, měly na základě výsledků farmakokinetických studií u dobrovolníků podobnou bezpečnost a profil snášenlivosti. Mezi metodami nebyl významný rozdíl v místní snášenlivosti nebo v povaze a četnosti nežádoucích účinků.
Ve Spojených státech doporučila FDA v září 2003 a v Evropě EMEA v lednu 2006 v léčbě komplikovaných kožních infekcí a měkkých tkání vyvolaných grampozitivními mikroorganismy bez současné bakteriemie dávku 4 mg/kg/den podávanou jednou denně po dobu 7–14 dní nebo do vyléčení infekce. Později, v březnu 2006, FDA určila pro léčení stafylokokové sepse a pravostranné stafylokokové endokarditidy dávku 6 mg/kg jedn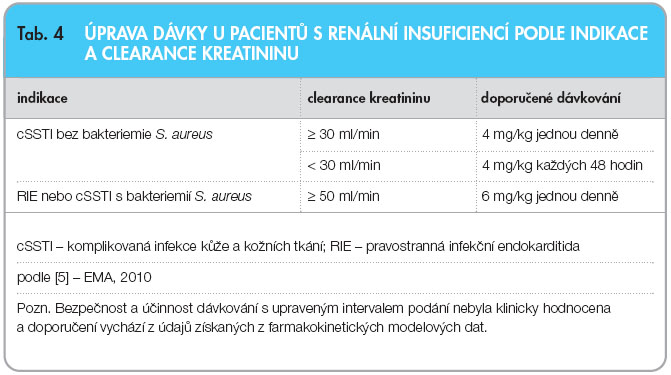 ou denně. Potřebná délka terapie může překročit 14 dní v souladu s předpokládaným rizikem komplikací u jednotlivého pacienta. U pacientů s nedostatečností ledvin (Clkr < 30 ml/min) se interval podání prodlužuje, viz tab. 4. Při podávání daptomycinu pacientům s mírnou nebo střední jaterní nedostatečností (Childova-Pughova třída B) není nutná žádná úprava dávkování. U pacientů s těžkou jaterní nedostatečností (Childova-Pughova třída C) nejsou k dispozici žádné údaje. U starších pacientů se používá doporučené dávkování, s výjimkou pacientů s těžkou renální insuficiencí [4, 5, 48].
ou denně. Potřebná délka terapie může překročit 14 dní v souladu s předpokládaným rizikem komplikací u jednotlivého pacienta. U pacientů s nedostatečností ledvin (Clkr < 30 ml/min) se interval podání prodlužuje, viz tab. 4. Při podávání daptomycinu pacientům s mírnou nebo střední jaterní nedostatečností (Childova-Pughova třída B) není nutná žádná úprava dávkování. U pacientů s těžkou jaterní nedostatečností (Childova-Pughova třída C) nejsou k dispozici žádné údaje. U starších pacientů se používá doporučené dávkování, s výjimkou pacientů s těžkou renální insuficiencí [4, 5, 48].
Podávání daptomycinu dětem a mladistvým do 18 let věku se vzhledem k nedostatečným údajům o bezpečnosti a účinnosti nedoporučuje.
Balení
Dostupné v balení obsahujícím 1 lahvičku k jednorázovému použití z čirého skla typu I o objemu 10 ml, s pryžovými zátkami typu I a hliníkovými uzávěry se žlutými plastovými odskakovacími víčky. Jedna injekční lahvička obsahuje daptomycinum 350 mg. Po rekonstituci s použitím 7 ml roztoku chloridu sodného 9 mg/ml (0,9 %) nebo vody na injekci je v jednom ml obsaženo 50 mg daptomycinu. Rekonstituovaný roztok je čirý.
Stabilita
Léčivý přípravek je nutno uchovávat v chladničce (2–8 °C). Doba použitelnosti je 3 roky. Pro použití rekonstituovaného roztoku v injekční lahvičce byla chemická a fyzikální stabilita prokázána po dobu 12 hodin při teplotě 25 °C a až 48 hodin při teplotě 2–8 °C po rekonstituci. Chemická a fyzikální stabilita naředěného roztoku v infuzních vacích je stanovena na 12 hodin při teplotě 25 °C nebo 24 hodin při teplotě 2–8 °C.
Součet doby uchovávání pro 30minutovou intravenózní infuzi (rekonstituovaný roztok v injekční lahvičce a naředěný roztok v infuzním vaku) při teplotě 25 °C nesmí překročit 12 hodin (nebo 24 hodin při teplotě 2–8 °C). Doba uchovávání rekonstituovaného roztoku v injekční lahvičce pro 2minutovou intravenózní injekci při teplotě 25 °C nesmí překročit 12 hodin (nebo 48 hodin při teplotě 2–8 °C).
Daptomycin není fyzikálně ani chemicky kompatibilní s roztoky obsahujícími glukózu [46].
Pozn. V tomto textu je termín antibiotikum použit pro označení všech látek s antibakteriálním účinkem.
Seznam použité literatury
- [1] Kaatz GW, Seo S, Reddy VN, et al. Daptomycin compared with teicoplanin and vancomycin for therapy of experimental Staphylococcus aureus endocarditis. Antimicrob Agents Chemother 1990; 34: 2081–2085.
- [2] Kotra LP. Daptomycin. Current opinion in anti-infective investigational drugs 2000; 2: 185–205.
- [3] Tally FP, DeBruin MF. Development of daptomycin for gram-positive infections. J Antimicrob Chemother 2000; 46: 523–526.
- [4] FDA. Cubicin® (daptomycin injection) for the treatment Staphylococcus aureus bacteremia, including those with known or suspected infective endocarditis. FDA briefing document for anti-infective drugs Advisory Committee Meeting, March 6, 2006.
- [5] EMA. Cubicin Summary of Product Characteristics. Dostupné na: http://www.ema.europa.eu/ docs/en_GB/document_library/EPAR_-_Product_ Information/human/000637/WC500036049.pdf
- [6] Canepari P, Boaretti M, Lleó MM, Satta G. Lipoteichoic acid as a new target for activity of antibiotics: mode of action of daptomycin (LY 146032). Antimicrob Agents Chemother 1990; 34: 1220–1226.
- [7] Alborn WE, Allen NE, Preston, DA. Daptomycin disrupts membrane potential in growing Staphylococcus aureus. Antimicrob Agents Chemother 1991; 35: 2282–2287.
- [8] Hanberger H, Nilsson LE, Maller R, Isaksson B. Pharmacodynamics of daptomycin and vancomycin on Enterococcus faecalis and Staphylococcus aureus demonstrated by studies of initial killing and postantibiotic effect and influence of Ca+ and albumin on these drugs. Antimicrob Agents Chemother 1991; 35: 1710–1716.
- [9] Silverman JA, Perlmutter NG, Shapiro HM. Correlation of daptomycin bactericidal activity and membrane depolarization in Staphylococcus aureus. Antimicrob Agents Chemother 2003; 47: 2538–2544.
- [10] English BK, Maryniw EM, Talati AJ, et al. Diminished macrophage inflammatory response in Staphylococcus aureus isolates exposed to daptomycin versus oxacillin and vancomycin. Antimicrob Agents Chemother 2008; 50: 2225–2227.
- [11] Rybak MJ, Hershberger E, Moldovan T, et al. In vitro activities of daptomycin, vancomycin, linezolid, and quinupristin-dalfopristin against staphylococci and enterococci, including vancomycin-intermediate and resistant strains. Antimicrob Agents Chemother 2000; 44: 1062–1066.
- [12] Bush LM, Boscia JA, Wendeler M, et al. In vitro postantibiotic effect of daptomycin (LY 146032) against Enterococcus faecalis and methicillin-susceptible and methicillin-resistant Staphylococcus aureus strains. Antimicrob Agents Chemother 1989; 33: 1198–1200.
- [13] Stewart PS, Davison WM, Steenbergen JN. Daptomycin rapidly penetrates a Staphylococcus epidermidis biofilm. Antimicrob Agents Chemother 2009; 53: 3505–3507.
- [14] Roveta S, Marchese A, Schito GC. Activity of daptomycin on biofilms produced on a plastic support by Staphylococcus spp. Int J Antimicrob Agents 2008; 31: 321–328.
- [15] Fux CA, Costerton JW, Stewart PS, et al. Survival strategies of infectious biofilm. Trends Microbiol 2005; 13: 34–40.
- [16] LaPlante KL, Woodmansee S. Activities of daptomycin and vancomycin with rifampin and gentamicin against biofilm-forming methicillin-resistant Staphylococcus aureus isolates in an experimental model of endocarditis. Antimicrob Agents Chemother 2009; 53: 3880–3886.
- [17] Microbiology review. Cubicin. Dostupné na: http: //www.accessdata.fda.gov/drugsatfda_docs/nda/2003/21-572_Cubicin_Microbr_P1.pdf
- [18] Marco F, García de la Mária C, Armero Y, et al. Daptomycin is effective in treatment of experimental endocarditis due to methicillin-resistant and glycopeptide-intermediate Staphylococcus aureus. Antimicrob Agents Chemother 2008; 52: 2538–2543.
- [19] Antimicrobial resistance surveillance in Europe 2009. Dostupné na: http://www.ecdc.europa. eu/en/publications/Publications/1011_SUR_annual_EARS_Net_2009.pdf
- [20] Silverman JA, Oliver N, Andrew T, et al. Resistance studies with daptomycin. Antimicrob Agents Chemother 2001; 45: 1799–1802.
- [21] Friedman L, Alder JD, Silverman JA. Genetic changes that correlate with reduced susceptibility to daptomycin in Staphylococcus aureus. Antimicrob Agents Chemother 2006; 50: 2137–2145.
- [22] Sakoulas G, Rose W, Rybak MJ, et al. Evaluation of endocarditis caused by methicillin-susceptible Staphylococcus aureus developing nonsusceptibility to daptomycin. J Clin Microbiol 2008; 46: 220–224.
- [23] Cui L, Tominaga E, Neoh HM, Hiramatsu K. Correlation between reduced daptomycin susceptibility and vancomycin resistance in vancomycin,
- [24] Akins RL, Rybak MJ. Bactericidal activities of two daptomycin regimens against clinical strains of glycopeptide intermediate-resistant Staphylococcus aureus, vancomycin-resistant Enterococcus faecium, and methicillin-resistant Staphylococcus aureus isolates in an in vitro pharmacodynamic model with simulated endocardial vegetations. Antimicrob Agents Chemother 2001; 45: 454–459.
- [25] Howden BP, Ward PB, Charles PG, et al. Treatment outcomes for serious infections caused by methicillin-resistant Staphylococcus aureus with reduced vancomycin susceptibility. Clin Infect Dis 2004; 38: 521–528.
- [26] Hayden MK, Rezai K, Hayes RA, et al. Development of daptomycin resistance in vivo in methicillin-resistant Staphylococcus aureus. J Clin Microbiol 2005; 43: 5285–5287.
- [27] Hirschwerk D, Ginocchio CC, Bythrow M, Condon S. Diminished susceptibility to daptomycin accompanied by clinical failure in a patient with methicillin-resistant Staphylococcus aureus bacteremia. Infect Control Hosp Epidemiol 2006; 27: 315–317.
- [28] Marty FM, Yeh WW, Wennersten CB, et al. Emergence of a clinical daptomycin-resistant Staphylococcus aureus isolate during treatment of methicillin-resistant Staphylococcus aureus bacteremia and osteomyelitis. J Clin Microbiol 2006; 44: 595–597.
- [29] Jones T, Yeaman MR, Sakoulas G, et al. Failures in clinical treatment of Staphylococcus aureus infection with daptomycin are associated with alterations in surface charge, membrane phospholipid asymmetry, and drug. Antimicrob Agents Chemother 2008; 52: 269–278.
- [30] Skiest DJ. Treatment failure resulting from resistance of Staphylococcus aureus to daptomycin. J Clin Microbiol 2006; 44: 655–656.
- [31] Green MR, Anasetti C, Sandin RL, et al. Development of daptomycin resistance in a bone marrow-transplant patient with vancomycin-resistant Enterococcus durans. J Oncol Pharm Pract 2006; 12: 179–181.
- [32] Long JK, Choueiri TK, Hall GS, et al. Daptomycin-resistant Enterococcus faecium in a patient with acute myeloid leukemia. Mayo Clin Proc 2005; 80: 1215–1216.
- [33] Munoz-Price LS, Lolans K, Quinn JP. Emergence of resistance to daptomycin during treatment of vancomycin-resistant Enterococcus faecalis infection. Clin Infect Dis 2005; 41: 565–566.
- [34] Schoen C, Unzicker C, Stuhler G, et al. Life-threatening infection caused by daptomycin-resistant Corynebacterium jeikeium in a neutropenic patient. J Clin Microbiol 2009; 47: 2328–2331.
- [35] EUCAST technical note on daptomycin. The European Committee on Antimicrobial Susceptibility Testing (EUCAST) Steering Committee. Clin Microbiol Infect 2006; 12: 599–601. Dostupné také na: http: //www.eucast.org/fileadmin/src/media/ PDFs/4ESCMID_Library/3Publications/EUCAST_Documents/Technical_Notes/EUCAST_clm_1455.pdf
- [36] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; twentieth informational supplement. CLSI Document M100–S20. Clinical and Laboratory Standards Institute, USA, Pa, 2010.
- [37] European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. Version 1,1 April 2010. Dostupné na: http: //www.eucast.org/clinical_breakpoints/
- [38] Urbášková P. Vyšetření citlivosti k antibotikům. Vybrané metody. ISBN 80–238–3106–2. Trios Praha 1998.
- [39] EUCAST European Committee on Antimicrobial Susceptibility Testing. MIC distributions. Dostupné na: http: //www.eucast.org/mic_distributions/
- [40] EUCAST European Committee on Antimicrobial Susceptibility Testing. EUCAST quality control. Dostupné na: http: //www.eucast.org/eucast_ disk_diffusion_test/eucast_qc_tables/
- [41] Hair PI and Keam SJ. Daptomycin. A review of its use in the management of complicated skin and soft-tissue infections and Staphylococcus aureus bacteremia. Drugs 2007; 67: 1483–1512.
- [42] Safdar N, Andes D, Craig WA. In vivo pharmacodynamic activity of daptomycin. Antimicrob Agents Chemother 2002; 46: 31–33.
- [43] Wise R, Gee T, Andrews JM, et al. Pharmacokinetics and inflammatory fluid penetration of intravenous daptomycin in volunteers. Antimicrob Agents Chemotherap 2002; 46: 31–33.
- [44] Steenbergen JN, Alder J, Thorne GM, Tally FP. Daptomycin: a lipopeptide antibiotic for treatment of serious Gram-positive infections. J Antimicrob Chemother 2005; 55: 283–288.
- [45] Enoch DA, Bygott JM, Daly ML, Karas JA. Daptomycin. J Infect 2007; 55: 205–213.
- [46] Cubicin. Product monograph. Chiron 2006.
- [47] Sakoulas G, Brown J, Lamp KC, et al. Clinical outcomes of patients receiving daptomycin for the treatment of Staphylococcus aureus infection and assessment of clinical factors for daptomycin failure: a retrospective cohort study utilizing the Cubicin outcomes registry and experience. Clin Ther 2009; 31: 1936–1945.
- [48] Owens Jr RC, Lamp KC, Friedrich LV, Russo R. Postmarketing clinical experience with skin-structure infections treated with daptomycin. Amer J Med 2007; 120: S6–S12.
- [49] Levine DP, Lamp KC. Daptomycin in the treatment of patients with infective endocarditis: experience from a registry. Amer J Med 2007; 120: S28–S33.
- [50] Fowler Jr VG, Boucher HW, Corey GR, et al. Daptomycin versus standard therapy for bacteremia and endocarditis caused by Staphylococcus aureus. N Engl J Med 2006; 355: 653–665.
- [51] Martone WJ, Lamp KC. Efficacy of daptomycin in complicated skin and skin structure infections due to methicillin sensitive and -resistant Staphylococcus aureus: results from CORE registry. Curr Med Res Opin 2006; 22: 2337–2343.
- [52] Sakoulas G, Golan Y, Lamp KC, et al. Daptomycin in the treatment of bacteremia. Amer J Med 2007; 120: S21–S27.
- [53] Bassetti M, Nicco H, Ginocchio F, et al. High-dose daptomycin in documented Staphylococcus aureus infections. Int J Antimicrob Agents 2010; 36: 459–461.
- [54] Hayes Jr D, Anstead MI, Kun RJ. Eosinophilic pneumonia induced by daptomycin. J Infect 2007; 54: e 211–e 213.
- [55] Arbeit RD, Maki D, Tailly FP, et al. The safety and efficacy of daptomycin for the treatment of complicated skin and skin structure infection. Clin Infect Dis 2004; 38: 1637–1681.