Daratumumab – průlomová monoklonální protilátka v léčbě mnohočetného myelomu
Souhrn:
Mnohočetný myelom je agresivní hematoonkologické onemocnění, které zaznamenalo v posledních letech poměrně zásadní vývoj v možnostech léčby. Terapie pomocí monoklonálních protilátek byla dosud vyhrazena jen pro lymfomové či vzácněji leukemické choroby, ale nyní je cílem této léčby rovněž mnohočetný myelom. Anti‑CD38 (daratumumab) je humánní monoklonální protilátka vázající se na antigen CD38 exprimovaný preferenčně na myelomových buňkách. Pomocí navázání protilátky na cílový antigen, následné aktivace protilátkové cytotoxicity a také komplementové reakce spouští v těle řadu cílených imunologických pochodů. Před zahájením léčby je nutné podání premedikace, ale výskyt nežádoucích účinků se snižuje s dalším užíváním daratumumabu. Účinnost terapie byla potvrzena v několika klinických studiích u pacientů s relabujícím/refrakterním mnohočetným myelomem (GEN501, SIRIUS, CASTOR, POLLUX) a nadále probíhají sledování využívající daratumumab v primoterapii (ALCYONE, CASSIOPEIA).
Key words: multiple myeloma – daratumumab – monoclonal antibody.
Summary:
Multiple myeloma is an aggressive hemato‑oncological disease, with fairly significant development in the range of treatment options in the last decades. The therapy with monoclonal antibodies has been restricted to lymphoma or rare leukemic diseases up till now but currently, multiple myeloma is the target of this type of therapy as well. Anti‑CD38 antibody (daratumumab) is a human monoclonal antibody binding to the CD38 antigen expressed preferentially on the myeloma cells. It initiates a range of targeted immunological processes in the body by binding to the target antigen, subsequent activation of the antibody‑dependent cytotoxicity, and complement reaction as well. Premedication is necessary before the initiation of treatment but adverse reaction occurrence declines with further use of daratumumab. Efficacy of the treatment has been confirmed in several clinical trials in patients with relapsed/refractory multiple myeloma (GEN501, SIRIUS, CASTOR, POLLUX) and other evaluations using daratumumab in primary therapy are currently underway (ALCYONE, CASSIOPEIA).
Úvod
Léčba mnohočetného myelomu (MM) prošla v posledních letech klíčovými změnami, z nichž nejpodstatnější je v případě uvedené závažné hematoonkologické choroby uplatnění terapie prostřednictvím monoklonálních protilátek. První klinické testy s protilátkou anti CD20 (rituximab) byly publikovány v roce 2006, bohužel bez zásadního klinického efektu [1]. Ani první klinické výzkumy s protilátkou anti CD38 nebyly příliš úspěšné [2], až sledování zaměřená na kombinovanou léčbu anti CD38 s kortikoidy prokázala významný klinický přínos s minimem nežádoucích účinků [3,5].
Farmakologická skupina a indikace
Daratumumab (Darzalex) je monoklonální humánní IgG1 protilátka antigenu CD38, která je vytvářena savčí buněčnou linií (ovaria čínského křečíka, chinese hamster ovary) pomocí technologie rekombinantní DNA. Farmakologicky patří do skupiny cytostatik, monoklonálních protilátek s kódem ATC L01XC24.
Daratumumab je podle Souhrnu údajů o přípravku (SPC) [4] indikován v monoterapii u dospělých pacientů s relabujícím/refrakterním MM, u nichž předchozí léčba zahrnovala inhibitor proteazomu (proteasome inhibitor, PI) a imunomodulační látku (immunomodulatory drug, IMID) a kteří při poslední terapii vykázali progresi nemoci. V kombinaci s lenalidomidem a dexametazonem nebo bortezomibem a dexametazonem je indikována k léčbě dospělých pacientů s MM, kteří podstoupili alespoň jednu předcházející terapii.
Daratumumab byl schválen nejprve jako monoterapie pro pacienty po alespoň třech liniích terapie (zahrnující jak PI, tak IMID) [5] nebo pro pacienty refrakterní na PI i IMID (tzv. double refractory), a to v roce 2015 ve Spojených státech amerických a v roce 2016 v zemích Evropské unie. Stalo se tak na podkladě dvou otevřených studií fáze I/II (GEN501) [5] a fáze II (SIRIUS) [6].
Mechanismus účinku, farmakodynamický efekt
Antigen CD38 je transmembránový glykoprotein [7], který je exprimován na hematologických buňkách (vyskytuje se např. v případě MM, chronické lymfocytární leukemie, Waldenströmovy nemoci [7]) a méně často na nehematologických buňkách (např. osteoklasty) [8,9]. Tento glykoprotein o molekulové hmotnosti 46 kDa má 93 % své molekuly uloženo extracelulárně [10]. Uvedená molekula má mnohočetné funkce, jako jsou receptorem zprostředkovaná adheze, přenos buněčného signálu a enzymatická aktivita. Daratumumab se jako lidská monoklonální protilátka IgG1κ váže na antigen CD38, který je nejčastěji exprimován na plazmatických buňkách MM. Daratumumab in vivo silně inhibuje růst nádorových buněk exprimujících CD38.
Na základě studií in vitro způsobuje imunitně zprostředkovanou apoptózu třemi způsoby:
- navázáním anti CD38 na povrchový antigen CD38 se aktivuje komplementová cytotoxicita (complement dependent cytotoxicity, CDC)
- při navázání anti CD38 se aktivuje rovněž protilátková cytotoxicita (antibody dependent cell mediated cytotoxicity, ADCC);
- při navázání anti-CD38 na buněčný povrch se aktivuje buněčná fagocytóza (antibody dependent cellular phagocytosis, ADCP) (obr. 1).
U buněk exprimujících CD38
vlivem těchto imunitních pochodů dojde k lýze. Daratumumab
prostřednictvím buněčné lýzy redukuje také skupinu
supresorových buněk (regulační T lymfocyty, CD38+ regulační
B lymfocyty), neboť uvedené buňky CD38 exprimují [11]. Tímto
způsobem dochází při léčbě daratumumabem ke vzestupu
celkového počtu CD4+ a CD8![Mechanismus účinku daratumumabu; podle [7] – van de Donk, et al., 2011. ADCC – protilátkou zprostředkovaná cytotoxicita, antibody‑dependent cell‑mediated cytotoxicity; ADCp – protilátkou indukovaná buněčná fagocytóza, antibody‑dependent cellular phagocytosis; ADpr – adenosindifosfátribóza; C1q – protein, složka komplementu; cADpr – cyklická adenosindifosfátribóza; CDC – na komplementu závislá cytotoxicita, complement‑dependent cytotoxicity; MAC – komplex atakující membránu, membrane attack complex; NAD – nikotinamidadenindinukleotid](https://www.remedia.cz/photo-a-31322---.jpg) + T lymfocytů i počtu
lymfocytů v periferní plné krvi a v kostní dřeni.
Daratumumab navíc moduluje enzymatickou aktivitu CD38, kdy inhibuje
cyklázovou enzymatickou aktivitu a stimuluje hydrolázovou
aktivitu.
+ T lymfocytů i počtu
lymfocytů v periferní plné krvi a v kostní dřeni.
Daratumumab navíc moduluje enzymatickou aktivitu CD38, kdy inhibuje
cyklázovou enzymatickou aktivitu a stimuluje hydrolázovou
aktivitu.
Jelikož NK buňky (cytotoxické buňky nespecifické imunity) exprimují velké množství CD38, jsou velmi náchylné k buněčné lýze zprostředkované daratumumabem. Proto při léčbě daratumumabem dojde ke snížení absolutního počtu a procenta celkových NK buněk (CD16+ a CD56+) a aktivovaných NK buněk v periferní krvi a kostní dřeni. Vstupní počet NK buněk však podle hodnocení nevykazoval souvislost s klinickou odpovědí.
Imunogenicita
Téměř 500 pacientů (199 osob podstupujících monoterapii a 299 osob léčených kombinovanou terapií) bylo v rámci klinických studií hodnoceno z hlediska tvorby antiterapeutických protilátek (až do 8 týdnů po skončení léčby). Maximálně 0,7 % pacientů s kombinovanou léčbou a 0 % pacientů s monoterapií mělo pozitivní výsledek testu. U jednoho nemocného byla přítomnost těchto neutralizačních protilátek přechodná. Nicméně použité testy mají limitace v detekci protilátek proti daratumumabu v případě přítomnosti vysokých koncentrací této účinné látky. Z tohoto důvodu nemusí být výskyt protilátek tímto testem spolehlivě stanoven.
Dávkování
Standardní dávkování daratumumabu
v monoterapii nebo v kombinaci s lenalidomidem
(čtyřtýdenní cyklus) je 16 mg/kg tělesné hmotnosti podávaných
ve formě intravenózní infuze podle dávkovacího schématu
v tabulce 1.
Po naředění infuze je stabilita roztoku 24 hodin při
uchování v chladu, při pokojové teplotě pak 15 hodin.
Doporučená dávka daratumumabu v rámci upraveného dávkovacího schématu v kombinaci s bortezomibem (třítýdenní cyklus) je 16 mg/kg tělesné hmotnosti podávaných ve formě intravenózní infuze podle schématu v tabulce 2.
Po naředění se podání
daratumumabu zahajuje infuzní rychlostí podle tabulky 3.
Postupné zvyšování rychlosti infuze je možné, pouze pokud
nedošlo k reakci související s infuzí.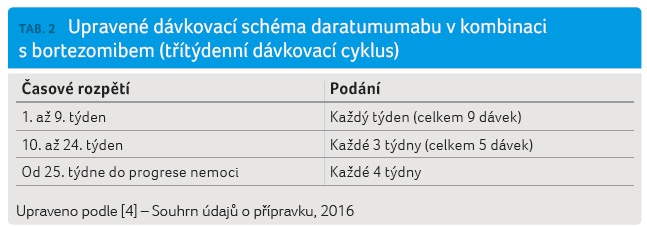
U pacientů s poruchou funkce
ledvin a poruchou funkce jater nebyly provedeny žádné
formální studie, a není tedy doporučena žádná úprava
dávkování. U pacientů se střední a těžkou formou
perzistentního asthma bronchiale, kteří mají vysoké riziko
bronchospasmu, je nutné zvážit užívání daratumumabu
a eventuálně profylakticky podat inhalační kortikosteroidy
či β2 agonisty. Bezpečnost a účinnost
podání daratumumabu u dětí mladších 18 let nebyla dosud
stanovena. Pokud dojde k vynechání plánované dávky, měla
by být následná dávka podána co nejdříve a dávkovací
schéma upraveno podle původní podoby.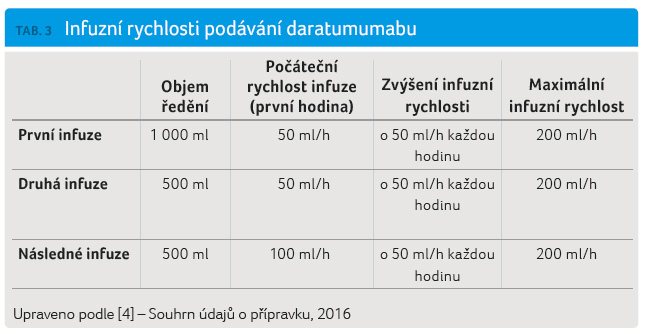
Před infuzní léčbou daratumumabem je nutné ke snížení rizika vzniku reakcí souvisejících s infuzí podat premedikaci:
- a) kortikosteroid (dlouhodobě nebo střednědobě působící) ‒ metylprednisolon v dávce 100 mg intravenózně nebo ekvivalent (nedojde li k nežádoucí reakci, je možné před druhou infuzí daratumumabu dávku kortikosteroidu snížit nebo podat perorálně);
- b) antipyretikum ‒ paracetamol v dávce 650‒1 000 mg;
- c) antihistaminikum ‒ difenhydramin v dávce 25‒50 mg či ekvivalent perorálně nebo intravenózně.
V případě závažnosti infuzní reakce stupně 1 až 2 (mírné až středně závažné) lze po odeznění příznaků obnovit infuzi maximálně poloviční rychlostí, než při jaké reakce vznikla. Pokud se u pacienta neobjeví žádné další symptomy, je možné pokračovat ve zvyšování rychlosti infuze až do maximální hodnoty 200 ml za hodinu. Při třetím stupni závažnosti reakce (závažné) lze obnovit infuzi maximálně rychlostí poloviční oproti té, při níž reakce vznikla. Pokud se u nemocného další příznaky neobjeví, je možné pokračovat ve zvyšování rychlosti podle doporučeného postupu. Jestliže se nežádoucí symptomy objeví opakovaně, nelze již daratumumab dále užívat. V případě závažnosti reakce stupně 4 (život ohrožující) není možné daratumumab podávat.
Během léčby daratumumabem je doporučena běžná monitorace jako u aplikace jiných biologických léčiv – sledování krevního tlaku, pulzu a tělesné teploty zpočátku ve třicetiminutových intervalech, při stabilním stavu pak po 60 minutách.
Nežádoucí účinky
Výskyt nežádoucích účinků při podávání daratumumabu je poměrně nízký.
Mezi nejčastější reakce při infuzním podání patří teplota, třesavka, zimnice, faryngitida, eventuálně kašel a zvracení. Ze závažnějších nežádoucích účinků se pak vyskytuje bronchospasmus či laryngospasmus. V naprosté většině případů dosáhly tyto reakce stupně závažnosti 1‒2 a v převážné většině se objevily pouze při prvním podání (u 92 % pacientů ve studii POLLUX). Celkový výskyt těchto reakcí byl podle klinických hodnocení 40‒70 %, nikdy nebyl zaznamenán život ohrožující nežádoucí účinek. Pravděpodobným patofyziologickým mechanismem je náhlé uvolnění prozánětlivých cytokinů ‒ interleukinů 6 a 8, tumor nekrotizujícího faktoru α a interferonu γ [12]. Z tohoto důvodu je navržen postup rychlosti podávání infuze, kdy první by měla trvat přibližně 6‒7 hodin, následující již mohou být kratší (zhruba 3 hodiny), podle tolerance pacienta a eventuálních infuzních reakcí.
K nejzásadnějším nežádoucím účinkům kromě reakcí bezprostředně souvisejících s infuzním podáním lze řadit únavu, anémii, neutropenii, trombocytopenii, průjem či infekční komplikace. Ve studiích hodnotících monoterapii daratumumabem se tyto nežádoucí účinky vyskytly maximálně u 40 % pacientů a byly v převážné většině stupně závažnosti 1‒2 [3]. Nežádoucích účinků vyššího stupně byla zaznamenána pouze 3 % (únava, horečka).
Specifika během léčby
Interference s Coombsovými testy (protilátky proti erytrocytům)
Jelikož se antigen CD38 v malé míře vyskytuje i na erytrocytech, může u pacientů léčených daratumumabem dojít k falešné pozitivitě nepřímého antiglobulinového testu. Tuto reakci zprostředkovávají volně cirkulující molekuly daratumumabu v séru pacienta, které reagují s dárcovskými erytrocyty [13]. Uvedená falešná pozitivita komplikuje časnou přípravu kompatibilních transfuzních přípravků a reakce může trvat až 6 měsíců po ukončení léčby přípravkem [14]. Proto je doporučeno ještě před zahájením terapie provést kompletní transfuzní imunohematologické vyšetření (stanovení krevní skupiny a Rh faktoru, screening eventuálních protilátek, fenotypizace, genotypizace).
Možností „odmaskování“ falešné pozitivity je tzv. metoda DTT pomocí přidání ditiotreitolu, kdy dojde k denaturaci antigenů Kell na povrchu erytrocytů. Metoda je však náročná jak časově, tak finančně a je limitována u Kell pozitivních pacientů.
Interference s vyšetřením elektroforézou
Daratumumab patří mezi imunoglobuliny typu IgG1κ, jeho působením může tedy při standardním vyšetření pomocí elektroforézy (metoda umožňující rozdělit látky v elektrickém poli podle jejich velikosti a náboje, ELFO) dojít ke dvěma situacím. Látka může komigrovat s původním paraproteinem a z tohoto důvodu může dojít k nadhodnocení koncentrace celkového monoklonálního imunoglobulinu (obvyklá koncentrace daratumumabu nepřesahuje 1 g/l). Naopak u pacientů, kteří dosáhnou laboratorní kompletní remise, může být tato malá frakce falešně hodnocena jako zbytková populace paraproteinu, a proto není možné určit pravou kompletní remisi. Možností odlišení je tzv. metoda DIRA (daratumumab specific immunofixation electrophoresis reflex assay), kdy se pomocí přidání myší anti daratumumabové protilátky vyváže samotný daratumumab a komplex obou látek se přesune v elektroforetickém gelu mimo imunoglobulinovou oblast. Citlivost této metodiky je zřetelná již od koncentrace daratumumabu v hodnotě 0,2 g/l.
Klinické studie
První klinické studie (GEN501 a SIRIUS) hodnotící cílovou dávku daratumumabu v monoterapii byly prováděny u velmi předléčených pacientů, proto jejich cílem nebylo stanovení místa v terapii MM, ale obě poukázaly na výraznou účinnost léku i v monoterapii [5,6].
V roce 2016 byly publikovány výsledky dvou randomizovaných multicentrických studií fáze III pro relabující/refrakterní MM (CASTOR a POLLUX) porovnávající kombinovanou léčbu s daratumumabem [15,16]. Studie CASTOR srovnávala kombinaci daratumumab/bortezomib a dexametazon oproti kombinaci bortezomib/dexametazon. Po jednom roce léčby byl medián doby do progrese onemocnění (progression free survival, PFS) u první kombinace více než dvojnásobný oproti kontrolní skupině (60,7 % vs. 26,9 %; HR [poměr rizik] 0,39; p < 0,001). Signifikantně vyšší byla rovněž pravděpodobnost dosažení objektivní léčebné odpovědi (objective response rate, ORR) (82,9 % vs. 63,2 %; p < 0,001), u kompletních remisí (complete remission, CR) dokonce 19,2 % vs. 9,0 % (p = 0,001). Výskyt nežádoucích účinků byl v obou ramenech obdobný, během infuzního podání daratumumabu měla téměř polovina pacientů (45,3 %) reakci lehkého stupně, stupeň závažnosti 3 a více se vyskytl jen u 9 % osob a naprostá většina (92 %) nežádoucích účinků se projevila pouze při podání první dávky [15].
Ve studii POLLUX byla porovnávána kombinace daratumumab/lenalidomid a dexametazon oproti kombinaci lenalidomid/dexametazon. V případě první kombinace nebylo dosaženo mediánu PFS ve 12 měsících, jeho hodnota v rameni bez daratumumabu byla 18,4 měsíce (83 % versus 60 %). Opět signifikantně vyšší byla hodnota ORR (92,9 % vs. 76,4 %; p < 0,001), u CR pak byl poměr 43,1 % vs. 19,2 % (p < 0,001). Spektrum a četnost nežádoucích účinků byly velmi podobné studii CASTOR a závažné infuzní reakce po aplikaci daratumumabu se vyskytly jen u 5 % pacientů [16].
Obě tyto studie přinesly mimořádné výsledky a rovněž při nepřímém porovnání s jinými vysoce efektivními léky mají tato sledování pouze s monoterapií daratumumabem podobné či spíše příznivější výstupy. Právě odlišný mechanismus účinku daratumumabu v kombinaci se standardně užívanými přípravky (lenalidomid, bortezomib) slibuje velmi vysoký počet ORR s maximálním zastoupením kompletních remisí. V brzké době jsou očekávány výsledky kombinovaných režimů u nově diagnostikovaného myelomu (studie ALCYONE a CASSIOPEIA) [17].
Závěr
Pokrok v léčbě MM je jedním z nejvýznamnějších v hematoonkologii a za posledních 15 let se zásadně zlepšilo celkové přežívání pacientů, proto se v éře dalších nových léků a jejich kombinací očekává, že MM bude patřit mezi potencionálně vyléčitelná onemocnění [18].
Optimálním výhledem v terapii je zařazení daratumumabu do standardního léčebného algoritmu z důvodu jeho vysoké účinnosti, a to jak pro relabované pacienty, tak v primoléčbě. První možností je užití širších kombinací již od úvodních fází terapie bez dřívějšího rizika, že tím vyčerpáme všechny účinné postupy. Druhou možností je pak využití v případě rezistence na dosud užívané léky. Podle pilotních výsledků studií u nově diagnostikovaného myelomu se zatím jeví čtyřkombinace daratumumab/IMID/PI/kortikoid jako nejefektivnější indukční režim. Tato kombinace by měla zásadním způsobem ovlivnit hloubku remise a tím i dramaticky zlepšit celkové přežívání [19].
Limitujícím faktorem mohou být vysoké náklady na léčbu, které mohou zhoršit její dostupnost v různých zemích či regionech podle aktuální ekonomické výkonnosti zdravotnického systému [20].
Seznam použité literatury
- [2] Ellis KH, Barber KA, Tutt A, et al. Engineered anti‑CD38 monoclonal antibodies for immunotherapy of multiple myeloma. J Immunol 1995; 155: 925–937.
- [3] Lokhorst HM, Plesner T, Laubach JP, et al. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015; 373: 1207–1219.
- [4] Darzalex (daratumumab). Souhrn údajů o přípravku. Státní ústav pro kontrolu léčiv, květen 2016. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/004077/WC500207296.pdf
- [5] Usmani SZ, Weiss BM, Plesner T, et al. Clinical efficacy of daratumumab monotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma. Blood 2016; 128: 37–44.
- [6] Lonial S, Weiss BM, Usmani SZ, et al. Daratumumab monotherapy in patients with treatment‑refractory multiple myeloma (SIRIUS): an open‑label, randomised, phase 2 trial. Lancet 2016; 387: 1551–1560.
- [7] De Weers M, Tai YZ, Van der Veer MS, et al. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol 2011; 186: 1840–1848.
- [8] Van de Donk NWC, Janmaat ML, Mutis T. Monoclonal antibodies targeting CD38 in hematological malignancies and beyond. J Immunol 2011; 186: 1840–1848.
- [9] Deaglio S, Mehta K, Malavasi F. Human CD38:a (r)evolutionary story of enzymes and receptors. Leuk Res 2001; 25: 1–12.
- [10] Malavasi F, Deaglio S, Funaro A, et al. Evolution and function of the ADP ribosyl cyclase/CD38 gene family in physiology and pathology. Physiol Rev 2008; 88: 841–886.
- [11] Sandoval‑Montes C, Santos‑Argumed L. CD38 is expressed selectively during the activation of a subset of mature T cells with reduced proliferation but improved potential to produce cytokines. J Leukoc Biol 2005; 77: 513–521.
- [12] Jelínek T, Kořístka M, Čermáková Z, Hájek R. Daratumumab – naděje pro myelomové pacienty, výzva pro klinické laboratoře. Klin Onkol 2017; 30: 13–19.
- [13] McCudden CR, Voorhees PM, Hainsworth SA, et al. Interference of monoclonal antibody therapies with serum protein electrophoresis tests. Clin Chem 2010; 56: 1897–1899.
- [14] Chapuy CI, Nicholson RT, Aguad MD, et al. Resolving the daratumumab interference with blood compatibility testing. Transfusion 2015; 55: 1545–1554.
- [15] Palumbo A, Chanan‑Khan A, Weisel K, et al. CASTOR Investigators – Daratumumab, bortezomib, and dexamethasone for multiple myeloma. N Engl J Med 2016; 375: 754–766.
- [16] Dimopoulos MA, Oriol A, Nahi H, et al. POLLUX Investigators – Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016; 375: 1319–1331.
- [17] Mateos MV, Cavo M, Jakubowiak AJ, et al. A randomized open‑label study of bortezomib, melphalan, and prednisone (VMP) versus daratumumab (DARA) plus VMP in patients with previously untreated multiple myeloma (MM) who are ineligible for high‑dose therapy: 54767414MMY3007 (Alcyone). J Clin Oncol 2015; 33 (Suppl 15): Abstr TPS8608.
- [18] Barlogie B, Mitchell A, van Rhee F, et al. Curing myeloma at last: defining criteria and providing the evidence. Blood 2014; 124: 3043–3051.
- [19] Gay F, Larocca A, Wijermans P, et al. Complete response correlates with long‑term progression‑free and overall survival in elderly myeloma treated with novel agents: analysis of 1,175 patients. Blood 2011; 117: 3025–3031.
- [20] Špička I. Daratumumab v monoterapii pacientů s relabujícím či refrakterním mnohočetným myelomem. Komentář k článku. Farmakoterapie 2017; 13: 243–245.