Dronedaron
Dronedaron je nové antiarytmikum třídy III, jehož elektrofyziologické vlastnosti se podobají amiodaronu. Má však mnohem lepší bezpečnostní profil. Dronedaron je u pacientů s fibrilací síní účinný v kontrole srdečního rytmu i v kontrole srdeční frekvence. Dronedaron je prvním antiarytmickým lékem, u kterého byla prokázána schopnost zlepšit kardiovaskulární prognózu u pacientů s fibrilací síní.
Farmakologická skupina
Dronedaron patří mezi antiarytmika třídy III. ATC kód: C01BD07.
Chemické a fyzikální vlastnosti
Chemicky je dronedaron N-(2-butyl-3-(p-(3-(dibutylamino)propoxy)benzoyl)-5-benzofuranyl)methansulfonamid.
Sumární vzorec: C31H44N2O5S
Relativní molekulová hmotnost: 556,758
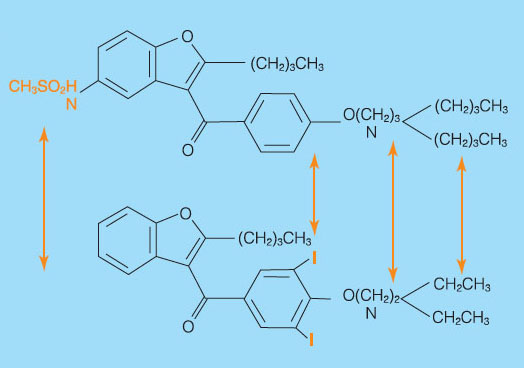 Molekula dronedaronu je derivátem benzofuranu strukturálně odvozeným od molekuly amiodaronu. Dva zásadní rozdíly ve složení molekuly dronedaronu představuje jednak absence jódu, což vede ke snížení orgánové toxicity, jednak přítomnost methylsulfonylové skupiny, která snižuje lipofilitu. Důsledkem je menší akumulace ve tkáních a kratší eliminační poločas ve srovnání s amiodaronem (obr. 1) [1].
Molekula dronedaronu je derivátem benzofuranu strukturálně odvozeným od molekuly amiodaronu. Dva zásadní rozdíly ve složení molekuly dronedaronu představuje jednak absence jódu, což vede ke snížení orgánové toxicity, jednak přítomnost methylsulfonylové skupiny, která snižuje lipofilitu. Důsledkem je menší akumulace ve tkáních a kratší eliminační poločas ve srovnání s amiodaronem (obr. 1) [1].
Mechanismus účinku, farmakodynamika
Dronedaron je zařazen do III. třídy klasifikace antiarytmik podle Vaughana-Williamse. Má však elektrofyziologické vlastnosti patřící do všech čtyř tříd této klasifikace. Dronedaron je multikanálový blokátor, který působí inhibici jak draslíkových kanálů směřujících ven z buňky, tak kanálů sodíkových a kalciových směřujících do buněk. Dochází k prodloužení trvání akčního potenciálu a prodlužuje se refrakterní perioda [2]. Dronedaron také vykazuje antiadrenergní aktivitu [3]. V závislosti na dávce dochází k poklesu srdeční frekvence v klidu i při zátěži a k mírnému prodloužení intervalů PR a QTc. Interval QTc je třeba sledovat a při prodloužení přesahujícím 500 milisekund je léčbu nutno přerušit. Dochází i k mírnému snížení krevního tlaku a ke snížení kontraktility myokardu. Dronedaron má mírné vazodilatační účinky v koronárních i periferních tepnách [4]. Podobně jako je tomu při léčbě amiodaronem, dochází i při užívání dronedaronu k velmi mírnému a reverzibilnímu zvýšení hladiny kreatininu (průměrně o 10 mmol/l), jež dosahuje vrcholu po 7 dnech. Důvodem je inhibice tubulární sekrece kreatininu, aniž by byla postižena glomerulární filtrace. Toto zvýšení není důvodem k vysazení léčby inhibitory ACE nebo sartany. Týden po zahájení léčby je však doporučováno zkontrolovat hladinu kreatininu [5].
Farmakokinetické vlastnosti
Po perorálním podání je dronedaron dobře absorbován (z více než 70 %). Podobně jako u amiodaronu je absorpce zvýšena při podávání s jídlem. Při jídle s vysokým obsahem tuku se absorpce zvyšuje až čtyřnásobně. Značná část dávky léku je odbourána prostřednictvím enzymů cytochromu CYP3A4 při prvním průchodu játry. Absolutní biologická dostupnost při současném požití s jídlem je proto pouze 15 %. Vrcholové plazmatické koncentrace je dosaženo během 3–6 hodin. Při dávce 400 mg podávané dvakrát denně je ustáleného stavu dosaženo během 4–8 dní. Kinetika dronedaronu není lineární, takže dvojnásobné zvýšení dávky vede až k trojnásobnému zvýšení plazmatické koncentrace a plochy pod křivkou. Ve srovnání s amiodaronem má dronedaron rychlejší nástup účinku.
Podobně jako amiodaron, je dronedaron metabolizován cestou oxidace CYP3A4. Hlavní cirkulující metabolit vzniká N-debutylací. Dále dochází k jeho oxidaci a oxidativní deaminaci na neaktivní metabolity. N-debutylovaný metabolit přispívá k farmakologické aktivitě, je však 3–10krát méně účinný. Dronedaron i jeho hlavní metabolit se váží z více než 98 % na plazmatické bílkoviny, zejména na albumin. Dronedaron je méně lipofilní než amiodaron, takže má mnohem menší distribuční objem. Po intravenózním podání je v ustáleném stavu distribuční objem dronedaronu 1200–1400 l.
 Po perorálním podání je přibližně 6 % dávky vyloučeno močí a 84 % stolicí, v obou případech převážně ve formě metabolitů. Terminální eliminační poločas dronedaronu je 25–30 hodin, poločas jeho N-debutylovaného metabolitu je 20–25 hodin. Eliminační poločas jednorázové dávky je 13–19 hodin, při dlouhodobém podávání dávky 400 mg dvakrát denně je poločas 27–32 hodin. Při dlouhodobém podávání dochází k úplné clearance dronedaronu a jeho metabolitu z plazmy za dva týdny poté, co bylo podávání léku ukončeno (tab. 1) [6].
Po perorálním podání je přibližně 6 % dávky vyloučeno močí a 84 % stolicí, v obou případech převážně ve formě metabolitů. Terminální eliminační poločas dronedaronu je 25–30 hodin, poločas jeho N-debutylovaného metabolitu je 20–25 hodin. Eliminační poločas jednorázové dávky je 13–19 hodin, při dlouhodobém podávání dávky 400 mg dvakrát denně je poločas 27–32 hodin. Při dlouhodobém podávání dochází k úplné clearance dronedaronu a jeho metabolitu z plazmy za dva týdny poté, co bylo podávání léku ukončeno (tab. 1) [6].
Hlavními příčinami farmakokinetické variability jsou věk, pohlaví a tělesná hmotnost. Plazmatická koncentrace může být zvýšena u žen, u osob s nižší tělesnou hmotností a u pacientů starších než 65 let nebo u nemocných s jaterním poškozením. Všechny tyto faktory mají však jen mírný vliv. Srdeční selhání i těžká porucha renálních funkcí neovlivňují významně farmakokinetiku, takže není potřeba upravovat dávkování.
Klinické zkušenosti
Studie DAFNE
DAFNE (Dronedarone Atrial Fibrillation study after Electrical Cardioversion) byla multicentrická, mezinárodní, prospektivní, placebem kontrolovaná, dvojitě zaslepená studie fáze II navržená k určení vhodné dávky dronedaronu pro prevenci recidivy fibrilace síní po kardioverzi u pacientů s perzistující fibrilací síní. Pacienti, kteří měli fibrilaci síní v trvání více než 72 hodin a méně než 12 měsíců, byli randomizováni buď k podávání placeba, nebo k podávání dronedaronu v dávce dvakrát denně 400 mg, 600 mg a 800 mg po dobu 6 měsíců. Pokud nedošlo do 5 dnů po zahájení medikace k verzi na sinusový rytmus, byla provedena elektrická kardioverze. Studie se zúčastnilo 270 pacientů v 50 centrech v 11 zemích. Primárním sledovaným ukazatelem byla doba do první recidivy fibrilace síní. Mezi sekundární ukazatele patřily spontánní verze po randomizaci, srdeční frekvence při recidivě fibrilace síní a výskyt vedlejších účinků. Dronedaron v dávce 400 mg dvakrát denně významně prodloužil dobu do první recidivy fibrilace síní ve srovnání s placebem. U těch pacientů, kde došlo k recidivě, dronedaron významně zpomaloval komorovou frekvenci. Nejčastějšími nežádoucími účinky léčby dronedaronem byly gastrointestinální obtíže. Při podávání dávky dvakrát 400 mg se však vyskytovaly relativně vzácně (k přerušení léčby vedly u 1,3 % pacientů). Pacienti léčení dávkou dvakrát 800 mg měli gastrointestinální obtíže častěji, navíc u nich došlo k významnému prodloužení QT intervalu. Dávka 400 mg podávaná dvakrát denně byla tedy nejlepší z hlediska poměru mezi účinností a bezpečností, a byla proto zvolena pro následné studie fáze III klinického zkoušení [7].
Studie EURIDIS/ADONIS
Cílem dvojice studií EURIDIS (European Trial in Atrial Fibrillation of Flutter Patients Receiving Dronedarone for the Maintenance of Sinus Rhythm) a ADONIS (American-Australian Trial with Dronedarone in Atrial Fibrillation or Flutter Patients for the Maintenance of Sinus Rhythm) bylo posoudit účinnost dronedaronu při udržení sinusového rytmu po elektrické, farmakologické nebo spontánní kardioverzi u paroxysmální a perzistující fibrilace síní a u síňového flutteru. Obě studie fáze III byly dvojitě zaslepené, kontrolované placebem. Studie EURIDIS proběhla ve 12 evropských zemích a bylo do ní zařazeno 612 pacientů. Studie ADONIS byla provedena ve Spojených státech, Kanadě, Jihoafrické republice a v Argentině a zúčastnilo se jí 625 pacientů. Kritériem pro zařazení byla minimálně jedna epizoda fibrilace síní v předcházejících třech měsících a sinusový rytmus alespoň jednu hodinu před randomizací. Mezi vylučovací kritéria patřilo srdeční selhání NYHA III nebo IV. V obou studiích dohromady bylo 828 pacientů léčeno dronedaronem v dávce dvakrát 400 mg a 409 pacientů dostávalo placebo. Primárním sledovaným ukazatelem byla doba do první recidivy fibrilace nebo flutteru síní. Hlavními sekundárními ukazateli byly symptomatické epizody fibrilace síní a průměrná komorová frekvence při první recidivě. Řada pacientů užívala další léky ke kontrole srdeční frekvence (betablokátory, blokátory kalciového kanálu, digoxin). V obou studiích dohromady byla průměrná doba do recidivy fibrilace síní 116 dní u pacientů léčených dronedaronem a 53 dní v placebové skupině. Po 12 měsících ![Graf 1 Doba do první recidivy fibrilace síní po 12 měsících sledování – společná analýza studií EURIDIS/ADONIS; podle [8] – Singh, et al., 2007.](https://www.remedia.cz/photo-a-28341---.jpg) sledování byl výskyt recidiv fibrilace síní 64,1 % v dronedaronové skupině a 75,2 % u pacientů dostávajících placebo (HR 0,75, 95% CI 0,65–0,87; p < 0,001), viz graf 1. Podobně jako ve studii DAFNE, dronedaron rovněž významně snižoval komorovou frekvenci v případě recidivy (117 tepů/min vs. 103 tepů/min; p < 0,001). Výskyt nežádoucích účinků byl u aktivně léčené a placebové skupiny srovnatelný. U pacientů léčených dronedaronem nebyly prokázány známky orgánové toxicity nebo proarytmické účinky. Post hoc analýza obou studií dohromady ukázala, že podávání dronedaronu vedlo k významnému snížení rizika všech hospitalizací nebo úmrtí o 27 % ve srovnání s placebem (HR 0,73; 95% CI 0,57–0,93; p = 0,01) [8].
sledování byl výskyt recidiv fibrilace síní 64,1 % v dronedaronové skupině a 75,2 % u pacientů dostávajících placebo (HR 0,75, 95% CI 0,65–0,87; p < 0,001), viz graf 1. Podobně jako ve studii DAFNE, dronedaron rovněž významně snižoval komorovou frekvenci v případě recidivy (117 tepů/min vs. 103 tepů/min; p < 0,001). Výskyt nežádoucích účinků byl u aktivně léčené a placebové skupiny srovnatelný. U pacientů léčených dronedaronem nebyly prokázány známky orgánové toxicity nebo proarytmické účinky. Post hoc analýza obou studií dohromady ukázala, že podávání dronedaronu vedlo k významnému snížení rizika všech hospitalizací nebo úmrtí o 27 % ve srovnání s placebem (HR 0,73; 95% CI 0,57–0,93; p = 0,01) [8].
Studie ERATO
Cílem studie ERATO (Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for The cOntrol of ventricular rate during atrial fibrillation) bylo posoudit účinnost dronedaronu při kontrole průměrné 24hodinové frekvence komor u pacientů se symptomatickou permanentní FS. Dronedaron byl přidán k současné další léčbě (např. betablokátory včetně sotalolu, blokátory kalciového kanálu nebo digoxin). Do této multicentrické, dvojitě zaslepené, paralelní studie bylo zařazeno 174 pacientů, kteří dostávali buď placebo, nebo dronedaron v dávce dvakrát 400 mg denně po dobu 6 měsíců. Primárním ukazatelem byla průměrná 24hodinová frekvence komor po dvou týdnech léčby. Sekundárními ukazateli byly např. komorová frekvence během submaximální a maximální zátěže po 2 týdnech, změna v trvání zátěže po 2 týdnech a průměrná komorová frekvence po 4 měsících. Přestože pacienti mohli užívat i další léky ke kontrole srdeční frekvence, dronedaron snížil průměrnou 24hodinovou komorovou frekvenci o 11,7 tepu za minutu (p < 0,0001) a maximální komorovou frekvenci při zátěži o 24,5 tepu za minutu (p < 0,0001). Léčba dronedaronem nevedla k omezení tolerance zátěže a účinky přetrvávaly dlouhodobě (po dobu 6 měsíců). Závažné nežádoucí účinky se vyskytly u 17 % pacientů ve skupině s dronedaronem a u 14 % v placebové skupině. Léčba byla přerušena u 15 % pacientů ve skupině s dronedaronem a u 10 % pacientů ve skupině placeba. Gastrointestinální vedlejší účinky se vyskytly u 20 % pacientů v dronedaronové skupině a u 14 % pacientů v placebové skupině. Tyto rozdíly nebyly statisticky významné. V této studii rovněž nebyly prokázány organotoxické nebo arytmogenní účinky dronedaronu [9].
Studie ANDROMEDA
ANDROMEDA (The ANtiarrhythmic trial with DROnedarone in Moderate to severe CHF Evaluating morbidity DecreAse) byla multicentrická, dvojitě zaslepená, placebem kontrolovaná studie fáze III zaměřená na posouzení potenciálního přínosu dronedaronu u pacientů se srdeční insuficiencí. Do studie bylo zařazeno 627 pacientů hospitalizovaných s nově vzniklým nebo zhoršeným srdečním selháním a minimálně jednou epizodou dušnosti při minimální nebo žádné zátěži (funkční klasifikace NYHA III nebo IV) nebo s paroxysmální noční dušností v posledním měsíci před přijetím do nemocnice. Kritériem pro zařazení byla také hodnota ejekční frakce levé komory ≤ 35 %. Celkem 25 % pacientů mělo při zařazení do studie fibrilaci síní. Mezi vylučovací kritéria patřil infarkt myokardu v posledních sedmi dnech, srdeční frekvence nižší než 50 tepů/min a nedávno prodělaná srdeční operace. Primárním ukazatelem byla celková mortalita nebo hospitalizace pro zhoršení srdeční insuficience. Studie byla předčasně ukončena 7 měsíců po zařazení prvního pacienta (průměrná doba sledování byla pouze dva měsíce) kvůli zvýšené mortalitě ve skupině pacientů léčených dronedaronem (8,1 % vs. 3,8 %, HR 2,13; 95% CI 1,07–4,25; p = 0,03). Celkový počet úmrtí byl 25 ve skupině s dronedaronem a 12 v placebové skupině. Zvýšená mortalita při léčbě dronedaronem byla převážně způsobena zhoršením srdečního selhání, ke kterému mohlo přispět ukončení podávání inhibitorů ACE nebo sartanů při reverzibilním zvýšení hladiny sérového kreatininu. Tento jev je však běžným a klinicky nevýznamným průvodním jevem léčby dronedaronem. Počet arytmických nebo náhlých smrtí se mezi oběma skupinami nelišil. Nebylo zaznamenáno žádné úmrtí způsobené komorovou tachykardií typu torsades de pointes. Nejsilnějšími prediktory úmrtí byla léčba dronedaronem a systolická dysfunkce levé komory [10].
Studie ATHENA
Fibrilace síní je spojena s rizikem řady prognosticky závažných kardiovaskulárních komplikací. Cílem studie ATHENA (A Placebo-controlled, Double-blind, Parallel Arm Trial to Assess the Efficacy of Dronedarone 400 mg Bid for the Prevention of Cardiovascular Hospitalization or Death From Any Cause in Patients With Atrial Fibrillation/Atrial Flutter) bylo proto posoudit účinnost a bezpečnost dronedaronu v dávce dvakrát 400 mg denně v prevenci těchto komplikací během dlouhodobé léčby. Tím, že se studie ATHENA zaměřila na prognostické (morbiditní a mortalitní) cíle, představuje určitý přelom v plánování studií s antiarytmiky. Do této mezinárodní, multicentrické, placebem kontrolované studie bylo zařazeno celkem 4628 pacientů, což představuje největší dosud provedenou studii s antiarytmickým lékem. Kritériem pro zařazení byla paroxysmální nebo perzistující fibrilace síní dokumentovaná EKG a alespoň jeden z následujících rizikových faktorů – věk minimálně 70 let, arteriální hypertenze léčená dvěma a více skupinami antihypertenziv, diabetes mellitus, stav po prodělané cévní mozkové příhodě, tranzitorní ischemické atace nebo systémové embolizaci, velikost levé síně ≥ 50 mm a ejekční frakce levé komory ≤ 40 %. V době zařazení měli mít pacienti buď sinusový rytmus nebo fibrilaci či flutter síní s plánovanou kardioverzí po předchozí antikoagulační přípravě. Mezi hlavní vylučovací kritéria patřila přítomnost permanentní fibrilace síní, hemodynamická nestabilita, srdeční selhání NYHA IV a bradykardie se srdeční frekvencí pod 50 tepů/min. Primárním ukazatelem byla kombinace kardiovaskulárních hospitalizací a celkové mortality. Mezi ![Graf 2 Výskyt kardiovaskulárních hospitalizací ve studii ATHENA; podle [11] – Hohnloser, et al., 2009.](https://www.remedia.cz/photo-a-28342---.jpg) sekundární ukazatele patřily samostatně celková mortalita, kardiovaskulární mortalita a hospitalizace z kardiovaskulárních příčin. Průměrný věk zařazených pacientů byl 71,6 ± 0,0 let. Ženy tvořily 46,9 %, hypertenzi mělo 86,3 % a ischemickou chorobu srdeční 30,4 % pacientů. Srdeční selhání NYHA II nebo III mělo v anamnéze 21,2 % účastníků studie; 60,2 % pacientů bylo léčeno antagonisty vitaminu K. Průměrná délka sledování byla 21 ± 5 měsíců. Primární ukazatel se vyskytl u 734 (31,9 %) pacientů randomizovaných k podávání dronedaronu a u 917 (39,4 %) pacientů ve skupině placeba. Poměr rizik primárního ukazatele byl 0,76 (95% CI 0,69–0,84; p < 0,001). K hospitalizaci z kardiovaskulárních příčin došlo u 675 (29,3 %) pacientů v dronedaronové skupině a u 859 (36,9 %) pacientů v placebové skupině (HR 0,74; 95% CI 0,67–0,82; p < 0,001), viz graf 2. Ve skupině léčené dronedaronem zemřelo 116 (5,0 %) pacientů, ve skupině s placebem zemřelo 139 (6,0 %) pacientů (HR 0,84; 95% CI 0,66–1,08; p = 0,18). Úmrtí z kardiovaskulárních příčin se vyskytlo u 63 (2,7 %) pacientů ve skupině dronedaronu a u 90 (3,9 %) ve skupině placeba (HR 0,71; 95% CI 0,51–0,98; p = 0,03). Léčba byla předčasně ukončena u 30,2 % pacientů léčených dronedaronem a u 30,8 % pacientů v placebové skupině. Pacienti léčení dronedaronem měli častěji bradykardie (3,5 % vs. 1,2 %) a gastrointestinální obtíže (26,2 % vs. 22,0 %) než pacienti ve skupině placeba. Výskyt plicních nebo thyreoidálních nežádoucích účinků se nelišil [11].
sekundární ukazatele patřily samostatně celková mortalita, kardiovaskulární mortalita a hospitalizace z kardiovaskulárních příčin. Průměrný věk zařazených pacientů byl 71,6 ± 0,0 let. Ženy tvořily 46,9 %, hypertenzi mělo 86,3 % a ischemickou chorobu srdeční 30,4 % pacientů. Srdeční selhání NYHA II nebo III mělo v anamnéze 21,2 % účastníků studie; 60,2 % pacientů bylo léčeno antagonisty vitaminu K. Průměrná délka sledování byla 21 ± 5 měsíců. Primární ukazatel se vyskytl u 734 (31,9 %) pacientů randomizovaných k podávání dronedaronu a u 917 (39,4 %) pacientů ve skupině placeba. Poměr rizik primárního ukazatele byl 0,76 (95% CI 0,69–0,84; p < 0,001). K hospitalizaci z kardiovaskulárních příčin došlo u 675 (29,3 %) pacientů v dronedaronové skupině a u 859 (36,9 %) pacientů v placebové skupině (HR 0,74; 95% CI 0,67–0,82; p < 0,001), viz graf 2. Ve skupině léčené dronedaronem zemřelo 116 (5,0 %) pacientů, ve skupině s placebem zemřelo 139 (6,0 %) pacientů (HR 0,84; 95% CI 0,66–1,08; p = 0,18). Úmrtí z kardiovaskulárních příčin se vyskytlo u 63 (2,7 %) pacientů ve skupině dronedaronu a u 90 (3,9 %) ve skupině placeba (HR 0,71; 95% CI 0,51–0,98; p = 0,03). Léčba byla předčasně ukončena u 30,2 % pacientů léčených dronedaronem a u 30,8 % pacientů v placebové skupině. Pacienti léčení dronedaronem měli častěji bradykardie (3,5 % vs. 1,2 %) a gastrointestinální obtíže (26,2 % vs. 22,0 %) než pacienti ve skupině placeba. Výskyt plicních nebo thyreoidálních nežádoucích účinků se nelišil [11].
Retrospektivní post hoc analýza výskytu cévních mozkových příhod ve studii ATHENA ukázala, že pacienti randomizovaní k léčbě dronedaronem měli statisticky významně sníženo riziko výskytu cévních mozkových příhod. V placebové skupině byl roční výskyt 1,8 %, zatímco u pacientů léčených dronedaronem byl 1,2 %, což znamenalo relativní riziko 0,66 (95% CI 0,46–0,96; p = 0,027). Protektivní účinek dronedaronu nebyl ovlivněn užíváním antikoagulační léčby a vzrůstal se stoupajícím CHADS2 skóre [12].
Další následná analýza studie ATHENA potvrdila účinnost dronedaronu při kontrole srdečního rytmu a srdeční frekvence. U pacientů, kteří měli na začátku studie sinusový rytmus, byla průměrná doba do recidivy fibrilace nebo flutteru síní 498 dní v placebové skupině a 737 dní u pacientů léčených dronedaronem (HR 0,749; 95% CI 0,681–0,824; p < 0,001). Elektrická kardioverze byla provedena u 15 % pacientů v placebové skupině a u 21 % pacientů ve skupině s dronedaronem (HR 0,684; 95% CI 0,596–0,786; p < 0,001). V případě první recidivy fibrilace nebo flutteru síní byla průměrná srdeční frekvence 85,3 tepu/min při léčbě dronedaronem a 95,5 tepu/min při podávání placeba (p < 0,001) [13].
Studie DIONYSOS
Studie DIONYSOS (Efficacy and Safety of Dronedarone Versus Amiodarone for the Maintenance of Sinus Rhythm in Patients With Atrial Fibrillation) porovnala účinnost a bezpečnost dronedaronu (400 mg dvakrát denně) s amiodaronem (600 mg denně po dobu 28 dní a následně 200 mg denně) u 504 pacientů s perzistující fibrilací síní. Průměrná doba léčby byla 7 měsíců. Dronedaron byl v udržení sinusového rytmu méně účinný než amiodaron – k recidivě fibrilace síní došlo u 63,5 % pacientů ve skupině dronedaronu a u 42 % ve skupině amiodaronu. Přes krátké trvání studie však byla prokázána výrazně lepší tolerabilita a bezpečnost dronedaronu [14].
Zařazení do současnépalety léčiv
Kontrola srdečního rytmu
U pacientů s perzistující nebo paroxysmální fibrilací síní dronedaron účinně přispívá k udržení sinusového rytmu. Jeho účinnost je srovnatelná s ostatními antiarytmiky s výjimkou amiodaronu. Dronedaron je možno použít i u pacientů, u kterých je plánována elektrická kardioverze. K akutní léčbě paroxysmu fibrilace síní se však samotný dronedaron nehodí. Podobně jako u většiny ostatních antiarytmik zatím nemáme důkazy o jeho přínosnosti v těch případech, kdy v pokusu udržet sinusový rytmus selhaly jiné léky. Chybějí také data o použití u komorových arytmií, i když z elektrofyziologického hlediska pro tuto indikaci dronedaron má předpoklady.
Kontrola srdeční frekvence
K dispozici je sice méně informací než pro kontrolu rytmu, nicméně u perzistující i paroxysmální fibrilace síní dronedaron účinně zpomaluje komorovou frekvenci v případě recidivy fibrilace, a to zvláště u těch pacientů, kteří užívají další bradykardizující medikaci. Je ale účinný i při kontrole srdeční frekvence u fibrilace permanentní. Méně dokladů máme o vlivu samotného dronedaronu na srdeční frekvenci u těch pacientů, kteří neužívají žádné další léky ke snížení srdeční frekvence. Pokud však pacient, který užívá dronedaron, dostane fibrilaci síní, neznamená to, že je léčbu nutno přerušit, neboť požadovaná kontrola srdeční frekvence může být dostatečná.
Bezpečnost
Silnou stránkou dronedaronu je jeho vynikající bezpečnostní profil. Nežádoucí účinky se vyskytují poměrně vzácně a zcela chybí kumulativní orgánová toxicita. To může být výhodou zvláště tam, kde se předpokládá dlouhodobá léčba, např. i u mladších pacientů. Dronedaron má také velmi nízké riziko proarytmogenních účinků. Léčbu je možno zahajovat ambulantně, není nutný agresivní nasycovací režim. Nejsou vyvinuty zcela přesné postupy pro přechod z léčby jinými antiarytmiky na léčbu dronedaronem. Při předchozí léčbě antiarytmiky třídy I a III je třeba před zahájením léčby dronedaronem počkat na uplynutí alespoň pěti plazmatických poločasů. Studie EURIDIS a ADONIS ukázaly, že u pacientů, kteří nemají příliš prodloužený QT interval nebo výraznější bradykardii, je možný relativně rychlý přechod z léčby amiodaronem na dronedaron (během 2 dnů). Optimální způsob převádění je předmětem probíhající dvojice studií ARTEMIS AF loading a ARTEMIS AF long-term. V každém případě je třeba sledovat délku QT intervalu a hodnotu srdeční frekvence. Při léčbě dronedaronem je třeba brát v úvahu interakce s řadou léčiv, výhodná je ale absence klinicky významné interakce s perorální antikoagulační léčbou. To je u ![Obr. 2 Nová evropská doporučení pro postup u fibrilace síní; podle [15] – Camm, et al., 2010.](https://www.remedia.cz/photo-a-28343---.jpg) onemocnění, kde je tato léčba většinou dlouhodobě indikována, z praktického hlediska velmi důležité. Dronedaron je vhodný pro pacienty s dalšími extrakardiálními přidruženými onemocněními. Na rozdíl od jiných antiarytmik je dronedaron bezpečný také u pacientů s ischemickou chorobou srdeční a u pacientů s hypertrofií levé komory.
onemocnění, kde je tato léčba většinou dlouhodobě indikována, z praktického hlediska velmi důležité. Dronedaron je vhodný pro pacienty s dalšími extrakardiálními přidruženými onemocněními. Na rozdíl od jiných antiarytmik je dronedaron bezpečný také u pacientů s ischemickou chorobou srdeční a u pacientů s hypertrofií levé komory.
Dronedaron je kontraindikován u pacientů se srdečním selháním funkční klasifikace NYHA III a IV a u pacientů s těžší systolickou dysfunkcí levé komory srdeční (EF ≤ 35 %). Kontraindikován je také v případech recentní kardiální dekompenzace a hemodynamické nestability. Pokud je pacient s lehčí formou srdeční insuficience léčen dronedaronem, je třeba sledovat, zda nedochází ke zhoršování klinických symptomů. Role dronedaronu u pacientů s diastolickou dysfunkcí levé komory není zatím zcela jasná.
Podle současných evropských doporučení pro léčbu fibrilace síní je dronedaron indikován u pacientů bez strukturálního srdečního onemocnění, u nemocných s ischemickou chorobou srdeční, hypertrofií levé komory a stabilním srdečním selháním funkční klasifikace NYHA I a II, viz obr. 2 [15].
Ovlivnění prognózy
Dronedaron je prvním antiarytmikem, u kterého bylo zásluhou studie ATHENA u nepermanentní fibrilace síní prokázáno zlepšení klinické prognózy, zejména díky významnému snížení nutnosti hospitalizací z kardiovaskulárních příčin. Velmi nadějná je také evidence o snížení kardiovaskulární mortality v této studii. Potenciálně velmi významný je také post hoc prokázaný nižší výskyt cévních mozkových příhod. Tyto nálezy však v každém případě znamenají posun od zažitého pohledu na antiarytmickou léčbu – od pouhé kontroly symptomů a sledování EKG parametrů (srdeční rytmus, srdeční frekvence) ke zlepšování prognosticky významných klinických výsledků. Otázku, zde je možno pozitivní ovlivnění prognózy léčbou dronedaronem uplatnit i u permanentní fibrilace síní, v současné době zkoumá probíhající klinická studie PALLAS.
Indikace
Dronedaron je indikován u dospělých klinicky stabilních pacientů, kteří mají v anamnéze nepermanentní fibrilaci síní nebo tímto onemocněním trpí v současnosti, jako prevence rekurence fibrilace síní nebo ke snížení komorové frekvence.
V některých zemích, např. v USA, je dronedaron indikován ke snížení rizika kardiovaskulárních hospitalizací u pacientů s paroxysmální nebo perzistující fibrilací nebo s flutterem síní, kteří prodělali recentní epizodu fibrilace/flutteru síní, mají zvýšené kardiovaskulární riziko a mají sinusový rytmus nebo je u nich plánována kardioverze.
Kontraindikace
Dronedaron je kontraindikován u závažného srdečního selhání (NYHA IV a nestabilní NYHA III), u síňokomorového  bloku druhého nebo třetího stupně nebo u sick sinus syndromu, pokud není pacient zajištěn funkčním kardiostimulátorem. Další kontraindikací je bradykardie < 50 tepů za minutu, QTc interval (dle Bazetta) ≥ 500 milisekund, závažná porucha funkce jater a těžké renální postižení s glomerulární filtrací < 30 ml/min. Kontraindikováno je současné podávání silných inhibitorů CYP3A4 a přípravků, které mohou navodit komorovou tachykardii typu torsades de pointes (fenothiaziny, tricyklická antidepresiva, některé makrolidy, antiarytmika třídy I a III), viz tab. 2.
bloku druhého nebo třetího stupně nebo u sick sinus syndromu, pokud není pacient zajištěn funkčním kardiostimulátorem. Další kontraindikací je bradykardie < 50 tepů za minutu, QTc interval (dle Bazetta) ≥ 500 milisekund, závažná porucha funkce jater a těžké renální postižení s glomerulární filtrací < 30 ml/min. Kontraindikováno je současné podávání silných inhibitorů CYP3A4 a přípravků, které mohou navodit komorovou tachykardii typu torsades de pointes (fenothiaziny, tricyklická antidepresiva, některé makrolidy, antiarytmika třídy I a III), viz tab. 2.
Nežádoucí účinky
Informace o nežádoucích účincích vycházejí ze závěrů pěti randomizovaných klinických studií kontrolovaných placebem, kterých se zúčastnilo přes 6000 pacientů. V těchto studiích ukončilo léčbu předčasně 11,8 % pacientů ze skupiny s dronedaronem a 7,7 % pacientů ze skupiny placeba. Nejčastějšími subjektivními nežádoucími účinky byly gastrointestinální obtíže (průjem, nauzea, bolesti břicha, zvracení), které byly důvodem k vysazení léčby u 3,2 % pacientů léčených dronedaronem a u 1,8 % pacientů v placebových skupinách. V některých případech gastrointestinální obtíže spontánně ustupují a nevedou k nutnosti léčbu ukončit. K častějším nežádoucím účinkům patřila rovněž bradykardie, únava a astenie. V nedávné době byla zaznamenána závažná jaterní poškození u 2 pacientů léčených dronedaronem. Proto je doporučováno, zvláště v úvodu léčby, kontrolovat jaterní testy.
V žádné z dosud provedených klinických studií nebyly prokázány proarytmické účinky dronedaronu (ani závažné bradyarytmie, ani tachyarytmie nebo torsades de pointes). Rovněž nebyly prokázány amiodaronu podobné toxické účinky na štítnou žlázu a plicní parenchym, ani neurotoxické či okulotoxické nežádoucí účinky.
Lékové interakce
Farmakodynamické interakce
Dronedaron má antiadrenergní účinky a inhibuje řadu transmembranózních iontových kanálů (draslíkových, sodíkových i vápníkových), které ovlivňují elektrofyziologické vlastnosti převodního systému. Proto hrozí riziko poruch tvorby a vedení vzruchu. Při komedikaci dronedaronu s léky majícími negativně chronotropní efekt, tj. s betablokátory, ivabradinem, verapamilem či diltiazemem, se může objevit sinusová bradykardie. Při současném podávání dronedaronu s léky majícími negativně dromotropní účinek, tj. typicky s betablokátory, s antiarytmiky I. a III. třídy, s verapamilem či s diltiazemem, vzrůstá riziko síňo-komorových převodních blokád. Některá neuroleptika a tricyklická antidepresiva zpomalují repolarizaci myokardu (manifestující se prodloužením intervalu QT) a zvyšují riziko převodních blokád nebo v horším případě se mohou vyskytnout komorové tachykardie typu torsades de pointes.
Farmakokinetické interakce
Dronedaron je ještě na úrovni enterocytu a dále v jaterních mikrozomech intenzivně metabolizován oxidázou CYP3A4 a eliminován glykoproteinem P. Díky tomu je výsledná biologická dosažitelnost dronedaronu relativně nízká, jen 10–20 %. Inhibice izoenzymu CYP3A4 tak může zásadním způsobem zvýšit biologickou dostupnost. Silné inhibitory CYP3A4, zejména azolová antimykotika (ketokonazol, itrakonazol, flukonazol), některá makrolidová antibiotika (klarithromycin, erythromycin) či antiretrovirotika (ritonavir) zvyšují již po několika dnech koncentraci dronedaronu téměř o řád a expozici až 25krát. V praxi je nutno se současnému podání silných inhibitorů CYP3A4 bezpodmínečně vyhnout. Slabší inhibitory izoenzymu CYP3A4, verapamil či diltiazem, v praxi často podávané souběžně s dronedaronem, zvyšují expozici jen dvoj- až trojnásobně, nicméně při popsané farmakodynamické interakci je i tato interakce klinicky závažná. Mezi inhibitory CYP3A4 patří též flavonoidy z grepové šťávy. U grapefruitové šťávy stačí k účinné inhibici CYP3A4 již 500 ml po dobu jednoho až tří dnů. V menší koncentraci však jsou tyto flavonoidy obsaženy i ve šťávě z jiných citrusů či ve víně. Dlouhodobá konzumace džusů či vína může proto expozici dronedaronu mírně zvýšit též.
Obdobný vztah k expozici dronedaronu platí též pro efluxní transportní protein – glykoprotein P. Jeho inhibice na úrovni enterocytu či hepatocytu vede ke zvýšení dostupnosti a výsledné expozice. Inhibitory oxidázy CYP3A4 a glykoproteinu P jsou obdobné. K silným inhibitorům patří opět azolová a některá makrolidová antibiotika.
Vedle inhibitorů mohou expozici významně ovlivnit také induktory zmíněných metabolických a transportních systémů. Indukce izoenzymu CYP3A4 či glykoproteinu P může snížit expozici dronedaronu na méně než čtvrtinu a terapeutický efekt selhává. K významným induktorům obou systémů patří např. třezalka tečkovaná (odvar či tinktura), fenobarbital, rifampicin, některá antiepileptika, některá antiretrovirotika, klotrimazol či morfin.
Donedaron není pouze substrátem, je též, podobně jako amiodaron, významným inhibitorem řady metabolických a transportních systémů. Dronedaron je středně silným inhibitorem oxidázy CYP3A4 a glykoproteinu P, dále je významným inhibitorem oxidázy CYP2D6. Díky této skutečnosti zpomaluje biotransformaci a biodegradaci řady substrátů těchto izoenzymů a zvyšuje biologickou dostupnost a zpomaluje eliminaci substrátů glykoproteinu P. Na rozdíl od amiodaronu dronedaron neovlivňuje izoenzym 2C9, který degraduje například warfarin. Hodnoty INR proto nejsou při léčbě dronedaronem významně ovlivněny.
Mezi léky, které jsou často podávány u nemocných léčených dronedaronem a jež současně patří mezi substráty CYP3A4 a glykoproteinu P, patří lipofilní statiny – simvastatin, lovastatin a částečně i atorvastatin. Dronedaron významně zvyšuje expozici těmto statinům: expozice simvastatinu a lovastatinu se zvyšuje 2–4násobně, méně již je ovlivněn metabolismus atorvastatinu. Rosuvastatin není substrátem CYP3A4, proto expozice rosuvastinu ovlivněna není a do kombinace je vhodný.
Významným substrátem glykoproteinu P je také digoxin. Dronedaron zvyšuje jeho expozici dvoj- až trojnásobně, což je při velmi úzkém terapeutickém oknu digoxinu klinicky významné kvůli riziku závažných poruch srdečního rytmu [16]. Proto je nutno stanovit hladinu digoxinu za 2–3 týdny po zahájení souběžné medikace a upravit jeho dávku.
Třetí významnou interakci je nutno uvést ve skupině inhibitorů fosfodiesterázy-5 (sildenafil, tadalafil či vardenafil), léků užívaných k léčbě erektilní dysfunkce. Dronedaron může několikanásobně prodloužit dobu účinku inhibitorů PDE-5 a při současném podání nitrátů hrozí závažná hypotenze.
 Významné interakce mohou vzniknout též na úrovni izoenzymu CYP2D6. Substráty jsou například lipofilní betablokátory (metoprolol, karvedilol, event. nebivolol) či řada psychofarmak a antiarytmik. Důležité je upozornit na časté podávání lipofilních betablokátorů společně s dronedaronem k docílení kontroly frekvence. Dronedaron zvyšuje expozici např. metoprololu i jeho koncentraci více než dvojnásobně [17]. Tato skutečnost by nebyla významná, nicméně při současné interakci farmakodynamické může hrozit přílišná inhibice sinusového uzlu a převodního systému. Do kombinace s dronedaronem je proto vhodné volit hydrofilní betablokátory (např. betaxolol a bisoprolol). Inhibicí oxidázy CYP2D6 může klesat také koncentrace účinného metabolitu některých opiátů a antitusik (tramadol, kodein), viztab. 3.
Významné interakce mohou vzniknout též na úrovni izoenzymu CYP2D6. Substráty jsou například lipofilní betablokátory (metoprolol, karvedilol, event. nebivolol) či řada psychofarmak a antiarytmik. Důležité je upozornit na časté podávání lipofilních betablokátorů společně s dronedaronem k docílení kontroly frekvence. Dronedaron zvyšuje expozici např. metoprololu i jeho koncentraci více než dvojnásobně [17]. Tato skutečnost by nebyla významná, nicméně při současné interakci farmakodynamické může hrozit přílišná inhibice sinusového uzlu a převodního systému. Do kombinace s dronedaronem je proto vhodné volit hydrofilní betablokátory (např. betaxolol a bisoprolol). Inhibicí oxidázy CYP2D6 může klesat také koncentrace účinného metabolitu některých opiátů a antitusik (tramadol, kodein), viztab. 3.
Těhotenství a kojení
Dronedaron není doporučován v těhotenství, protože u zvířat byla prokázána reprodukční toxicita. Klinické údaje nejsou k dispozici. Není známo, zda se dronedaron vylučuje do mateřského mléka.
Dávkování
Doporučená dávka dronedaronu je 400 mg dvakrát denně, ráno a večer s jídlem. Dávku není potřeba upravovat u žen nebo u starších pacientů.
Seznam použité literatury
- [1] Dale KM, White CM. Dronedarone: an amiodarone analog for the treatment of atrial fibrillation and atrial flutter. Ann Pharmacother 2007; 41: 599–605.
- [2] Lalevée N, Nargeot J, Barrére-Lemaire S, et al. Effects of amiodarone and dronedarone on voltage-dependent sodium current in human cardiomyocytes. J Cardiovasc Electrophysiol 2003; 14: 885–890.
- [3] Manning A, Thisse V, Hodeige D, et al. SR 33589, a new amiodarone-like antiarrhythmic agent: electrophysiological effects in anesthetized dogs. J Cardiovasc Pharmacol 1995; 25: 252–261.
- [4] Tafreshi MJ, Rowles J. A review of the investigational antiarrhythmic agent dronedarone. J Cardiovasc Pharmacol Ther 2007; 12: 15–26.
- [5] Tschuppert Y, Buclin T, Rothuizen LE, et al. Effect of dronedarone on renal function in healthy subjects. Br J Clin Pharmacol 2007; 64: 785–791.
- [6] Clinical Investigator's brochure: SR33589B Dronedarone. Bridgewater, NJ, Sanofi-Synthelabo Recherche, Edition: E07, 2006.
- [7] Touboul P, Brugada J, Capucci A, et al. Dronedarone for prevention of atrial fibrillation: a dose-ranging study. Eur Heart J 2003; 24: 1481–1487.
- [8] Singh BN, Connolly SJ, Crijns HJ, et al; EURIDIS and ADONIS Investigators. Dronedarone for maintenance of sinus rhythm in atrial fibrillation or flutter. N Engl J Med 2007; 357: 987–999.
- [9] Davy JM, Herold M, Hoglund C, et al. Dronedarone for the control of ventricular rate in permanent atrial fibrillation: the Efficacy and safety of dRonedArone for The cOntrol of ventricular rate during atrial fibrillation (ERATO) study. Am Heart J 2008; 156: 521–529.
- [10] Ko/ber L, Torp-Pedersen C, McMurray JJ, et al; Dronedarone Study Group. Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med 2008; 358: 2678–2687.
- [11] Hohnloser SH, Crijns HJ, van Eickels M, et al; ATHENA Investigators. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360: 668–678.
- [12] Connolly SJ, Crijns HJ, Torp-Pedersen C, et al; ATHENA Investigators. Analysis of stroke in ATHENA: a placebo-controlled, double-blind, parallel-arm trial to assess the efficacy of dronedarone 400 mg BID for the prevention of cardiovascular hospitalization or death from any cause in patients with atrial fibrillation/atrial flutter. Circulation 2009; 120: 1174–1180.
- [13] Page RL, Connolly SJ, Crijns HJ, et al; ATHENA Investigators. Rhythm- and Rate-Controlling Effects of Dronedarone in Patients With Atrial Fibrillation (from the ATHENA Trial). Am J Cardiol 2011; 107: 1019–1022.
- [14] Le Heuzey JY, De Ferrari GM, Radzik D, et al. A short-term, randomized, double-blind, parallel-group study to evaluate the efficacy and safety of dronedarone versus amiodarone in patients with persistent atrial fibrillation: the DIONYSOS study. J Cardiovasc Electrophysiol 2010; 21: 597–605.
- [15] European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery, Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31: 2369–2429.
- [16] Nademanee K, Kannan R, Hendrickson J, et al. Amiodarone-digoxin interaction: clinical significance, time course of development, potential pharmacokinetic mechanisms and therapeutic implications. J Am Coll Cardiol 1984; 4: 111–116.
- [17] Damy T, Pousset F, Caplain H, et al. Pharmacokinetic and pharmacodynamic interactions between metoprolol and dronedarone in extensive and poor CYP2D6 metabolizers healthy subjects. Fundam Clin Pharmacol 2004; 18: 113–123.