Eplerenon
Eplerenon je selektivní blokátor aldosteronu. Perorálně podávaný eplerenon je schválen pro léčbu nemocných se systolickou dysfunkcí levé komory a známkami srdečního selhání po infarktu myokardu ve většině zemí Evropské unie včetně České republiky. Přidání eplerenonu ke standardní terapii nemocných s akutním infarktem myokardu a známkami srdečního selhání při systolické dysfunkci levé komory vedlo ve studii EPHESUS (Eplerenone Post-acute myocardial infarction Heart failure Efficacy and Survival Study) k výraznému zlepšení prognózy nemocných se snížením morbidity i mortality. Tento pozitivní účinek byl pozorován již 30. den po randomizaci. Léčba eplerenonem byla doprovázena minimem nežádoucích účinků. Ve studiích u hypertoniků byla léčba 50–200 mg eplerenonu srovnatelná s léčbou 10–40 mg enalaprilu s poklesem krevního tlaku v průměru o 15/11 mm Hg a s normalizací krevního tlaku u 46 % nemocných s monoterapií. Doporučené a ověřené dávky jsou jedenkrát denně 25–50 mg u srdečního selhání po infarktu myokardu a 50–200 mg při léčbě hypertenze.
Farmakologická skupina
Eplerenon je kalium šetřící diuretikum – antagonista aldosteronu (selektivní blokátor aldosteronových receptorů).
ATC kód: C03DA04
Chemické a fyzikální vlastnosti
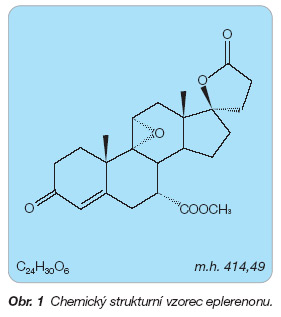
Eplerenon je 9a,11a-epoxiderivát mexrenonu, přesněji methyl (2´R)-9,11a-epoxi-3,5´-dioxo-4´,5´-dihydrospiro[androst-4-en-17,2´(3H)-furan]-7a-karboxylát.
Sumární vzorec: C24H30O6
Molekulová hmotnost: 414,49
Eplerenon (obr. 1) je bílý nebo téměř bílý krystalický prášek bez zápachu. Ve vodě je velmi těžce rozpustný. Jeho rozpustnost ve vodě neovlivňuje pH. Eplerenon je velice dobře rozpustný v chloroformu, benzyl- alkoholu a acetonitrilu. Jeho rozdělovací koeficient oktanol/voda je 7,1 při pH 7,0. Jedná se o opticky aktivní sloučeninu s 8 chirálními centry.
Vývoj antagonistů aldosteronu
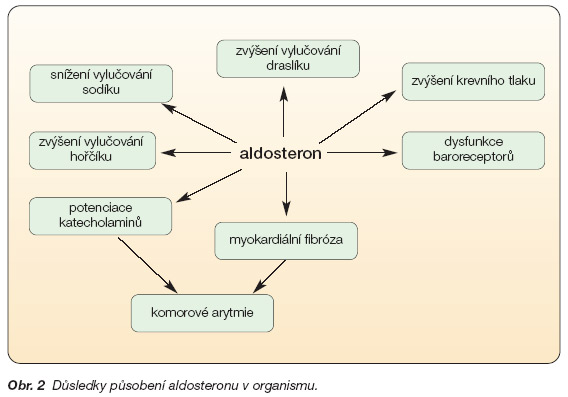
Aldosteron je jedním z klíčových hormonů systému renin-angiotenzin-aldosteron (RAA). Mezi hlavní účinky aldosteronu patří zadržování sodíku v ledvinách a zvýšené vylučování draslíku a hořčíku. Aldosteron dále způsobuje myokardiální a perivaskulární fibrózu, blokuje vychytávání noradrenalinu v myokardu a zvyšuje hladiny inhibitoru aktivátoru plazminu (obr. 2). Společně s angiotenzinem II vede k poškození cév, podněcuje endoteliální dysfunkci a snižuje poddajnost arterií. Celý systém RAA tak hraje důležitou roli při rozvoji hypertenze a srdečního selhání, a tedy je i klíčovým systémem pro terapeutické intervence. Běžně předepisovanými léčivy pro kontrolu hypertenze a srdečního selhání jsou inhibitory systému RAA, které zahrnují inhibitory angiotenzin konvertujícího enzymu (ACEI) a antagonisty AT II receptorů zasahující do syntézy aldosteronu [1].
Podnětem k syntéze a zkoušení antagonistů aldosteronu byly dva objevy. Jednalo se o odhalení struktury aldosteronu, který je 18-aldehydickým derivátem glukokortikoidu kortikosteronu [2], a o klinické pozorování progesteronem zvýšeného vylučování sodíku u lidí po exogenním podání mineralokortikoidu [3]. Antagonismus mineralokortikoidní aktivity byl pozorován i u dalších steroidních sloučenin. Kombinací struktury progesteronu a digoxinu (s cílem dosáhnout kardiotonického účinku) byla vytvořena řada molekul 17-spirolaktonu, které díky strukturní podobě laktonového kruhu těchto sloučenin a poloacetalového cyklu aldosteronu kompetitivně blokovaly receptory pro aldosteron [4]. Po několika dalších strukturních modifikacích a po následném navázání kyseliny thio-octové vznikla z původně parenterálně podávaného spirolaktonu perorální léková forma spironolakton. Ten byl v roce 1960 schválen americkou FDA jako kalium šetřící diuretikum užívané v terapii primárního aldosteronismu, edémů, esenciální hypertenze a hypokalémie a následně uveden na trh.
Když byl v roce 1961 popsán vztah mezi reninem, angiotenzinem II a sekrecí aldosteronu [5], farmaceutický průmysl se při výzkumu potenciálních kardiovaskulárních léčiv zaměřil na inhibici angiotenzin konvertujícího enzymu (ACE), reninu a blokování angiotenzinu II. K obratu došlo po objevení fyziologicky specifických mineralokortikoidních receptorů v jádrech nefronů a po zjištění, že působením aldosteronových antagonistů lze inhibovat vazbu aldosteronu k těmto receptorům.
Zatímco mechanismus inhibice spironolaktonem je založen na snížení aldosteronem zvýšené syntézy jaderné RNA [6], byly hledány látky, které by se stejně jako aldosteron vázaly selektivně na receptor, a tím ho inhibovaly. Dlouhodobé užívání nebo vysoké dávky spironolaktonu jsou spojeny s endokrinními účinky, jako je např. ztráta libida, nepravidelná menstruace, gynekomastie a impotence [7]. Tyto vedlejší účinky jsou dány především vazbou spironolaktonu na progesteronové a androgenní receptory [8, 9].
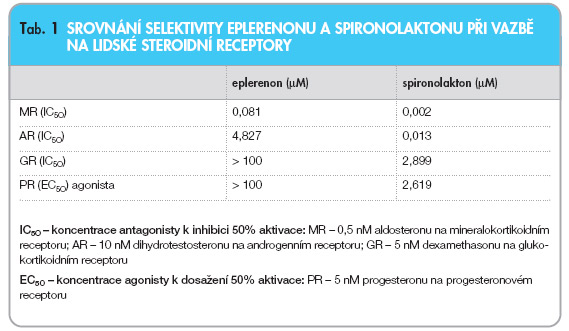
Objev molekuly eplerenonu a potvrzení její mineralokortikoidní afinity a selektivity vzešel z laboratoří Ciba-Geigy [10]. Základním znakem, který zaručuje selektivitu, je 9,11-epoxidový můstek v laktonovém kruhu. Tuto zvýšenou selektivitu ve srovnání se spironolaktonem prokázaly pokusy na lidských steroidních receptorech, kdy byla sledována schopnost sloučenin stimulovat nebo antagonizovat čistě agonistickou transkripční odpověď při působení aldosteronu [11].
Po objevu aldosteronových receptorů v neepiteliálních tkáních byl zjištěn jeho škodlivý účinek a dán do souvislosti vztah mezi aktivací systému RAA a rozvojem remodelace srdečních komor [12]. V následujících studiích byly tyto objevy potvrzeny, i když se předpokládá, že primární poškození je indukováno cévním zánětem a poraněním drobných arterií a arteriol v tkáních, které předchází vlastnímu reaktivnímu a reparativnímu procesu fibrózy [13].
Mechanismus účinku, farmakodynamika
Receptorová aktivita
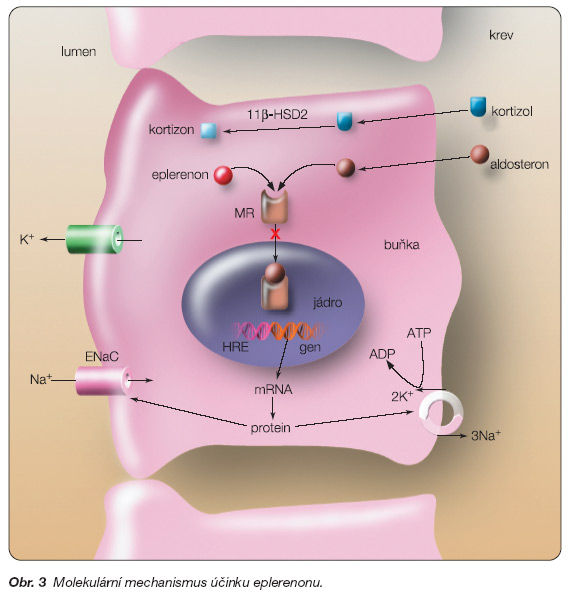
Eplerenon je 9a,11a-epoxiderivát mexrenonu, který se váže na mineralokortikoidní receptory, kde působí jako antagonista aldosteronu. Mineralokortikoidní receptory se vyskytují převážně na úrovni ledvinných tubulů a v menší míře i v dalších epiteliích (slinné žlázy a gastrointestinální trakt). Jedná se o receptory regulující genovou expresi a vedoucí k Na+/K+ výměně (obr. 3).
Nedávné důkazy potvrzují výskyt aldosteronových receptorů v mnohých neepiteliálních lokalizacích. Účinek aldosteronu je v těchto místech zprostředkováván systémem druhých poslů, který vede k aktivaci Na+/K+ transportéru. Eplerenon antagonizuje účinky aldosteronu na obou typech těchto receptorů [14, 15], takže příznivý efekt eplerenonu pozorujeme jak na úrovni renálního mechanismu (redukce plazmatického volumu, exkrece sodíku), tak i extrarenálně (např. potlačení zánětlivé reakce v ateroskleroticky postižených cévách, redukce oxidativního stresu, regrese endoteliální dysfunkce, snížení agregace destiček, snížení aktivity tkáňových metaloproteináz, potlačení remodelace levé komory a ovlivnění buněčného transportu Na+/K+, rovnováha na ose renin-angiotenzin, změna tlaku krve a srdeční, renální a orgánová protekce).
Studie in vitro prokázaly, že díky přítomnosti 9,11-epoxidové vazby má eplerenon 10–20násobně nižší afinitu k mineralokortikoidnímu receptoru než spironolakton [16, 17]. In vivo je aldosteron z 50 % inhibo- ván poloviční dávkou eplerenonu (0,8 mg/ kg) při vazbě na ledvinné mineralokortikoidní receptory u krys ve srovnání se spironolaktonem (1,7 mg/kg). Menší rozdíl v receptorové afinitě in vivo může být zapříčiněn o 50 % nižší vazbou eplerenonu k plazmatickým bílkovinám [16]. Vazebná místa mineralokortikoidního receptoru jsou stejná pro všechny tři ligandy, tedy pro agonisty i antagonisty. Eplerenon a spironolakton mají dokonce k mineralokortikoidnímu receptoru podobné vazebné determinanty, ale ty se liší od vazebné determinanty aldosteronu [18].
Největší rozdíl mezi eplerenonem a spironolaktonem je v jejich afinitě k androgenním a progesteronovým receptorům. Eplerenon má 500krát nižší afinitu k těmto receptorům, což vede ke značnému poklesu vedlejších účinků progestagenní a antiandrogenní povahy. Eplerenon je zároveň 370krát méně aktivní v blokování aktivace androgenních receptorů spojené s dihydrogentestosteronem (tab. 1) [16].
Ovlivnění Na+/K+ transportu
Eplerenon i spironolakton vyvolávají slabou natriurézu. I přes různou receptorovou afinitu mají in vivo obě sloučeniny stejný vliv na poměr Na+: K+ v moči. U pacientů s cirhózou a ascitem nebo srdečním selháním se pro zvýšení odpovědi organismu doporučuje podání spironolaktonu v kombinaci s kličkovým diuretikem [19, 20].
Osa renin-angiotenzin
Antagonisté aldosteronových receptorů i inhibitory ACE vedou přerušením krátké zpětné vazby osy renin-angiotenzin k její aktivaci. Navíc blokáda aldosteronu na mineralokortikoidních receptorech v distálním nefronu stimuluje uvolňování reninu a přerušením dlouhé zpětné vazby systému RAAS zvyšuje hladiny aldosteronu, přičemž 100 mg eplerenonu vyvolává menší změny než podání spironolaktonu [21].
Přestože eplerenon i spironolakton ovlivňují hladiny aldosteronu v organismu bez zásahu do jeho biosyntézy, jejich zvýšení se obejde bez škodlivého působení. Mineralokortikoidní receptory jsou zablokovány antagonisty, a tím jsou nedostupné pro endogenní substrát. Zvýšená hladina aldosteronu je důležitým markerem, který vypovídá o mineralokortikoidní blokádě.
Krevní tlak
Mechanismus poklesu krevního tlaku je založen na jednoduchých změnách volumu. Po podání noradrenalinu či angiotenzinu II se snižuje odpověď organismu, neboť kardiovaskulární reaktivita je inhibována blokováním mineralokortikoidních receptorů. Charakter odpovědi organismu na podání spironolaktonu nezávisí na běžných plazmatických hladinách aldosteronu.
Organoprotekce
Studie, které by porovnávaly efektivitu eplerenonu a spironolaktonu při ochraně koncových orgánů, nejsou k dispozici stejně jako odpověď organismu závislá na dávce a vliv na specifické srdeční a ledvinné funkce.
Ovlivnění remodelace levé komory
Předpokládaným mechanismem vzniku poškození srdce je zvýšená hladina aldosteronu, která způsobuje myokardiální fibrózu a je spojena s tloušťkou stěny levé komory. Na zvířecích modelech bylo potvrzeno, že k fibróze dochází pod vlivem aldosteronu, zatímco hypertrofie myocytů vzniká v důsledku mechanických faktorů, především hypertenze. Navíc mezi hladinou aldosteronu a tloušťkou srdeční stěny byla potvrzena signifikantně významná korelace nezávislá na tlaku krve. Tyto faktory jsou jasným znamením pro rozvoj srdečního selhání [22–24].
V preklinických studiích se ukázalo, že podávání eplerenonu vede k výraznému zmírnění remodelace levé srdeční komory u potkanů s infarktem myokardu, přičemž největšího přínosu bylo dosaženo při jeho současném podávání s inhibitorem ACE. Léčba eplerenonem tedy např. vedla ke snížení enddiastolického tlaku či ke zmenšení objemu levé komory na konci diastoly. Jistě velice zajímavé rovněž bylo i pozorování, že eplerenon významně snižoval množství kolagenu obsaženého v okolním nepostiženém myokardu (tj. reaktivní fibróza) [25, 26].
Farmakokinetické vlastnosti
Absorpce a distribuce
Absolutní biologická dostupnost eplerenonu není v literatuře dosud udávána, i když studie prokazují rychlou absorpci z oblasti gastrointestinálního traktu, a to bez výrazného ovlivnění potravou, s maximem cmax za 1,3 hod. a ustálením plazmatické koncentrace během 2 hodin. Distribuční objem kolísá v rozpětí 43–90 l, přičemž přibližně polovina množství eplerenonu přítomného v plazmě je vázána na bílkoviny krevní plazmy, především na kyselý a1-glykoprotein. Eplerenon se přednostně neváže na červené krevní buňky [27].
Metabolismus a eliminace
Eplerenon je metabolizován cytochromázovým systémem P-450 3A4 bez vzniku aktivních metabolitů. Hlavními metabolity jsou 6b-hydroxyeplerenon a otevřený laktonový kruh, které při pokusech na lidských mineralokortikoidních receptorech nevykazují žádnou aktivitu. Přibližně 67 % z podané dávky se vylučuje močí a 33 % je vyloučeno stolicí. Biologický poločas eplerenonu je udáván mezi 4 a 6 hodinami; plazmatická clearance je 10 l/h (tab. 2) [27, 28].
Zvláštní skupiny pacientů
U osob starších 65 let dochází ve srovnání se zdravými dobrovolníky při podání dávky 100 mg eplerenonu jedenkrát denně k vzestupu cmax a AUC o 22 %, resp. o 45 %. Farmakokinetické změny ve stáří jsou vysvětlovány poklesem ledvinné funkce a/nebo vnitřní enzymatické výbavy jedince.
Vzestup cmax a AUC byl rovněž zaznamenán u osob v různých fázích renální insuficience a u osob s poškozením jater (třída B podle Childovy-Pughovy klasifikace). Naopak u černošské populace jsou cmax i AUC v ustáleném stavu nižší.
U pacientů se srdečním selháním byl prokázán rychlejší nástup cmax a větší AUC, avšak clearance byla ve studii EPHESUS (Eplerenone Post-AMI Heart Failure Efficacy and Survival Study) podobná výsledkům u zdravých jedinců.
Tyto odchylky v eliminačním profilu je třeba brát v úvahu při volbě vhodné terapeutické dávky, neboť eplerenon nelze odstranit hemodialýzou. Regulace dávky není nutná u starších pacientů ani u osob s mírným nebo středně závažným jaterním onemocněním. Doporučuje se sledování hladiny draslíku [27].
Klinické zkušenosti
Eplerenon byl zkoušen především u nemocných se srdečním selháním po infarktu myokardu a u nemocných s hypertenzí.
Srdeční selhání
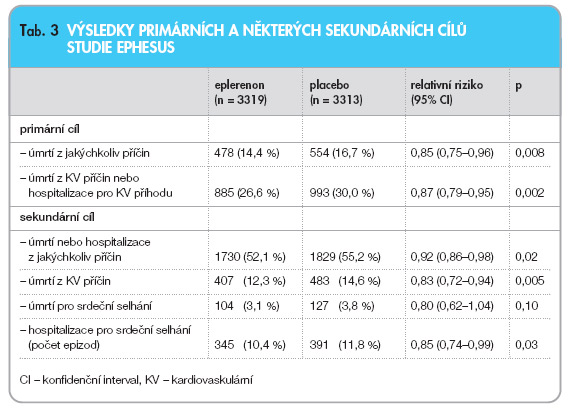
Studie EPHESUS (Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study) měla za cíl zhodnotit efekt eplerenonu, selektivního blokátoru aldosteronových receptorů, na morbiditu a mortalitu u pacientů po akutním infarktu myokardu komplikovaném dysfunkcí levé komory a srdečním selháním [29, 30]. Jednalo se o randomizovanou dvojitě slepou placebem kontrolovanou mezinárodní multicentrickou studii. Úvodní dávka eplerenonu byla 25 mg, cílová 50 mg.
Do studie bylo zařazeno 6632 pacientů 3.–14. den po akutním infarktu myokardu s dysfunkcí levé komory (ejekční frakce (EF) < 40 %) a s dokumentovaným srdečním selháním (symptomy srdečního selhání nebyly vyžadovány u diabetiků). Průměrný věk 64 ± 11 let, 72 % mužů, 90 % bělochů, průměrná EF 33 ± 6 %. Průměrná doba sledování byla 16 měsíců. Podáván byl eplerenon 50 mg v jedné denní dávce, nebo placebo. Průměrná dávka eplerenonu na konci studie byla 43 mg. Jakákoliv reperfuzní léčba byla povolena, další medikaci představovaly inhibitory ACE (87 %), b-blokátory (75 %), diuretika (60 %), kyselina acetylsalicylová (89 %), statiny (47 %).
Přidání eplerenonu ke standardní medikaci signifikantně snížilo mortalitu a morbiditu nemocných se systolickou dysfunkcí levé komory a známkami srdečního selhání po akutním infarktu myokardu [29, 31]. Nemocní léčení eplerenonem měli 15% relativní snížení úmrtnosti a 13% snížení kombinovaného cíle kardiovaskulární úmrtí a hospitalizace. Celková úmrtnost po jednom roce léčby byla 11,8 % u nemocných léčených eplerenonem a 13,6 % u nemocných dostávajících placebo (standardní terapii). Výsledky některých cílů studie jsou uvedeny v tab. 3.
Pozdější analýzy ukázaly, že statisticky významné snížení mortality bylo pozorovatelné již 30. den po randomizaci, v této době byla celková mortalita při léčbě eplerenonem 3,2 % a při podávání placeba 4,6 %, výskyt kardiovaskulární mortality byl 30. den 8,6 % u pacientů léčených eplerenonem a 9,9 % ve skupině dostávající placebo [30].
Snížení mortality bylo především důsledkem snížení počtu náhlých úmrtí (4,9 % v. 6,1 %, p = 0,03), nebyl doložen statisticky významný rozdíl v počtu úmrtí na reinfarkty, srdeční selhání či cévní mozkové příhody. Během studie bylo pozorováno významné snížení počtu hospitalizací pro srdeční selhání (11,8 % v. 13,3 %, p = 0,13) a zkrácení délky hospitalizace (8,6 v. 10,3 dní, p = 0,013).
Eplerenon byl účinný u nemocných s anamnézou hypertenze (n = 4007) i u nemocných s diabetes mellitus a srdečním selháním (n = 1483). U nemocných s hypertenzí byla celková mortalita snížena o 23 % (p = 0,001) a kombinovaný cíl kardiovaskulární morbidita a mortalita o 16 % (p = 0,002) při léčbě eplerenonem. U nemocných s diabetes mellitus a srdečním selháním snížila léčba eplerenonem celkovou mortalitu o 15 %, kardiovaskulární mortalitu a morbiditu o 17 % a kardiovaskulární mortalitu taktéž o 17 %.
Eplerenon byl stejně účinný u nemocných, kteří podstoupili reperfuzní terapii akutní koronární příhody, i u nemocných bez této léčby. Celková mortalita byla snížena o 19 % (p = 0,07) u nemocných s reperfuzní léčbou a o 14 % (p = 0,037) u nemocných bez reperfuzní léčby, kardiovaskulární morbidita a mortalita byla snížena o 17 % (p = 0,015) a 11 % (p = 0,037), kardiovaskulární mortalita o 25 % (p = 0,023) a 14 % (p = 0,05).
Hypertenze
Eplerenon byl zkoušen v několika klinických studiích při monoterapii hypertenze i v kombinační léčbě, celkem bylo zařazeno do těchto studií 3091 nemocných, z čehož 46 % tvořily ženy a 22 % představovaly osoby starší 65 let. Hlavním vylučovacím kritériem byla hladina draslíku nad normou a manifestní renální insuficience [31].
Eplerenon byl zkoušen v několika studiích proti placebu, kdy vstupním kritériem byl diastolický krevní tlak 95–114 mm Hg a použité dávky léčiva se pohybovaly od 25 mg do 400 mg. V doporučených terapeutických dávkách 50–200 mg byl pokles systolického krevního tlaku o 6–13 mm Hg větší než při podávání placeba, diastolický tlak poklesl o 3–7 mm Hg. Klinické studie s dávkováním 1krát denně a s ambulantním monitorováním krevního tlaku prokázaly 24hodinovou účinnost. Pokles krevního tlaku byl zřetelný po dvou týdnech s maximem účinku po čtyřech týdnech, ukončení léčby nebylo doprovázeno nežádoucími reakcemi.
Eplerenon byl zkoušen v kombinační léčbě s inhibitory ACE, antagonisty receptorů pro angiotenzin II, kalciovými blokátory, b-blokátory a hydrochlorothiazidem. Pokles krevního tlaku byl ve všech kombinacích zachován.
Podávání eplerenonu nemělo vliv na tepovou frekvenci, trvání PQ, QRS či QT intervalů.
Ve velké jednoleté klinické studii Eplerenone versus Enalapril in Hypertension byl eplerenon srovnán s enalaprilem [32]. Zařazeno bylo 499 hypertoniků s TKd 90–110 mm Hg, hladina draslíku musela dosahovat 3,0–5,0 mmol/l. Úvodní dávka enalaprilu byla 10 mg a eplerenonu 50 mg, ve 4., 8. a 12. týdnu mohla být dávka zvyšována až na 40 mg enalaprilu nebo 200 mg eplerenonu. Po 6 měsících byla dávka snížena na 1. stupeň (např. 100 mg eplerenonu). K léčbě eplerenonem bylo zařazeno 253 nemocných, k léčbě enalaprilem 246 nemocných. Během prvních 24 týdnů léčbu ukončilo 36,4 % nemocných užívajících eplerenon a 36,6 % léčených enalaprilem. Po 6 měsících byl pokles krevního tlaku po léčbě eplerenonem 14,5/11,2 mm Hg a po léčbě enalaprilem 12,7/11,3 mm Hg (ns). Po 12 měsících mělo 46 % nemocných léčených eplerenonem a 52 % nemocných léčených enalaprilem TK < 140/90 mm Hg. U nemocných s poměrem albumin/kreatinin v moči < 30 mg/g byl pokles o 8,4 % po podávání eplerenonu a o 10,5 % po léčbě enalaprilem (ns), u nemocných s poměrem albumin/kreatinin v moči ≥ 30 mg/g byl pokles o 61,5 % po léčbě eplerenonem a o 25,7 % po enalaprilu (p = 0,01).
Autoři uzavírají, že eplerenon byl stejně účinný jako enalapril při snižování krevního tlaku a účinnější při snížení mikroalbuminurie.
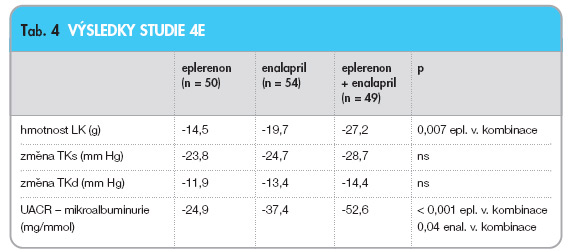
Ve studii 4E (Eplerenone, Enalapril and Eplerenone/Enalapril Combination Therapy in Patients with Left ventricular Hypertrophy) byl srovnáván eplerenon, enalapril a jejich kombinace u hypertoniků s hypertrofií levé komory srdeční. Vstupními kritérii byly systolický krevní tlak 140–200 mm Hg a diastolický ≥ 90 mm Hg a echokardiografické známky hypertrofie levé komory. Po vysazení předchozí medikace byli nemocní randomizováni na 3 skupiny: 1. skupina dostávala eplerenon v dávce 200 mg denně (n = 50), 2. skupina enalapril v dávce 40 mg denně (n = 54) a 3. skupina byla léčena kombinací eplerenon 200 mg + enalapril 10 mg denně (n = 49). Pokud tato léčba nevedla k normalizaci krevního tlaku, mohl být do kombinace přidán hydrochlorothiazid a amlodipin. Změny krevního tlaku, poměru albumin/kreatinin a hmotnosti levé komory ukazuje tab. 4. Eplerenon a enalapril byly v této studii rovnocenné v ovlivnění krevního tlaku, mikroalbuminurie i hypertrofie LK. Kombinace obou se jevila velmi výhodná z pohledu snížení mikroalbuminurie, což by mohlo být přínosné především pro léčbu hypertenze u diabetiků [33].
Zařazení do současné palety léčiv
Eplerenon je dnes především pro svůj vliv na remodelaci levé komory doporučován do kombinace s inhibitory ACE (při intoleranci antagonistů AII) a s b-blokátory u nemocných s klinickými projevy srdečního selhání po infarktu myokardu a s ejekční frakcí levé komory ≤ 40 % a je v této indikaci uveden ve všech doporučeních pro diagnostiku a léčbu srdečního selhání [34–37]. Poslední evropská i česká doporučení uvádějí eplerenon mezi léky doporučenými všem nemocným ve funkční třídě NYHA III–IV bez ohledu na etiologii srdečního selhání. Limitací je, že v kombinaci s dalšími blokátory osy renin-angiotenzin-aldosteron (ACEI, antagonisté ATII) se může objevit zvýšený výskyt hyperkalémie, a je třeba hladinu draslíku monitorovat. Druhou významnou limitací je v současnosti cena.
Dle amerických doporučení je eplerenon indikován všem nemocným s elevacemi úseku ST v důsledku infarktu myokardu, pokud nejsou kontraindikace, především hyperkalémie, renální insuficience a hypotenze.
Eplerenon nebyl v roce 2003 zařazen mezi základní antihypertenziva do evropských, amerických ani českých doporučení pro léčbu hypertenze [38–40]. Důvodem byl nedostatek znalostí o tomto přípravku a skupina blokátorů aldosteronu je zmíněna v kapitole o diureticích. Dnes můžeme eplerenon doporučit pro monoterapii i jako součást kombinační léčby hypertenze všem nemocným (s ohledem na kontraindikace). Je třeba monitorovat hladinu draslíku a renální funkce. V České republice jsou dnes blokátory aldosteronu doporučovány především do kombinační léčby u pacientů s rezistentní hypertenzí.
Farmakoekonomika
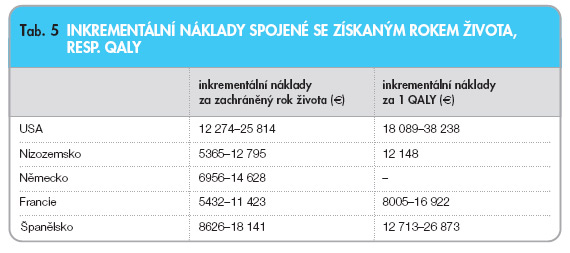
Na základě výsledků studie EPHESUS byla ve Spojených státech a v Evropě (Nizozemsko, Německo, Francie a Španělsko) analyzována efektivnost nákladů (cost-effectiveness analysis, CEA). Údaje o přímých medicínských nákladech byly sbírány prospektivně s využitím dat o místních nákladech. Dále bylo provedeno modelování za účelem zjištění přírůstkových (inkrementálních) nákladů spojených se zachráněným rokem života nebo s roky se zlepšenou kvalitou života QALY (Quality-Adjusted-Life-Year), s křivkami přežití předpokládajícími rovnoběžnost po ukončení terapie.
Terapie eplerenonem byla během studie ve srovnání s placebem spojena se získáním 0,0304 let života (11 dní). Na základě této studie je možné tvrdit, že užívání eplerenonu po dobu 16 měsíců v kombinaci se standardní terapií je u pacientů po infarktu myokardu se systolickou dysfunkcí levé komory cost-efektivní ve všech uvedených zemích při srovnání s placebem.
Ve všech sledovaných zemích kromě Německa nedosahovalo více než 90 % inkrementálních nákladů za získaný rok života hranice 50 tisíc € (tab. 5) [41].
Indikace
Eplerenon je v současné době indikován jako doplněk standardní terapie u stabilizovaných pacientů s dysfunkcí levé komory (LVEF ≤ 40 %) a s klinickými známkami srdečního selhání po nedávno prodělaném infarktu myokardu.
Kontraindikace
Mezi absolutní kontraindikace léčby eplerenonem patří hladina draslíku > 5,5 mmol/l a clearance kreatininu ≤ 30 ml/min.
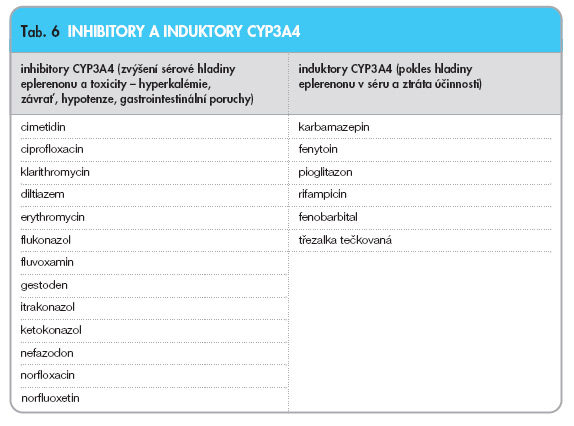
Eplerenon by neměl být používán současně se solemi draslíku či dalšími kalium šetřícími diuretiky. Eplerenon je relativně kontraindikován při současné léčbě látkami inhibujícími CYP3A4. Není k dispozici dostatek informací o bezpečnosti podávání eplerenonu u gravidních a kojících žen, proto je gravidita a kojení relativní kontraindikací. Eplerenon nebyl zkoušen u dětí.
Nežádoucí účinky
Tolerabilita byla posuzována především ve studii EPHESUS a nebyl nalezen rozdíl mezi eplerenonem a placebem v počtu léčených nemocných, u kterých se vyskytly nežádoucí účinky (78,9 % v. 79,5 %). Nejčastěji byly hlášeny kardiovaskulární problémy (> 50 %), které se pravděpodobně vztahovaly spíše k základnímu onemocnění než k medikaci (častěji se objevovaly u pacientů, jimž bylo podáváno placebo!). Při léčbě eplerenonem se vyskytlo o něco více gastrointestinálních obtíží (p = 0,05). Při podávání placeba bylo zaznamenáno více respiračních obtíží (p = 0,05), především dušnosti (p = 0,01). Nebyl zaznamenán rozdíl ve výskytu gynekomastie a její celkový výskyt v obou skupinách nepřesahoval 1 %.
Při léčbě eplerenonem se vyskytlo méně metabolických abnormalit než při podávání placeba (17,2 % v. 19,2 %, p = 0,03). Hypokalémie hlášená řešiteli se vyskytla významněji méně (0,5 % v. 1,5 %, p < 0,001), obdobně jako laboratorně stanovená hypokalémie vyžadující suplementaci draslíku a/nebo hodnotu draslíku < 3,5 mmol/l (8,4 % v. 13,1 %, p < 0,001). Méně častá byla i hypoglykémie (0,6 % v. 1,1 %, p = 0,04). Naopak hyperkalémie nahlášená řešiteli byla častější po terapii eplerenonem (3,4 % v. 2,0 %, p < 0,01), obdobně laboratorně stanovená hyperkalémie definovaná jako hladina draslíku > 6,0 mmol/l (5,5 % v. 3,9 %, p = 0,001). Dvanáct nemocných ve skupině léčené eplerenonem a 3 nemocní ve skupině s placebem museli být hospitalizováni pro závažnou hyperkalémii, v placebové skupině byla u jednoho nemocného jako příčina úmrtí označena hyperkalémie. Výskyt hyperkalémie vykazoval těsnou souvislost s renálními funkcemi, za hranici s nutnou větší obezřetností je považována kreatininová clearance < 50 ml/min. Po jednom roce léčby byl pozorován větší vzestup hladiny kreatininu při léčbě eplerenonem než při podávání placeba (+5,3 mmol/l v. +1,8 mmol/l, p < 0,001) i draslíku (+0,3 mmol/l v. + 0,2 mmol/l, p < 0,001). Jako nezávislé faktory předpovídající možnou hyperkalémii byly označeny: zvýšená hladina draslíku před léčbou, zvýšená hodnota kreatininu, diabetes mellitus a podávání antiarytmik. Úmrtí z možného důvodu hyperkalémie včetně náhlé smrti se však častěji vyskytlo v placebové větvi (4,9 % v. 6,1 %, p = 0,016).
Po roce léčby byl vzestup krevního tlaku méně vyjádřen při léčbě eplerenonem než při podávání placeba (+5/3 mm Hg v. + 8/4 mm Hg, p < 0,01).
Lékové interakce
Interakce eplerenonu s jinými léčivy souvisejí s ovlivněním hladiny draslíku a s metabolizací prostřednictvím jaterních mikrozomálních enzymů.
Eplerenon by neměl být podáván pacientům užívajícím kalium šetřící diuretika a doplňky stravy obsahující draslík, neboť hrozí riziko hyperkalémie. Hladina K+ v séru > 5,5 mmol/l může vyvolat velice závažné až fatální arytmie.
Mezi klinicky nejvýznamnější farmakokinetické interakce eplerenonu patří společné podání se silnými inhibitory cytochromu P-450 3A4, např. s azolovým antimykotikem ketokonazolem. Samotný eplerenon je substrátem tohoto enzymu a neinhibuje ani izoenzymy CYP1A2, CYP2C19, CYP2C9 a CYP2D6. V terapeutických dávkách není substrátem ani inhibitorem P-glykoproteinu.
Při podání 100 mg eplerenonu současně s 200 mg ketokonazolu dochází k téměř pětinásobnému zvýšení AUC eplerenonu. Eplerenon je kontraindikován v kombinaci se silnými inhibitory CYP3A4, pro současné podání s mírnými až středními inhibitory tohoto enzymu je doporučováno snížit dávku eplerenonu na 25 mg. Grapefruitová šťáva farmakokinetiku eplerenonu významně neovlivnila.
Současné podání silného induktoru CYP3A4, např. třezalky tečkované, snižuje AUC o třetinu. Současné podání není doporučeno ani s ostatními silnými induktory CYP3A4 [28].
Z léčiv, která neinterferují s eplerenonem na úrovni jaterních enzymů, ale potenciálně mohou ovlivnit jeho farmakokinetiku, je třeba zmínit léčiva se silnou vazbou k plazmatickým bílkovinám (glibenklamid, warfarin) a léčiva s vysokou ledvinnou clearance, např. digoxin. Ovlivnění farmakokinetiky však nebylo u žádné z těchto látek klinicky prokázáno jako signifikantní [28].
Dávkování
Jako cílová dávka je doporučováno 50 mg eplerenonu jednou denně. Léčba eplerenonem by měla být zahájena dávkou 25 mg jednou denně a postupně titrována během 4 týdnů do dávky cílové. Léčba eplerenonem by měla být zahájena v rozmezí 3–14 dnů po prodělaném akutním infarktu myokardu. Dávku je nutno titrovat s ohledem na plazmatickou hladinu draslíku, která by neměla přesáhnout 5,5 mmol/l.
Balení
Viz tab. 7.
Podporováno VVZ 0021 622 402.
Seznam použité literatury
- [1] Dieterich HA, Wendt C, Saborowski F. Cardio-protection by aldosterone receptor antagonism in heart failure: 1. The role of aldosterone in heart failure. Hum Physiol 2005; 31: 706–714.
- [2] Simpson SA, Tait JF, Wettstein A, et al. Isolierung eines neuen kristallisierten hormons aus nebennieren mit besonderer hoher wirksamkeit auf den mineralstoff wechsel. Experientia 1953; 9: 33–38.
- [3] Landau RL, Bergenstal DM, Lugibihl AB, Kascht ME. The metabolic effects of progesterone in man. J Clin Endocrinol Metab 1952; 15: 1194–1215.
- [4] Kagawa CM, et al. Action of new steroids blocking effects of aldosterone and desoxycortico-sterone on salt. Science 1957; 126: 1015–1016.
- [5] Carpenter C, Davi, JO, Ayers CR. Relation of renin, angiotensin II, and experimental renal hypertension to aldosterone secretion. J Clin Invest 1961; 40: 2026–2042.
- [6] Hutchinson JH, Porter GA. Spirolactone inhibition of aldosterone induced nuclear RNA synthesis in toad urinary bladder. Res Comm Chem Path Pharm 1970; 1 (3): 363–369.
- [7] Greenblatt DJ, Koch-Weser J. Adverse reactions to spironolactone: a report from the Boston Collaborative Drug Surveillance Program. J Am Med Assoc 1973; 225: 40–43.
- [8] Corval P, Michaud A, Menard J, et al. Antiandrogenic effect of spirolactones: mechanism of action. Endocrinology 1979; 104: 1194–1200.
- [9] Huffman DH, Kampmann JP, Hignite CE, Azarnoff DL. Gynecomastia induced in normal males by spironolactone. Clin Pharmacol Ther 1978; 24: 465–473.
- [10] deGasparo M, Joss U, Ramjoue HP, et al. Three new epoxy-spirolactone derivatives: characterization in vivo and in vitro. J Pharm Exp Ther 1987; 240: 650–656.
- [11] Garthawaite SM, McMahon EG. The evolution of aldosterone antagonists. Mol Cell Endocrinol 2004; 217: 27–31.
- [12] Brilla C, Pick R, Tan L, et al. Remodeling of the right and left ventricles in experimental hypertension. Circ Res 1990; 67: 1355–1364.
- [13] Rocha R, Rudolph AE, Frierdich GE, et al. Aldosterone induces a vascular inflammatory pheno type in the rat heart. Am J Physiol 2002; 283: H1802–H1810.
- [14] Frishman WH, Ster CT. Aldosterone and aldosterone antagonism in systemic hypertension. Curr Hypertens Rep 2004; 6: 195–200.
- [15] Ster CT, Koenig S, Lee DY, et al. Aldosterone and aldosterone antagonism in cardiovascular disease. Heart Disease 2003; 5: 102–118.
- [16] Garthawaite SM, McMahon EG. The evolution of aldosterone antagonists. Mol Cell Endocrinol 2004; 217: 27–31.
- [17] Medard J. The 45-year story of the developement of an antialdosterone more specific than spironolactone. Mol Cell Endocrinol 2004; 217: 45–52.
- [18] Rogerson FM, Yao Y, Smith BJ, Fuller PJ. Differences in the determinants of eplerenone, spironolactone and aldosterone binding to the mineralocorticoid receptor. Clin Exp Pharm Phys 2004; 31: 704–709.
- [19] Barr CS, Lang CC, Hanson J, et al. Effects of adding spironolactone to an angiotensin-converting enzyme inhibitor in chronic congestive heart failure secondary to coronary artery disease. Am J Cardiol 1995; 76: 1259–1265.
- [20] Santos J, Planas R, Pardo A, et al. Spironolactone alone or in combination with furosemide in the treatment of moderate ascites in nonazotemic cirrhosis. A randomized comparative study of efficacy and safety. J Hepatol 2003; 39: 187–192.
- [21] Weinberger MH, Roniker B, Krause SL, Weiss RJ. Eplerenone, a selective aldosterone blocker, in mild-to moderate hypertension. Am J Hypertens 2002; 15: 709–716.
- [22] Weber KT, Brilla CG. Pathological Hypertrophy and Cardiac Interstitium: Fibrosis and Renin-Angiotensin-Aldosterone System. Circ 1991; 83: 1849.
- [23] Pessina AC, Sacchetto A, Rossi GP. Left Ventricular Anatomy and Function in Primary Aldosteronism and Renovascular Hypertension. Hyper tension and the Heart, Eds., Zanchetti A, et al. New York, Plenum, 1997.
- [24] Duprez DA, Bauwens FR, De Buyzere ML. Influence of Arterial Blood Pressure and Aldosterone on Left Ventricular Hypertrophy in Moderate Essentials Hypertension. Am J Cardiol 1993; 71: 17A.
- [25] Delyani JA, Rocha R, Cook CS, et al. Eplerenone: a selective aldosterone receptor antagonist (SARA). Cardiovasc Drug Rev 2001; 19:185–200.
- [26] Fraccarollo D, Galuppo P, Hildemann S, et al. Additive improvement of left ventricular remo-deling and neurohormonal activation by aldosterone receptor blockade with eplerenone and ACE inhibition in rats with myocardial infarction. J Am Coll Cardiol 2003; 42: 1666–1673.
- [27] Cook CS, Berry LM, Bible RH, et al. Pharmacokineticcs and metabolism of [14C] eplerenone after oral administration to humans. Drug Metab Dispos 2003; 31: 1448–1455.
- [28] Keating GM, Plosker GL. Eplerenone: A review of its use in left ventricular systolic dysfunction and heart failure after acute myocardial infarction. Drugs 2004; 64: 2689–2707.
- [29] Pitt B, Remme W, Zannad F, et al. (for the EPHESUS). Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348: 1309–1321.
- [30] Pitt B, Remme W, Zannad F, et al. (for the EPHESUS). Eplerenone reduced mortality 30 days after randomization following acute myocardial infarction in patinets with left ventricular systolic dysfunction and heart failure. JACC 2005, 46: 425–431.
- [31] Vítovec J, Špinar J. Farmakoterapie kardiovaskulárních onemocnění. Praha, Grada 2004.
- [32] Williams GH, Burgess E, Kolloch RE, et al. Efficacy of eplerenone vs enalapril as monotherapy in systemic hypertension. Am J Cardiol 2004; 93: 990–996.
- [33] Pitt B, Reichek N, Willenbrock R, et al. Effects of eplerenone, enalapril, and eplerenone/enalapril in patients with essential hypertension and left ventricular hypertrophy: the 4E-left ventricular hypertrophy study. Circulation 2003; 108: 1831–1838.
- [34] Swedberg K, Cleland J, Dargie H, et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): the Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J 2005; 26: 1115–1140.
- [35] Nieminen MS, Boehm M, Cowie MR, et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure. Eur Heart J 2005; 26: 383–416.
- [36] Špinar J, Špinarová L, Hradec J, et al. Doporučení pro diagnostiku a léčbu chronického srdečního selhání. Cor Vasa 2006; (v tisku).
- [37] Špinar J, Janský P, Kettner J, Málek I. Doporučení pro diagnostiku a léčbu akutního srdečního selhání. Cor Vasa 2006; 48: K3–31.
- [38] Cífková R, Horký K, Widimský J sr, et al. Doporučení diagnostických a léčebných postupů u arteriální hypertenze – verze 2004. Doporučení České společnosti pro hypertenzi. Vnitřní lék 2004; 50: 709–722.
- [39] Chobanian AV. JNC 7 Express. NIH publication 2003; 03–5233: 1–52.
- [40] Zanchetti A, for the guidelines committee: 2003 European Society of Hypertension – European Society of Cardiology guidelines for the management of arterial hypertension. J Hypertenz 2003; 21: 1011–1023.
- [41] Croom KF, Plosker GL. Eplerenone: A pharmacoeconomic review of its use in patients with post-myocardial infarction heart failure. Pharmacoeconomics 2005; 23: 1057–1072.
- [42] Takeda, Y. Pleiotropic Actions of Aldosterone and the Effects of Eplerenone, a Selective Mineralocorticoid Receptor Antagonist. Hypertens Res 2004; 27: 781–789.