Fampridin PR
Prvním lékem indikovaným ke zlepšení rychlosti chůze u pacientů s roztroušenou sklerózou je fampridin PR, který blokuje napěťově ovládané
draslíkové kanály na excitabilních nervových buňkách a upravuje porušený přenos signálu. Chemicky se jedná o 4-aminopyridin, který je upraven do tablet s postupným uvolňováním a nazýván v USA fampridine SR (sustained release) a v Evropě fampridine PR (prolonged release). Fampridin PR je rozpustný v tucích a snadno prostupuje hematoencefalickou bariérou. Terapeutické hladiny dosahuje do 2–3 hodin po podání, v těle se neváže na bílkoviny, nekumuluje se a je vylučován ledvinami.
V klinických studiích fáze III byla splněna primární předem definovaná kritéria účinnosti, kdy bylo pozorováno trvající zlepšení rychlosti chůze po dobu podávání léku u 34,8–42,9 % pacientů léčených fampridinem oproti 8,3–9,3 % pacientů ze skupiny, která dostávala placebo (p < 0,0001). Rychlost chůze se při podávání fampridinu PR zlepšila v průměru asi o 25 %. Fampridin PR je kontraindikován u pacientů s anamnézou epileptických záchvatů a se sníženou renální funkcí. Doporučené dávkování je 10 mg p.o. každých 12 hodin. Pacient by měl být poučen o tom, že tabletu fampridinu PR nesmí kousat, drtit či půlit a vynechané dávky se nemají nahrazovat. Protože na lék odpovídá méně než 50 % pacientů, je doporučeno po dvou týdnech zhodnotit účinnost léčby spolu s pacientem při ambulantní návštěvě, a pokud pacient nepociťuje jednoznačný užitek z léčby, lék nadále nepředepisovat. Podávání tohoto léku nenahrazuje biologickou léčbu, protože nemá vliv na aktivitu onemocnění.
Farmakologická skupina
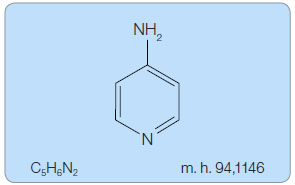 Fampridin PR je prvním lékem, který je indikován ke zlepšení rychlosti chůze u pacientů s roztroušenou sklerózou (RS). Chemicky se jedná o 4-aminopyridin (obr. 1), který je upraven do tablet s postupným uvolňováním a nazýván v USA fampridine SR (sustained release) a v Evropě fampridine PR (prolonged release).
Fampridin PR je prvním lékem, který je indikován ke zlepšení rychlosti chůze u pacientů s roztroušenou sklerózou (RS). Chemicky se jedná o 4-aminopyridin (obr. 1), který je upraven do tablet s postupným uvolňováním a nazýván v USA fampridine SR (sustained release) a v Evropě fampridine PR (prolonged release).
Sumární vzorec: C5H6N2
Molekulová hmotnost: 94,1146
4-aminopyridin blokuje napěťově ovládané draslíkové kanály na excitabilních nervových buňkách a upravuje porušený přenos signálu. Fampridin PR patří do farmakoterapeutické skupiny Jiná léčiva nervového systému a je jediným zástupcem v ATC skupině N07XX07. Tento lék nenahrazuje biologickou léčbu, protože nemá vliv na aktivitu onemocnění.
Mechanismus účinku
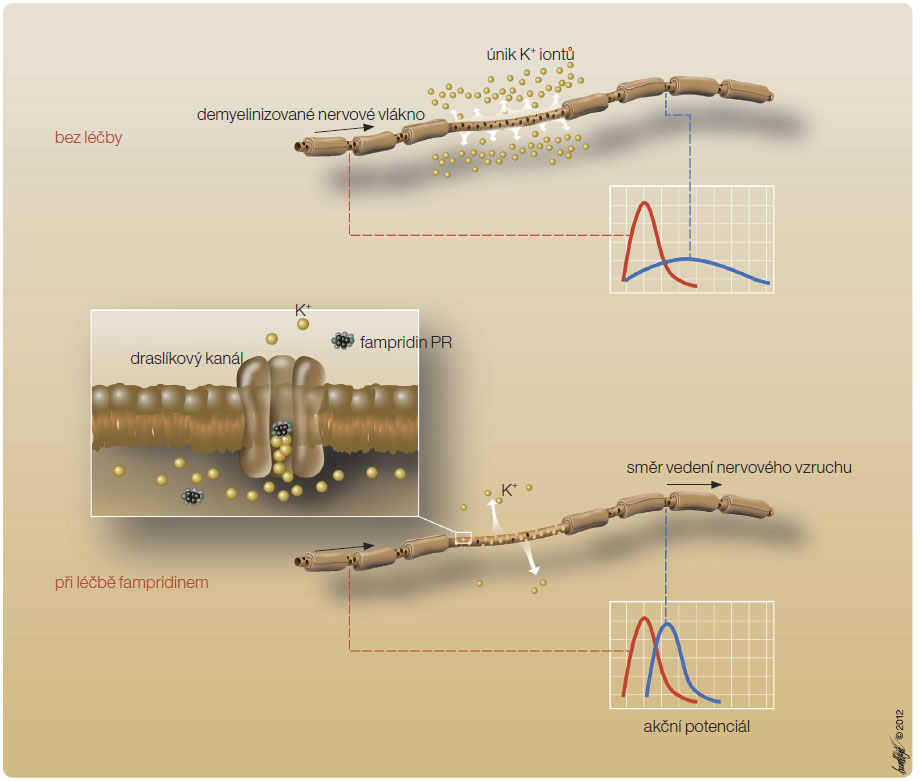 Ztráta části myelinu pokrývajícího axony v centrálním nervovém systému při RS je příčinou obnažení napěťově ovládaných draslíkových kanálů v internodálních částech axonu, což vede k úniku draslíkových iontů a ke snížení akčního potenciálu na membráně (obr. 2). Fampridin PR se váže na napěťově ovládané draslíkové kanály (Kv) a snižuje tok iontů přes membránu, čímž prodlužuje repolarizaci a upravuje tak tvorbu akčního potenciálu v axonech poškozených demyelinizací [1, 2]. U normálně myelinizovaných vláken nemá fampridin PR na vytváření akčního potenciálu žádný účinek.
Ztráta části myelinu pokrývajícího axony v centrálním nervovém systému při RS je příčinou obnažení napěťově ovládaných draslíkových kanálů v internodálních částech axonu, což vede k úniku draslíkových iontů a ke snížení akčního potenciálu na membráně (obr. 2). Fampridin PR se váže na napěťově ovládané draslíkové kanály (Kv) a snižuje tok iontů přes membránu, čímž prodlužuje repolarizaci a upravuje tak tvorbu akčního potenciálu v axonech poškozených demyelinizací [1, 2]. U normálně myelinizovaných vláken nemá fampridin PR na vytváření akčního potenciálu žádný účinek.
Farmakokinetické vlastnosti
Absorpce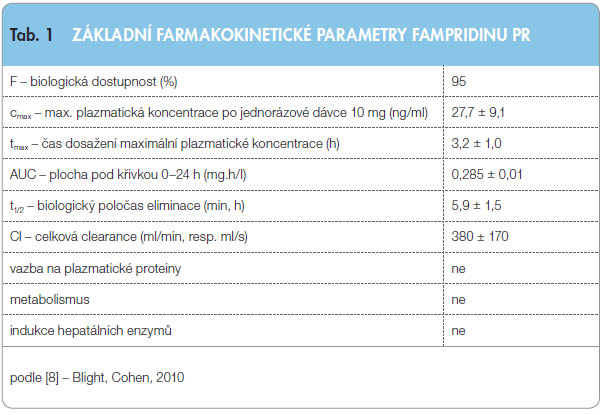
Perorálně podaný fampridin PR je kompletně absorbován ze zažívacího traktu a dosahuje maximální plazmatické koncentrace (cmax) během 2,5–3,5 hodiny po podání. Relativní biologická dostupnost fampridinu PR (ve srovnání s vodným perorálním roztokem) je 95 % (tab. 1) [3].
4-aminopyridin má úzký terapeutický index a jeho nežádoucí účinky souvisí s jeho koncentrací v krvi. 4-aminopyridin jako původní molekula byl předepisován magistraliter v USA a v některých zemích Evropy (v České republice nikoli) pro pacienty s RS, poraněním míchy nebo Lambertovým-Eatonovým syndromem, avšak nedošlo k jeho širšímu užívání pro nevýhodnou farmakokinetiku této lékové formy a s tím spojenými riziky [4–7]. Po perorálním podání původního 4-aminopyridinu je absorpce ovlivněna příjmem potravy, dochází k okamžitému přestupu látky do oběhu a ke vzestupu koncentrace v krvi mnohonásobně nad potřebnou terapeutickou hladinu (20 ng/ml) a poté k ![Graf 1 Koncentrace 4-aminopyridinu v plazmě po podání fampridinu PR nalačno, po jídle a porovnání s koncentrací po podání 4-aminopyridinu v magistraliter přípravě; podle [8] – Blight, Cohen, 2010.](https://www.remedia.cz/photo-a-28977---.jpg) jejímu strmému poklesu (graf 1) [8]. Hladiny 4-aminopyridinu v krvi vyšší než 40 ng/ml jsou spojeny se snížením prahu epileptogeneze a rizikem epileptických záchvatů. Z tohoto důvodu byl vyvinut 4-aminopyridin ve formě tablety s prodlouženým uvolňováním označovaný jako fampridin PR, který se vyznačuje lineární (na dávce závislou) farmakokinetikou s terminálním poločasem vylučování asi 6 hodin. Dávkování fampridinu PR 10 mg každých 12 hodin umožňuje udržet koncentraci v plazmě v bezpečné terapeutické oblasti.
jejímu strmému poklesu (graf 1) [8]. Hladiny 4-aminopyridinu v krvi vyšší než 40 ng/ml jsou spojeny se snížením prahu epileptogeneze a rizikem epileptických záchvatů. Z tohoto důvodu byl vyvinut 4-aminopyridin ve formě tablety s prodlouženým uvolňováním označovaný jako fampridin PR, který se vyznačuje lineární (na dávce závislou) farmakokinetikou s terminálním poločasem vylučování asi 6 hodin. Dávkování fampridinu PR 10 mg každých 12 hodin umožňuje udržet koncentraci v plazmě v bezpečné terapeutické oblasti.
Distribuce
Fampridin PR je rozpustný v tucích a snadno prochází hematoencefalickou bariérou. Téměř se neváže na plazmatické proteiny (vázaná frakce se v lidské plazmě pohybuje mezi 3–7 %) a jeho distribuční objem je asi 2,6 l/kg.
Metabolismus
Fampridin PR je metabolizován oxidací na 3-hydroxy-4-aminopyridin za účasti cytochromu P450 2E1 (CYP2E1) a dále konjugován na 3-hydroxy-4-aminopyridin-sulfát. Metabolity fampridinu PR nejsou aktivní vůči draslíkovým kanálům. Působení fampridinu PR na kultivované lidské hepatocyty nemělo podstatný vliv na indukci enzymové aktivity izoforem CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2E1 nebo CYP3A4/5. Fampridin PR není substrátem glykoproteinu P.
Eliminace
Hlavní cestou vylučování fampridinu PR je renální exkrece, přičemž asi 90 % dávky izolované v moči během 24 hodin po podání se nachází ve formě původní léčivé látky. Na vylučování se podílí jak glomerulární filtrace, tak aktivní exkrece prostřednictvím renálního transportéru OCT2. Užívání léků, které jsou substrátem OCT2 (např. karvedilol, propranolol, metformin), by mohlo vést ke zpomalení exkrece fampridinu PR. Vylučování stolicí tvoří méně než 1 % podané dávky. U pacientů s normální funkcí ledvin nebyla prokázána klinicky významná kumulace fampridinu PR. U pacientů s poruchou funkce ledvin dochází ke kumulaci úměrně k míře poruchy funkce ledvin.
Klinické zkušenosti
Určení optimální dávky
První studie se 4-aminopyridinem s prodlouženým uvolňováním byla provedena na malém vzorku pacientů pod vedením Dr. S. Schwida v roce 1994 [9]. Klinická účinnost a bezpečnost fampridinu PR podávaného v dávkách 10–40 mg dvakrát denně byla hodnocena v randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích fáze II. Studie MS-F201, která zahrnovala 36 pacientů s RS sledovaných po dobu 7 týdnů, ukázala, že fampridin PR byl dobře tolerován v dávce 10–25 mg p.o. 2krát denně [10]. Studie MS-F202 (n = 206, délka trvání studie 12 týdnů) ukázala, že se testované dávky fampridinu PR 10 mg, 15 mg a 20 mg p.o. 2krát denně ve svém efektu na zlepšení rychlosti chůze významně neliší [11].
Studie vedly k závěrům, že odpověď na léčbu v podobě zlepšení rychlosti chůze je pozorována u asi 36 % pacientů a že zvyšování dávky nad 10 mg nepřináší pacientům další zlepšení chůze. Ke klinickému užívání a dalším studiím byla s ohledem na optimální bezpečnostní profil a účinnost určena dávka fampridinu PR 10 mg podávaná každých 12 hodin.
Studie fáze III
Účinnost a bezpečnost používání fampridinu PR u pacientů s RS ke zlepšení chůze byla hodnocena ve dvou studiích fáze III [12, 13]. Do těchto studií byli zahrnuti pacienti s remitentní, sekundárně progresivní nebo primárně progresivní RS, s průměrným věkem 51 let, průměrným EDSS 5,7 a trváním nemoci průměrně 13 let.
Ve studiích fáze III byl základem měření účinnosti fampridinu PR test rychlosti chůze – tzv. Timed 25-foot walk test (T25FW). Pacienti byli považováni ve studiích za respondéry, pokud byla jejich rychlost chůze při nejméně třech ze 4 návštěv vyšší než maximální rychlost chůze dosažená před podávanou léčbou (fampridinem PR, respektive placebem). Ve studii MS-F203 [12] splnilo kritéria zlepšení rychlosti chůze 34,8 % pacientů léčených fampridinem PR oproti 8,3 % pacientů ze skupiny dostávající placebo; ve studii MS-F204 [13] se zlepšila rychlost chůze u 42,9 % léčených fampridinem PR versus 9,3 % pacientů ze skupiny placeba (p < 0,0001). Rychlost chůze se zlepšila v průměru o 25 % a efekt trval po celou dobu podávání léku. K ověření léčebného přínosu, jaký pociťovali pacienti ve studiích III. fáze, bylo použito hodnocení pomocí škály MSWS-12 (Multiple Sclerosis Walking Scale), která obsahuje 12 otázek na kvalitu a obtížnost hybnosti z pohledu pacienta [14]. Pacienti, kteří po podání fampridinu PR prokázali zlepšení rychlosti chůze, odpovídali shodně i při hodnocení pomocí škály MSWS-12.
Indikace
Evropská léková agentura (EMA) vydala v srpnu 2011 rozhodnutí o indikaci fampridinu PR ke zlepšení chůze u dospělých pacientů s RS, kteří mají potíže s chůzí a EDSS skóre mezi 4,0–7,0 [15, 16]. Přípravek je v České republice registrován, ale nemá zatím stanovenou cenu a úhradu. Indikační kritéria schválená Kanadskou lékovou agenturou specifikují rozmezí EDSS na 3,5–7,0. Identický lék (pod jiným obchodním názvem) byl schválen k používání ve Spojených státech amerických a jeho indikace není omezena stupněm EDSS.
V USA byl schválen generický název fampridine SR (sustained release), v Kanadě fampridine ER (extended release) a v Evropě fampridine PR (prolonged release). Jedná se vždy o stejnou látku.
Predikce odpovědi na lék
Velká pozornost byla ve studiích věnována možnostem předem identifikovat pacienty, kteří budou dobře odpovídat na léčbu fampridinem PR. Analýzy podskupin pacientů ve studiích III. fáze ukázaly, že údaje o věku, pohlaví, typu RS, délce onemocnění ani míře neurologického postižení neumožní předvídat biologickou odpověď na léčbu fampridinem PR.
Kontraindikace
Fampridin PR je kontraindikován u pacientů s anamnézou záchvatovitého onemocnění, zejména epilepsie. Léčba fampridinem PR musí být ukončena, pokud pacient v průběhu terapie vyvine epileptický záchvat. Vzhledem k tomu, že hlavní cestou eliminace je renální exkrece a její zpomalení by mohlo vést ke zvýšení koncentrací léku v plazmě, je fampridin PR kontraindikován u pacientů se sníženou funkcí ledvin.
Nežádoucí účinky
Nežádoucí účinky pozorované u pacientů léčených fampridinem PR zahrnují nespavost, nervozitu, poruchu rovnováhy, závratě, parestezie, třes, bolest hlavy a slabost. Výskyt epileptických záchvatů u pacientů léčených fampridinem PR v dávce 10 mg 2krát denně nepřesáhl výskyt záchvatů u pacientů s RS neléčených fampridinem PR, avšak vzhledem k riziku epileptogeneze je jeho použití u pacientů s anamnézou epileptických záchvatů kontraindikováno. Ve studiích III. fáze byl u pacientů léčených fampridinem PR pozorován zvýšený výskyt močových infekcí (respektive močové urgence bez průkazu bakteriální infekce).
Lékové interakce
Většina pacientů v klinických studiích byla zároveň léčena interferonem beta nebo glatiramer acetátem, což nevedlo k lékovým interakcím a nemělo žádný vliv na účinnost fampridinu PR.
Praktické zkušenosti s použitím léku
Terapii fampridinem PR zahajujeme ve standardním dávkování 10 mg p.o. každých 12 hodin po dobu dvou týdnů, po kterou bude pacient pozorovat účinek léku. Tableta fampridinu PR se nesmí půlit, kousat či drtit. Po dvou týdnech je doporučeno zhodnotit účinnost léku spolu s pacientem při ambulantní návštěvě, a pokud pacient nepociťuje jednoznačný užitek z léčby, doporučuje se lék nadále nepředepisovat. Ke kvantifikaci zlepšení rychlosti chůze je možno před podáním léku a při kontrolní návštěvě použít měření rychlosti chůze na vzdálenost 8 metrů nebo jiný test rychlosti chůze.
Zařazení do současné palety léčiv
Fampridin PR je jako první lék umožňující zlepšení rychlosti chůze u pacientů s ireverzibilním neurologickým posti-
žením následkem demyelinizace axonů významným přínosem pro pacienty s RS. V současné době neexistuje žádná reparativní terapie u RS, která by umožnila návrat poškozených neurologických struktur. Fampridin PR nemá žádný vliv na aktivitu onemocnění a nenahrazuje biologickou terapii. Může být užíván souběžně s interferonem beta či jinými biologickými léky, či v pozdějších fázích onemocnění i bez nich. Lék je indikován u pacientů se zřejmým postižením chůze.
Seznam použité literatury
- [1] Lechat P, Thesleff S, Bowman WC. Aminopyridines and similarly acting drugs, effects on nerves, muscles and synapses. Oxford: Pergamon Press, 1982, 346 s.
- [2] Judge SI, Bever CT Jr. Potassium channel blockers in multiple sclerosis: neuronal Kv channels and effects of symptomatic treatment. Pharmacol Ther 2006; 111: 224–259.
- [3] SPC Fampyra, dostupné na http://www.ema.europa.eu, citováno dne 30. 7. 2012.
- [4] Stefoski D, Davis FA, Fitzsimmons WE, et al. 4-aminopyridine in multiple sclerosis: prolonged administration. Neurology 1991; 41: 1344–1348.
- [5] Van Diemen HA, Polman CH, van Dongen TM, et al. The effect of 4-aminopyridine on clinical signs in multiple sclerosis: a randomized, placebo-controlled, double-blind, cross-over study. Ann Neurol 1992; 32: 123–130.
- [6] Bever CT Jr, Young D, Anderson PA, et al. The effects of 4-aminopyridine in multiple sclerosis patients: results of a randomized, placebo-controlled, double-blind, concentration-controlled, crossover trial. Neurology 1994; 44: 1054–1059.
- [7] Solari A, Uitdehaag B, Giuliani G, et al. Aminopyridines for symptomatic treatment in multiple sclerosis. Cochrane Database Syst Rev 2002; 2: CD001330.
- [8] Blight AR, Cohen R. Patent application title: Methods of using sustained release aminopyridine compositions. Patent application number 20100061935; http://www.faqs.org/patents/app/20100061935#ixzz24HljtyGU Accessed 20 July 2012.
- [9] Schwid SR, Petrie MD, McDermott MP, et al. Quantitative assessment of sustained-release 4-aminopyridine for symptomatic treatment of multiple sclerosis. Neurology 1997; 48: 817–821.
- [10] Goodman AD, Cohen JA, Cross A, et al. Fampridine SR in multiple sclerosis: a randomized, double-blind, placebo-controlled, dose-ranging study. Multiple Sclerosis 2007; 13: 357–368.
- [11] Goodman AD, Brown TR, Cohen JA, et al. Dose-comparison trial of sustained-release fampridine in multiple sclerosis. Neurology 2008; 71: 1134–1141.
- [12] Goodman AD, Brown TR, Krupp LB, et al. Fampridine MS-F 203 Investigators. Sustained-release oral fampridine in multiple sclerosis: a randomized, double-blind, controlled trial. Lancet 2009; 373: 732–738.
- [13] Goodman AD, Brown TR, Edwards KR, et al. A phase 3 trial of extended release oral dalfampridine in multiple sclerosis. Ann Neurol 2010; 68: 494–502.
- [14] Hobart JC, Riazi A, Lamping DL, et al. Measuring the impact of MS on walking ability: the 12-Item MS Walking Scale (MSWS-12). Neurology 2003; 60: 31–36.
- [15] Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33: 1444–1452.
- [16] Cohen RA, Kessler HR, Fischer M. The Extended Disability Status Scale (EDSS) as a predictor of impairments of functional activities of daily living in multiple sclerosis. J Neurol Sci 1993; 115: 132–135.