Fixní kombinace beklometason/formoterol
Fixní kombinace beklometason/formoterol k inhalačnímu podávání využívá potenciace účinku kortikosteroidu a dlouhodobě působícího b2-sympatomimetika. Přípravek obsahující tuto kombinaci léčiv je aplikován pomocí bezfreonového aerosolového dávkovače, jehož inovativní charakter spočívá v unikátní technologii Modulite. Velmi jemné částice o velikosti přibližně 1,5 mm (tzv. extra-fine) zajišťují rovnoměrné rozptýlení účinných látek v centrálních i periferních částech průduškového stromu. Díky vysoké plicní depozici lze redukovat dávku beklometasonu v přípravku, což omezuje nežádoucí systémovou absorpci. Indikací fixní kombinace beklometason/formoterol je dlouhodobá léčba astmatu u dospělých osob. Klinická účinnost a bezpečnost této kombinace je prokázána řadou studií; výskyt nežádoucích účinků je obdobný jako v léčbě ostatními inhalačními fixními kombinacemi.
Farmakologická skupina
Fixní kombinace beklometason (glukokortikoid)/formoterol (dlouhodobě působící β2-sympatomimetikum) představuje léčivo používané jako bronchodilatans, antiastmatikum. ATC kód je R03AK07.
Chemické a fyzikální vlastnosti
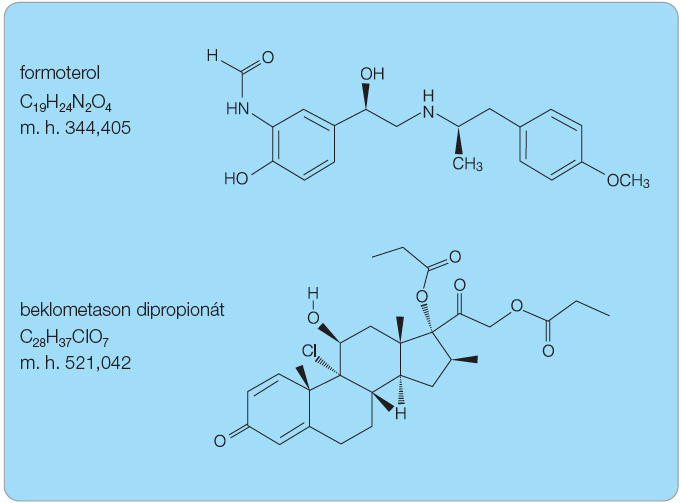
Beklometason dipropionát (BDP) je chemicky (8S,9R,10S,11S,13S,14S,16S,17R)-9-chlor-11-hydroxy-10,13,16-trimethyl-3-oxo-17-[2-(propionyloxy)acetyl]-6,7,8,9,10,11,12,13,14,15,16,17-dodekahydro-3H-cyklopenta[a]fenantren-17-yl propionát (obr. 1). BDP představuje syntetický chlorovaný kortikosteroid. Je to bílý až krémově bílý prášek bez zápachu, který je omezeně rozpustný ve vodě a velmi dobře rozpustný v ethanolu.
Formoterol je chemicky rac-(R,R)-N-[2-hydroxy-5-[1-hydroxy-2-[1-(4-methoxy-fenyl) propan-2-ylamino]ethyl]fenyl]form amid (obr. 1); v léčivém přípravku je obsažen ve formě soli (fumarát). Jedná se o opticky aktivní látku bez zápachu. Formoterol je dobře rozpustný ve vodě a v ethanolu, prakticky nerozpustný v acetonu, ethylacetátu a diethyletheru.
 Sumární vzorec:
Sumární vzorec:
beklometason: C22H29ClO5
beklometason dipropionát: C28H37ClO7
formoterol: C19H24N2O4
formoterol fumarát: C42H52N4O12
Molární hmotnost:
beklometason: 408,92 g/mol
beklometason dipropionát: 521,042 g/mol
formoterol: 344,405 g/mol
formoterol fumarát: 804,88 g/mol
Jako hnací plyn (propelent) je v kombinovaném léčivém přípravku použit norfluran čili 1,1,1,2-tetrafluorethan (HFA-134a). Jedná se o chemicky inertní nehořlavý plyn těžší než vzduch.
Mechanismus účinku, farmakodynamika
Beklometason dipropionát představuje syntetický kortikosteroid (KS) s relativně nízkým glukokortikoidním působením. Podobně jako ostatní inhalační KS se po průchodu membránou cílových buněk váže na cytoplazmatický receptor II a spolu s ním pak vstupuje do buněčného jádra, kde nasedá na molekulu DNA a tím aktivuje nebo potlačuje expresi určitých genů, což má významný protizánětlivý efekt. Glukokortikoidní aktivitu vykazuje především biologicky aktivní metabolit beklometason-17-monopropionát (B17MP) [1].
Vdechování formoterolu, podobně jako dalších β2-sympatomimetik, vede k dilataci dýchacích cest díky relaxaci hladké svaloviny v jejich stěně. Formoterol se váže na cytoplazmatické β2-adrenergní receptory, což vede v buňkách hladké svaloviny k aktivaci adenylát cyklázy a následné produkci cAMP (cyklický adenosin-monofosfát) [2]. Formoterol je mírně lipofilní. V důsledku toho se poměrně rychle zabudovává do lipidové vrstvy plazmalemy buněk hladké svaloviny dýchacích cest, kde vytváří depotum, ze kterého postupně difunduje a obsazuje β2-adrenergní receptory. Část molekul formoterolu je navíc schopna vázat se na vodnou fázi receptoru, což vysvětluje rychlost nástupu jeho účinku [3].
Současné podávání inhalačních KS a dlouhodobě působících β2-sympatomimetik vede k potenciaci jejich účinku. Přesný mechanismus tohoto synergického působení není dosud spolehlivě objasněn. Jak však ukazují některé studie, mohou KS zvyšovat expresi β2-adrenergních receptorů indukcí transkripce příslušných genů a β2-sympatomimetika mohou potencovat aktivitu glukokortikoidu zvýšením jaderné lokalizace glukokortikoidního plazmatického receptoru a přímým ovlivněním protizánětlivých mediátorů [4–8].
Přípravek s obsahem léčivých látek beklometason/formoterol plně využívá všech výhod technologie Modulite, která umožňuje vhodnou kombinací použitých těkavých a netěkavých rozpouštědel a utvářením výstupní trysky dávkovače kontrolovat velikost částic ve vytvářeném aerosolovém oblaku. Přípravek je tedy aplikován jako aerosol s velmi jemnými částicemi (tzv. extra-fine) ve formě roztoku. Termín extra-fine se používá pro označení rozměrů částic aerosolové mlžiny vytvořené aerosolovým dávkovačem (pressurized metered-dose inhaler – pMDI), které mají velikost okolo 1,5 µm a menší. Jako hnací plyn je použit 1,1,1,2-tetrafluorethan (HFA-134a), látka ze skupiny hydrofluoralkanů (HFA), která podle současných znalostí neinteraguje s ozonem. Rozpouštědlem obou účinných látek je bezvodý ethanol. Podrobnější charakteristiky uvedené technologie a lékové formy byly v českém písemnictví již publikovány [9, 10].
Farmakokinetické vlastnosti
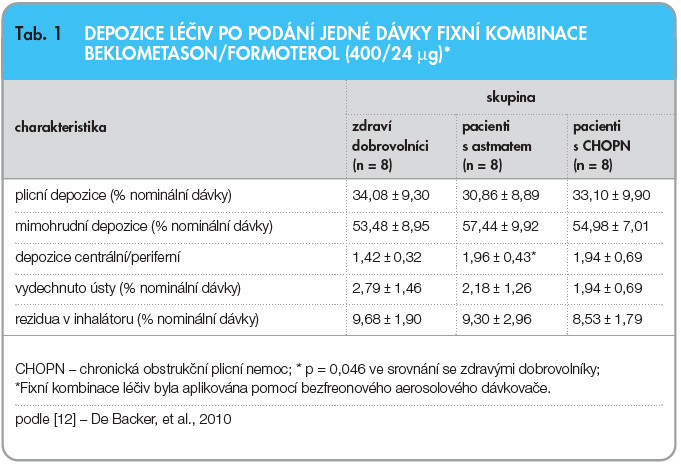 Plicní depozice, která je rozhodujícím kritériem ukazujícím dostupnost inhalovaných léčivých látek fixní kombinace beklometason/formoterol, dosahuje v průměru 34 % nominální dávky* u zdravých dobrovolníků, 31 % u pacientů s astmatem a 33 % u pacientů s chronickou obstrukční plicní nemocí (CHOPN). Průměrná mimohrudní depozice je u těchto tří skupin rovněž velmi podobná a dosahuje 53 %, 59 % a 55 % nominální dávky (tab. 1). Inhalovaná dávka navíc rovnoměrně zasahuje centrálně a periferně uložené dýchací cesty (graf 1) [11, 12].
Plicní depozice, která je rozhodujícím kritériem ukazujícím dostupnost inhalovaných léčivých látek fixní kombinace beklometason/formoterol, dosahuje v průměru 34 % nominální dávky* u zdravých dobrovolníků, 31 % u pacientů s astmatem a 33 % u pacientů s chronickou obstrukční plicní nemocí (CHOPN). Průměrná mimohrudní depozice je u těchto tří skupin rovněž velmi podobná a dosahuje 53 %, 59 % a 55 % nominální dávky (tab. 1). Inhalovaná dávka navíc rovnoměrně zasahuje centrálně a periferně uložené dýchací cesty (graf 1) [11, 12].
![Graf 1 Centrální a periferní plicní depozice fixní kombinace beklometason/formoterol u pacientů s astmatem; podle [11] – Moriotti, et al., 2007.](https://www.remedia.cz/photo-a-28526---.jpg) Inhalačně podaný BDP se rychle absorbuje plícemi a v plazmě již není detekovatelný 1,5 hodiny po aplikaci dávky (400 µg). Před vstřebáním probíhá intenzivní konverze BDP na aktivní metabolit B17MP díky esteráze, enzymu, který se nachází ve většině tkání. Systémová dostupnost B17MP pochází z plic (36 %) a z absorpce z gastrointestinálního traktu (GIT) ze spolykané dávky. Se zvyšující se dávkou dochází k přibližně lineárnímu vzestupu systémové expozice [12–14]. BDP je esterázami v séru, plicích a játrech velmi rychle odstraňován ze systémové cirkulace a B17MP je transformován na biologicky neaktivní metabolity [15].
Inhalačně podaný BDP se rychle absorbuje plícemi a v plazmě již není detekovatelný 1,5 hodiny po aplikaci dávky (400 µg). Před vstřebáním probíhá intenzivní konverze BDP na aktivní metabolit B17MP díky esteráze, enzymu, který se nachází ve většině tkání. Systémová dostupnost B17MP pochází z plic (36 %) a z absorpce z gastrointestinálního traktu (GIT) ze spolykané dávky. Se zvyšující se dávkou dochází k přibližně lineárnímu vzestupu systémové expozice [12–14]. BDP je esterázami v séru, plicích a játrech velmi rychle odstraňován ze systémové cirkulace a B17MP je transformován na biologicky neaktivní metabolity [15].
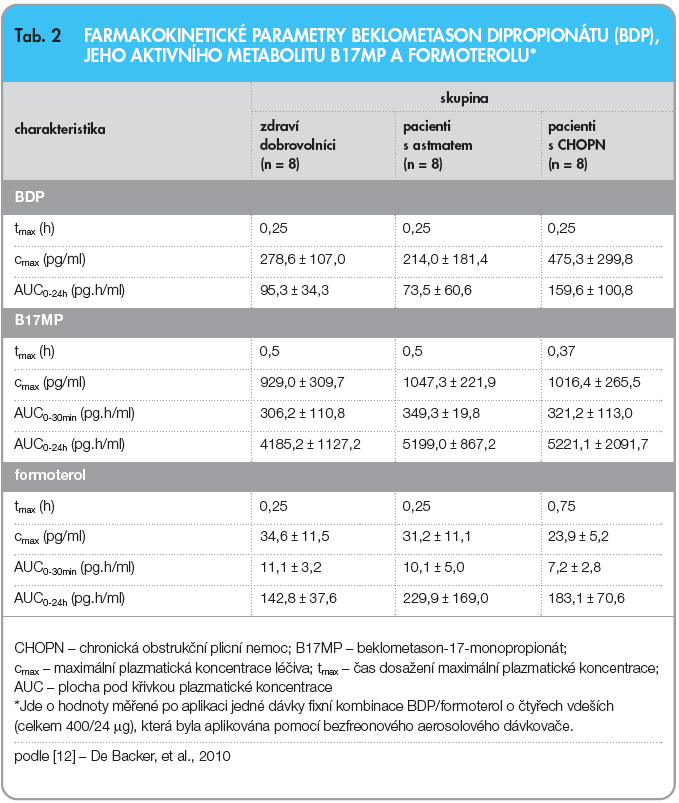 Maximální plazmatické koncentrace B17MP je u zdravých jedinců a u pacientů s astmatem dosahováno po aplikaci jedné dávky 400 µg BDP za 30 minut. U pacientů s CHOPN je maximální plazmatické koncentrace B17MP dosaženo v průměru za 37 minut. Maximální plazmatická koncentrace B17MP dosahuje 929,0 Ī 309,7 pg/ml u zdravých dobrovolníků, 1047,3 Ī 221,9 pg/ml u pacientů s astmatem a 1016,4 Ī 265,6 pg/ml u pacientů s CHOPN [12]. Další farmakokinetické parametry jsou uvedeny v tab. 2.
Maximální plazmatické koncentrace B17MP je u zdravých jedinců a u pacientů s astmatem dosahováno po aplikaci jedné dávky 400 µg BDP za 30 minut. U pacientů s CHOPN je maximální plazmatické koncentrace B17MP dosaženo v průměru za 37 minut. Maximální plazmatická koncentrace B17MP dosahuje 929,0 Ī 309,7 pg/ml u zdravých dobrovolníků, 1047,3 Ī 221,9 pg/ml u pacientů s astmatem a 1016,4 Ī 265,6 pg/ml u pacientů s CHOPN [12]. Další farmakokinetické parametry jsou uvedeny v tab. 2.
V další otevřené, překřížené studii kontrolované placebem byla 12 zdravým dobrovolníkům aplikována jedna dávka fixní kombinace BDP/formoterol (400/24 µg), jedna ekvipotentní dávka 1000 µg BDP + 24 µg formoterolu v oddělených inhalátorech a placebo. Výsledky této studie ukázaly, že plicní depozice je u fixní kombinace BDP/formoterol o 86 % vyšší než při aplikaci oddělené kombinace BDP a formoterolu v ekvipotentní dávce. Naopak systémová expozice je při použití fixní kombinace BDP/formoterol o 35 % nižší než u oddělené kombinace [16].
Formoterol je po inhalaci vstřebáván z dýchacích cest a z GIT. Při aplikaci formoterolu prostřednictvím aerosolového dávkovače může být spolknuto 60–90 % uvolněné dávky [13]. Maximální plazmatické koncentrace je po inhalačním podání dosaženo za 15–45 minut [12]. Formoterol je metabolizován v játrech přímou vazbou na kyselinu glukuronovou a následně demethylací cytochromem P-450 [17]. Plazmatický poločas formoterolu je kolem 10 hodin. Celkem 67 % podaného formoterolu je vylučováno močí zejména v podobě jeho metabolitů. Zbytek je vylučován stolicí. V průběhu 12 hodin po aplikaci je vyloučeno zhruba 25 % podané dávky formoterolu [2].
Klinické zkušenosti
Již v dřívějších studiích bylo u pacientů s mírným astmatem prokázáno, že 100 µg BDP v jedné inhalované dávce aerosolu s částicemi o velikosti 1,5 mm (extra-fine) je klinicky ekvivalentní jedné inhalované dávce 250 µg BDP s částicemi většími než 1,5 mm (non-extrafine) [18, 19].
Klinická účinnost fixní kombinace DBP/ formoterol ve výše charakterizované lékové formě (HFA-134a pMDI) byla ověřena několika klinickými studiemi.
Srovnávací studie s volnou kombinací a samotným kortikosteroidem
První z těchto klinických sledování je multicentrická, randomizovaná, dvojitě zaslepená a double-dummy studie v délce trvání 24 týdnů, do níž bylo zařazeno celkem 645 pacientů se středně těžkým až těžkým perzistujícím astmatem. Pacienti byli rozděleni do tří skupin: v první z nich jich bylo 212 léčeno fixní kombinací obsahující v jedné nominální dávce BDP/formoterol (100/6 µg) a HFA-134a jako propelent. Pacienti inhalovali dvakrát denně po dvou vdeších, takže celková denní dávka představovala 400 µg BDP a 24 µg formoterolu. Ve druhé skupině bylo léčeno 220 pacientů volnou kombinací těchto léčiv. BDP ve freonovém aerosolovém dávkovači (CFC) byl aplikován v celkové denní dávce 1000 µg, formoterol v inhalátoru pro práškovou formu léku (DPI – dry powder inhaler; Aerolizer) v celkové denní dávce 24 µg. Třetí skupina pacientů (n = 213) byla léčena samotným BDP CFC v celkové denní dávce 1000 µg (dva vdechy denně). Jako primární parametr hodnocení účinnosti léčby bylo zvoleno sledování ranní hodnoty PEF (vrchol výdechové rychlosti, peak expiratory flow). Dále byly posuzovány hodnoty FEV1 (objem vzduchu vydechnutý za první sekundu usilovného výdechu, forced expiratory volume in 1 second), denní a noční symptomy astmatu, procento dnů bez klinických příznaků a procento dnů, ve kterých bylo onemocnění pod kontrolou. Podávání fixní kombinace BDP/formoterol HFA-134a pMDI a kombinace odděleně podaného BDP a formoterolu vedlo ke srovnatelnému zlepšení ranního PEF a FEV1 a ke statisticky významnému zlepšení ve srovnání s podáním samotného BDP v ekvipotentní dávce. Použití fixní kombinace BDP/formoterol a volné kombinace BDP a formoterolu vedlo v průběhu 24 týdnů ke snížení procenta dnů s denními a nočními příznaky astmatu. U pacientů léčených fixní kombinací bylo zjištěno statisticky významně vyšší procento dnů s kontrolou nad onemocněním než u pacientů léčených volnou kombinací a samotným BDP [20].
Srovnávací studie s fixními kombinacemi
V první z těchto studií byla jako srovnávací použita fixní kombinace budesonid/formoterol DPI, a to z důvodu přítomnosti stejné molekuly β2-sympatomimetika. Studie byla koncipována jako kontrolovaná, multicentrická, randomizovaná, dvojitě zaslepená, double-dummy. Do studie bylo zařazeno celkem 219 dospělých pacientů se středně těžkým až těžkým perzistujícím astmatem, kteří byli po dvoutýdenní tzv. run-in periodě randomizováni do dvou paralelních skupin. Jedna skupina (n = 109) byla léčena fixní kombinací budesonid/formoterol DPI (Turbuhaler), druhá skupina (n = 110) fixní kombinací BDP/formoterol HFA-134a pMDI. Použité léčivé přípravky byly v obou skupinách aplikovány ve dvou denních dávkách, které celkem obsahovaly 800/24 µg kombinace budesonid/formoterol, nebo 400/24 µg kombinace BDP/ formoterol. Kontroly proběhly 2 týdny před randomizací a následně ve 2., 4., 8. a 12. týdnu po začátku léčby. Byly hodnoceny následující parametry: ranní PEF (měřeno pacientem), ranní FEV1 (měřeno pacientem) a FEV1 a FVC (usilovná vitální kapacita, forced vital capacity; měřeno při kontrole lékařem). Jako sekundární klinické parametry byly hodnoceny skóre symptomů (denní a noční příznaky astmatu), výskyt exacerbací a nutnost použití záchranné terapie. Závěry této studie potvrdily srovnatelné výsledky zlepšení plicních funkcí u obou fixních kombinací, a to přesto, že dávka KS v případě fixní kombinace BDP/ formoterol byla poloviční oproti dávce KS ve fixní kombinaci budesonid/formoterol. Rovněž v kontrole symptomů astmatu a počtu exacerbací prokázaly obě srovnávané fixní kombinace podobné hodnoty [21].
V další studii byla jako srovnávací použita fixní kombinace flutikason/salmeterol. Studie byla rovněž kontrolovaná, multicentrická, randomizovaná, dvojitě zaslepená, double-dummy. Do studie bylo zařazeno celkem 228 dospělých pacientů se středně těžkým až těžkým perzistujícím astmatem, kteří byli po dvoutýdenní run-in periodě randomizováni do dvou paralelních skupin. Jedna skupina (n = 113) byla léčena fixní kombinací flutikason/salmeterol DPI (Discus), druhá skupina (n = 115) fixní kombinací BDP/formoterol HFA-134a pMDI. V obou skupinách byly použité léčivé přípravky aplikovány ve dvou denních dávkách, které celkem obsahovaly 500/100 µg kombinace flutikason/salmeterol, nebo 400/24 µg kombinace BDP/formoterol. Při kontrolách, které proběhly 2 týdny před randomizací a následně ve 2., 4., 8. a 12. týdnu po začátku léčby, byly hodnoceny následující parametry: ranní PEF (měřeno pacientem), ranní FEV1 (měřeno pacientem) a FEV1 a FVC (měřeno při kontrole lékařem). Sekundární klinické parametry představovaly i zde skóre ![Změny FVC u pacientů s astmatem léčených fixní kombinací beklometason dipropionát/formoterol (BDP/F) ve srovnání s fixní kombinací flutikason/salmeterol (FL/SALM); podle [22] – Papi, et al., 2007.](https://www.remedia.cz/photo-a-28528---.jpg) symptomů (denní a noční příznaky astmatu), výskyt exacerbací a nutnost použití záchranné terapie. Obě fixní kombinace se ukázaly jako srovnatelně účinné ve zlepšení plicních funkcí měřených pomocí parametrů PEF a FEV1. Rovněž v kontrole symptomů astmatu a počtu exacerbací byly obě fixní kombinace srovnatelné. Bronchodilatace navozená kombinací BDP/formoterol však byla v průběhu první hodiny po aplikaci intenzivnější, než tomu bylo u kombinace flutikason/salmeterol, a statisticky významný byl také rozdíl v nárůstu FVC ve prospěch kombinace BDP/formoterol (graf 2) [22].
symptomů (denní a noční příznaky astmatu), výskyt exacerbací a nutnost použití záchranné terapie. Obě fixní kombinace se ukázaly jako srovnatelně účinné ve zlepšení plicních funkcí měřených pomocí parametrů PEF a FEV1. Rovněž v kontrole symptomů astmatu a počtu exacerbací byly obě fixní kombinace srovnatelné. Bronchodilatace navozená kombinací BDP/formoterol však byla v průběhu první hodiny po aplikaci intenzivnější, než tomu bylo u kombinace flutikason/salmeterol, a statisticky významný byl také rozdíl v nárůstu FVC ve prospěch kombinace BDP/formoterol (graf 2) [22].
Toto zjištění je v souladu s již dříve prokázanou redukcí tzv. air-trapping* a snížením obstrukce malých dýchacích cest [18, 23–26] a s obdobným trendem ve vývoji FVC po aplikaci BDP v lékové formě s částicemi extra-fine u dětí ve srovnání s flutikasonem [27]. Tato data naznačují vyšší potenciál fixní kombinace BDP/formoterol HFA-134a pMDI extra-fine v efektivitě potlačení zánětu v periferních dýchacích cestách.
*Termín air-trapping označuje „uvěznění“ části vydechovaného vzduchu, ke kterému dochází v důsledku zvýšení nitrohrudního tlaku při usilovném výdechu a následného uzavření bronchiolů ještě před vydechnutím nadechnutého objemu vzduchu.
Srovnávací studie se samotným β2-sympatomimetikem
V poslední době byly publikovány dvě studie, ve kterých byla srovnávána účinnost fixní kombinace BDP/formoterol HFA-134a pMDI, fixní kombinace budesonid/ formoterol a samostatně podávaného formoterolu. V obou těchto studiích byla prokázána srovnatelná účinnost obou fixních kombinací na zlepšení plicních funkcí (hodnoceno prostřednictvím změny FEV1) a statisticky významně vyšší zlepšení ve srovnání se samotným formoterolem. Rovněž nástup klinického účinku byl u obou fixních kombinací rychlejší než v případě samostatně podávaného formoterolu [28, 29]. Ve všech třech srovnávaných léčebných postupech bylo pozorováno snížení počtu exacerbací, zmírnění symptomů onemocnění a snížení nutnosti užití záchranné medikace [29].
Zařazení do současné palety léčiv
Použití kombinace KS a dlouhodobě působícího β2-sympatomimetika k inhalačnímu podávání dnes patří ke standardům v léčbě průduškového astmatu a CHOPN. Jak ukázaly četné klinické studie, má přidání dlouhodobě působícího β2-sympatomimetika větší přínos pro kontrolu astmatu než pouhé zvýšení dávky inhalačního KS [30–32]. V současné době jsou na českém trhu kromě fixní kombinace beklometason/ formoterol dostupné ještě další dvě fixní kombinace KS s dlouhodobě působícím β2-sympatomimetikem, a to budesonid/ formoterol a flutikason/salmeterol.
Použití fixní kombinace léčiv (zjednodušení léčebného režimu) často zvyšuje adherenci pacienta k léčbě [33]. V respirační medicíně zatím nemáme dostatek kvalitních studií, které by hodnotily adherenci k léčbě fixními kombinacemi ve srovnání s terapií oběma léčivy podávanými ve dvou samostatných inhalačních systémech. V observační studii, která zahrnula více než 2500 astmatiků, byla analyzována databáze vyzvednutých receptů a hodnocena compliance a perzistence (setrvání v terapii). Ve 12měsíčním sledování bylo podávání fixní kombinace flutikason/salmeterol spojeno se zvýšením perzistence ve srovnání s podáváním této kombinace v samostatných inhalátorech nebo s monoterapií flutikasonem. Compliance hodnocená parametrem MPR (medication possession ratio, poměr počtu dní pokrytých léčbou k délce trvání léčby) byla rovněž vyšší v kohortě s fixní kombinací (MPR = 69 %) než v kohortě léčené volnou kombinací (MPR = 58 %, p < 0,05). U pacientů léčených fixní kombinací byla rovněž zaznamenána nejnižší potřeba medikace krátkodobě působícími β2-sympatomimetiky [34].
Inhalační terapie vykazuje řadu specifických rysů. Jednotlivá inhalační zařízení se od sebe vzájemně odlišují technologickou úpravou, mechanismem uvedení systému do chodu, složením (charakteristikami propelentu), dávkou k inhalaci, způsobem manipulace a cenou. Aerosolové dávkovače ![Obr. 2 Vývoj formulace aerosolových dávkovačů typu pMDI (pressurized metered-dose inhaler); podle [35] – Nicolini, et al., 2008.CFC – freony (chlorfluorkarbony); HFA – hydrofluoralkany](https://www.remedia.cz/photo-a-28529---.jpg) patří mezi nejčastěji používané inhalační systémy. Léčivo může být v tlakové nádobce obsaženo ve formě suspenze nebo (výhodněji) ve formě roztoku. Důvodem k vývoji technologie Modulite, která umožňuje regulovat velikost částic léčiva, byla potřeba řešení technických a farmakologických obtíží spojených s přechodem z freonových propelentů na propelenty na bázi HFA (obr. 2). Terapeutická účinnost fixní kombinace BDP/formoterol HFA pMDI je kromě vlastností léčiv dána i zajištěním velmi jemných částic (extra-fine), což umožnilo snížení dávky BDP z původních 250 µg v přípravku s freonovým propelentem na 100 µg [10, 35].
patří mezi nejčastěji používané inhalační systémy. Léčivo může být v tlakové nádobce obsaženo ve formě suspenze nebo (výhodněji) ve formě roztoku. Důvodem k vývoji technologie Modulite, která umožňuje regulovat velikost částic léčiva, byla potřeba řešení technických a farmakologických obtíží spojených s přechodem z freonových propelentů na propelenty na bázi HFA (obr. 2). Terapeutická účinnost fixní kombinace BDP/formoterol HFA pMDI je kromě vlastností léčiv dána i zajištěním velmi jemných částic (extra-fine), což umožnilo snížení dávky BDP z původních 250 µg v přípravku s freonovým propelentem na 100 µg [10, 35].
Indikace
Fixní kombinace BDP/formoterol je indikována pro pravidelnou léčbu astmatu tam, kde je vhodná léčba kombinující inhalační KS a β2-mimetikum s dlouhodobým účinkem:
- u pacientů, u nichž léčba inhalačními KS a β2-mimetiky s krátkodobým účinkem podle potřeby nedosáhla dostatečné kontroly astmatu;
- u pacientů, kteří jsou správně léčeni inhalačním KS a β2-mimetikem s dlouhodobým účinkem (samostatně) [13].
Kontraindikace
Fixní kombinace BDP/formoterol není vhodná pro léčbu akutního záchvatu astmatu. U dětí a dospívajících mladších 18 let nejsou s použitím přípravku dostatečné zkušenosti, proto není použití v tomto věku doporučeno [13].
U pacientů se srdečními arytmiemi (AV bloky, tachyarytmie) a vážnými srdečními chorobami je třeba tuto fixní kombinaci používat s opatrností (případně i pacienta monitorovat) [13].
Nežádoucí účinky
Fixní kombinace BDP/formoterol je velmi dobře tolerována, což ukázaly všechny publikované studie. Frekvence nežádoucích účinků, které jsou závislé na charakteru použitých účinných látek, je srovnatelná s dosud běžně používanými fixními kombinacemi [21, 22]. Rovněž nebylo pozorováno, že by současné použití obou účinných látek frekvenci nežádoucích účinků zvyšovalo [20]. Typické nežádoucí reakce způsobované formoterolem jsou: hypokalemie, bolest hlavy, tremor, palpitace, kašel, svalové spasmy a prodloužení intervalu QT. Nežádoucí účinky přičítané beklometasonu jsou: kvasinkové infekce úst, orální kandidóza, dysfonie, dráždění v krku [13].
Dysfonii a kandidóze lze předejít výplachem úst, kloktáním vodou nebo čištěním zubů kartáčkem po užití přípravku. Symptomatická kandidóza může být léčena lokálními antimykotiky a léčbu fixní kombinací není třeba přerušovat [13].
Lékové interakce
Účinek formoterolu je snížen (nebo zcela anulován) užíváním betablokátorů; současné užívání formoterolu a jiného agonisty betareceptorů může mít naopak aditivní účinek.
Formoterol může indukovat prodloužení intervalu QT. Je tedy třeba opatrnosti u pacientů s prodlouženým intervalem QT (i anamnesticky), kongenitálním nebo indukovaným léčivy [13].
Dávkování
Přípravek je určen k inhalačnímu podávání. U dospělých pacientů ve věku 18 let a starších je doporučována jedna nebo dvě inhalační dávky dvakrát denně. Maximální denní dávkou jsou tedy 4 inhalace denně [13].
Balení
Lékovou formu představuje tlaková nádobka se 120 a 180 odměřenými dávkami. V jedné odměřené dávce je obsaženo 100 µg beklometasonu a 6 µg formoterolu. To odpovídá podané dávce 86,4 µg beklometasonu a 5 µg formoterolu.
Před výdejem pacientovi je třeba uchovávat přípravek v chladničce při teplotě 2–8 °C (po dobu maximálně 15 měsíců). Po vydání pacientovi doporučuje výrobce teplotu uchovávání do 25 °C (maximálně 3 měsíce). Přípravek nemá být vystaven teplotám vyšším než 50 °C. Jelikož se jedná o roztok (nikoli suspenzi), není třeba přípravek před použitím protřepávat [13].
Seznam použité literatury
- [1] Winkler J, Hochhaus G, Derendorf H. How the lung handles drugs: pharmacokinetics and pharmacodynamics of inhaled corticosteroid. Proc Am Thorac Soc 2004; 1: 356–363.
- [2] Faulds D, Hollingshead IM, Goa KI. Formoterol: A review of its pharmacological properties and therapeutic potential in reversible obstructive airways disease. Drugs 1991; 42: 115–137.
- [3] Kips JC, Pauwels RA. Long-acting inhaled beta(2)-agonists therapy in asthma. Am J Respir Crit Care Med 2001; 164: 923–932.
- [4] Barnes PJ. Scientific rationale for inhaled combination therapy with long-acting b2-agonists and corticosteroids. Eur Respir J 2002; 19: 182–191.
- [5] Caramori G, Ito K, Papi A, et al. Interactions between long-acting b2-agonists and glucocorticoids. Drug Discov Today Ther Strateg 2007; 3: 261–268.
- [6] Scotty MG, Stan C, Wheatley AP, Hall IP. Identification of novel polymorphisms within the promoter region of the human b2-adrenergic receptor gene. Br J Pharmacol 1999; 126: 841–844.
- [7] Eickelberg O, Roth M, Lox R, et al. Ligand-independent activation of the glucocorticoid receptor by b2-adrenergic receptor agonists in primary human lung fibroblasts and vascular smooth muscle cells. J Biol Chem 1999; 274: 1005–1010.
- [8] Farmer P, Pugin J. Beta-adrenergic agonists exert thein „anti-anflammatory“ effects in monocytic cells through the IkappaB/NF-kappaB pathway. Am J Physiol Lung Cell Mol Physiol 2000; 279: 675–682.
- [9] Kašák V. Fixní kombinace beklometason dipropionát/formoterol fumarát. Remedia 2009; 19: 64–68.
- [10] Kašák V. Nové inhalační systémy užívané v léčbě chronických nemocí dýchacího ústrojí s obstrukcí dýchacích cest. Remedia 2007; 17: 26–38.
- [11] Moriotti F, Poli G, Acerbi D, et al. Lung deposition of BDP/Formoterol HFA pMDI in healthy volunteers, asthmatic and COPD patients (abstract). Poster presented at the VII UIP National congress, Florence, 4–7 December 2007.
- [12] De Backer W, Devolder A, Poli G, et al. Lung deposition of BDP/Formoterol HFA pMDI in healthy volunteers, asthmatic and COPD patients. J Am Aerosol Med Pulm Drug Del 2010; 23: 137–148.
- [13] Souhrn údajů o přípravku. Combair 120 Inhaler, Torrex Chiesi CZ, s.r.o., datum poslední revize textu 16. 5. 2007.
- [14] Daley-Yates PT, Price AC, Sisson JR, et al. Beclomethasone dipropionate: absolute bioavailability, pharmacokinetics and metabolism following intravenous, oral, intranasal and inhaled administration in man. Br J Clin Pharmacol 2001; 51: 400–409.
- [15] Foe K, Brown KF, Seale JP. Comparative kinetics of metabolism of beclomethasone propionate esters in human lung homogenates and plasma. J Pharm Sci 1999; 89: 1143–1150.
- [16] Bousquet J, Poli G, Acerbi D, et al. Systemic exposure and implications for lung deposition with an extra-fine hydrofluoroalkane beclometasone dipropionate/formoterol fixed combination. Clin Pharm 2009; 48: 347–358.
- [17] Lecaillon JB, Kaiser G, Pamisano M, et al. Pharmacokinetics and tolerability of formoterol in healthy volunteers after a single high dose of Foradil dry powder inhalation via Aerolizer. Eur J Pharmacol 1999; 55: 131–138.
- [18] Dhillon S, Kreating GM. Beclomethasone dipropionate/formoterol: in an HFA-propelled pressurised metered-dose inhaler. Drugs 2006; 66: 1475–1483.
- [19] Rigamonti E, Kottakis I, Pelc M, et al. Comparison of a new extrafine beclomethasone dipropionate HFA 134a-formulated pMDI with a standard BDP CFC pMDI in adults with moderate persistent asthma (abstract). Eur Respir J 2006; 28 (Suppl. 50): P 1236.
- [20] Huchon G, Magnussen H, Chuchalin A, et al. Lung function and asthma control with beclomethasone and formoterol in a single inhaler. Resp Med 2009; 103: 41–49.
- [21] Papi A, Paggiaro PL, Nicolini G, et al. Beclomethasone/formoterol versus budesonide/formoterol combination therapy in asthma. Eur Respir J 2007; 29: 682–689.
- [22] Papi A, Paggiaro P, Nicolini G, et al. Beclomethasone/formoterol vs fluticasone/salmeterol inhaled combination in moderate to severe asthma. Allergy 2007; 62: 1182–1188.
- [23] Verbanck S, Schuermans D, Paiva M, Vinckem W. The functional benefit of anti-inflammatory aerosols in the lung periphery. J Allergy Clin Immunol 2006; 118: 340–346.
- [24] Martin RJ. Therapeutic significance of distal airway inflammation in asthma. J Allergy Clin Immunol 2002; 2 (Suppl.): S447–S460.
- [25] Goldin JG, Tashkin DP, Kleerup EC, et al. Comparative effects of hydrofluoroalkane and chlorofluorocarbon beclomethasone dipropionate inhalation on small airways: assessment with functional helical thin-section computed tomography. J Allergy Clin Immunol 1999; 104: 258–267.
- [26] Scichilone N, Battaglia S, Sorino C, et al. Effects of extra-fine inhaled beclomethasone/formoterol on both large and small airways in asthma. Allergy 2010; 65: 897–902.
- [27] van Aalderen WM, Price D, De Baets FM, Price J. Beclometasone dipropionate extrafine aerosol versus fluticasone propionate in children with asthma. Respir Med 2007; 101: 1585–1593.
- [28] Cazzola M, Pasqua F, Ferri L, et al. Rapid onset of bronchodilation with formoterol/beclomethasone Modulite and formoterol/budesonide Turbuhaler as compared to formoterol alone in patients with COPD. Pulm Pharmacol Ther 2011; 24: 118–122.
- [29] Calverley PM, Kuna P, Monsó E, et al. Beclomethasone/formoterol in the management of COPD: a randomised controlled trial. Respir Med 2010; 104: 1858–1868.
- [30] Lalloo UG, Malolepszy J, Kozma D, et al. Budesonide and formoterol in a single inhaler improves asthma control compared with increasing the dose of corticosteroid in adults with mild-to-moderate asthma. Chest 2003; 123: 1480–1487.
- [31] Greening AP, Ind PW, Northfield M, Shaw G. Added salmeterol versus higher-dose corticosteroid in asthma patients with symptoms on existing inhaled corticosteroid. Allen and Hanburys Limited UK Study Group. Lancet 1994; 344: 219–224.
- [32] Ringdal N, Chuchalin A, Chovan L, et al. Evaluation of different inhaled combination therapies (EDICT): a randomized, double-blind comparison of Seretide (50/250 microg bd) Diskus vs. Formoterol (12 mcrog bd) and budesonide (800 mg bd) given concurrently (both via Turbuhaler) in patients with moderate-to-severe asthma. Respir Med 2002; 96: 851–861.
- [33] Bangalore S, Kamalakkannan G, Parkar S, Messerli FH. Fixed-dose combinations improve medication compliance: a meta-analysis. Am J Med 2007; 120: 713–719.
- [34] Stoloff SW, Stempel DA, Meyer J, et al. Improved refill persistence with fluticasone propionate and salmeterol in a single inhaler compared with other controller therapies. J Allergy Clin Immunol 2004; 113: 245–251.
- [35] Nicolini G, Scichilone N, Bizzi A, et al. Beclomethasone/formoterol fixed combination for the management of asthma: patient considerations. Ther Clin Risk Manag 2008; 4: 855–864.