Fixní kombinace elbasvir a grazoprevir
Souhrn:
Léčba chronické hepatitidy typu C kombinací přímo působících perorálních virostatik (directly acting antivirals, DAA) má vysokou účinnost (až 100 %), minimum kontraindikací a mimořádně příznivý bezpečnostní profil. Fixní kombinace elbasviru s grazoprevirem (Zepatier) představuje nově dostupnou, vysoce účinnou variantu této léčby určenou pro pacienty infikované virem hepatitidy typu C (HCV) genotypu 1 nebo 4. Elbasvir (EBR) je inhibitor NS5A (nestrukturálního proteinu 5A) druhé vlny 1. generace, grazoprevir (GZR) proteázový inhibitor 2. generace. Léčivý přípravek Zepatier obsahuje 50 mg EBR a 100 mg GZR. Standardní dávkování představuje jedna tableta denně.
Key words: chronic hepatitis C – directly acting antivirals – elbasvir – grazoprevir.
Summary:
Chronic hepatitis C therapy using directly acting antivirals (DAA) has high efficacy (up to 100%), minimum contraindications plus an extraordinarily favorable safety profile. Fixed combination of elbasvir and grazoprevir represents a newly available, highly effective variant of this therapy, indicated for patients infected with hepatitis C virus (HCV), genotypes 1 or 4. Elbasvir (EBR) is a NS5A inhibitor of the second wave of the 1st generation; grazoprevir (GZR) is a protease inhibitor of the 2nd generation. The preparation Zepatier includes 50 mg of EBR and 100 mg of GZR. The standard dose is one tablet daily.
Úvod
Infekce virem hepatitidy typu C (HCV) je celosvětově jednou z hlavních příčin chronického onemocnění jater. Dlouhodobý efekt infekce HCV je velmi variabilní, kolísá od minimálních histologických změn až po extenzivní fibrózu a cirhózu s hepatocelulárním karcinomem/bez hepatocelulárního karcinomu (HCC). Odhaduje se, že na světě žije 115 milionů osob s pozitivitou protilátek proti HCV, z nichž asi 80 % trpí chronickou infekcí HCV. Většina z nich o této infekci neví. Péče o pacienty infikované HCV se za posledních dvacet let významně zlepšila díky hlubšímu porozumění patofyziologii onemocnění, zdokonalení diagnostiky, terapeutických a preventivních možností [1].
Léčba chronické hepatitidy typu C prodělává v posledních pěti letech zcela mimořádné změny. Do praxe se postupně zavádějí přímo působící antivirotika (directly acting antivirals, DAA), která se podávají především v bezinterferonových (interferon free) režimech. Tyto režimy eliminují závažné nežádoucí účinky pegylovaného interferonu (PEG IFN) alfa a ribavirinu (RBV), nemají prakticky kontraindikace a jejich účinnost se blíží 100 %.
Primárním cílem léčby chronické hepatitidy typu C je vyléčení infekce, tady dosažení setrvalé virologické odpovědi (SVR) definované jako nedetekovatelná nukleová kyselina viru (HCV RNA) v periferní krvi za 12 týdnů nebo 24 týdnů po skončení antivirové léčby. Dosažení SVR je obecně spojeno se snížením rizika vzniku pokročilé jaterní fibrózy, cirhózy jater, dekompenzace cirhózy, vzniku HCC a potřeby transplantace jater [2].
Farmakologická charakteristika
Nový přípravek je vysoce účinnou
fixní kombinací inhibitoru NS5A (nestrukturálního proteinu
5A) druhé vlny 1. generace elbasviru (EBR ‒ 50 mg)
s proteázovým inhibitorem 2. generace grazoprevirem
(GZR ‒ 100 mg). Chemickou strukturu obou antivirotik
ilustruje obrázek 1
a místo zásahu do replikačního cyklu HCV
obrázek 2 [3].
Tato kombinace je určena pro léčbu pacientů chronicky
infikovaných HCV genotypu 1 nebo 4. Standardní dávkování je
jedna tableta denně [4].![OBR. 1 Chemická struktura elbasviru (a) a grazopreviru (b); podle [3] – keating, 2016.](https://www.remedia.cz/photo-a-31162---.jpg)
Elbasvir i grazoprevir jsou
částečně metabolizovány cytochromem P450 3A (CYP3A), avšak
metabolity nelze prokázat v plazmě. Eliminace metabolitů
probíhá žlučí a stolicí. Grazoprevir je substrátem
P glykoproteinu (P gp) a transportní molekuly
v bazolaterální membráně hepatocytu přenášející
polypeptid 1B (organic anion transporting polypeptide 1B, OATP1B),
elbasvir je substrátem P gp. V plazmě jsou obě látky
vázány na bílkoviny a jejich poločas je 24 a 31
hodin. Farmakokinetický profil obou látek je determinován
funkční schopností jaterní tkáně, proto je kombinace GZR/EBR
kontraindikována u pacient![PravděpoOBR. 2 replikační cyklus hCV; podle [3] – keating, 2016. hCV cirkuluje v krevním oběhu hostitele jako částice asociovaná s lipidy, která vstupuje do hepatocytu způsobem označovaným jako receptory medio va ná endocytóza (1). nejdůležitějším faktorem vstupu hCV do buňky je protein Cd81. Vlastní replikace virové rna probíhá v cytoplazmě infi kované buňky ve struktuře označované jako membránová síť (2). Funkcí sítě je koncentrace nezbytných proteinů pro replikaci a ochrana před vrozenou imunitou hostitele. uvolnění viru se děje konstitutivní sekrecí v těsné vazbě na syntézu Vldl (lipoprotein o velmi nízké hustotě) (3). Cd81 – antigen, lidský transmembránový protein (tetraspanin); Cldn1 – protein klaudin 1; Cypa – podrodina cytochromu P450; er – endoplazmatické retikulum; hCV – virus hepatitidy typu C; ld – laktátdehydrogenáza; mir‑122 – typ mikroRNa; MW – molekulární hmotnost; ns3, ns4B, ns5a, ns5B – regulační proteiny; p7 – protein obalující vlákna RNa; ptdins4kiiiα – fosfatidylinositol 4 kináza IIIα; rna – ribonukleová kyselina; sr‑B1 – scavengerový receptor třídy B1](https://www.remedia.cz/photo-a-31163---.jpg) ů s jaterní cirhózou funkční
klasifikace podle Childa‒Pugha B a C. U nemocných
s renální insuficiencí všech stupňů včetně osob
v pravidelném dialyzačním léčení není třeba redukovat
dávku. Vzhledem k výše zmíněnému vztahu k CYP3A mohou
induktory těchto proteinů (karbamazepin, bosentan, modafinil,
fenytoin, efavirenz, etravirin atd.) snižovat jejich plazmatické
koncentrace, a proto je jejich současné podání považováno
za kontraindikované. Podání inhibitorů CYP3A naopak zvyšuje
jejich plazmatické koncentrace, a proto jsou rovněž
kontraindikovány (např. cyklosporin, rifampicin). Při podání
dalších farmak interferujících s CYP3A je třeba opatrnosti,
jde např. o takrolimus, některé statiny či dabigatran
[6‒10].
ů s jaterní cirhózou funkční
klasifikace podle Childa‒Pugha B a C. U nemocných
s renální insuficiencí všech stupňů včetně osob
v pravidelném dialyzačním léčení není třeba redukovat
dávku. Vzhledem k výše zmíněnému vztahu k CYP3A mohou
induktory těchto proteinů (karbamazepin, bosentan, modafinil,
fenytoin, efavirenz, etravirin atd.) snižovat jejich plazmatické
koncentrace, a proto je jejich současné podání považováno
za kontraindikované. Podání inhibitorů CYP3A naopak zvyšuje
jejich plazmatické koncentrace, a proto jsou rovněž
kontraindikovány (např. cyklosporin, rifampicin). Při podání
dalších farmak interferujících s CYP3A je třeba opatrnosti,
jde např. o takrolimus, některé statiny či dabigatran
[6‒10].
Terapeutické indikace
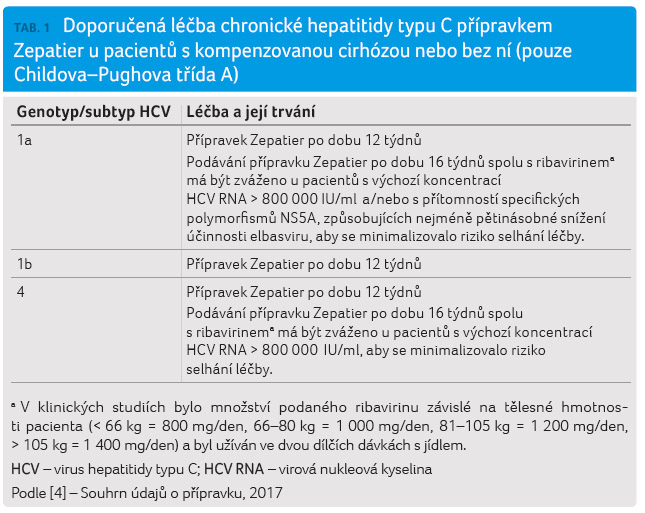
Doporučená léčba přípravkem Zepatier je uvedena v tabulce 1. Z hlediska České republiky je zásadní léčba pacientů infikovaných subtypem 1b. Tito pacienti v současnosti představují 60‒65 % všech nemocných s chronickou infekcí HCV v naší zemi. Dosud neléčení (naivní) pacienti a opakovaně léčení pacienti infikovaní genotypem 1b s kompenzovanou cirhózou nebo bez ní by měli být léčeni fixní kombinací GZR/EBR po dobu 12 týdnů bez RBV [4].
Klinická hodnocení
Doporučení v tabulce 1 jsou založena na výsledcích klinických studií fáze II a III. Souhrn všech klinických studií s kombinací GZR/EBR s RBV/bez RBV je uveden v tabulce 2. V následujícím textu jsou okomentována jen některá z uvedených hodnocení.
Studie C EDGE TN zahrnovala
léčebně naivní pacienty infikované subtypy 1a nebo 1b, kteří
byli léčeni kombinací GZR/EBR po dobu 12 týdnů bez RBV. Při
infekci subtypem 1a bylo dosaženo setrvalé virologické odpovědi
ve 12. týdnu (SVR12) u 92 % léčených, při
infekci subtypem 1b dokonce u 99 % pacientů. Úspěšnost
terapie nebyla ovlivněna jaterní cirhózou [11,12].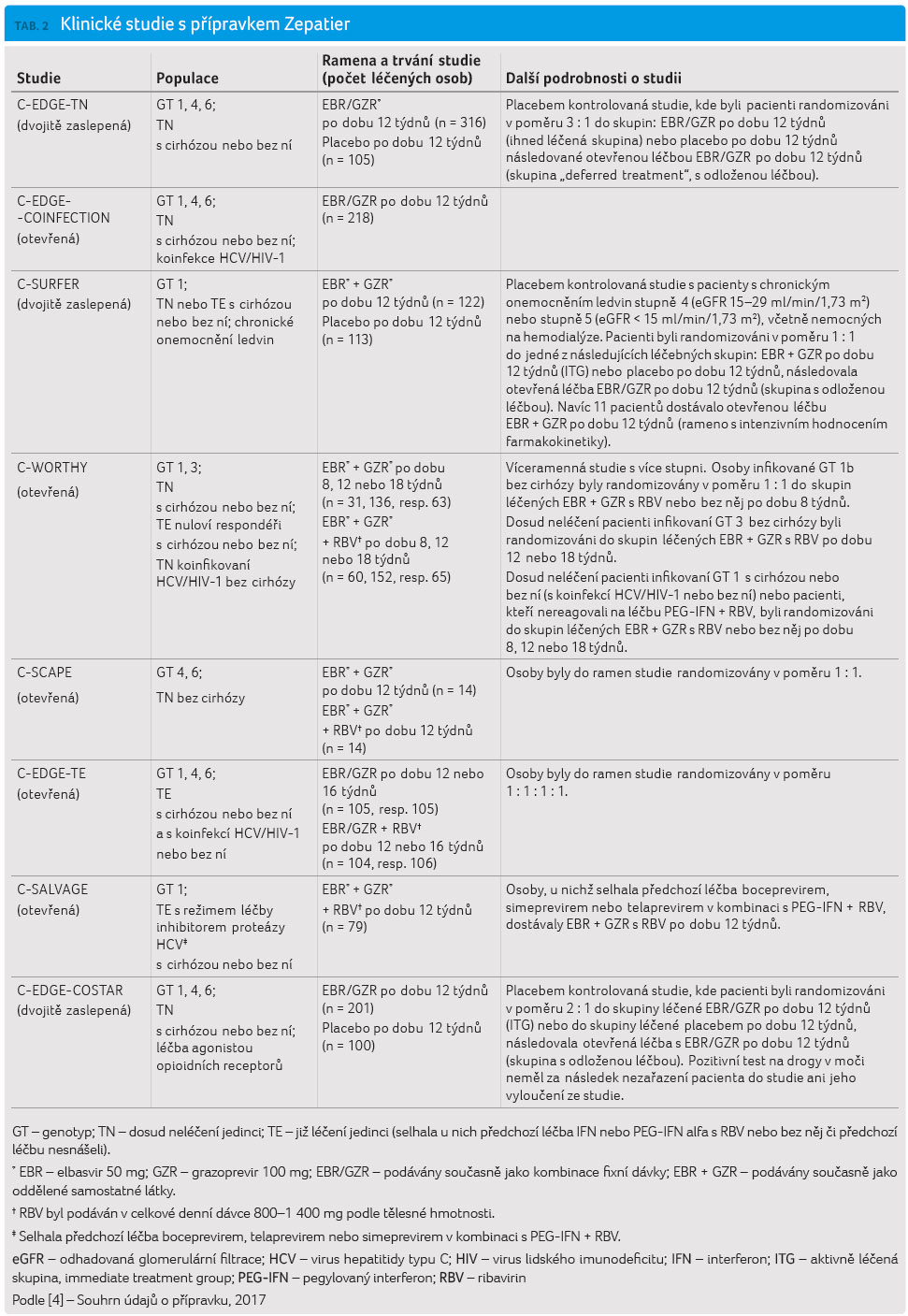
Studie C EDGE COINFECTION měla za cílovou populaci osoby současně infikované HCV i virem lidského imunodeficitu (HIV), s jaterní cirhózou nebo bez ní. Léčba probíhala 12 týdnů. Pravděpodobnost dosažení SVR12 byla srovnatelná při infekci subtypem 1a (97 %) i 1b (95 %). U infekce subtypem 1a byla pravděpodobnost dosažení SVR významně ovlivněna výší viremie a přítomností aminokyselin spojených s rezistencí (RAS) na elbasvir. Při viremii vyšší než 800 000 IU/ml a současné přítomnosti RAS klesla pravděpodobnost dosažení SVR12 až na 52 %. Délka léčby by proto u těchto pacientů měla být prodloužena na 16 týdnů. Žádný pacient ve studiích fáze II a III neměl při HCV RNA ≤ 800 000 IU/ml prokázanou přítomnost RAS pro EBR [13].
Opakovaně léčené osoby tvořily cílovou populaci studie C EDGE TE, léčebný režim byl představován kombinací GZR/EBR bez RBV po dobu 12 týdnů a SVR12 u subtypu 1a bylo dosaženo v 92 % a u subtypu 1b ve 100 % případů. Přidání RBV úspěšnost léčby významně neovlivnilo (93 % u subtypu 1a a 97 % u 1b). Podobné výsledky byly při délce terapie 16 týdnů bez RBV (94 % u 1a, 98 % u 1b). S podáváním RBV bylo 16 týdnů léčby úspěšných u obou subtypů ve 100 % [14].
Z výsledků klinických hodnocení C EDGE TN, C EDGE COINFECTION a C EDGE TE [11,13,14] vyplynula pro terapii nemocných infikovaných genotypem 4 následující doporučení: a) dosud neléčení pacienti s kompenzovanou cirhózou nebo bez ní by měli být léčeni kombinací GZR/EBR po dobu 12 týdnů bez RBV, b) opakovaně léčení pacienti s kompenzovanou cirhózou nebo bez ní s výchozí hodnotou HCV RNA > 800 000 IU/ml by měli být léčeni kombinací GZR/EBR po dobu 16 týdnů s RBV v obvyklém dávkování [4].
Kontraindikace
Absolutní kontraindikací podávání přípravku Zepatier je hypersenzitivita na léčivé látky nebo na kteroukoliv pomocnou látku obsaženou v daném přípravku. Léčivo nelze podávat ani pacientům se středně těžkou nebo těžkou poruchou funkce jater (Childova‒Pughova třída B nebo C). Současné podávání s inhibitory OATP1B, jako jsou rifampicin, atazanavir, darunavir, lopinavir, saquinavir, tipranavir, kobicistat nebo cyklosporin, je kontraindikované. To stejné platí pro současné podávání s induktory CYP3A nebo P gp, mezi něž patří například efavirenz, fenytoin, karbamazepin, bosentan, etravirin, modafinil nebo třezalka tečkovaná (Hypericum perforatum) [4].
Nežádoucí účinky
Bezpečnost přípravku Zepatier byla hodnocena na základě tří placebem kontrolovaných studií a sedmi nekontrolovaných klinických hodnocení fáze II a III u přibližně 2 000 jedinců s chronickou infekcí HCV s kompenzovaným onemocněním jater (s cirhózou nebo bez ní). V klinických studiích byly nejčastěji hlášenými nežádoucími účinky (více než 10 %) únava a bolest hlavy. Méně než 1 % osob léčených přípravkem Zepatier s RBV nebo bez RBV mělo závažné nežádoucí účinky (bolesti břicha, tranzitorní ischemická ataka a anémie). Méně než 1 % osob léčených přípravkem Zepatier s RBV nebo bez RBV léčbu v důsledku nežádoucích účinků ukončilo. Četnost závažných nežádoucích účinků a ukončení terapie v důsledku nežádoucích účinků u nemocných s kompenzovanou cirhózou byla srovnatelná s četností pozorovanou u nemocných bez cirhózy. Při hodnocení GZR/EBR v kombinaci s RBV byly nejčastější nežádoucí účinky kombinované léčby GZR/EBR + RBV konzistentní se známým bezpečnostním profilem RBV.
V Souhrnu údajů o přípravku (SPC) Zepatier je jako zvláštní upozornění uvedeno pozdní zvýšení aktivity alaninaminotransferázy (ALT). Během klinických hodnocení přípravku Zepatier s RBV nebo bez něj, bez ohledu na trvání léčby, došlo u méně než 1 % (13/1 690) osob ke zvýšení koncentrací ALT z normálních hodnot na více než pětinásobek horní hranice normálu, obecně v 8. týdnu léčby nebo později (průměrná doba objevení se 10 týdnů, rozmezí 6‒12 týdnů). Tato pozdní zvýšení hodnot ALT byla obvykle asymptomatická, většina z nich vymizela během probíhající léčby přípravkem Zepatier nebo po jejím dokončení. Četnost pozdních zvýšení hodnot ALT byla vyšší u nemocných s vyššími plazmatickými koncentracemi GZR. Incidence pozdních zvýšení hodnot ALT nebyla trváním terapie ovlivněna a cirhóza nebyla jejich rizikovým faktorem. U méně než 1 % osob léčených přípravkem Zepatier s RBV nebo bez něj bylo během terapie zjištěno zvýšení hodnot ALT na více než 2,5‒5násobek horní hranice normálu; kvůli těmto vzestupům nedošlo k žádnému ukončení léčby. Vyšší frekvence pozdních zvýšení koncentrací ALT se vyskytla u žen (2 %, 11/652), Asiatů (2 %, 4/165) a osob ve věku ≥ 65 let (2 %, 3/187). V reakci na tuto skutečnost jsou v SPC uvedena následující doporučení:
Před léčbou, v 8. týdnu léčby a v případě klinické indikace i jindy je nutno provést laboratorní vyšetření jaterních funkcí. U pacientů léčených po dobu 16 týdnů se ve 12. týdnu musejí provést další laboratorní vyšetření jaterních funkcí.
Pacienty je nutno poučit, aby se
bezodkladně poradili s lékařem, pokud se u nich objeví
únava, slabost, ztráta chuti k jídlu, na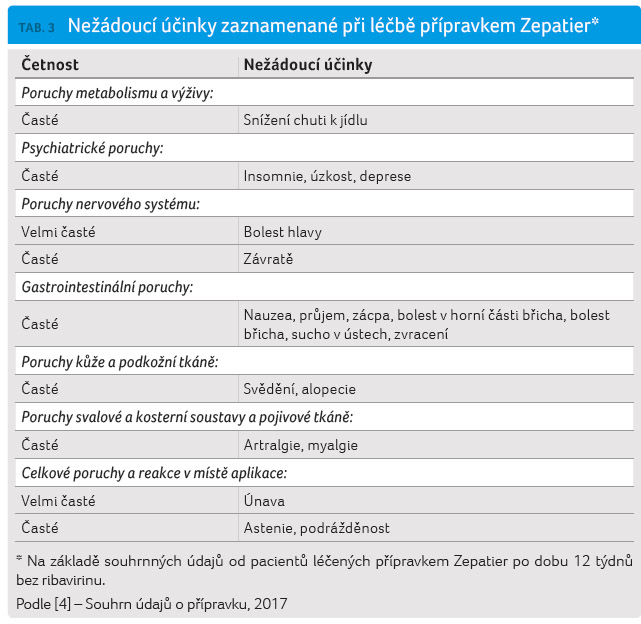 uzea a zvracení,
žloutenka nebo změna barvy stolice.
uzea a zvracení,
žloutenka nebo změna barvy stolice.
Pokud se potvrdí zvýšení aktivity
ALT na více než 10násobek horní hranice normálu, je nutno
zvážit ukončení terapie přípravkem Zepatier.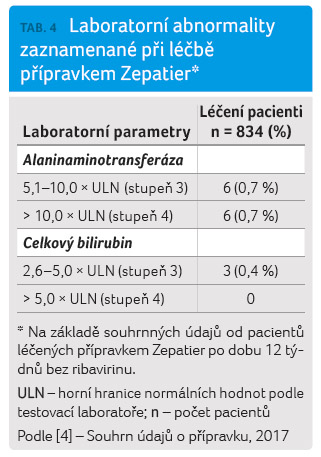
Léčbu přípravkem Zepatier je nutno přerušit, pokud je zvýšení aktivity ALT doprovázeno známkami nebo příznaky hepatitidy nebo vzestupem hodnot konjugovaného bilirubinu, alkalické fosfatázy nebo mezinárodního normalizovaného poměru (INR). V tabulkách 3 a 4 jsou uvedeny nežádoucí účinky, které byly zjištěny u pacientů užívajících přípravek Zepatier bez RBV po dobu 12 týdnů.
Nežádoucí účinky jsou v tabulce 3 seřazeny podle tříd orgánových systémů a četnosti. Četnosti jsou definovány následovně: velmi časté (≥ 1/10), časté (≥ 1/100 až < 1/10), méně časté (≥ 1/1 000 až < 1/100), vzácné (≥ 1/10 000 až < 1/1 000) nebo velmi vzácné (< 1/10 000) [4].
Závěr
Přípravek Zepatier významně rozšiřuje terapeutické možnosti léčby chronické infekce HCV. Jeho místo je především u infekcí subtypem 1b HCV, kde dosahuje téměř stoprocentní účinnosti, a to bez RBV. Velkou výhodou nového přípravku je možnost použití u pacientů s renální insuficiencí všech stupňů, včetně pacientů v pravidelném dialyzačním léčení, bez nutnosti redukovat dávku. Velmi významné jsou i jednoduchost užívání (jedna tableta denně), mimořádně dobrá snášenlivost a bezpečnost léčby. Všechny uvedené vlastnosti vzbuzují velká očekávání, která hepatologové do nového přípravku vkládají.
Seznam použité literatury
- [1] World Health Organization. Guidelines for the screening, care and treatment of persons with chronic hepatitis C infection. Updated version April 2016. Dostupné na: www.who.int/hiv/topics/hepatitis/en. Navštíveno 27. 3. 2017.
- [2] Husa P, Husa P ml. Bezinterferonová léčba hepatitidy C. Intern Med 2016; 18: 226–230.
- [3] Keating GM. Elbasvir/grazoprevir: first global approval. Drugs 2016; 76: 617–924.
- [4] ZEPATIER. Souhrn údajů o přípravku. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_Information/human/004126/WC500211235.pdf. Navštíveno 27. 3. 2017.
- [5] Landaverde C, Wells J, Hamner R, Goldstein JL. Dual therapy of grazoprevir and elbasvir for the treatment of hepatitis C infection. Expert Rev Gastroent 2016; 10: 419–429.
- [6] Alric L, Bonnet D. Grazoprevir + elbasvir for the treatment of hepatitis C virus infection. Expert Opin Pharmacoter 2016; 17: 735–742.
- [7] European Association for the Study of Liver. EASL recommendations on treatment of hepatitis C 2016. Summary. Dostupné na: www.easl.eu/medias/cpg/HCV2016/Summary.pdf. Navštíveno 27. 3. 2017.
- [8] American Association for the Study of Liver Diseases. AASLD recommendation for testing, managing, and treating hepatitis C. Dostupné na: www.hcvguidelines.org. Navštíveno 27. 3. 2017.
- [9] Pawlotsky JM. Hepatitis C virus resistance to Direct Acting Antiviral drugs in interferon free regimens. Gastroenterology 2016; 151: 70–86.
- [10] Urbánek P, Husa P, Šperl J, et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C. Dostupné na: www.ces hep.cz. Navštíveno 27. 3. 2017.
- [11] Zeuzem S, Chalib R, Reddy KR, et al. Grazoprevir elbasvir combination therapy for treatment naive cirrhotic and noncirrhotic patients with chronic hepatitis virus genotype 1, 4, or 6 infection: a randomized trial. Ann Intern Med 2015; 163: 1–13.
- [12] Zeuzem S, Rockstroh JK, Kwo PY, et al. Predictors of response to grazoprevir/elbasvir among HCV genotype 1 (GT1) infected patients: integrated analysis of Phase 2–3 trials. Hepatology 2015; 62: 554A–555A.
- [13] Rockstroh JK, Nelson M, Katlama C, et al. Efficacy and safety of grazoprevir (MK 5172) and elbasvir (MK 8774) in patients with hepatitis C virus and HIV co infection (C EDGE COINFECTION): a non randomised, open label trial. Lancet HIV 2015; 2: e319–e327.
- [14] Kwo P, Gane E, Peng CY, et al. Efficacy and safety of grazoprevir/elbasvir plus or minus RBV for 12 weeks in patients with HCV G1 or G4 infection who previously failed peginterferon/RBV: C EDGE Treatment Experienced trial. J Hepatol 2015; 62: S674–S675.