Fremanezumab
Souhrn:
Matalová P. Fremanezumab. Remedia 2019; 29: 514–518.
Fremanezumab, plně humanizovaná protilátka ze skupiny antagonistů calcitonin gene‑related peptide (CGRP), je indikován jako profylaktický lék u pacientů trpících migrénou nejméně čtyři dny v měsíci. Podává se formou subkutánní injekce jednou měsíčně nebo jednou za tři měsíce. V registračních studiích bylo fremanezumabem léčeno přes 2 500 pacientů, více než 1 400 z nich bylo léčeno po dobu alespoň 12 měsíců. Nežádoucí účinky byly vesměs mírné a nevedly k přerušení léčby. Fremanezumab vykazuje velice nízkou imunogenicitu a výskyt protilátek nesnižoval účinnost zkoušeného přípravku. Počet dnů s migrénou byl u pacientů trpících epizodickou a chronickou migrénou průměrně snížen o 3‒5.
Summary:
Matalova P. Fremanezumab. Remedia 2019; 29: 514–518.
Fremanezumab, fully humanized antibody from a group of calcitonin gene‑related peptide (CGRP) antagonists, is indicated as prophylaxis in patients suffering from migraine at least 4 days a month. It is administered subcutaneously once a month or once every three months. In registration trials, over 2,500 patients were treated with fremanezumab, more than 1,400 of them for at least 12 months. Adverse events were mostly mild and did not lead to treatment discontinuation. Fremanezumab exhibits a very low imunogenicity and generation of antibodies did not lower the efficacy of the medicinal product. Average decrease in the number of days with migraine in patients with episodic and chronic migraine reached 3–5 days.
Key words: fremanezumab, migraine, CGRP, monoclonal antibody
Farmakologická skupina a indikace
Fremanezumab (ATC kód N02CX, jiná antimigrenika) je plně humanizovaná monoklonální protilátka typu IgG2бa/κ vyráběná technologií rekombinantní DNA v ovariálních buňkách křečíka čínského (CHO buňky). Má molekulovou hmotnost 148 kDa [1].
Fremanezumab je indikován k profylaxi migrény u dospělých, kteří mívají migrénu nejméně čtyři dny v měsíci.
Dávkování
Léčba fremanezumabem je určena pacientům, u nichž dochází k atace migrény minimálně čtyřikrát v měsíci. Přípravek má dvě možné varianty dávkování: 225 mg jednou měsíčně nebo 675 mg každé tři měsíce. Injekce (jedna nebo tři) se podávají subkutánně (intravenózní nebo intramuskulární podání není dovoleno). Přípravek s obsahem fremanezumabu lze podávat injekčně do břicha, stehna nebo horní části paže v místě, které není citlivé, zarudlé, nenachází se na něm podlitina ani indurace. Při podávání více injekcí je nutno místa aplikace střídat. Pacienti si mohou aplikovat injekce sami, pouze pokud je zdravotnický pracovník zaškolí v technice samostatného podávání subkutánních injekcí.
Přínos léčby je třeba vyhodnotit do tří měsíců po jejím zahájení. Rozhodnutí o potenciálním pokračování terapie je třeba činit individuálně na základě její úspěšnosti. Doporučuje se pokračování v léčbě pravidelně přehodnocovat. Při zahájení léčby fremanezumabem je možné pokračovat v konkomitantní preventivní terapii migrény, pokud to předepisující lékař pokládá za nezbytné.
Údaje pro použití u pacientů
ve věku nad 65 let jsou omezené, nicméně dle Souhrnu údajů
o přípravku (SPC) není nutná úprava dávky. Stejně tak je
tomu u pacientů s lehkou až středně těžkou poruchou
funkce ledvin a s poruchou funkce jater. Fremanezumab není
určen k terapii dětí a mladistvých [2].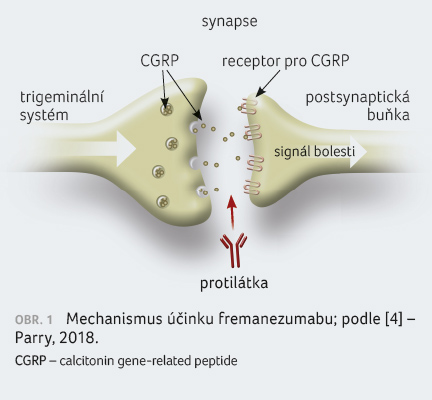
Mechanismus účinku
Fremanezumab se selektivně váže na calcitonin gene related peptide (CGRP) a blokuje obě jeho izoformy (α CGRP a β CGRP), takže se nemohou navázat na receptor pro CGRP. Calcitonin gene related peptide má vazodilatační účinky a funguje jako neurotransmiter bolesti v trigeminálním systému. Bylo prokázáno, že koncentrace CGRP se během migrény výrazně zvyšuje a po odeznění bolesti hlavy se vrací k normálu. Ačkoliv přesný mechanismus účinku není znám, předpokládá se modulace trigeminálního systému [3], obrázek 1.
Farmakokinetika
Absorpce
Po jednorázovém subkutánním podání 225 mg a 675 mg fremanezumabu je medián času potřebného k dosažení maximálních koncentrací (tmax) u zdravých subjektů 5‒7 dnů. Absolutní biologická dostupnost fremanezumabu po subkutánním podání dávky 225 mg a 900 mg zdravým subjektům činila 55‒66 %. U dávkovacích režimů 225 mg měsíčně a 675 mg čtvrtletně bylo dosaženo ustáleného stavu zhruba za 168 dní, tedy přibližně za šest měsíců [2].
Distribuce, biotransformace a eliminace
Fremanezumab jakožto protein podléhá v organismu v retikuloendotelovém systému enzymatické proteolýze – štěpení na menší peptidy a aminokyseliny, které mohou být použity k de novo syntéze jiných bílkovin nebo vyloučeny ledvinami. V játrech se nemetabolizuje [5]. Při 66% biologické dostupnosti po s.c. podání je odhadovaný distribuční objem přibližně 3,6 litru. Odhadovaný biologický poločas fremanezumabu činí 30 dní. Úprava dávky u pacientů s nestandardní tělesnou hmotností se nevyžaduje, taktéž není potřeba úprava dávky u pacientů s poruchou funkce ledvin nebo jater [2].
Kontraindikace, interakce a zvláštní upozornění
Kontraindikací je hypersenzitivita na složky léku, nicméně hypersenzitivní reakce se vyskytují u méně než 1 % pacientů. Přípravek vzhledem ke své povaze protilátky nevykazuje žádné lékové interakce. Podání u těhotných a kojících se vzhledem k nedostatku informací z preventivních důvodů nedoporučuje. Nejsou taktéž dostupná data u pacientů s anamnézou infarktu myokardu, cévní mozkové a tromboembolické příhody, jelikož tito byli z klinických studií vedoucích k registraci přípravku vyloučeni.
Nežádoucí účinky
V registračních studiích bylo fremanezumabem léčeno přes 2 500 pacientů. Více než 1 400 nemocných bylo léčeno po dobu alespoň 12 měsíců. Často hlášenými nežádoucími účinky léčiva byly lokální reakce v místě aplikace injekce (indurace ‒ 17 %, erytém ‒ 16 %, pruritus ‒ 2 %). Reakce v místě aplikace obecně nevedly k nutnosti přerušení podávání léčivého přípravku [2].
Imunogenicita
Ve studiích kontrolovaných placebem se u 0,4 % pacientů léčených fremanezumabem (6 z 1 701) vyvinuly protilátky proti fremanezumabu (anti drug antibodies, ADA). Tyto protilátky měly velmi nízké titry. U jednoho z těchto šesti pacientů se vyvinuly neutralizující protilátky. Ve stále probíhající dlouhodobé studii dokončilo 12měsíční léčbu 1 494 pacientů. Protilátky ADA byly zjištěny u 2 % pacientů. Zajímavá a důležitá je skutečnost, že bezpečnost a účinnost fremanezumabu nebyly vývojem protilátek ADA ovlivněny [6].
Závěry klinických studií
Hlavní studie fáze III (multicentrické, randomizované, dvojitě zaslepené), konkrétně HALO EM (u pacientů s epizodickou migrénou) a halo cm (u pacientů s chronickou migrénou), prokázaly účinnost a bezpečnost u sledovaných pacientů. Do studií byli zařazeni nemocní ve věku 18‒70 let.
Ve studii HALO EM bylo zařazeno 875 pacientů s anamnézou epizodické migrény (tj. méně než 15 záchvatů v měsíci). Pacienti byli randomizováni do tří ramen – fremanezumab podávaný subkutánně v dávce 225 mg jednou měsíčně (290 pacientů), fremanezumab podávaný subkutánně v dávce 675 mg jednou za tři měsíce (291 pacientů) a placebo podávané měsíčně (294 pacientů). Průměrný počet atak migrény činil 8,9, 9,2 a 9,1 dne v jednotlivých výše zmíněných skupinách.
Pacientům bylo taktéž dovoleno
užívat akutní medikaci na bolest hlavy a 21 % osob
užívalo nějaký preventivní lék na bolest hlavy. Výsledky
jsou shrnuty v tabulce 1
[3,7].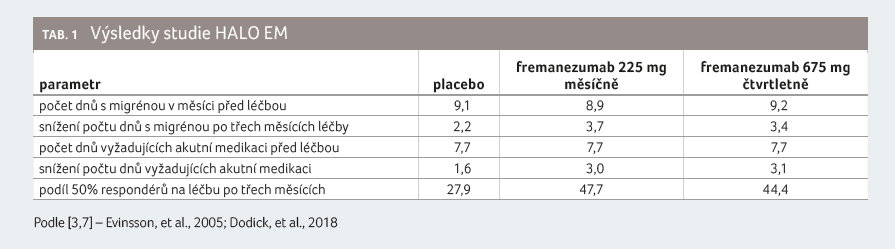
Do studie halo cm bylo
zařazeno 1 130 pacientů s chronickou migrénou, tj.
takových, u nichž se vyskytlo 15 nebo více dní bolesti hlavy
za měsíc, z toho minimálně devět s migrénou.
Studie trvala 12 týdnů a měla následující uspořádání ‒
placebo (371 pacientů), fremanezumab 675 mg čtvrtletně (375
pacientů) a fremanezumab 225 mg měsíčně při počáteční
dávce 675 mg (375 pacientů). Pacienti byli ve věku 18‒70
let (průměr 41 let) a 88 % z nich byly ženy. Střední
frekvence výskytu bolesti hlavy ve výchozím stavu byla
přibližně 21 dní s bolestí hlavy za měsíc.
Podobně jako v předchozí studii i v této pacienti
mohli užívat akutní medikaci na bolest hlavy. Celkem 21 %
nemocných bylo také umožněno souběžné užívání jednoho
běžného preventivního léčivého přípravku (betablokátor,
antidepresivum, blokátor kalciového kanálu, antikonvulzivum)
[3,8]. Výsledky jsou shrnuty v tabulce 2.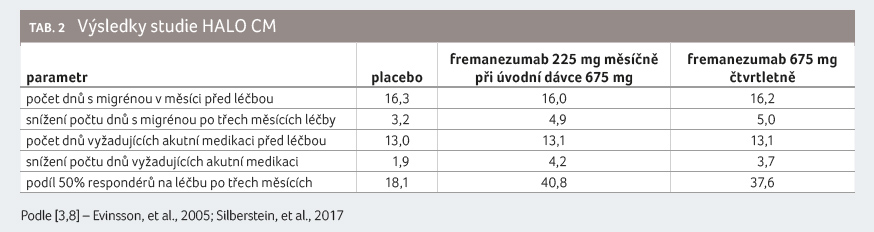
Posledním registračním klinickým hodnocením, jehož závěry byly prezentovány na meetingu Americké neurologické akademie (American Academy of Neurology, AAN) v květnu 2019, byla 52 týdnů trvající multicentrická randomizovaná studie, v níž bylo zařazeno 1 890 pacientů. Byla provedena u nemocných, kteří byli zařazeni v jedné z předchozích studií. Průměrné snížení počtu dnů s migrénou u pacientů s chronickou migrénou představovalo 7,2 dne při čtvrtletním podávání a 8,1 dne při měsíčním podávání. U pacientů s epizodickou migrénou činilo průměrné snížení 5,2 dne ve skupině s čtvrtletním dávkováním a 5,1 dne ve skupině s měsíčním dávkováním. Nejčastějším nežádoucím účinkem byla reakce v místě aplikace (u 33 % pacientů). Studie prokázala účinnost a bezpečnost přípravku při dlouhodobé terapii [9].
Studie FOCUS
Studie FOCUS, probíhající do června roku 2018, byla provedena u 838 pacientů, u nichž v předchozích 10 letech došlo k selhání dvou až čtyř medikací používaných k prevenci migrény (pro účely studie betablokátory, topiramát, amitriptylin, flunarizin, kandesartan, valproát a onabotulinumtoxin A). Studie se účastnili jak nemocní s chronickou migrénou (více než 15 migrenózních dnů v měsíci), tak s epizodickou migrénou (6‒15 migrenózních dnů v měsíci). Snížení frekvence výskytu migrény u čtvrtletního schématu dávkování činilo 3,1 dne ve srovnání s placebem a u měsíčního schématu dávkování 3,5 dne. Počty dní, kdy pacienti nemuseli užívat žádnou akutní medikaci (triptany a námelové alkaloidy), byly u čtvrtletního schématu nižší o 3,1 dne a u měsíčního dávkování o 3,4 dne [10].
Zařazení do současné palety léčiv
Antagonisté CGRP jsou novou skupinou léčiv. V České republice jsou registrovány tři monoklonální protilátky s tímto mechanismem účinku. Jedná se o erenumab, galkanezumab a fremanezumab, z nichž erenumab a fremanezumab jsou dostupné, avšak zatím bez úhrady zdravotních pojišťoven. Ve fázi klinického zkoušení se nachází eptinezumab. Jejich dávkování je měsíční nebo kvartální. Všechny tyto přípravky dosáhly v klinických zkouškách podobných výsledků, počet dnů s migrénou se v průměru snížil o dva až pět. U části pacientů došlo jen k malému efektu, zatímco u jiných se počet dnů s migrénou snížil velmi významně. Tento efekt byl pozorován u všech výše zmíněných protilátek. Také bezpečnost a spektrum nežádoucích účinků byly podobné. Jedná se o novou skupinu léčiv, nejsou tedy dostupná data o rizicích při dlouhodobém užívání.
Seznam použité literatury
- [1] Schou WS, Ashina S, Amin FM, et al. Calcitonin gene‑related peptide and pain: a systematic review. J Headache Pain 2017; 18: 34.
- [2] SPC Ajovy. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/ajovy‑epar‑product‑information_cs.pdf [navštíveno 15. 9. 2019]
- [3] Evinsson L, Uddnam R. Neurobiology in primary headaches. Brain Res Rev 2005; 48: 438‒456.
- [4] Parry RV. Monoclonal Antibodies to Mitigate Migraine. Bath ASU, May 10th, 2018. Dostupné na: https://bathasu.com/research/monoclonal‑antibodies‑to‑mitigate‑migraine/ [navštíveno 16. 9. 2019]
- [5] Hoy SM. Fremanezumab: First Global Approval. Drugs 2018; 78: 1829‒1834.
- [6] Teva Pharmaceuticals Inc. AJOVYTM (fremanezumab‑vfrm) injection, for subcutaneous use: US prescribing information, 2018. Dostupné na: http://www.fda.gov [navštíveno 10. 9. 2019]
- [7] Dodick DW, Silberstein SD, Bigal ME, et al. Effect of fremanezumab compared with placebo for prevention of episodic migraine: a randomized clinical trial. JAMA 2018; 319: 1999‒2008.
- [8] Silberstein SD, Dodick DW, Bigal ME, et al. Fremanezumab for the preventive treatment of chronic migraine. N Engl J Med 2017; 377: 2113‒2122.
- [9] AAN 2019: Efficacy of the CGRP Inhibitor Fremanezumab Inhibitor in Migraine Maintained Over 12 Months of Treatment (Abstract). Dostupné na: https://www.practiceupdate.com/content/aan‑2019‑efficacy‑of‑the‑cgrp‑inhibitor‑fremanezumab‑inhibitor‑in‑migraine‑maintained‑over‑12‑months‑of‑treatment/83300
- [10] Ferrari MD, Diener HC, Ning X, et al. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double‑blind, placebo‑controlled, phase 3b trial. Lancet 2019; 394: 1030‒1040.