Glatiramer acetát: standardní léčba a nový způsob aplikace 40 mg třikrát týdně
Souhrn:
Glatiramer acetát patří mezi imunomodulační léčiva ovlivňující počet relapsů a parametry hodnocené na magnetické rezonanci mozku u klinicky definitivní relabující remitující roztroušené sklerózy a u klinicky izolovaného syndromu. Má protizánětlivé a neuroprotektivní účinky, velmi příznivý bezpečnostní profil a je velmi dobře tolerován v původně registrované dávce 20 mg denně podkožně. Klinické studie však jednoznačně prokázaly jeho srovnatelnou účinnost se zachováním bezpečnostních parametrů i v dávce 40 mg aplikované 3krát týdně podkožně.
Key words: multiple sclerosis, glatiramer acetate, immunomodulation, neuroprotection, frequency of applications, dose.
Summary:
Glatiramer acetate is an immunomodulatory drug reducing the relapse rate and magnetic resonance parameters in clinically definite relapsing remitting multiple sclerosis and in clinically isolated syndrome. It has both anti inflammatory and neuroprotective effects and a very favorable safety profile. It is very well tolerated when applied subcutaneously in the originally registered dose 20 mg daily. However, clinical studies have clearly confirmed its similar efficacy and safety profile with subcutaneous applications of 40 mg three times a week.
Úvod
V roce 1968 profesorka Ruth Arnon a její kolegové prof. Sela a Dr. Titelbaum z Weizmannova institutu v Izraeli syntetizovali několik molekul (kopolymery), které napodobovaly strukturu centrálního myelinu. Vědci předpokládali, že aplikace těchto molekul dokáže modelovat roztroušenou sklerózu (RS) u laboratorních zvířat, což se ale nepodařilo. Přes počáteční neúspěchy vědci pokračovali ve studiu vlastností kopolymeru a ke svému překvapení v roce 1971 zjistili, že tyto molekuly blokují rozvoj experimentální autoimu-nitní encefalitidy (EAE). V letech 1972–1974 byly předloženy patentové žádosti týkající se kopolymeru 1 (Cop 1) nejen v Izraeli, ale i v několika dalších zemích. Mezitím se ukázalo, že Cop 1 ovlivňuje imunitní systém selektivně, a to jen u některých laboratorních zvířat.
První klinická hodnocení u pacientů s RS se uskutečnila v roce 1977 na Hadassah – Hebrejské universitě Lékařského centra v Jeruzalémě – ve spolupráci s Dr. Abramskym, bývalým postgraduálním studentem prof. Arnon. Čtyřem pacientům s RS v terminálním stadiu onemocnění byl podán Cop 1, bez projevů jakýchkoliv nežádoucích účinků. V letech 1978–1981 se vědci ve Weizmannově institutu pustili do impozantního úkolu přesvědčit lékaře k provádění klinických zkoušek ve větším měřítku. Jen dva lékaři však reagovali na jejich výzvu: Dr. Bauer z University v Göttingenu a Dr. Bornstein z Albert Einstein College of Medicine v New Yorku. V období let 1980–1985 již bylo zřejmé, že předběžné výsledky jsou jak v Göttingenu, tak v New Yorku povzbudivé. Bylo rozhodnuto o prodloužení hodnocení Cop 1 dvojitě zaslepenou, placebem kontrolovanou studií pod vedením Dr. Bornsteina. V roce 1987 byly výsledky studie zveřejněny v časopise New England Journal of Medicine. Bylo jednoznačně potvrzeno, že při podávání Cop 1 pacientům s relabující remitující roztroušenou sklerózou (RR RS) došlo ke snížení počtu relapsů a tato léčba byla provázena minimálními nežádoucími účinky. V témže roce získala farmaceutická společnost vyvíjející Cop 1 licenční práva. Vý-zkumy, které měly objasnit účinek Cop 1, pokračovaly. Dne 14. června 1995 byl Cop 1 předložen ke schválení americkému úřadu FDA (Food and Drug Administration) [1].
V prosinci 1996, po téměř 30 letech výzkumu, byl na základě souhlasu FDA a následně i se souhlasem Evropské lékové agentury (European Medicines Agency, EMA) uveden na trh Cop 1 k léčbě RR RS. Léčivo bylo později označeno jako glatiramer acetát (GA). V roce 2014 byla schválena silnější varianta přípravku s nižší frekvencí podávání (40 mg GA 3krát týdně). Jeho zavedení do léčby se v ČR předpokládá nyní, v průběhu roku 2015.
Farmakologická skupina
Glatiramer acetát je zařazen mezi Ostatní cytokiny a imunomodulační látky, ATC kód L03AX13.
Glatiramer acetát je acetátová sůl syntetických polypeptidů obsahujících čtyři přirozeně se vyskytující aminokyseliny: L glutamovou kyselinu, L alanin, L tyrosin a L lysin (obr. 1) v molárním frakčním rozmezí 0,129–0,153, 0,392–0,462, 0,086–0,100 a 0,300–0,374. Průměrná molekulová hmotnost G je v rozmezí 5 000–9 000 daltonů.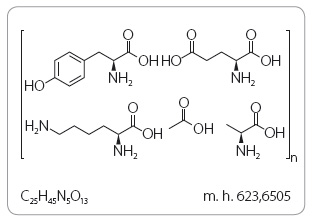
Sumární vzorec: C25H45N5O13
Molekulová hmotnost: 623,6505 g/mol
Mechanismus účinku
Mechanismus účinku, kterým GA působí u pacientů s RS, není zcela objasněn. Předpokládá se, že ovlivňuje imunitní procesy, které jsou dle současných znalostí zodpovědné za patogenezi RS. Tuto hypotézu podporují výsledky studií, které byly provedeny s cílem objasnit patogenezi EAE. Toto onemocnění lze navodit u několika zvířecích druhů pomocí imunizace látkou izolovanou z centrálního nervového systému, která obsahuje myelin a je často používána jako zvířecí model RS.
Studie u zvířat i u pacientů s RS naznačují, že po aplikaci GA dochází k indukci GA specifických regulačních T lymfocytů CD4+ a CD8+ a k jejich aktivaci na periferii. Posun ve prospěch Th2 lymfocytů vede ke zvýšení produkce pro![Obr. 2 Mechanismus účinku glatiramer acetátu; podle [25] – Hestvik, 2010. 1. Glatiramer acetát může ovlivnit celou řadu imunokompetentních buněk, včetně T lymfocytů CD4+ a CD8+, Treg, B lymfocytů, NK buněk a APC. 2. Glatiramer acetát indukuje protizánětlivý profil APC a T lymfocytů, tyto buněčné populace se mohou vzájemně stimulovat. Buňky, které reagují s GA (tzv. GA reaktivní), produkují protizánětlivé cytokiny (např. IL 4, IL 6, IL 10). Předpokládá se, že GA je rozpoznáván na molekulách HLA třídy II prezentovaných na povrchu APC v periferních lymfoidních orgánech. 3. Aktivované T lymfocyty mohou překračovat zánětem postiženou hematoencefalickou bariéru a infiltrují CNS. 4. V CNS může být reaktivace GA reaktivních T lymfocytů spuštěna cíleně nebo náhodnou zkříženou reaktivitou s peptidy CNS prezentovanými APC. 5. Reaktivace GA reaktivních T lymfocytů může být též spuštěna na T buněčných receptorech stimulovaných trvale zánětlivým prostředím v CNS. 6. Reaktivace GA reaktivních lymfocytů T2/3 v CNS může vést k sekreci protizánětlivých cytokinů, které pak ve svém okolí potlačují aktivitu auto-agresivních T lymfocytů, včetně těch, které jsou namířeny proti jiným antigenům (mechanismus tzv. bystander suppression). 7. Sekrece neurotrofních faktorů (BDNF) aktivovanými T lymfocyty může mít vliv na neurogenezi a remyelinizaci poškozených axonů. APC – antigen presenting cell, buňka prezentující antigen; BDNF – brain derived neurotrophic factor, mozkový neurotrofní faktor; CNS – centrální nervový systém; GA – glatiramer acetát; HLA – human leukocyte antigen; IL 4, IL 6, IL 10 – interleukin 4, 6, 10; NK – natural killer, buňka označovaná jako přirozený zabíječ; NT 3, NT 4 – neurotrofiny 3, 4; Treg – regulační T lymfocyt; TGFβ – transforming growth factor beta, transformující růstový faktor beta](https://www.remedia.cz/photo-a-30050---.jpg) tizánětlivých cytokinů; GA specifické Th2 lymfocyty migrují přes hematoencefalickou bariéru a vedou k supresi autoagresivních Th1 lymfocytů. Glatiramer acetát ovlivňuje buňky prezentující antigen, např. monocyty a dendritické buňky [2]; tzv. GA reaktivní T buněčné linie zvyšují pod vlivem GA produkci neurotrofního faktoru BDNF (brain derived neurotrophic factor), který chrání oligodendrocyty před zánětlivým poškozením a v experimentu vede k remyelinizaci [3]. Mechanismu účinku GA je uveden na obr. 2.
tizánětlivých cytokinů; GA specifické Th2 lymfocyty migrují přes hematoencefalickou bariéru a vedou k supresi autoagresivních Th1 lymfocytů. Glatiramer acetát ovlivňuje buňky prezentující antigen, např. monocyty a dendritické buňky [2]; tzv. GA reaktivní T buněčné linie zvyšují pod vlivem GA produkci neurotrofního faktoru BDNF (brain derived neurotrophic factor), který chrání oligodendrocyty před zánětlivým poškozením a v experimentu vede k remyelinizaci [3]. Mechanismu účinku GA je uveden na obr. 2.
Farmakokinetické vlastnosti
Farmakokinetické studie u pacientů nebyly provedeny. Údaje získané in vitro a omezená data získaná u zdravých dobrovolníků ukazují, že při subkutánním (s.c.) podání GA je aktivní látka snadno absorbována a velká část dávky je rychle degradována na menší fragmenty již v podkožní tkáni.
Klinické zkušenosti
Do první větší dvojitě zaslepené studie kontrolované placebem bylo zařazeno 251 subjektů ve věku 18–45 let s RR RS. Mezi vstupní kritéria patřilo hodnocení míry neurologického postižení pacienta pomocí škály Expanded Disability Status Scale (EDSS) v rozmezí 0–5,0, alespoň dva relapsy během dvou let a trvání nemoci minimálně jeden rok. Primárním cílem byl počet relapsů za rok (annualised relapse rate, ARR), který poklesl u pacientů léčených GA v dávce 20 mg s.c. denně (125 pacientů) oproti placebu o 29 % [4].
Stěžejní význam měla práce Johnsona a kol. (tab. 1), pros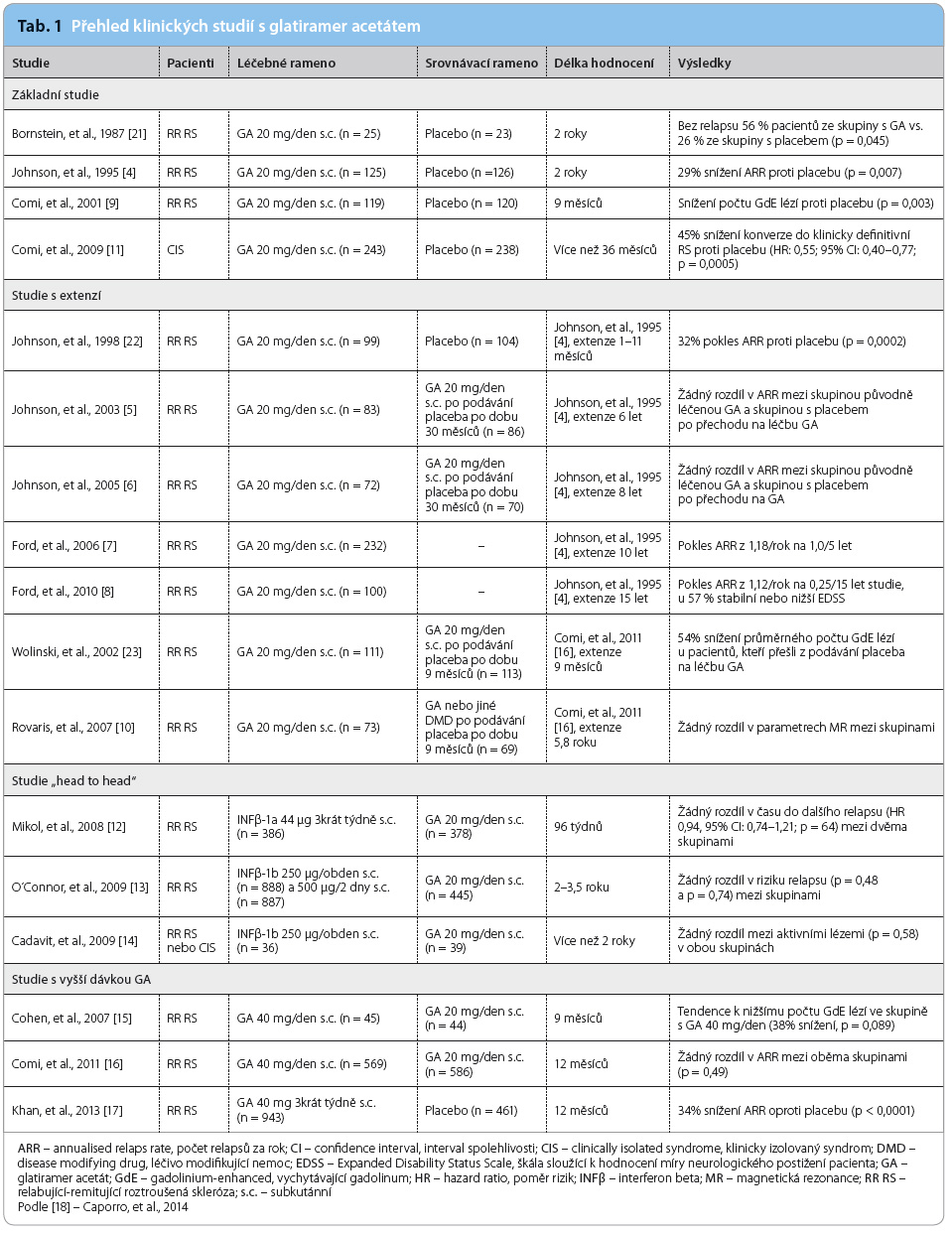 pektivní otevřená studie, která ukázala výhody včasného zahájení léčby GA proti podání opožděnému o 3, 6 a 8 let [5,6]. Z desetileté extenze studie byla získána data od 47 % jedinců z původní kohorty [7]. Ukáza-lo se, že kontinuální léčba GA vedla k více než 80% poklesu počtu relapsů (z původního počtu 1,18 relapsu/rok na 1 relaps/5 let), a to, co je důležité, bez významné progrese disability hodnocené pomocí skóre EDSS.
pektivní otevřená studie, která ukázala výhody včasného zahájení léčby GA proti podání opožděnému o 3, 6 a 8 let [5,6]. Z desetileté extenze studie byla získána data od 47 % jedinců z původní kohorty [7]. Ukáza-lo se, že kontinuální léčba GA vedla k více než 80% poklesu počtu relapsů (z původního počtu 1,18 relapsu/rok na 1 relaps/5 let), a to, co je důležité, bez významné progrese disability hodnocené pomocí skóre EDSS.
Další extenze této studie ukázala, že během patnáctiletého sledování zůstávalo z původně randomizovaných pacientů 43 % stále lé-čeno GA, dvě třetiny z nich nedosáhly sekundární progrese, 57 % subjektů mělo stabilní nebo zlepšené skóre EDSS a 82 % pacientů může ještě chodit [8]. V otevřené fázi evropsko kanadské studie, která zahrnula 94 % subjektů z původní kohorty, bylo pozorováno u pacientů, u nichž bylo podávání placeba nahrazeno léčbou GA, 54% snížení výskytu lézí vychytávajících gadolinium (gadolini-um enhanced, GdE) na magnetické rezonanci (MR) mozku a další snížení počtu ložisek GdE u pacientů léčených od počátku GA [9]. Následná extenze studie trvající 5,8 roku zahrnula 63,4 % původní kohorty léčených a ukázala, že 66 % těchto pacientů bylo stále léčeno GA a období bez relapsu onemocnění u nich bylo ve srovnání s pacienty převedenými na léčbu interferony, případně s těmi, kteří zůstali bez léčby, nejdelší. Žádné rozdíly v parametrech zjištěných vyšetřením na MR u pacientů léčených od počátku placebem nebo GA neby-ly pozorovány [10]. Přesto byl podíl pacientů bez potřeby opory při chůzi nižší než v první skupině (p = 0,034), což může znamenat, že časná léčba GA může mít příznivý vliv na vývoj nemoci v delším období. Od těchto studií byl jen krok k ověření účinku a bezpečnosti léčby GA u klinicky izolovaného syndromu (clinically isolated syndrome, CIS).
Podávání GA v dávce 20 mg bylo schváleno FDA i EMA k léčbě pacientů s CIS na základě studie, do níž byli zařazeni pacienti s jednou klinickou epizodou po vyloučení jiných příčin onemocnění [11]. Jednalo se o 481 pacientů s monofokální neurologickou symptomatologií a se dvěma nebo více T2 lézemi na MR mozku většími než 6 mm, kteří byli náhodně rozděleni do placebové a léčebné větve. Statisticky významné bylo zpoždění rozvoje klinicky definitivní RS (772 dnů při léčbě GA oproti 336 dnům v placebové větvi), stejně jako zlepšení parametrů zjištěných na MR, které byly sledovány po 2,4 roku.
V letech 2008–2009 byly provedeny tři rozsáhlé „head to head“ studie porovnávající účinek GA s účinkem interferonu beta 1a podá-vaného v dávce 44 μg 3krát týdně s.c. a s interferonem beta podávaným obden s.c. [12–14]. Žádná z těchto studií neprokázala mezi léčenými skupinami statisticky významný rozdíl v klinických i radiologických parametrech.
Po původních pilotních studiích sledujících účinnost GA v dávce 20 mg s.c. s nižší frekvencí podávání se přistoupilo k ověření účin-nosti, bezpečnosti a snášenlivosti GA v dávce 40 mg.V první z těchto studií bylo 99 pacientů randomizováno do dvou skupin, ve kterých byl GA podáván po dobu 9 měsíců v dávce 40 mg nebo 20 mg denně. Primárním cílem byly parametry MR – GdE léze, které byly měřeny v 7., 8. a 9. měsíci léčby. Rozdíl mezi skupi-nami se začal projevovat již počátkem 3. měsíce (58% redukce GdE lézí, p = 0,0898). Lokální postinjekční reakce byly však poněkud silnější než při podání nižší dávky [15]. Další podobné sledování proběhlo jako multicentrická, randomizovaná, dvojitě zaslepená para-lelní studie porovnávající aplikaci GA 40 mg a 20 mg denně po dobu jednoho roku [16]. Zařazeno bylo celkem 1 155 subjektů. Primár-ním cílem byly klinické parametry (ARR), zatímco sekundární výstupy zahrnovaly parametry na MR mozku (kumulativní počet GdE lézí, počet nových T2 lézí po 12 měsících a změny objemu mozku). V primárním cíli nebyly mezi oběma skupinami nalezeny žádné rozdíly (p = 0,49), snížení počtu GdE lézí bylo zřetelnější ve skupině s dávkou 40 mg (–37,6 %, p = 0,012) než ve skupině s dávkou 20 mg (–21,9 %, p = 0,172). Průměrný počet nových T2 lézí a objemové změny mozku byly ve 12. měsíci podobné v obou skupinách.
Tyto dvě studie sice neprokázaly vyšší účinnost dvojnásobné denní dávky GA, ale dolož![Graf 1 Výsledky klinických měření ve studii GALA; podle [17] – Khan, et al., 2013. Během sledovaného období došlo k 34% poklesu ročního počtu relapsů u skupiny léčené glatiramer acetátem v dávce 40 mg podávané 3krát týdně oproti placebu.](https://www.remedia.cz/photo-a-30052---.jpg) ily dobrou snášenlivost dávky 40 mg, jejíž podávání vedlo k myšlence redistribuce týdenní dávky GA do menšího počtu aplikací s cílem zlepšit adherenci k léčbě. Na základě předchozích zkušeností byla zahájena studie GALA (Glatiramer Acetate Low frequency Administration), kterou její autoři navrhli jako randomizovanou, placebem kontrolovanou studii fáze III s cílem ověřit bezpečnost a účinnost GA podávaného 3krát týdně s.c. [17]. Do studie bylo zařazeno 1 440 pacientů s RR RS, z nichž 943 dostávalo GA v dávce 40 mg 3krát týdně. V otevřené části bylo všem účastníkům studie nabídnuto pokračování v léčbě po dobu 12 měsíců. U subjektů léčených GA došlo k významnému snížení ARR (0,331 při podávání GA vs. 0,505 při podávání placeba, p < 0,0001, graf 1). Kromě toho byl ale v léčené skupině větší podíl pacientů bez relapsu a celá skupina vykazovala delší dobu do manifestace dalšího relapsu onemocnění. Parametry zjištěné na MR byly hodnoce-ny jako sekundární cíl, u pacientů, jimž byl podáván GA, došlo jak po šestém, tak i po dvanáctém m
ily dobrou snášenlivost dávky 40 mg, jejíž podávání vedlo k myšlence redistribuce týdenní dávky GA do menšího počtu aplikací s cílem zlepšit adherenci k léčbě. Na základě předchozích zkušeností byla zahájena studie GALA (Glatiramer Acetate Low frequency Administration), kterou její autoři navrhli jako randomizovanou, placebem kontrolovanou studii fáze III s cílem ověřit bezpečnost a účinnost GA podávaného 3krát týdně s.c. [17]. Do studie bylo zařazeno 1 440 pacientů s RR RS, z nichž 943 dostávalo GA v dávce 40 mg 3krát týdně. V otevřené části bylo všem účastníkům studie nabídnuto pokračování v léčbě po dobu 12 měsíců. U subjektů léčených GA došlo k významnému snížení ARR (0,331 při podávání GA vs. 0,505 při podávání placeba, p < 0,0001, graf 1). Kromě toho byl ale v léčené skupině větší podíl pacientů bez relapsu a celá skupina vykazovala delší dobu do manifestace dalšího relapsu onemocnění. Parametry zjištěné na MR byly hodnoce-ny jako sekundární cíl, u pacientů, jimž byl podáván GA, došlo jak po šestém, tak i po dvanáctém m![Graf 2a–c Výsledky měření pomocí magnetické rezonance ve studii GALA; podle [17] – Khan, et al., 2013. Při léčbě GA v dávce 40 mg 3krát týdně došlo oproti placebu k poklesu nárůstu zvětšujících se T2 (a) a T1 (b) lézí a ke snížení úbytku mozkového objemu (c). GA – glatiramer acetát; RR – relativní riziko](https://www.remedia.cz/photo-a-30053---.jpg) ěsíci léčby ke snížení kumulativní-ho počtu GdE lézí a počtu nových nebo zvětšujících se T2 lézí ve srovnání s placebem (graf 2a–c).
ěsíci léčby ke snížení kumulativní-ho počtu GdE lézí a počtu nových nebo zvětšujících se T2 lézí ve srovnání s placebem (graf 2a–c).
Indikace a zařazení do současné palety léčiv
Glatiramer acetát je podáván v dávce 20 mg/den jako lék první volby u pacientů s CIS s vysokou pravděpodobností rozvoje do klinicky definitivní RS. Podávání GA v obou dávkách představuje léčbu první volby u RR RS, pokud pacient prodělal 2 ataky (relapsy) během jednoho roku nebo 3 ataky za dva roky a relapsy byly natolik těžké, že bylo nutné podávat vysoké dávky kortikosteroidů. Od ostatních léků první volby (interferonu beta 1a, interferonu beta 1b a terifluno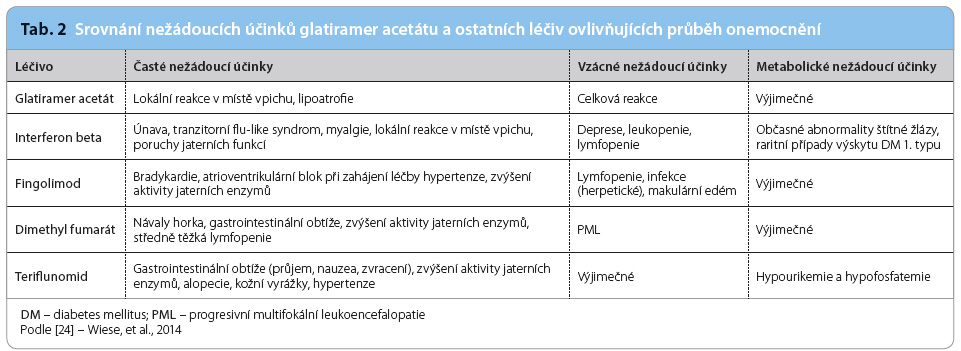 midu) se liší relativně velmi dobrým poměrem nízkého rizika nežádoucích účinků ve srovnání s léčebným přínosem, jak vyplývá z tab. 2. U části nemocných činí obtíže denní podkožní aplikace, která je eliminována novým způsobem podání – aplikací 3krát týdně s.c. Úhrada plátci zdravotní péče je však v rozporu se zásada-mi medicíny založené na důkazech (evidence based medicine, EBM), protože subjekty v registračních klinických studiích byly zařaze-ny do léčby, pokud u nich byla doložena minimálně jedna ataka za rok, bez ohledu na to, jak byla léčena.
midu) se liší relativně velmi dobrým poměrem nízkého rizika nežádoucích účinků ve srovnání s léčebným přínosem, jak vyplývá z tab. 2. U části nemocných činí obtíže denní podkožní aplikace, která je eliminována novým způsobem podání – aplikací 3krát týdně s.c. Úhrada plátci zdravotní péče je však v rozporu se zásada-mi medicíny založené na důkazech (evidence based medicine, EBM), protože subjekty v registračních klinických studiích byly zařaze-ny do léčby, pokud u nich byla doložena minimálně jedna ataka za rok, bez ohledu na to, jak byla léčena.
Kontraindikace
Léčba GA je kontraindikována u pacientů s přecitlivělostí na GA nebo mannitol a u těhotných žen.
Nežádoucí účinky
Bezpečnostní profil léčiva je velmi příznivý. Ve všech klinických studiích byly nejčastěji pozorovanými nežádoucími účinky reakce v místě vpichu injekce, které byly hlášeny u většiny pacientů užívajících GA. V kontrolovaných studiích byl podíl pacientů, kteří zazna-menali tyto reakce, nejméně jedenkrát vyšší u pacientů léčených GA (70 %) oproti pacientům užívajícím placebo (37 %). Nejobvyklej-šími reakcemi v místě vpichu, které byly hlášeny častěji u pacientů léčených GA v porovnání s pacienty užívajícími placebo, byly ery-tém, bolest, zatvrdnutí, pruritus, otok, zánět a přecitlivělost. U 2 % nemocných je udáván výskyt lipoatrofie.
Reakce spojená alespoň s jedním nebo s několika z následujících příznaků byla popsána jako bezprostřední postinjekční reakce: va-zodilatace, tlak na hrudi, dušnost, palpitace nebo tachykardie. Tato reakce se může objevit během několika minut po podání injekce přípravku. Alespoň jedna složka bezprostřední postinjekční reakce byla hlášena nejméně jednou u 31 % pacientů užívajících GA oproti 13 % pacientů užívajících placebo.
Podávání GA v dávce 40 mg jednou denně i 3krát týdně má podobný bezpečnostní profil jako 20 mg GA. Ve studii GALA udávali pacienti s aktivní léčbou zejména lokální postinjekční reakce (35,2 % v případě aktivní léčby vs. 5 % při podávání placeba), naprostá většina těchto reakcí byla ale velmi lehké intenzity. Tyto reakce se nejčastěji projevovaly zarudnutím, svěděním nebo bolestí. Frekvence těchto příznaků byla podobná jako při podávání placeba. Výskyt závažných nežádoucích účinků, které by vedly k přerušení léčby, byl pozorován ve skupině s léčbou GA u 3,1 % nemocných a ve skupině s placebem u 1,3 % pacientů [18].
GLACIER (GLatiramer Acetate low frequenCy safety and patIent ExpeRience) byla otevř![Graf 3 Výskyt postinjekčních lokálních reakcí při aplikaci glatiramer acetátu ve studii GLACIER; podle [19] – Wolinski, et al., 2014. Při aplikaci GA v dávce 40 mg 3krát týdně s.c. došlo ke snížení frekvence výskytu postinjekčních lokálních reakcí o 50 % oproti aplikaci GA v dávce 20 mg denně s.c. CI – interval spolehlivosti; GA – glatiramer acetát; LSR – lokální postinjekční reakce; RR – relativní riziko; SD – směrodatná odchylka](https://www.remedia.cz/photo-a-30055---.jpg) ená „head to head” studie fáze III, která se zabývala srovnáním nežádoucích účinků při podávání GA 20 mg denně a 40 mg 3krát týdně. Frekvence a závažnost lokálních reakcí byly při podávání dávky 40 mg během roku nižší o 50 % (35,3 vs. 70,4; relativní riziko, risk ratio – RR: 0,50, confidence interval, interval spolehlivosti – CI: 0,34–0,74; p = 0,0006), graf 3; 60% pokles průměrného počtu ročních celkových nežádoucích reakcí byl zřejmý při podávání GA 3krát týdně v dávce 40 mg ve srovnání s GA podávaným denně v dávce 20 mg (0,88 vs. 2,2; RR: 0,40; CI: 0,323–0,73; p = 0,0021). Aplikace vyšší dávky GA s nižší frekvencí podání byla pro pacienty trvale snadnější a příjemnější [19].
ená „head to head” studie fáze III, která se zabývala srovnáním nežádoucích účinků při podávání GA 20 mg denně a 40 mg 3krát týdně. Frekvence a závažnost lokálních reakcí byly při podávání dávky 40 mg během roku nižší o 50 % (35,3 vs. 70,4; relativní riziko, risk ratio – RR: 0,50, confidence interval, interval spolehlivosti – CI: 0,34–0,74; p = 0,0006), graf 3; 60% pokles průměrného počtu ročních celkových nežádoucích reakcí byl zřejmý při podávání GA 3krát týdně v dávce 40 mg ve srovnání s GA podávaným denně v dávce 20 mg (0,88 vs. 2,2; RR: 0,40; CI: 0,323–0,73; p = 0,0021). Aplikace vyšší dávky GA s nižší frekvencí podání byla pro pacienty trvale snadnější a příjemnější [19].
Lékové interakce
Interakce GA s jinými léčivými přípravky nebyly hodnoceny. Údaje o interakcích s interferonem beta nejsou k dispozici. Zvýšený výskyt reakcí v místě vpichu byl pozorován u pacientů léčených GA, kteří jsou souběžně léčeni kortikosteroidy. Studie in vitro naznačují, že GA je v krvi vysoce vázán na plazmatické proteiny, není však z vazby vytěsňován ani z vazby nevytěsňuje fenytoin nebo carbamazepin. Protože však existuje teoretická možnost, že GA může ovlivňovat distribuci látek, které se vážou na plazmatické bílkoviny, musí být souběžné použití těchto léčiv pečlivě monitorováno.
Těhotenství a kojení
Údaje o podávání GA u těhotných žen nejsou k dispozici nebo je jejich množství omezené. Studie na zvířatech nejsou pro možné účinky na těhotenství, embryofetální vývoj, porod a postnatální vývoj dostačující. Potenciální riziko pro člověka není známo. Přípravek nesmí být podáván během těhotenství. Při podávání tohoto přípravku musí být zváženo použití kontraceptiv. Z hlediska rizika léčby patří GA do kategorie B dle FDA.
Údaje týkající se vylučování GA, jeho metabolitů nebo protilátek do mateřského mléka nejsou dostupné. Při podávání GA kojícím matkám se musí postupovat opatrně. Musí být zvážen prospěch pro matku vůči relativnímu riziku pro dítě [19].
Ovlivnění pozornosti
Nebyly provedeny žádné studie sledující účinky GA na schopnost pacientů řídit a obsluhovat stroje.
Dávkovaní
Glatiramer acetát je aplikován jako injekční roztok v předplněných stříkačkách s bílým pístem pro subkutánní aplikaci dávky 20 mg. Injekce jsou podávány každý den. Předplněné stříkačky s modrým pístem jsou určeny pro subkutánní aplikaci dávky 40 mg, která je podávána 3krát týdně s odstupem minimálně 48 hodin. Nejsou k dispozici žádné klinické studie o léčbě u mladistvých ve věku do 12 let a u starší populace.
Stabilita a kompatibilita
Injekční stříkačky je nutno uchovávat v chladničce (2–8 °C) uzavřené v krabičce, aby byl přípravek chráněn před světlem. Jestliže injekční stříkačky nemohou být uchovávány v chladničce, mohou být uchovávány při pokojové teplotě (15–25 °C) po dobu až jednoho měsíce. Jestliže stříkačky s přípravkem nebyly použity a jsou ještě v původním obalu, musí být po této jednoměsíční lhůtě vráceny k uchovávání do chladničky (2–8 °C).
Závěr
O strategii léčby GA rozhoduje specialista v centrech pro RS. Nová formule GA přináší zvýšené pohodlí pro pacienta i ošetřující personál. Léčba bude přínosná pro nově diagnostikované nemocné anebo pro ty, kteří netolerují jiné varianty léčiv první volby.
Seznam použité literatury
- [1] Arnon R. The development of Cop 1 (Copaxone), an innovative drug for the treatment of multiple sclerosis: personal reflections. Immunol Lett 1996; 50: 1–15.
- [2] Schrempf W, Ziemssen T. Glatiramer acetate: mechanisms of action in multiple sclerosis. Autoimmun Rev 2007; 6: 469–475.
- [3] Aharoni R, Kayhan B, Eilam R, et al. Glatiramer acetate specific T cells in the brain express T helper 2/3 cytokines and brain derived neurotrophic factors in situ. Proc Natl Acad Sci USA 2003; 100 (2 Suppl): 14157–14162.
- [4] Johnson KP, Brooks BR, Cohen JA, et al. Copolymer 1 reduces relapse rate and improves disability in relapsing remitting multiple sclerosis: results of a phase III multi-center, double blind placebo controlled trial. The Copolymer 1 Multiple Sclerosis Study Group. Neurology 1995; 45: 1268–1276.
- [5] Johnson KP, Brooks BR, Ford CC, et al. Glatiramer acetate (Copaxone): comparison of continuous versus delayed therapy in a six year organized multiple sclerosis trial. Mult Scler 2003; 9: 585–591.
- [6] Johnson KP, Ford CC, Lisak RP, Wolinsky JS. Glatiramer acetate (Copaxone): neurologic consequence of delaying glatiramer acetate therapy for multiple sclerosis: 8 year data. Acta Neurol Scand 2005; 111: 42–47.
- [7] Ford CC, Johnson KP, Lisak RP, et al. A prospective open label study of glatiramer acetate: over a decade of continuous use in multiple sclerosis patients. Mult Scler 2006; 12: 309–320.
- [8] Ford C, Goodman AD, Johnson K, et al. Continuous long term immunomodulatory therapy in relapsing multiple sclerosis: results from the 15 year analysis of the US prospective open label study of glatiramer acetate. Mult Scler 2010; 16: 342–350.
- [9] Comi G, Filippi M, Wolinsky JS, et al. European/Canadian multicenter, double blind, randomized, placebo controlled study of the effects of glatiramer acetate on magnetic resonance imaging measured disease activity and burden in patients with relapsing multiple sclerosis. Ann Neurol 2001; 49: 290–297.
- [10] Rovaris M, Comi G, Rocca MA, et al. Long term follow up of patients treated with glatiramer acetate: a multicentre, multinational extension of the European/Canadian double blind, placebo controlled, MRI monitored trial. Mult Scler 2007; 13: 502–508.
- [11] Comi G, Martinelli V, Rodegher M, et al. Effect of glatiramer acetate on conversion to clinically definite multiple sclerosis in patients with clinically isolated syndrome (PreCISe study): a randomised, double blind, placebo controlled trial. Lancet 2009; 374: 1503–1511.
- [12] Mikol DD, Barkhof F, Chang P, et al. Comparison of subcutaneous interferon beta 1a with glatiramer acetate in patients with relapsing multiple sclerosis (the REbif vs Glatiramer Acetate in Relapsing MS Disease [REGARD] study): a multicentre, randomised, parallel, open label trial. Lancet Neurol 2008; 7: 903–914.
- [13] O’Connor P, Filippi M, Arnason B, et al. 250 microg or 500 microg interferon beta 1b versus 20 mg glatiramer acetate in relapsing remitting multiple sclerosis: a prospective, randomised, multicentre study. Lancet Neurol 2009; 8: 889–897.
- [14] Cadavid D, Wolansky LJ, Skurnick J, et al. Efficacy of treatment of MS with IFNβ 1b or glatiramer acetate by monthly brain MRI in the BECOME study. Neurology 2009; 72: 1976–1983.
- [15] Cohen JA, Rovaris M, Goodman AD, et al. Randomized, double blind, dose comparison study of glatiramer acetate in relapsing remitting MS. Neurology 2007; 68: 939–944.
- [16] Comi G, Cohen JA, Arnold DL, et al. Phase III dose comparison study of glatiramer acetate for multiple sclerosis. Ann Neurol 2011; 69: 75–82.
- [17] Khan O, Rieckmann P, Boyko A, et al. Three times weekly glatiramer acetate in relapsing remitting multiple sclerosis. Ann Neurol 2013; 73: 705–713.
- [18] Caporro M, Disanto G, Gobbi C, Zecca C. Two decades of subcutaneous glatiramer acetate injection: current role of the standard dose, and new high dose low frequency glatiramer acetate in relapsing remitting multiple sclerosis treatment. Patient Prefer Adherence 2014; 8; 1123–1134.
- [19] Wolinsky JS, Dietrich DW, Borresen TE, et al. GLACIER: open label, randomized safety/tolerability study of glatiramer acetate 40 mg/mL three times weekly versus 20 mg/mL daily in RRMS. ECTRIMS, 2014 Free Communication 3 (FC3.1 FC3.5) 12. 9. 2014.
- [20] Fragoso YD. Glatiramer acetate to treat multiple sclerosis during pregnancy and lactation: a safety evaluation. Expert Opin Drug Saf 2014; 13: 1743–1748.
- [21] Bornstein MB, Miller A, Slagle S, et al. A pilot trial of Cop 1 in exacerbating remitting multiple sclerosis. N Engl J Med 1987; 317: 408–414.
- [22] Johnson KP, Brooks BR, Cohen JA, et al. Extended use of glatiramer acetate (Copaxone) is well tolerated and maintains its clinical effect on multiple sclerosis relapse rate and degree of disability. Copolymer 1 Multiple Sclerosis Study Group. Neurology 1998; 50: 701–708.
- [23] Wolinsky JS, Comi G, Filippi M, et al. Copaxone’s effect on MRI monitored disease in relapsing MS is reproducible and sustained. Neurology 2002; 59: 1284–1286.
- [24] Wiese MD, Suppiah V, O’Doherty C. Expert Opin Drug Metab Toxicol 2014; 10: 1145–1159.
- [25] Hestvik ALK. The Double Edged Sword of Autoimmunity: Lessons from Multiple Sclerosis. Toxins 2010; 2: 856–877.