Hyrimoz – nový biosimilární lék v terapii revmatoidní artritidy
Souhrn:
Milota T, Horváth R. Hyrimoz – nový biosimilární lék v terapii revmatoidní artritidy. Remedia 2019; 29: 175–179.
Objev inhibitorů tumor nekrotizujícího faktoru alfa významně změnil léčbu celého spektra imunitně zprostředkovaných zánětlivých onemocnění včetně revmatoidní artritidy. Biologická léčba se ale současně stala významnou finanční zátěží pro plátce zdravotní péče. Zásadní okamžik tak znamenalo zavedení biosimilárních léčiv do klinické praxe, jejichž hlavním cílem je především snížení nákladů na biologickou léčbu a s tím související zvýšení její dostupnosti pro pacienty. Jednou z nejrozšířenějších a nejpoužívanějších molekul v revmatologických indikacích je adalimumab. V současné době jsou v České republice dostupné čtyři biosimilární léčivé přípravky z této skupiny. Jedním z nich je i Hyrimoz®, jehož účinnost a bezpečnost ve srovnání s originální molekulou byla ověřena nejen u pacientů s plakovou formou psoriázy (studie ADACCESS), ale také u skupiny pacientů s revmatoidní artritidou (studie ADMYRA).
Summary:
Milota T, Horvath R. Hyrimoz – new biosimilars in treatment of rheumatoid arthritis. Remedia 2019; 29: 175–179.
Since their discovery, TNF alpha inhibitors significantly changed the therapeutic approach to immune‑mediated inflammatory diseases, including rheumatoid arthritis. On the other hand, biological therapy became very expensive with pronounced impact on the budget of insurance companies. Therefore, the introduction of biosimilars into clinical practice has been further another crucial step. Their main goal is to reduce treatment expenses and improve the availability of the biologics. One of the most widespread molecule is adalimumab. Currently, 4 biosimilars from this group are available in the Czech Republic. The efficacy and safety of Hyrimoz® has been proven in patients with plaque type of psoriasis (ADACCESS trial) as well as in the group of patients with rheumatoid arthritis (ADMYRA trial).
Key words: Hyrimoz, adalimumab, TNFα inhibitors, biosimilars, rheumatoid arthritis
Úvod
Objev inhibitorů tumor nekrotizujícího
faktoru alfa (TNFα) a jejich zavedení do běžné
klinické praxe se staly významným okamžikem v léčbě
imunitně zprostředkovaných zánětlivých nemocí (immune mediated
inflammatory diseases, IMIDs), jako jsou idiopatické střevní
záněty (inflammatory bowel disease, IBD), psoriáza či revmatická
onemocnění. Jejich plošnému rozšíření však brání především
cena a omezené finanční zdroje plátců zdravotní péče,
které jsou v kontrastu s neustále narůstající potřebou
pacienty léčit. Finanční náročnost navíc ovlivňuje i fakt,
že terapie biologickými chorobu modifikujícími léky (biologic
disease modifying antirheumatic drugs, bDMARDs) je dlouhodobá.
Při jejím přerušení či úplném ukončení dochází u většiny
pacientů k opětovnému vzplanutí choroby [1].
Všeobecná zdravotní pojišťovna (VZP) v roce 2016 vynaložila
přes 700 milionů korun na léčbu více než 61 000 pacientů
s diagnózou revmatoidní artritidy (RA). Ve srovnání
s rokem 2013 se jednalo o 4,0% nárůst počtu pacientů,
přičemž současné zvýšení finančních nákladů představovalo
více než 30 %. Největší podíl na jejich růstu měla
především biologická léčba, která tvořila více než polovinu
všech výdajů. Na druhou stranu je tento fakt v kontrastu
s dostupností biologik, která jsou dle statistických údajů
k dispozici pouze pro zhruba 3 % pacientů [2]
(tab. 1). Jedná se
především o skupinu nemocných s vysokou, eventuálně
střední aktivitou onemocnění, u nichž selhala nebo nebyla
tolerována předchozí terapie konvenčními chorobu modifikujícími
léčivy (conventional synthetic disease modifying antirheumatic
drugs, csDMARDs).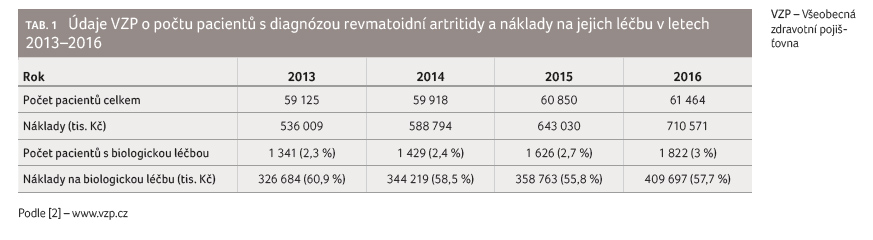
Další zlomový okamžik nastal se
zavedením biosimilárních léčiv, tzv. biosimilars. První
farmakoekonomické studie naznačovaly, že jejich použití by mohlo
vést ke snížení ceny o 25–30 %, a tudíž
ke zvýšení dostupnosti a zmírnění finanční
zátěže plátců zdravotní péče [3].
Tyto předpoklady byly potvrzeny i v reálné praxi [4,5].
Biosimilars definuje Evropská léková agentura (European Medicines
Agency, EMA) jako biologické léčivo, které je vysoce podobné
originálnímu přípravku ve všech sledovaných aspektech,
jimiž jsou fyzikálně chemické vlastnosti, farmakodynamika
a farmakokinetika, imunogenicita a v neposlední řadě
bezpečnost a účinnost. Ty jsou na klinické úrovni
ověřeny pouze v několika málo hodnoceních fáze III. Pokud
jsou sledované parametry biosimilárního léčiva srovnatelné
s originálním referenčním léčivým přípravkem, je
schváleno jeho použití u všech indikací původní molekuly.
Na rozdíl od originálního léčiva tedy nejsou
vyžadovány studie pro všechny diagnózy. Dodržení všech nutných
podmínek k registraci biosimilárního přípravku je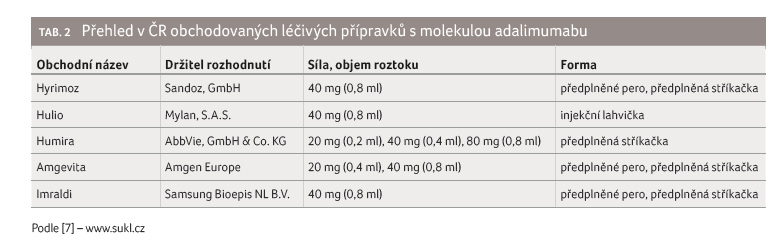 striktně
vyžadováno mezinárodními (EMA, Food and Drug Administration –
FDA) i národními regulačními autoritami (Státní ústav pro
kontrolu léčiv, SÚKL), tudíž se jedná o vysoce regulovanou
oblast [6,7]. Biosimilární léčivo může
být schváleno a registrováno až po vypršení platnosti
ochranného patentu, k němuž v případě originálního
adalimumabu, registrovaného pod obchodním názvem Humira
(AbbVie GmbH & Co. KG, Německo), došlo 16. října 2018.
To otevřelo cestu celé řadě nových biosimilárních léčiv
včetně biosimilární molekuly adalimumabu GP2017 (tab. 2).
striktně
vyžadováno mezinárodními (EMA, Food and Drug Administration –
FDA) i národními regulačními autoritami (Státní ústav pro
kontrolu léčiv, SÚKL), tudíž se jedná o vysoce regulovanou
oblast [6,7]. Biosimilární léčivo může
být schváleno a registrováno až po vypršení platnosti
ochranného patentu, k němuž v případě originálního
adalimumabu, registrovaného pod obchodním názvem Humira
(AbbVie GmbH & Co. KG, Německo), došlo 16. října 2018.
To otevřelo cestu celé řadě nových biosimilárních léčiv
včetně biosimilární molekuly adalimumabu GP2017 (tab. 2).
Biosimilární adalimumab GP2017 − Hyrimoz®
Jedním z nových biosimilárních léčiv ze skupiny adalimumabu je molekula GP2017, která úspěšně prošla všemi požadovanými preklinickými a klinickými zkouškami. V první preklinické fázi byla potvrzena shoda ve fyzikálně chemických vlastnostech molekuly GP2017 ve srovnání s referenčním originálním přípravkem. Následně byla prokázána shoda ve farmakodynamice a farmakokinetice na myších modelech a u zdravých dobrovolníků [8,9]. Zásadním krokem k úspěšné registraci přípravku však bylo prokázání účinnosti a bezpečnosti v klinických hodnoceních na úrovni fáze III. Jako první byla srovnatelná bezpečnost a účinnost s originálním adalimumabem potvrzená ve studii ADACCESS, dvojitě zaslepeném randomizovaném klinickém hodnocení pacientů s ložiskovou psoriázou [10]. Zásadní pro schválení indikace GP2017 ve skupině revmatologických pacientů byly výsledky studie ADMYRA.
Studie ADMYRA
V randomizované, dvojitě
zaslepené, multicentrické studii ADMYRA byla hodnocena účinnost,
bezpečnost a imunogenicita biosimilární molekuly GP2017
ve srovnání s originálem, a to u pacientů
trpících středně až vysoce aktivní revmatoidní artritidou,
kteří nedostatečně odpověděli na terapii csDMARD
zahrnující metotrexát. Primárním cílem studie bylo prokázání
ekvivalentní účinnosti GP2017 ve srovnání s originálním
referenčním adalimumabem (ref ADA) s poklesem parametru
aktivity onemocnění DAS28 CRP (Disease Activity Score 28
for Rheumatoid Arthritis with C reactive Protein) ve 12. týdnu
terapie (primární endpoint). Mezi ostatními posuzovanými
parametry pak b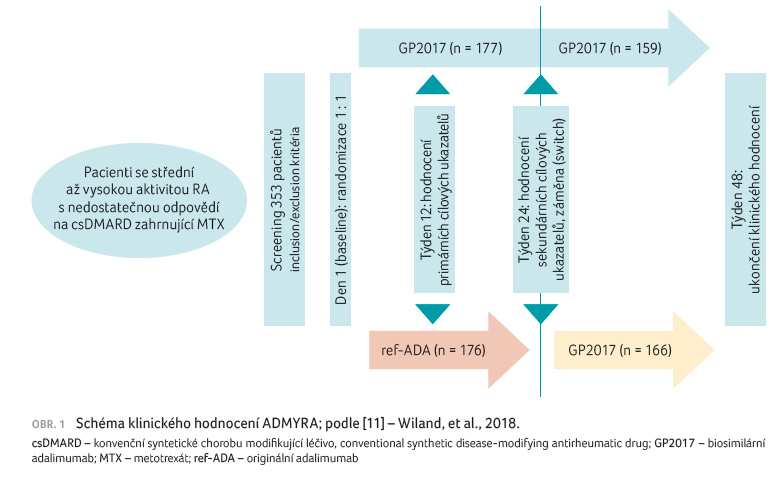 ylo sledování a porovnání odpovědi dle
ACR 20/50/70 (20%/50%/70% zlepšení dle kritérií American
College of Rheumatology), úroveň kvality života, změna DAS28 CRP
ve 24. týdnu a u pacientů po záměně
ref ADA za GP2017 ve 48. týdnu. Vedle parametrů
účinnosti byla hodnocena také bezpečnost, tolerabilita
a imunogenicita (obr. 1).
ylo sledování a porovnání odpovědi dle
ACR 20/50/70 (20%/50%/70% zlepšení dle kritérií American
College of Rheumatology), úroveň kvality života, změna DAS28 CRP
ve 24. týdnu a u pacientů po záměně
ref ADA za GP2017 ve 48. týdnu. Vedle parametrů
účinnosti byla hodnocena také bezpečnost, tolerabilita
a imunogenicita (obr. 1).
Celkem bylo do studie zařazeno
353 pacientů, kteří byli rozděleni do dvou ramen v poměru
1 : 1. Charakteristiky obou skupin ve sledovaných
ukazatelích (zastoupení mužů a žen, průměrný věk
pacientů, průměrná hodnota BMI, délka trvání onemocnění
a jeho aktivita, předchozí léčba) se signifikantně nelišily
(tab. 3). V obou
ramenech klinického hodnocení byla subkutánně aplikována dávka
40 mg ref ADA, nebo GP2017. Ve 12. týdnu klinického
hodnocení došlo u obou léčených skupin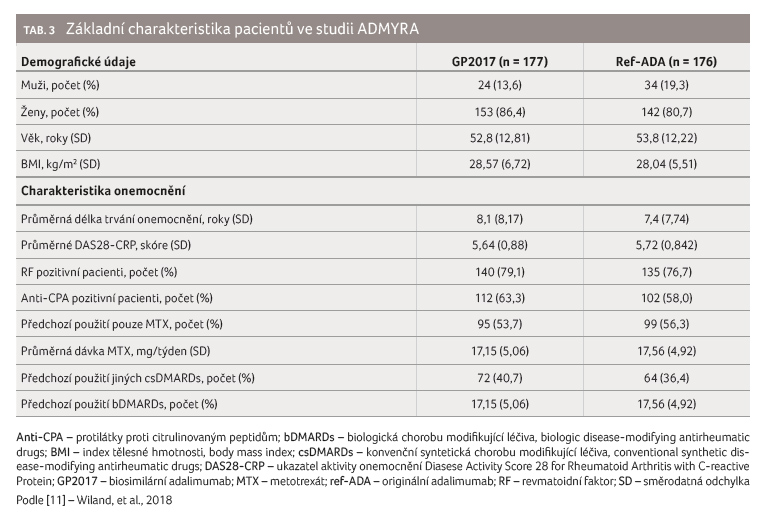 k signifikantnímu
a srovnatelnému poklesu DAS28 CRP z 5,64 (GP2017)
a 5,72 (ref ADA) na 3,39, respektive 3,36. Během
dalších 24 týdnů klinického hodnocení pak tento pokles
pokračoval (graf 1).
Obdobný trend byl zaznamenán při hodnocení míry odpovědi
dle ACR 20/50/70. Parametru ACR 20 bylo dosaženo
u 87,4 % pacientů léčených přípravkem GP2017
a u 94,2 % pacientů ve skupině s léčbou
ref ADA ve 24. týdnu hodnocení, ACR 70 pak
u 37,8 %, respektive 38,4 % pacientů (graf 2A−C). Pokles aktivity onemocnění byl v obou
skupinách doprovázen také signifikantním zlepšením kvality
života. Ke změně ve sledovaných ukazatelích nedošlo
ani po záměně (switch) ref ADA za GP2017, která
byla provedena u 166 pacientů ve 24. týdnu. Tato
fáze studie trvala do jejího ukončení (48. týden).
k signifikantnímu
a srovnatelnému poklesu DAS28 CRP z 5,64 (GP2017)
a 5,72 (ref ADA) na 3,39, respektive 3,36. Během
dalších 24 týdnů klinického hodnocení pak tento pokles
pokračoval (graf 1).
Obdobný trend byl zaznamenán při hodnocení míry odpovědi
dle ACR 20/50/70. Parametru ACR 20 bylo dosaženo
u 87,4 % pacientů léčených přípravkem GP2017
a u 94,2 % pacientů ve skupině s léčbou
ref ADA ve 24. týdnu hodnocení, ACR 70 pak
u 37,8 %, respektive 38,4 % pacientů (graf 2A−C). Pokles aktivity onemocnění byl v obou
skupinách doprovázen také signifikantním zlepšením kvality
života. Ke změně ve sledovaných ukazatelích nedošlo
ani po záměně (switch) ref ADA za GP2017, která
byla provedena u 166 pacientů ve 24. týdnu. Tato
fáze studie trvala do jejího ukončení (48. týden).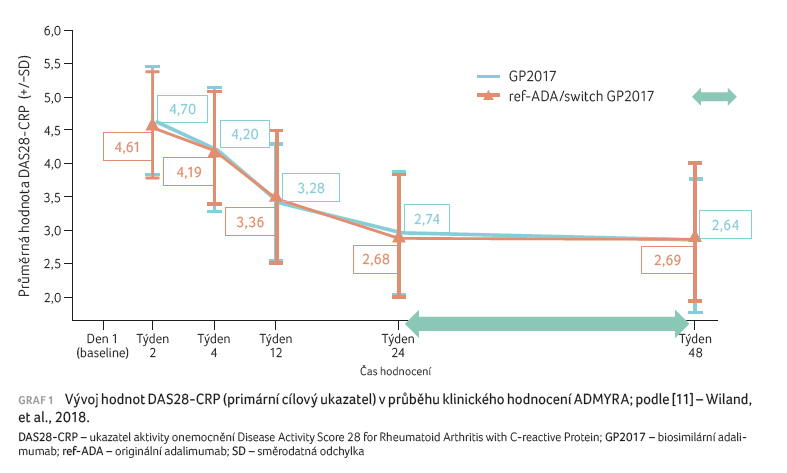
Z pohledu bezpečnosti
a tolerability byl v obou skupinách srovnatelný i výskyt
nežádoucích reakcí. Ty byly pozorovány u více než 60 %
pacientů v obou skupinách. Většina z těchto reakcí
byla hodnocena jako mírné nebo středně těžké intenzity,
závažné nežádoucí účinky byly pozorovány u 2,8 %
(GP2017), respektive 2,3 % (ref ADA) pacientů. Nejčastěji
se jednalo o infekce, které byly zaznamenány u 35,6 %
pacientů ve skupině s GP2017, respektive u 36,9 %
s ref ADA. Dominovaly infekty horních cest dýchacích.
Dále pacienti v obou skupinách udávali gastrointestinální
obtíže (11,9 % vs. 9,7 %), postižení muskuloskeletálního
systému (11,9 % vs. 8 %), lokální reakce v místě
aplikace (8,5 % vs. 8 %), postižení nervového systému (7,3 %
vs. 6,8 %) a kůže a podkoží (6,8 % vs. 5,1 %).
Pro nežádoucí účinky v obou skupinách terapii ukončili
dva pacienti. Z pohledu imunogenicity byly protilátky proti
GP2017 detekovány po 24. týdnu od zahájení studie
u 21,8 % pacientů léčených GP2017, protilátky proti
ref ADA pak ve 24,4 %. U obou skupin se ve více
než 70 % případů jednalo o protilátky neutralizující
[11].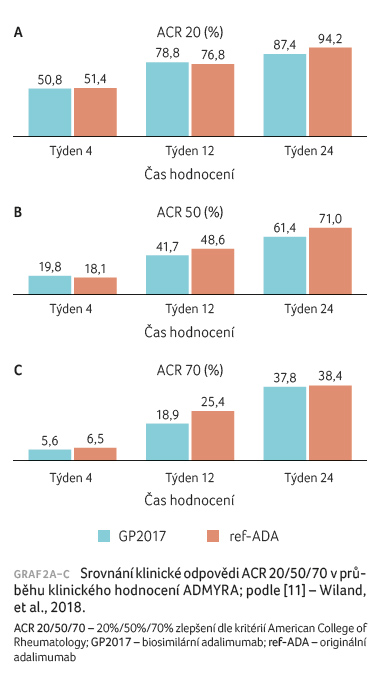
Závěr
Přípravek GP2017 prokázal srovnatelnou účinnost, bezpečnost a imunogenicitu s originálním referenčním adalimumabem u pacientů se střední až vysokou aktivitou onemocnění, u kterých selhala terapie csDMARDs. Na základě výsledků studie ADACCESS a ADMYRA tak byla schválena registrace biosimilárního adalimumabu GP2017, který je v České republice dostupný pod obchodním názvem Hyrimoz (Sandoz GmbH, Německo) ve všech indikacích originálního adalimumabu – revmatoidní artritida, juvenilní idiopatická artritida (polyartikulární a entezopatická forma), axiální spondylartritida, psoriáza a psoriatická artritida, hydradenitis suppurativa, Crohnova choroba, ulcerózní kolitida a uveitida. Hyrimoz je v současné době dostupný ve 40mg balení ve formě předplněného pera nebo injekční stříkačky. Lze ho tedy použít pouze u pacientů s tělesnou hmotností vyšší než 30 kg. Studie ADMYRA také potvrdila bezpečnost a efektivitu jednostranné záměny (switch) originálního za biosimilární přípravek. Vedle přípravku Hyrimoz je v současné době registrováno dalších několik biosmiliárních přípravků ze skupiny adalimumabu (tab. 2). Do budoucna lze tedy očekávat významné snížení ceny a zvýšení dostupnosti léčby adalimumabem, a to nejen u pacientů s revmatoidní artritidou, ale i v dalších schválených indikacích.
Seznam použité literatury
- [1] Mangoni AA, Okaily FA, Almoallim H, et al. Relapse rates after elective discontinuation of anti‑TNF therapy in rheumatoid arthritis: a meta‑analysis and review of literature. BMC Rheumatol 2019; 3: doi.org/10.1186/s41927‑019‑0058‑7.
- [2] www.vzp.cz. Všeobecná zdravotní pojišťovna.
- [3] Simoens, S, Jacobs I, Popovian R, et al. Assessing the Value of Biosimilars: A Review of the Role of Budget Impact Analysis. Pharmacoeconomics 2017; 35: 1047−1062.
- [4] Dorner T, Strand V, Cornes P, et al. The changing landscape of biosimilars in rheumatology. Ann Rheum Dis 2016; 75: 974−982.
- [5] Manova M, Savova A, Vasileva M, et al. Comparative Price Analysis of Biological Products for Treatment of Rheumatoid Arthritis. Front Pharmacol 2018; 9: doi: 10.3389/fphar.2018.01070.
- [6] www.ema.europa.eu. European Medicines Agency.
- [7] www.sukl.cz. Státní ústav pro kontrolu léčiv.
- [8] Kronthaler U, Fritsch C, Hainzl O, et al. Comparative functional and pharmacological characterization of Sandoz proposed biosimilar adalimumab (GP2017): rationale for extrapolation across indications. Expert Opin Biol Ther 2018; 18: 921−930.
- [9] von Richter O, Lemke L, Haliduola H, et al. GP2017, an adalimumab biosimilar: pharmacokinetic similarity to its reference medicine and pharmacokinetics comparison of different administration methods. Expert Opin Biol Ther 2019: doi: 10.1080/14712598.2019.1571580.
- [10] Blauvelt A, Lacour JP, Fowler JF Jr, et al. Phase III randomized study of the proposed adalimumab biosimilar GP2017 in psoriasis: impact of multiple switches. Br J Dermatol 2018; 179: 623−631.
- [11] Wiland P, Jeka S, Dokoupilova E, et al. A Randomized, Double‑Blind, Parallel‑Group, Multicenter Study to Compare the Efficacy, Safety and Immunogenicity of a Proposed Adalimumab Biosimilar (GP2017) with Reference Adalimumab in Patients with Moderate‑to‑Severe Active Rheumatoid Arthritis, in ACR/ARHP Annual Meeting 2018; Abstr 1936.