Inzulin detemir
Inzulin detemir je dlouhodobě působící analog inzulinu vytvořený rekombinantní technologií. Modifikace molekuly v případě inzulinu působí změnu fyzikálně-chemických vlastností, což podmiňuje plynulé a zpomalené uvolňování inzulinu detemiru do cirkulace a umožňuje jeho vazbu na albumin, a to přímo v místě aplikace v podkoží, v cirkulaci i v intersticiální tekutině. Tato vazba na molekuly albuminu působí snížení intraindividuální variability účinku inzulinu detemiru, což bylo potvrzeno ve farmakodynamických studiích.
Podání inzulinu detemiru osobám s diabetem 1. i 2. typu dosahuje ve srovnání s inzulinem NPH výraznějšího snížení ranních glykémií nalačno a významného snížení četnosti nočních hypoglykémií. V celé řadě studií je dále shodně potvrzen příznivější vliv inzulinu detemiru na hmotnost nemocných s diabetem 1. i 2. typu ve srovnání s inzulinem NPH či s inzulinem glarginem.
Farmakologická skupina
Inzulin detemir je analog humánního inzulinu vyráběný rekombinantní DNA technologií za použití Saccharomyces cerevisiae. ATC kód: A10AE04. Je řazen mezi antidiabetika, konkrétně mezi inzuliny a analoga dlouze působící.
Chemické a fyzikální vlastnosti
Inzulin detemir je dlouhodobě působící analog inzulinu, u něhož je modifikována molekula humánního inzulinu odstraněním aminokyseliny threoninu z pozice B30 a připojením kyseliny myristové na lysin, který je v pozici B29. Připojení 14uhlíkatého řetězce kyseliny myristové na každou molekulu inzulinu mění fyzikálně-chemické vlastnosti inzulinu detemiru a umožňuje jeho vazbu na albumin, a to přímo v místě aplikace v podkoží, v cirkulaci i v intersticiální tekutině. Chemicky je inzulin detemir LysB29 (Ne-tetradekanoyl)des(B30) humánní inzulin (obr. 1). 
 Sumární chemický vzorec: C267H402N64O76S6
Sumární chemický vzorec: C267H402N64O76S6
Molekulová hmotnost: 5916,9
Inzulin detemir je bílý krystalický prášek, rozpustný ve vodě.
Farmakologické vlastnosti
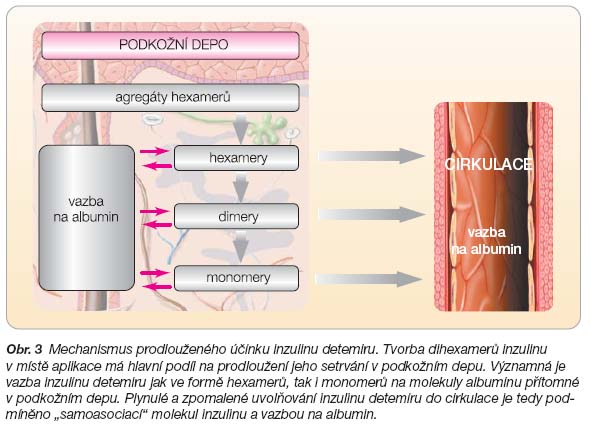
Přítomnost kyseliny myristové na molekule inzulinu detemiru vytváří hydrofobní oblast na jejím povrchu, a tím ovlivňuje spontánní agregaci molekul inzulinu a afinitu k albuminu. Data z farmakologických studií ukazují, že inzulin detemir je po aplikaci do podkoží přítomen ve formě hexamerů, ale jakmile dojde k náhradě adjuvancií 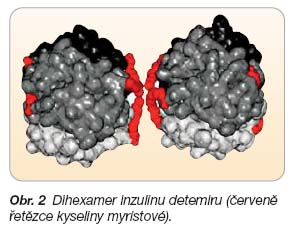 (fenol a kresol) za fyziologické elektrolyty, dochází k tvorbě dihexamerů prostřednictvím hydrofobních oblastí vytvořených na pólech hexamerů právě molekulami kyseliny myristové (obr. 2) [1]. Vytvoření dihexamerů se pravděpodobně významně podílí na opoždění disociace na monomery. Data z výzkumů, které studovaly rychlost mizení radioaktivně značeného inzulinu z místa aplikace, svědčí o skutečnosti, že agregace inzulinu v místě aplikace má rozhodující podíl pro prodloužení jeho setrvání v podkožním depu. Dále je ovšem významná i vazba inzulinu detemiru jak ve formě hexamerů, tak i monomerů na molekuly albuminu přítomné v podkožním depu. Plynulé a zpomalené uvolňování inzulinu detemiru do cirkulace je podmíněno „samoasociací“ molekul tohoto inzulinu a vazbou na albumin (obr. 3).
(fenol a kresol) za fyziologické elektrolyty, dochází k tvorbě dihexamerů prostřednictvím hydrofobních oblastí vytvořených na pólech hexamerů právě molekulami kyseliny myristové (obr. 2) [1]. Vytvoření dihexamerů se pravděpodobně významně podílí na opoždění disociace na monomery. Data z výzkumů, které studovaly rychlost mizení radioaktivně značeného inzulinu z místa aplikace, svědčí o skutečnosti, že agregace inzulinu v místě aplikace má rozhodující podíl pro prodloužení jeho setrvání v podkožním depu. Dále je ovšem významná i vazba inzulinu detemiru jak ve formě hexamerů, tak i monomerů na molekuly albuminu přítomné v podkožním depu. Plynulé a zpomalené uvolňování inzulinu detemiru do cirkulace je podmíněno „samoasociací“ molekul tohoto inzulinu a vazbou na albumin (obr. 3).
 Po přesunu do cirkulace je inzulin detemir vázán v 98 % na albumin, ale tato vazba má jen poměrně malý význam pro prodloužení účinku inzulinu ve srovnání s vazbou na albumin v podkožním rezervoáru, protože v cirkulaci je detemir ve formě monomerů, a proto snadno difunduje cévní stěnou do
Po přesunu do cirkulace je inzulin detemir vázán v 98 % na albumin, ale tato vazba má jen poměrně malý význam pro prodloužení účinku inzulinu ve srovnání s vazbou na albumin v podkožním rezervoáru, protože v cirkulaci je detemir ve formě monomerů, a proto snadno difunduje cévní stěnou do 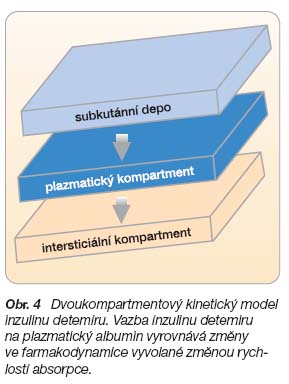 intersticiální tekutiny. Nicméně vazba inzulinu detemiru na sérový albumin přináší významný „pufrovací“ efekt, který omezuje farmakodynamickou variabilitu [2]. Změny v průtoku krve místem vpichu sice ovlivní přísun inzulinu detemiru do cirkulace, ale vzhledem ke skutečnosti, že se téměř všechen inzulin v cirkulaci naváže na albumin, jsou výsledné kvantitativní změny volné frakce inzulinu detemiru, která určuje rychlost vazby na inzulinový receptor, minimální. Rychlost přísunu inzulinu detemiru k receptoru pro inzulin je trvale vyrovnávána prostřednictvím vazby na sérový albumin. Fyzikálně-chemické vlastnosti inzulinu detemiru a z nich vyplývající vyrovnaná kinetika přesunu mezi jednotlivými kompartmenty přispívají k omezené variabilitě hypoglykemizujícího účinku inzulinu v průběhu času a mezi jednotlivými aplikacemi (obr. 4).
intersticiální tekutiny. Nicméně vazba inzulinu detemiru na sérový albumin přináší významný „pufrovací“ efekt, který omezuje farmakodynamickou variabilitu [2]. Změny v průtoku krve místem vpichu sice ovlivní přísun inzulinu detemiru do cirkulace, ale vzhledem ke skutečnosti, že se téměř všechen inzulin v cirkulaci naváže na albumin, jsou výsledné kvantitativní změny volné frakce inzulinu detemiru, která určuje rychlost vazby na inzulinový receptor, minimální. Rychlost přísunu inzulinu detemiru k receptoru pro inzulin je trvale vyrovnávána prostřednictvím vazby na sérový albumin. Fyzikálně-chemické vlastnosti inzulinu detemiru a z nich vyplývající vyrovnaná kinetika přesunu mezi jednotlivými kompartmenty přispívají k omezené variabilitě hypoglykemizujícího účinku inzulinu v průběhu času a mezi jednotlivými aplikacemi (obr. 4).
Vazba inzulinu detemiru na albumin a vztah k možným lékovým interakcím
Skutečnost, že volné mastné kyseliny a celá řada léků se váže na albumin, vedla k výzkumům možných interakcí, které by souvisely právě s vazbou na albumin. Je třeba uvést, že v terapeutických dávkách dosahuje inzulin detemir koncentrací 50 000krát nižších, než je koncentrace albuminu, a dále je zásadní fakt, že na molekule albuminu se nachází nejméně pět vazebných míst pro mastné kyseliny. Toxicita volných mastných kyselin pro tkáně vedla fylogeneticky k vytvoření značného nadbytku vazebných míst pro tyto látky právě na molekulách albuminu. Přesto byla provedena série studií, v nichž byla vyloučena možnost klinicky významných interakcí s fenylbutazonem, warfarinem, ibuprofenem, diazepamem, tolbutamidem, glibenklamidem, kyselinou acetylsalicylovou a valproátem [3].
Vazba inzulinu detemiru na inzulinový receptor
Ve studiích in vitro bylo demonstrováno, že inzulin detemir účinkuje jako plný agonista inzulinového receptoru, ale má nižší afinitu pro inzulinový receptor ve srovnání s humánním inzulinem 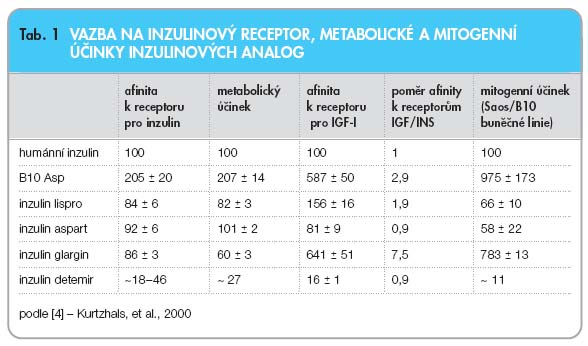 (tab. 1) [4]. Ani vazba inzulinu detemiru na inzulinový receptor není prodloužena ve srovnání s humánním inzulinem [4], což je pozitivní údaj, protože prodloužení tohoto parametru u jiného inzulinového analoga X10 bylo spojeno s karcinogenezí. Vazba na IGF-1 receptor, fyziologicky spojená s mitogenními účinky inzulinu, není u detemiru zvýšena oproti humánnímu inzulinu a je proporcionálně redukována na stejnou úroveň jako vazba detemiru na inzulinový receptor [4]. Lze tedy konstatovat, že inzulin detemir se vyznačuje stejným poměrem metabolických a mitogenních účinků jako humánní inzulin.
(tab. 1) [4]. Ani vazba inzulinu detemiru na inzulinový receptor není prodloužena ve srovnání s humánním inzulinem [4], což je pozitivní údaj, protože prodloužení tohoto parametru u jiného inzulinového analoga X10 bylo spojeno s karcinogenezí. Vazba na IGF-1 receptor, fyziologicky spojená s mitogenními účinky inzulinu, není u detemiru zvýšena oproti humánnímu inzulinu a je proporcionálně redukována na stejnou úroveň jako vazba detemiru na inzulinový receptor [4]. Lze tedy konstatovat, že inzulin detemir se vyznačuje stejným poměrem metabolických a mitogenních účinků jako humánní inzulin.
Farmakokinetické a farmakodynamické studie u dospělých osob
Clampové studie prokázaly, že inzulin detemir má in vivo zhruba 24% farmakologickou účinnost ve srovnání s inzulinem Neutral Protamin Hagedorn (NPH), pokud jsou použita ekvimolární množství obou inzulinů. Na základě těchto výsledků je komerčně vyráběný inzulin detemir ve čtyřnásobné koncentraci (1U = 24 nmol) oproti inzulinu NPH, který je v koncentraci 1U = 6 nmol. Plank a kol. sledovali ve své studii hypoglykemizující efekt subkutánně podaného inzulinu detemiru za použití isoglykemických clampových studií u 12 osob s diabetem 1. typu. Tato studie byla randomizovaná, dvojitě slepá, překřížená v 6 periodách. Inzulin detemir byl testován v dávkování 0,1 U/kg, 0,2 U/kg, 0,4 U/kg, 0,8 U/kg až 1,6 U/kg a srovnáván s inzulinem NPH v dávce 0,3 U/kg. Ve dvou nejvyšších dávkách přesáhly střední měřitelné délky působení inzulinu detemiru 24 hodin, zatímco u dávky 0,4 U/kg byla střední délka působení 20 hodin. Za použití parametru AUCGIR bylo zjištěno, že ekvivalentní dávka inzulinu detemiru má delší působení a nižší maximální efekt ve srovnání s inzulinem NPH. Dalším významným zjištěním byla nižší variabilita účinku vyjádřená 95% CI pro délku účinku a maximální efekt inzulinu [5].
Signifikantní snížení intraindividuální variability farmakodynamického účinku bylo prokázáno v randomizované clampové studii Heiseho u nemocných s diabetem 1. typu [6]. Autoři publikovali mnohem vyšší míru konzistence profilů účinku v čase u inzulinu detemiru (koeficient variace 27 %) ve srovnání s inzulinem glarginem (koeficient variace 48 %) a inzulinem NPH (koeficient variace 68 %); p < 0,0001 pro oba komparátory. Ve studii byla taktéž zjištěna nižší intraindividuální variabilita maximálního účinku inzulinu detemiru (hodnocená GIRmax) vyjádřená koeficientem variace (CV 23 % pro detemir) ve srovnání s inzulinem NPH (CV 46 %; p < 0,0001) a s inzulinem glarginem (CV 36 %; p < 0,0001).
Srovnání farmakodynamiky inzulinu detemiru s inzulinem glarginem v clampových studiích
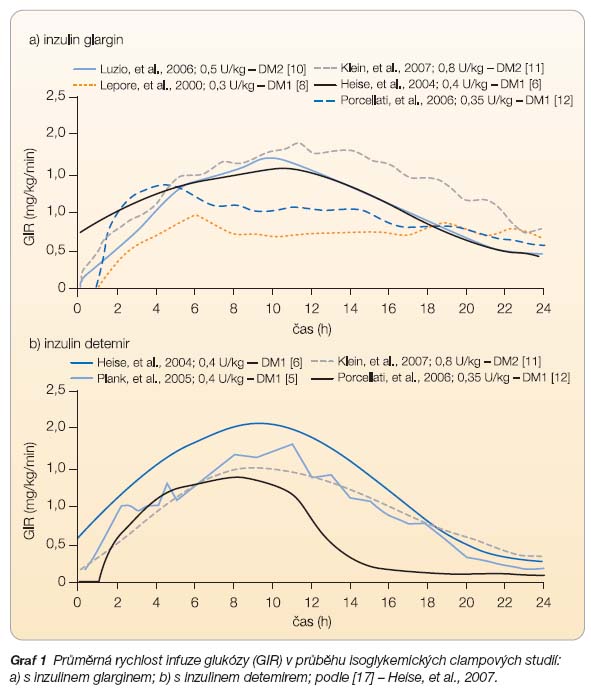 Inzulin glargin [6–13] a inzulin detemir [6, 11, 14–16] byly zkoumány v řadě isoglykemických clampových studií, které jsou považovány za zlatý standard pro posouzení farmakodynamických profilů inzulinových preparátů. Jen ovšem 3 studie přinesly přímé srovnání farmakodynamiky inzulinových analog detemiru a glarginu [6, 11, 13].
Inzulin glargin [6–13] a inzulin detemir [6, 11, 14–16] byly zkoumány v řadě isoglykemických clampových studií, které jsou považovány za zlatý standard pro posouzení farmakodynamických profilů inzulinových preparátů. Jen ovšem 3 studie přinesly přímé srovnání farmakodynamiky inzulinových analog detemiru a glarginu [6, 11, 13].
Profily účinku inzulinových analog jsou odvozovány od tvarů křivek GIR v závislosti na čase při isoglykemickém clampu (graf 1) [17]. Plochý profil účinku vykazoval inzulin glargin ve studii s nemocnými s DM 1. typu, kterou publikoval Lepore a kol. [8], ovšem žádná další clampová studie již podobný profil nezjistila. Naopak všechny ostatní byly zcela shodné ve zjištění mírného nárůstu a poklesu účinku, ať se jednalo o vyšetřování zdravých osob [7, 9], osob s DM 1. typu [6, 13] nebo osob s DM 2. typu [10, 11].
Inzulin detemir ve studiích taktéž shodně vykazoval mírný nárůst a pokles účinku v průběhu doby působení. Za zmínku stojí, že tvar průměrné křivky účinku v čase byl velmi podobný ve všech studiích provedených na různých pracovištích. Jedinou výjimkou byla studie, kterou publikoval Porcellati a kol. [13], zde byl zřetelný pokles účinku detemiru po 12hodinách průběhu studie. Výsledek této práce je ovšem považován za kuriózní, protože neodpovídá výsledkům rozsáhlých studií s opakovanými clampy, jež uskutečnili Heise a kol. [6] či Plank a kol. [14], kteří také vyšetřovali osoby s DM 1. typu. Jediné přímé srovnání farmakodynamiky inzulinů glargin a detemir u osob s DM 2. typu zjistilo téměř shodné profily účinku při podávání dávek inzulinu 0,4 a 0,8 IU/kg. Souhrnně lze konstatovat, že dostupné studie s výjimkou jedné [8] nacházejí mírný vrcholový účinek při léčbě oběma inzuliny – glarginem i detemirem. Ačkoli jsou profily účinku u obou analog výrazně plošší ve srovnání s inzulinem NPH, jejich průměrné profily zcela neodpovídají optimu, tedy bezvrcholovému profilu, jaký je dán endogenní bazální sekrecí inzulinu (graf 1).
Délka účinku bazálních analog je opět stanovena na základě provedených isoglykemických clampových studií. U inzulinu glarginu byla zjištěna délka účinku 22–24 hodin po jednorázovém podání [6, 8] a 24–25,6 hodin při vytvoření ustáleného stavu [11, 12]. Všechny studie shodně sdělují průměrné trvání účinku blížící se 24 hodinám, což podporuje podání 1krát denně, a právě tak by měl být podáván inzulin glargin dle doporučení SPC. Velmi podobné výsledky platí ovšem i pro inzulin detemir, kdy délka účinku byla stanovena na 21,5 hodiny ve studii Planka a kol. [14] a ve studii Heiseho a kol. byl průměrný konec účinku 23 hodin po podání při dávce 0,4 IU/kg. Velké diskuse vzbudily výsledky studie Kleina a kol. [11], která srovnávala délku účinku inzulinů detemir a glargin u nemocných s DM 2. typu. Tato studie neukázala žádné rozdíly v délce účinku obou inzulinů v rozmezí dávek 0,4–1,4 IU/kg. Vzhledem k délce vyšetření clampem, které činilo v této studii 24 hodin, jsou výsledky délky účinku obou inzulinů podhodnoceny. (Délka působení obou inzulinů přesáhla délku vyšetření, tj. 24 hodin.) Výsledky této studie byly zpochybňovány s odkazem na jejich možné ovlivnění endogenní sekrecí inzulinu u osob s DM 2. typu. Autoři studie se brání konstatováním, že do studie byly zařazeny jen osoby s nízkými hladinami C-peptidu nalačno (0,48 6± 0,28 nmol/l pro inzulin detemir vs. 0,45 6± 0,29 nmol/l pro inzulin glargin) a průměrné hladiny C-peptidu se ustálily na nízkých hodnotách v průběhu všech experimentů s oběma inzuliny, což dle autorů vylučovalo výraznější vliv endogenní sekrece na výsledky provedených měření.
Studie Kleina a kol. [11] spolu se studií Planka a kol. [14] demonstrovaly, že délka účinku obou inzulinových analog je závislá na dávce podaného inzulinu a se stoupající dávkou se zvyšuje. Z hlediska léčebné praxe je tedy potřebné znát délku účinku klinicky relevantních dávek. Ty se v případě léčby inzulinem detemirem pohybují kolem 0,4 IU/kg, jak bylo zjištěno ve studiích fáze III klinického zkoušení. V rozsáhlé observační studii inzulinu detemiru PREDICTIVE se pohybovaly střední efektivní dávky od 0,3 IU/kg u pacientů zahajujících léčbu inzulinem [18] až po cca 0,8 IU/kg u nemocných, kterým byla změněna léčba inzulinovými premixy na léčbu bazál-bolus [19]. Ke konci recentně publikované studie byl inzulin detemir podáván nemocným s DM 2. typu, kteří doposud nebyli léčeni inzulinem, 1krát denně v dávce 0,4–0,5 U/kg [20].
Ovlivnění farmakokinetických parametrů u speciálních populací
Studie, kterou uskutečnil Danne a kol., nezjistila vliv věku na standardní farmakokinetické parametry [21]. Ani přímé srovnání farmakokinetiky inzulinu detemiru u dětí, adolescentů a dospělých neukázalo žádný rozdíl. Jiné farmakokinetické studie nezjistily žádné klinicky významné rozdíly mezi osobami kavkazské, žluté či černé rasy. U osob s poruchou ledvinných či jaterních funkcí nebyly ve vztahu k farmakokinetice inzulinu detemiru zjištěny klinicky významné vlivy. Ovšem i u osob s těmito chorobami je potřebná titrace dávky dle individuálních potřeb, jako u ostatních osob s diabetem.
Klinické zkušenosti
Léčba diabetu 1. typu
Celá řada studií sledovala, jakou účinnost a bezpečnost léčby vykazuje inzulin detemir u osob s diabetem 1. typu. V dalším textu jsou zmíněny účinky detemiru na jednotlivé parametry účinnosti a bezpečnosti léčby a zpravidla srovnány s doposud užívanou léčbou. Přehled významných studií publikovaných v renomovaných časopisech je uveden v tab. 2.
Vliv inzulinu detemiru na ranní glykémii nalačno
Studie s podobným designem, jež publikovali Home a kol. [22] a Pieber a kol. [23], srovnávaly inzulin detemir s inzulinem NPH v rámci režimu bazál-bolus a prokázaly statisticky signifikantní zlepšení glykémie nalačno ve srovnání s inzulinem NPH, i když byla druhá injekce detemiru podána s večeří nebo před spaním. Průměrný rozdíl hodnot glykémie nalačno oproti inzulinu NPH činil 1,3 mmol/l, pokud byl inzulin detemir podán před večeří, a 2,3 mmol/l, pokud byl inzulin detemir podán před spaním, stejně jako inzulin NPH. Rozdíly glykémie nalačno byly statisticky signifikantní, zejména u aplikace detemiru před spaním. I průměrné glykémie nalačno zjištěné selfmonitoringem svědčily pro pokles u obou časů aplikace detemiru, a to o 0,8 mmol/l [22]. Ve studii Piebera a kol. byly průměrné glykémie nalačno 9,8 mmol/l, pokud byl inzulin detemir aplikován ráno a k večeři, pokud byl inzulin detemir aplikován ráno a před spaním, byla průměrná glykémie 9,2 mmol/l; u skupiny aplikující inzulin NPH 2krát denně (ráno a před spaním) byla průměrná glykémie nalačno 11,1 mmol/l. Obě skupiny, jimž byl podáván inzulin detemir, měly statisticky významně nižší glykémii než skupina léčená inzulinem NPH (p = 0,0061 a p < 0,0001) [23]. Podobný efekt na snížení glykémie nalačno ve srovnání s inzulinem NPH ukázala crossover studie, kterou publikoval Kolendorf a kol., kdy průměr glykémií ze selfmonitoringu byl 7,6 mmol/l při léčbě detemirem a 8,7 mmol/l při léčbě inzulinem NPH (p < 0,0001) [24].
Vliv inzulinu detemiru na četnost hypoglykemických epizod
Inzulin detemir byl při hodnocení četnosti hypoglykémií nejčastěji srovnáván s inzulinem NPH. Celá řada studií prokázala příznivý efekt inzulinu detemiru na pokles všech a zejména nočních hypoglykemických epizod [23–27]. Vague a kol. publikovali údaje o 22% poklesu v počtu všech hypoglykémií a doložili zřetelný pokles v počtu nočních hypoglykémií o 34 % (p < 0,005) oproti inzulinu NPH [25]. Tento příznivý trend pokračoval i při prodloužení této studie na 12 měsíců (redukce nočních hypoglykémií o 32 %; p < 0,016). Rozdíl v četnosti hypoglykémií při léčbě inzuliny detemirem a NPH se udržoval v průběhu celé studie bez náznaku konvergence v pozdějším období studie. Podobně i Home a kol. publikovali poznatky o tom, že inzulin detemir podávaný před spaním na snížení frekvence lehkých nočních hypoglykémií měl o 53 % vyšší efekt oproti inzulinu NPH podávanému ve stejné době (p < 0,001). Tato výrazná redukce četnosti hypoglykémií v noci přispěla výrazně ke snížení četnosti hypoglykemických epizod celkově, a to o 32 % (p < 0,002). V crossover studii publikované Kolendorfem a kol., kde četnost hypoglykémií byla primárním sledovaným parametrem, prokázal inzulin detemir ve srovnání s inzulinem NPH snížení rizika nočních hypoglykemických epizod o 50 % a snížení rizika všech hypoglykemických epizod o 18 % [24]. Počet těžkých hypoglykemických příhod je zmiňován v některých studiích. Numericky svědčí počty příhod pro příznivější efekt detemiru ve srovnání s inzulinem NPH, ale pro spolehlivé statistické hodnocení jsou zpravidla tyto studie malé.
Vliv inzulinu detemiru na celkovou kompenzaci diabetu
Ve většině komparativních klinických studií, v nichž byl podáván inzulin detemir, nebyl zaznamenán rozdíl v hodnotě HbA1c mezi srovnávanými léčebnými modalitami i přes pokles četnosti hypoglykémií u osob léčených inzulinem detemirem [16, 24–26, 28, 29]. V některých byl náznak poklesu HbA1c ve skupině léčené detemirem, ovšem statisticky nesignifikantní [22, 23, 27].
Vliv detemiru na tělesnou hmotnost
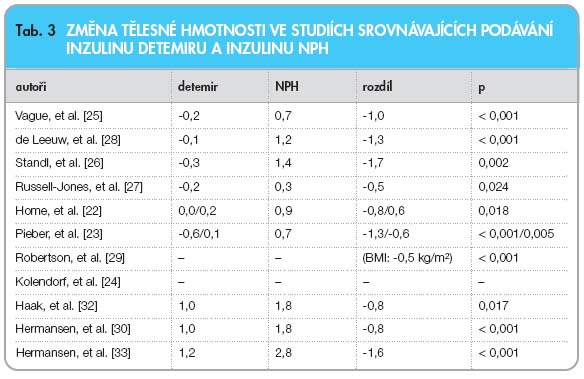 Již od úvodních klinických studií, kdy byl srovnáván inzulin detemir s inzulinem NPH, byl patrný rozdíl ve změně hmotnosti u srovnávaných skupin osob a tento fenomén byl potvrzen v celé řadě dalších studií (tab. 3).
Již od úvodních klinických studií, kdy byl srovnáván inzulin detemir s inzulinem NPH, byl patrný rozdíl ve změně hmotnosti u srovnávaných skupin osob a tento fenomén byl potvrzen v celé řadě dalších studií (tab. 3).
Dva nejvýraznější rozdíly změny hmotnosti u dospělé populace osob s diabetem 1. typu jsou publikovány u studií s delším trváním, což naznačuje, že vliv na změnu tělesné hmotnosti není přechodný, ale může být i kumulativní [26, 28]. Rozdíl ve změně hmotnosti pacientů při léčbě inzuliny detemir a NPH lze obecně odhadnout podle výsledků 12 měsíců trvajících studií na 1,5 kg.
Kombinace analog ve srovnání s kombinací humánních inzulinů v intenzifikovaném režimu
Hermansen a kol. publikovali výsledky 18týdenního srovnání kombinované léčby inzulinovými analogy detemir a aspart a léčby kombinací inzulinu NPH s humánním inzulinem regular u 595 osob s diabetem 1. typu [30]. Časy podávání bazálního inzulinu v této studii byly shodné v obou větvích (tj. ráno před snídaní a večer před spaním), jen pacienti užívající humánní inzulin regular byli poučeni o jeho aplikaci 30 minut před jídlem. Dosažená kompenzace diabetu byla lepší ve skupině osob léčených analogy inzulinu HbA1c; 7,9 % vs. 8,1 %, rozdíl 0,22 % (p < 0,0001). Profily glykémií získané při selfmonitoringu v závěru studie se taktéž signifikantně lišily s nižšími postprandiálními hladinami glykémie u skupiny léčené analogy, ovšem bez rozdílu v hodnotách glykémie nalačno. Použití analog v intenzifikovaném režimu vedlo ke snížení rizika nočních hypoglykémií o 55 % (p < 0,0001) a ke snížení rizika všech hypoglykémií o 21 % (p < 0,036). Navíc změna hmotnosti vztažená k HbA1c se lišila na konci studie o 1 kg ve prospěch analogové větve.
Srovnání s inzulinem glarginem
Jen jedna publikovaná klinické studie přímo srovnávala inzulin detemir a inzulin glargin v léčbě osob s DM 1. typu [31]. V této randomizované studii Piebera a kol., do níž byli zařazeni diabetici 1. typu, byl 161 nemocným podáván 2krát denně inzulin detemir a srovnáván s inzulinem glarginem podáváným v jedné denní dávce 159 osobám. V průběhu 26 týdnů došlo k poklesu HbA1c o 0,6 % v obou skupinách. Glykémie ráno nalačno byla nižší u nemocných léčených inzulinem glarginem (7,01 vs. 7,71 mmol/l; p < 0,001). Celkový průběh 9bodových plazmatických profilů byl podobný u obou léčebných skupin (p = 0,125). Intraindividuální variabilita glykémií před snídaní a večeří byla srovnatelná mezi oběma skupinami, ale ve skupině léčené detemirem byla signifikantně nižší variabilita glykémie před večeří (p < 0,05) a odpovídala signifikantnímu poklesu nočních (-32 %) a těžkých (-72 %) hypoglykemických epizod, zatímco četnost všech hypoglykémií byla podobná u obou léčebných skupin [31].
Léčba diabetu 2. typu
Úspěch inzulinových preparátů v léčbě diabetu 2. typu je odvozen od poněkud odlišné situace, než je tomu u léčby diabetu 1. typu. Je známým faktem, že populace osob s diabetem 2. typu je heterogenní skupinou jedinců s různým stupněm vyjádřené inzulinové rezistence a se značným výskytem nadváhy či obezity. Tendence ke vzniku hypoglykémie je obecně u osob s diabetem 2. typu nižší než u nemocných s diabetem 1. typu. Přítomnost reziduální sekrece inzulinu u osob s diabetem 2. typu vede k obtížnějšímu odhalení terapeutických vlastností jednotlivých inzulinových preparátů, než je tomu u nemocných s diabetem 1. typu. V neselektované populaci nemocných s diabetem 2. typu jsou přítomny osoby s hyperglykémiemi nalačno i postprandiálně, ale míra obou odchylek je u každého jedince různá. S těmito patofyziologickými souvislostmi koresponduje fakt, že mnohé studie, které se zaměřily pouze na jediný terapeutický cíl (tj. na glykémii nalačno či na glykémii postprandiální), nemusely v rámci neselektované populace diabetiků 2. typu vždy přinést mimořádný léčebný úspěch. V první studii u osob s diabetem 2. typu srovnávající inzulin detemir s inzulinem NPH byly oba bazální inzuliny použity jako součást intenzifikovaného inzulinového režimu a kombinovány s inzulinem aspartem podávaným preprandiálně [32]. Na konci 6měsíční léčby se výsledky HbA1c v obou skupinách nelišily (7,6 % u detemiru vs. 7,5 % u NPH; nesignifikantní rozdíl). Podobně ani glykémie nalačno měřené v laboratoři – 9,7 mmol/l a 9,6 mmol/l – a glykémie nalačno měřené v rámci selfmonitoringu – 7,5 mmol/l a 7,6 mmol/l – nebyly rozdílné u obou skupin. Avšak statisticky signifikantní byl rozdíl v přírůstku hmotnosti na konci studie (+1,0 kg inzulin detemir vs. +1,8 kg inzulin NPH; p < 0,017).
V publikované studii Hermansena a kol. srovnávající inzulin detemir s inzulinem NPH byly oba bazální inzuliny podávány 2krát denně a kombinovány s léčbou PAD [33]. Ve 24týdenní studii bylo použito schéma „léčba k cíli“, jehož pomocí se podařilo dosáhnout velmi dobré kompenzace diabetu (vyjádřené výsledky HbA1c 6,6 % u detemiru vs. 6,5 % u NPH; nesignifikantní). Při této míře kompenzace byla četnost hypoglykémií dostatečná pro spolehlivé statistické zpracování a výsledky jednoznačně prokázaly redukci rizika jakýchkoli hypoglykemických epizod o 47 % (p < 0,001) a redukci rizika nočních hypoglykémií o 55 % (p < 0,001) při léčbě inzulinem detemirem ve srovnání s inzulinem NPH. Dalším statisticky významným výsledkem byl opět rozdíl v přírůstku hmotnosti po 24 týdnech léčby (1,2 kg u detemiru vs. 2,8 kg u NPH; p < 0,001). Již v této studii byl pozorován jev, že léčba detemirem vedla k nižšímu přírůstku hmotnosti zejména u osob s vyšším BMI [34]. V nedávno publikované práci byly porovnávány účinky inzulinu detemiru podávaného v jedné denní dávce ráno nebo večer s inzulinem NPH podávaným večer u osob s DM 2. typu s nedostatečnou kompenzací při léčbě PAD (vstupní HbA1c 7,5–11 %) [35]. Ve všech 3 skupinách došlo na konci randomizované 20týdenní studie ke srovnatelnému poklesu HbA1c (-1,58 % u detemiru podávaného ráno, -1,48 % u detemiru podávaného večer, -1,74 % u NPH podávaného večer).
Při posouzení četnosti hypoglykémií bylo při podávání detemiru večer dosaženo redukce rizika všech hypoglykémií o 53 % (p = 0,019) a redukce nočních hypoglykémií o 65 % (p = 0,031) ve srovnání s inzulinem NPH podávaným večer. Inzulin detemir podávaný ráno před snídaní přinášel ještě výraznější redukci rizika nočních hypoglykémií – o 87 % (p < 0,001). Pozorovaný přírůstek hmotnosti byl 1,2 kg při léčbě detemirem podávaným ráno před snídaní, 0,7kg při podávání detemiru večer a 1,6 kg při léčbě inzulinem NPH (pro detemir večer vs. NPH p = 0,005). Autoři shrnují, že přidání inzulinu detemiru v 1 denní dávce do terapie osob s DM 2. typu a nedostatečnou kompenzací při léčbě PAD ve srovnání s inzulinem NPH nabízí jisté výhody v oblasti tolerance léčby.
Z klinického pohledu jsou důležité předběžné výsledky projektu nazvaného 4-T Study, kde jsou přímo srovnávány účinky přidání bifázického, prandiálního či bazálního inzulinu k již zavedené terapii perorálními antidiabetiky u osob s diabetem 2. typu se suboptimální kompenzací (HbA1c = 7–10 %). Holman a kol. publikovali výsledky po 1. roce trvání této 3leté randomizované multicentrické studie, v níž byl podáván bifázický aspart (Novomix30) 2krát denně, preprandiálně aplikovaný aspart 3krát denně a bazální inzulin detemir 1krát, eventuálně 2krát denně [36]. Sledovány byly parametry HbA1c, četnost hypoglykémií a změna hmotnosti. Po roce léčby dosáhli nemocní, kterým byl podáván bifázický a prandiální inzulin aspart, srovnatelné kompenzace (vyjádřené průměrným HbA1c = 7,3 % pro bifázický inzulin, HbA1c = 7,2 % pro prandiální inzulin), ale ve větvi léčené bazálním inzulinem detemirem byla kompenzace horší (HbA1c = 7,6 %; p < 0,001 pro obě srovnání). Průměrná četnost hypoglykémií v přepočtu na pacienta a rok byla 5,7 v bifázické větvi, 12,0 v prandiální větvi a 2,3 ve větvi léčené bazálním inzulinem. Změna hmotnosti po jednom roce byla +4,7 kg v bifázické větvi, +5,7 kg v prandiální větvi a +1,9 kg ve větvi léčené bazálním inzulinem. Přidání bifázického či prandiálního inzulinu k PAD u osob s DM 2. typu vedlo tedy sice k lepší kompenzaci onemocnění, ale bylo spojeno s vyšším rizikem hypoglykémií a vyšším vzestupem hmotnosti.
Tyto publikované výsledky jsou podobné výsledkům studie INITIATE, kde byly hodnoceny účinky přidání premixovaného analoga BiAsp 70/30 a srovnávány s efektem přidání inzulinu glarginu do kombinace s metforminem či pioglitazonem [37]. V neselektovaném souboru nemocných s diabetem 2. typu jsou jedinci s přítomností hyperglykémií nalačno i postprandiálně, ovšem postprandiální elevace glykémie je přítomna časněji a postupně progreduje [38]. Není proto překvapením, že intervence zaměřená na současné ovlivnění obou poruch přináší v neselektované populaci osob s diabetem 2. typu větší efekt ve smyslu snížení HbA1c. Výše uvedené výsledky ovšem naznačují, jak lépe využít dosavadní terapeutické možnosti. Za pomoci výsledků HbA1c, glykémie nalačno a glykémie postprandiální má lékař bezpochyby možnost svému pacientovi „ušít léčbu na míru“. Podle míry elevace glykémie nalačno či postprandiálně může intervenovat jednu, druhou či obě odchylky současně, což odpovídá podstatě moderní léčby diabetu 2. typu.
Srovnání s inzulinem glarginem
Přímé srovnání inzulinů detemir a glargin v léčbě osob s DM 2. typu je v publikovaných pracích vzácné. V jediné zveřejněné práci Rosenstocka a kol. u osob s diabetem 2. typu nebyl zjištěn rozdíl mezi oběma analogy ve smyslu ve vztahu k poklesu HbA1c, variabilitě glykémií či četnosti hypoglykémií, avšak rozdílný byl přírůstek hmotnosti, který byl statisticky významně nižší při léčbě inzulinem detemirem [39]. V této studii byl inzulin detemir podáván 1krát nebo 2krát denně, naproti tomu inzulin glargin byl podáván v jedné denní dávce; přesto se nejeví pravděpodobné, že by odlišné dávkovací schéma ovlivnilo takový parametr, jako je přírůstek hmotnosti. Za zmínku stojí, že pacienti s diabetem 2. typu léčení dvěma denními dávkami inzulinu detemiru nedosáhli lepších výsledků než ti, kteří aplikovali inzulin detemir v jedné denní dávce [39]. Tato skutečnost naznačuje, že u osob s DM 2. typu, jejichž kompenzace není uspokojivá při podávání jedné denní dávky inzulinu detemiru, bude mít pravděpodobně větší přínos přidání prandiálního inzulinu než další přídatné dávky bazálního inzulinu.
Zařazení do současné palety léčiv
Dlouhodobý inzulinový analog detemir dosahuje díky delšímu a vyrovnanějšímu profilu účinku v čase ve srovnání s inzulinem NPH při léčbě osob s diabetem 1. i 2. typu snížení ranních glykémií nalačno a významného snížení četnosti nočních hypoglykémií. Redukce počtu nočních hypoglykémií a úprava ranní glykémie nalačno se nemusí při léčbě bazálním inzulinem automaticky promítnout do zlepšení kompenzace diabetu ve smyslu snížení HbA1c, což je fenomén patrný i při léčbě inzulinem glarginem [40, 41].
Na druhé straně, redukce četnosti hypoglykemických epizod při léčbě detemirem otevírá cestu k dosažení lepší kompenzace diabetu, než je tomu při léčbě inzulinem NPH. Známá skutečnost, že zlepšení kompenzace diabetu (například při zvyšování dávky inzulinu) je provázeno vzestupem rizika hypoglykémie, právě brání dosažení těsné kompenzace diabetu. Snížení rizika hypoglykémií, které jsou limitujícím faktorem pro úspěšnou léčbu kterýmkoli inzulinovým preparátem, zřetelně upřednostňuje inzulin detemir před inzulinem NPH. Překvapivým faktem, který byl shodně potvrzen v celé řadě studií, je příznivější vliv na hmotnost nemocných ve srovnání s inzulinem NPH či glarginem (viz tab. 3). Také osoby s diabetem 2. typu dosahují během podávání inzulinu detemiru přírůstku hmotnosti, který je o 50 % nižší než přírůstek hmotnosti pozorovaný při podávání inzulinu NPH. Tyto publikované výsledky ukazují mimořádnou vlastnost inzulinu detemiru, která by byla zejména výhodná u osob s nadváhou a s diabetem 2. typu vyžadujících léčbu inzulinem. Výsledky 12měsíčních studií ve vztahu k hmotnosti bude potřebné podpořit dalšími výsledky dlouhodobějších projektů.
Pozice inzulinu detemiru v klinické praxi je určena vlastnostmi tohoto inzulinu, a je na lékaři, aby jich náležitě využil. K plnému zhodnocení potenciálu inzulinu detemiru je nezbytná adekvátní volba dávkovacího schématu, poměru dávek prandiálního a bazálního inzulinu a racionální stanovení cílů pro titraci podle glykémie nalačno a případně dle glykémie před večeří. Tyto potřebné atributy jsou nedílně spojeny s intenzivní edukací nemocného.
Z klinických studií vyplývá, že je možné podávat inzulin detemir před spaním nemocným s diabetem 2. typu, kteří jsou léčeni perorálními antidiabetiky; adekvátní dávka dlouhodobého analoga totiž sníží glykémii ráno nalačno s nižším rizikem hypoglykémií než inzulin NPH. Tato indikace použití inzulinu detemiru není v ČR povolena, neboť dle seznamu indikačních omezení je léčba inzulinem detemirem indikována jako 2. volba u nemocných léčených intenzifikovanou léčbou inzulinem, u nichž jsou přítomny opakované hypoglykémie a/nebo rozkolísaný diabetes s doloženou neuspokojivou kompenzací a/nebo nutnost podávání dlouhodobého inzulinu vícekrát denně. Inzulin detemir je tedy v České republice používán jako součást režimu bazál-bolus, a to jednou nebo dvakrát denně v závislosti na pacientově potřebě
Indikace
Léčba diabetes mellitus. Analoga inzulinů s dlouhodobým účinkem jsou předepisována v centrech specializovaných na léčbu pacientů s diabetem či na doporučení těchto center jako 2. volba u nemocných, kteří dostávají intenzifikovanou léčbu inzulinem, u nichž je indikována léčba inzulinovou pumpou (opakované hypoglykémie, rozkolísaný diabetes, nutnost podávat dlouhodobě účinný inzulin vícekrát denně). Pokles hodnoty HbA1c po třech měsících léčby by měl přesahovat 10 % původní hodnoty.
Kontraindikace
Kontraindikací léčby je přecitlivělost na inzulin detemir nebo na pomocnou látku.
Nežádoucí účinky
Nejvýznamnějším nežádoucím účinkem léčby inzulinem detemirem je hypoglykémie, i když riziko jejího vzniku je u tohoto inzulinu sníženo ve srovnání s jinými běžně užívanými inzulinovými přípravky. Z klinických výzkumů je známo, že významná hypoglykémie, definovaná nutností intervence třetí strany, se vyskytuje zhruba u 6 % pacientů.
Reakce v místě vpichu se během léčby inzulinem detemirem vyskytují častěji, než je tomu u humánních inzulinů. Tyto reakce zahrnují zarudnutí, zánět, modřiny, otok a svědění v místě vpichu. Většina těchto reakcí v místě vpichu je nezávažných a přechodné povahy, tj. normálně během pokračující léčby vymizí, a to v několika dnech nebo týdnech.
Lipodystrofie může vzniknout v místě vpichu jako následek zanedbání cyklické záměny míst vpichů v dané oblasti. Ve třech klinických studiích se subjekty léčenými v kombinaci s perorálními antidiabetiky byl pozorován vyšší výskyt (2,2 %) alergických reakcí a potenciálně alergických reakcí.
Dlouhodobě se zlepšující kompenzace diabetu snižuje riziko vývoje diabetické retinopatie. Na druhou stranu intenzivnější léčba inzulinem s náhlým zlepšením glykemického profilu může být spojena s přechodným zhoršením diabetické retinopatie. Podobně i vývoj přechodné refrakční anomálie je zpravidla spjat s rychlým zlepšením kompenzace diabetu na počátku léčby inzulinem.
Lékové interakce
Perorální antidiabetika, inhibitory monoaminoxidázy, inhibitory angiotenzin konvertujícího enzymu, salicyláty, alkohol, disopyramid apod. mohou samy snižovat hladiny glukózy v krvi. Proto jejich podání v kombinaci s inzulinem detemirem může zvýšit jeho účinek. Naopak látky zvyšující glykémii, jako jsou thiazidová diuretika, glukokortikoidy, hormony štítné žlázy, sympatomimetika, růstový hormon, danazol, mohou snížit účinky souběžně podávaného inzulinu detemiru. Betablokátory mohou zakrýt symptomy hypoglykémie.
Těhotenství a kojení
S aplikací inzulinu detemiru během těhotenství neexistují klinické zkušenosti. Studie na zvířatech neprokázaly rozdíl mezi humánním inzulinem a inzulinem detemirem. Potřeba inzulinu obvykle v prvním trimestru klesá a zvyšuje se následně během druhého a třetího trimestru. Všeobecně se doporučuje zvýšená kontrola glykémie během těhotenství. Stejné opatrnosti je třeba během podávání inzulinu detemiru v období kojení.
Ovlivnění pozornosti
Možná ztráta pozornosti je spojena se stavem možné hypoglykémie.
Dávkování
 Síla přípravku se uvádí v jednotkách. Tyto jednotky se vztahují výhradně na inzulin detemir a liší se od mezinárodních jednotek (IU) nebo jednotek používaných k vyjádření síly jiných inzulinových analog.
Síla přípravku se uvádí v jednotkách. Tyto jednotky se vztahují výhradně na inzulin detemir a liší se od mezinárodních jednotek (IU) nebo jednotek používaných k vyjádření síly jiných inzulinových analog.
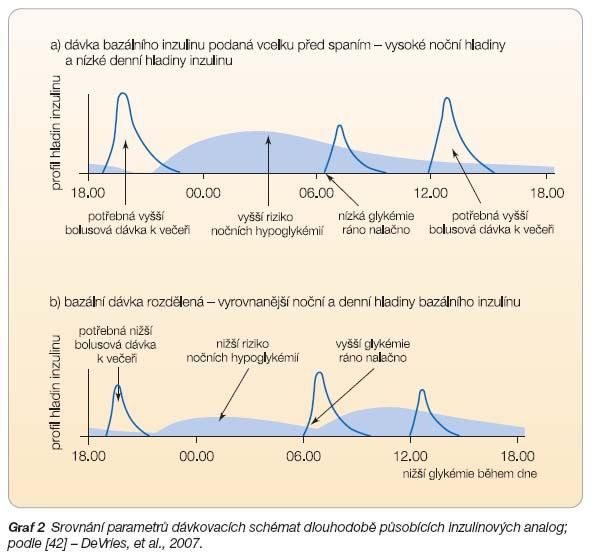
Při užití jako součásti inzulinového režimu bazál-bolus se inzulin detemir podává jednou nebo dvakrát denně v závislosti na pacientově potřebě. Vliv schématu dávkování dlouhodobého analoga na profil hladin inzulinu během dne a další parametry je znázorněn v grafu 2 [42].
Jedna dávka bazálního inzulinu
Podobně jako při použití inzulinu glarginu je možné titrovat dávku detemiru podaného večer podle ranní glykémie nalačno. Při použití tohoto titračního schématu je vhodný monitoring glykémie mezi 2. až 3. hodinou v noci, k vyloučení případných nočních hypoglykémií.
V otázce načasování aplikace inzulinu detemiru výsledky studií naznačují, že při kombinaci s rychle působícími analogy u nemocných s DM 1. typu, kde jsou dominantním problémem noční hypoglykémie, je vhodné podání dávky detemiru až před spaním, zatímco při podání s večeří lze předpokládat nejnižší vzestupy ranní glykémie nalačno [43]. Pokud je hodnota glykémie nalačno vyšší než 6 mmol/l, zvyšujeme večerní dávku bazálního inzulinu o 1–2 jednotky. Dávku bazálního inzulinu měníme nejdříve za tři dny po poslední změně. Pokud se objeví noční hypoglykémie, snížíme dávku zpět na poslední hodnotu bez hypoglykemických epizod.
Dvě dávky bazálního inzulinu
Toto schéma lze zvolit již při zahájení léčby inzulinem detemirem a nebo při neuspokojivé kompenzaci jednou denní dávkou detemiru. Neuspokojivou kompenzací rozumíme přetrvávání hyperglykémií ráno nalačno a současnou přítomnost nočních hypoglykémií nebo situaci, kdy se objevují hyperglykémie před večeří jako výraz nedostatečného efektu v závěru působení inzulinu. Titrace dávky inzulinu detemiru podané večer podle ranní glykémie nalačno a titrace dávky podané ráno podle glykémie před večeří jsou základními mechanismy vedoucími k nastavení adekvátního dávkování.
Balení
Léčivý přípravek obsahující inzulin detemir se jmenuje Levemir a je dodáván do České republiky firmou Novo Nordisk (tab. 4). Zásobní vložky Penfill jsou určené pro aplikátor NovoPen.
Seznam použité literatury
- [1] Witthingham JL, Havelund S, Jonassen I. Crystal structure of a prolonged-acting insulin with albumin-binging properties. Biochemistry 1997; 36: 2826–2823.
- [2] Kurtzhals P. Engineering predictability and protraction in basal insulin analogue: the pharmacology of insulin detemir. Int J Obes 2004; 28 (Suppl. 2): S23–S28.
- [3] Kurtzhals P, Havelund S, Jonassen I, Markussen J. Effect of fatty acids and selected drugs on the albumin binding of a long-acting, acylated insulin analogue. J Pharm Sci 1997; 86: 1365–1368.
- [4] Kurtzhals P, Schaffer L, Sörensen A, et al. Correlations of receptor binding and metabolic and mitogenic potencies of insulin analogs designed for clinical use. Diabetes 2000; 49: 999–1005.
- [5] Plank J, Bodenlenz M, Sinner F, et al. A double-blind, randomized, dose-response study investigating the pharmacodynamic and pharmacokinetic properties of the long-acting insulin analog detemir. Diabetes Care 2005; 28: 1107–1101.
- [6] Heise T, Nosek L, Ronn BB, et al. Lower within-subject variability of insulin detemir in comparison to NPH insulin and insulin glargine in people with type 1 diabetes. Diabetes 2004; 53: 1614–1620.
- [7] Scholtz HE, Pretorius SG, Wessels DH, Becker RH. Pharmacokinetic and glucodynamic variability: assessment of insulin glargine, NPH insulin and isulin ultralente in healthy volunteers using a euglycaemic clamp technique. Diabetologia 2005; 48: 1988–1995.
- [8] Lepore M, Pampanelli S, Fanelli C, et al. Pharmacokinetics and pharmacodynamics of subcutaneous injection of long-acting human insulin analog glargine, NPH insulin, and ultralente human insulin and continuous subcutaneous infusion of isulin lispro. Diabetes 2000; 49: 2142–2148.
- [9] Heinemann L, Linkeschova R, Rave K, et al. Time-action profile of the long acting insulin analog glargine (HOE 901) in comparison with those of NPH insulin and placebo. Diabetes Care 2000; 23: 644–649.
- [10] Luzio S, Dunseath G, Peter R, et al. Comparison of the pharmacokinetics and pharmacodynamics of biphasic insulin aspart and insulin glargine in people with 2 diabetes. Diabetologia 2006; 49: 1163–1168.
- [11] Klein O, Lynge J, Endahl L, et al. Albumin-bound basal insulin analogues (insulin detemir and NN344): comparable time-action profiles but less variability than insulin glargine in type 2 diabetes. Diabetes Obes Metab 2007; 9: 290–299.
- [12] Porcellati F, Rosetti P, Ricci NB, et al. Pharmacokinetics and pharmacodynamics of the long acting insulin analog glargine after one week of use as compared to its first administration in subjects with type 1 diabetes mellitus. Diabetes Care 2007; 30: 1261–1263.
- [13] Porcellati F, Rossetti P, Ricci NB, et al. Pharmacokinetics and -dynamics of therapeutic doses of the “long-acting” insulin analogues glargine and detemir at steady-state in type 1 diabetes. Diabet Med 2006; Suppl. 4: 341 (Abstract).
- [14] Plank J, Bodenlenz M, Sinner F, et al. A double-blind, randomized, dose-response study investigating the pharmacodynamic and pharmacokinetic properties of the long-acting insulin analog detemir. Diabetes Care 2005; 28: 1107–1112.
- [15] Heinemann L, Sinha K, Weyer C, et al. Time-action profile of the soluble, fatty acid acylated, long acting insulin analogue NN304. Diabet Med 1999; 16: 332–338.
- [16] Brunner GA, Sendhofer G, Wutte A, et al. Pharmacokinetic and pharmacodynamic properties of long-acting insulin analogue NN304 in comparison to NPH insulin in humans. Exp Clin Endocrinol Diabetes 2000; 108: 100–105.
- [17] Heise T, Pieber TR. Towards peakless, repro-ducible and long-acting insulins. An assessment of the basal analogues based on isoglycaemic clamp studies. Diabetes, obesity and metabolism 2007; 9: 648–659.
- [18] Dornhorst A, Hernandez FO, Koenen C, Lüd-deke HJ. Initiating insulin detemir improves glycaemic control without weight gain in OAD-treated, insulin naive patients with type 2 diabetes: results from the PREDICTIVE study. Diabet Med 2006; 23 (Suppl. 4): 136 (P370).
- [19] Tsur A, Hansen JB, Yenigun M. Switching from premix insulin to BB therapy with insulin detemir and insulin aspart improves glycaemic control and reduces hypoglycaemia, without weight gain, in type 2 patients: 3-month results from the PREDICTIVE study. Diabet Med 2006; 23 (Suppl. 4): 347 (P966).
- [20] Philis-Tsimikas A, Charpentier G, Clauson P, et al. Comparison of once- daily insulin detemir with NPH insulin added to a regimen of oral antidiabetic drugs in poorly controlled type 2 diabetes. Clin Ther 2006; 28: 1569–1581.
- [21] Danne T, Lupke K, Walte K, Von Schuetz W, Gall M-A. Insulin detemir is characterised by a consistent pharmacokinetic profile across age groups in children, adolescents, and adults with Type 1 diabetes. Diabetes Care 2003; 26: 2359–2356.
- [22] Home P, Bartley P, Russell-Jones D, et al.` Study to evaluate the administration of detemir insulin efficacy, safety and suitability (steadiness) study group. Insulin detemir offers improved glycemic control compared with NPH insulin in people with Type 1 diabetes: a randomized clinical trial. Diabetes Care 2004; 27: 1081–1087.
- [23] Pieber TR, Draeger E, Kristensen A, Grill V. Comparison of three multiple injection regimens for Type 1 diabetes: morning plus dinner or bedtime administration of insulin detemir vs. morning plus bedtime NPH insulin. Diabet Med 2005; 22: 850–857.
- [24] Kolendorf K, Ross GP, Pavlic-Renar I, et al. Insulin detemir lowers the risk of hypoglycaemia and provides more consistent plasma glucose levels compared with NPH insulin in type 1 diabetes. Diabet Med 2006; 23: 729–735.
- [25] Vague P, Selam JL, Skeie S, et al. Insulin detemir is associated with more predictable glycemic control and reduced risk of hypoglycemia than NPH insulin in patients with type 1 diabetes on basal-bolus regimen with premeal insulin aspart. Diabetes Care 2003; 26: 590–596.
- [26] Standl E, Lang H, Roberts A. The 12-month efficacy and safety of insulin detemir and NPH insulin an basal-bolus therapy for the treatment of Type 1 diabetes. Diabetes Technol Ther 2004; 6: 579–588.
- [27] Russell-Jones D, Simpson R, Hylleberg B, et al. Effects of QD insulin detemir or neutral protamine Hagedorn on blood glucose control in patients with type I diabetes mellitus using a basal-bolus regiment. Clin Ther 2004; 26: 724–736.
- [28] De Leeuw I, Vague P, Selam JL, et al. Insulin detemir used in basal-bolus therapy in people with type 1 diabetes is associated with a lower risk of nocturnal hypoglycaemia and less weight gain over 12 months in comparison to NPH insulin. Diabetes Obes Metab 2005; 7: 73–82.
- [29] Robertson KJ, Schoenle E, Gucev Z, et al. Insulin detemir compared with NPH insulin in children and adolescents with type 1 diabetes. Diabet Med 2007; 24: 27–34.
- [30] Hermansen K, Fontaine P, Kukolja KK, et al. Insulin analogues (insulin detemir and insulin aspart) versus traditional human insulin (NPH insulin and regular human insulin) in basal-bolus therapy for patients with type 1 diabetes. Diabetologia 2004; 47: 622–629.
- [31] Pieber TR, Treichel HC, Robertson LI, Mordhorst L, Gall MA. Insulin therapy in type 1 diabetes – insulin detemir plus insulin aspart is associated with less risk of major as well as nocturnal hypoglycaemia than insulin glargine plus insulin aspart at comparable levels of glycaemic control in type 1 diabetes. Diabetologia 2005; 48 (Suppl. 1): O242.
- [32] Haak T, Tiengo A, Draeger E, Suntum M, Waldhäusl W. Lower within-subject variability of fasting blood glucose and reduced weight gain with insulin detemir compared to NPH insulin in patients with type 2 diabetes. Diabetes Obes Metab 2005; 7: 56–64.
- [33] Hermansen K, Davies M, Derezinski T, et al. A 26-week, randomized, parallel, treat-to-target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetes Care 2006; 29: 1269–1274.
- [34] Hermansen K, Tamer S. The advantage of less weight gain increases with baseline obesity when insulin detemir rather than NPH Insulin is added to oral agents in Type 2 diabetes. Diabetes 2005; 54 (Suppl. 1): A67.
- [35] Philis-Tsimikas A, Charpentier G, Clauson P, et al. Comparison of once-daily insulin detemir with NPH insulin added to a regimen of oral antidiabetic drugs in poorly controlled type 2 diabetes. Clin Ther 2006; 28: 1569–1581.
- [36] Holman RR, Thorne KI, Farmer AJ, et al.; 4-T Study Group. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N Engl J Med 2007; 357: 1716–1730.
- [37] Raskin P, Allen E, Hollander P, et al. Comparison of basal insulins added to oral agents versus twice-dialy premixed insulin as initial therapy for type 2 diabetes. Diabetes Care 2005; 28: 260–265.
- [38] Monnier L, Colette C, Dunseath GJ, Owens DR. The loss of postprandial glycemic control precedes stepwise deterioration of fasting with worsening diabetes. Diabetes Care 2007; 30: 263–269.
- [39] Rosenstock J, Davies M, Home PD, et al. Insulin detemir added to oral antidiabetic drugs in type 2 diabetes provides glycemic control comparable to insulin glargine with less weight gain. Diabetes 2006; 55 (Suppl. 1): 555-P.
- [40] Ratner RE, Hirsch IB, Neifing JL, et al. for the US Study Group of insulin glargine in Type 1 diabetes: Less hypoglycaemia with insulin glargine in intensive insulin therapy for Type 1 diabetes. Diabetes Care 2000; 23: 639–643.
- [41] Pickup J, Mattock M, Kerry S. Glycaemic control with continuous subcutaneous insulin ifusion compared with intensive insulin injections in patients with Type 1 diabetes: meta-analysis of randomised controlled trials. Br Med J 2002; 324 (7339): 705.
- [42] DeVries JH, Natrass M, Pieber TR. Refining basal insulin therapy: What have we learned in the age of analogues? Diabetes Metab Res Rev 2007; 23: 441–454.
- [43] Home P, Kurtzhals P. Insulin detemir: from concept to clinical experience. Expert Opin Pharmacother 2006; 7: 325–343.