Leflunomidum
Leflunomid patří mezi tzv. chorobu modifikující léky revmatoidní artritidy (DMARDs). Do klinické praxe byl zařazen zhruba před 6 lety a značně obohatil celkem chudou paletu těchto léků. Patří mezi DMARDs chemické povahy, nikoliv biologické. Při dělení na DMARDs necystostatické a cystostatické patří do skupiny první. Mechanismus jeho účinku je možné charakterizovat jako imunomodulační. V současné době je leflunomid registrován pro léčbu revmatoidní artritidy (RA) a psoriatické artritidy (PsA). Potenciálními indikacemi do budoucna, u kterých je leflunomid zkoušen, jsou juvenilní idiopatická artritida, ankylozující spondylitida, Wegenerova granulomatóza, Crohnova nemoc a systémový lupus erythematodes.
Farmakologická skupina
Leflunomid je chorobu modifikující antirevmatikum (DMARD – disease-modifying antirheumatic drug) s antiproliferativními vlastnostmi.
Chemické a fyzikální vlastnosti
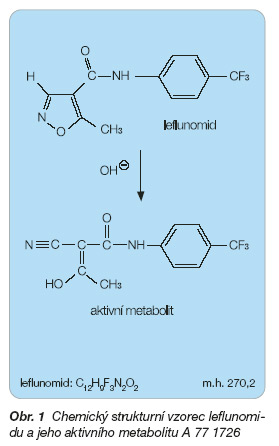
Leflunomid je chemicky N-(4´-trifluormethylphenyl)-5-methylisoxazol-4-carboxamid (obr. 1). Patří mezi deriváty isoxazolu.
Sumární vzorec: C12H9F3N2O2
Molekulová hmotnost: 270,2
Je to bílý prášek prakticky nerozpustný ve vodě, dobře rozpustný v ethanolu, pKa při 23 °C je 10,8.
Mechanismus účinku
Leflunomid je pokládán za proléčivo. Veškeré známé biologické aktivity jsou připisovány jeho aktivnímu metabolitu A 77 1726.
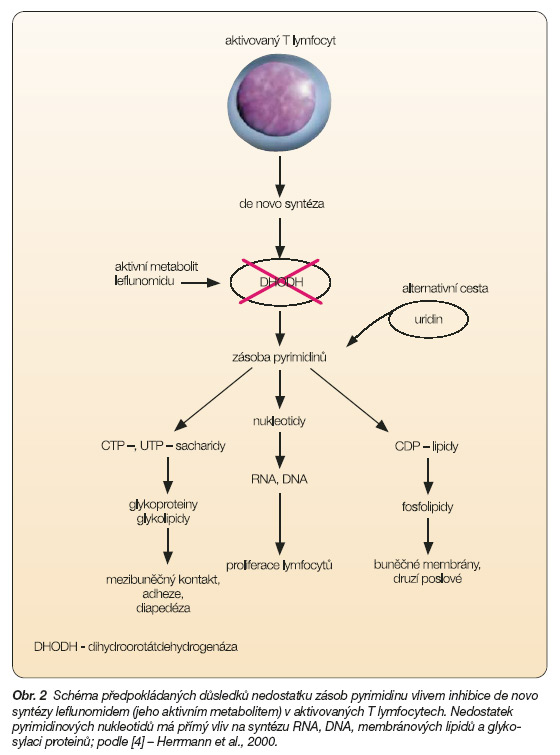
Byly popisovány mnohočetné mechanismy účinku tohoto aktivního metabolitu, ale zdá se, že nejdůležitějším efektem je inhibice dihydroorotátdehydrogenázy [2], což je klíčový enzym pro syntézu uridinmonofosfátu, který je prekurzorem pyrimidinových nukleotidů v aktivně se dělících lymfocytech [3] (obr. 2).
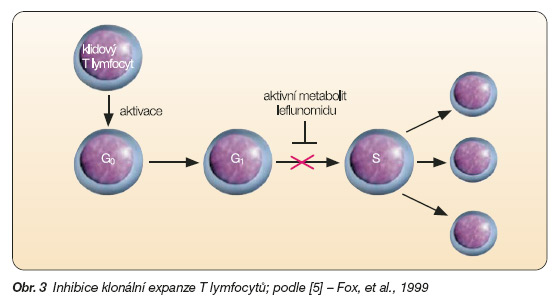
Dochází tedy k inhibici proliferace aktivovaných T lymfocytů v G1 fázi buněčného cyklu (obr. 3). Byly popsány i účinky na proliferaci B buněk, jejich diferenciaci a sekreci auto-protilátek [4]. Bylo prokázáno, že leflunomid ovlivňuje proliferaci B buněk závislou i nezávislou na T buňkách. Dalším popsaným mechanismem účinku je inhibice NF-kb, inhibice exprese adhezivních molekul a inhibice chemotaxe leukocytů, účinek na různé tyrozinkinázy [5]. Leflunomid byl zkoušen na řadě modelů autoimunitních onemocnění, jako je myasthenia gravis, proteoglykany indukovaná artritida, krysí adjuvantní artritida a systémové vaskulitidy [6].
Farmakokinetické vlastnosti
Perorálně podaný leflunomid je rychle metabolizován na vlastní účinný A 77 1726, ale přesné místo této přeměny není známo. Různé studie poukazují na metabolismus ve střevní stěně, v plazmě či jaterním cytochromu P-450. Léčivo je velmi silně vázáno na plazmatické bílkoviny (99 %), a proto má malý distribuční objem. A 77 1726 prochází enterohepatálním cyklem, který je také příčinou dlouhého biologického poločasu (asi 2 týdny). Kolem 48 % podané dávky je vyloučeno stolicí a 43 % močí. Věk ani pohlaví neovlivňují farmakokinetické parametry leflunomidu, vliv jaterního či renálního selhání je třeba ještě ozřejmit. A 77 1726 má velmi dlouhý biologický poločas (14–18 hodin), a proto se používají úvodní 3 dávky 100 mg, protože jinak je dosaženo steady-state po 2 měsících. Plazmatické hladiny jsou proporční k perorálním dávkám v dávkách 5–25 mg/den (tab. 1).
Cholestyramin nebo aktivní uhlí snižují plazmatické koncentrace A 77 1726 a lze je použít k léčbě při předávkování. Současné podávání s methotrexatem zvyšuje riziko hepatotoxicity. V jedné studii zvyšoval plazmatické koncentrace A 77 1726 rifampicin, naopak lékové interakce nebyly pozorovány v kombinaci s cimetidinem či perorálními kontraceptivy [7].
Klinické zkušenosti
Klinická účinnost u revmatoidní artritidy v monoterapii
Dvouleté sledování
Leflunomid prošel úspěšně II. fází klinického zkoušení. Ve III. fázi klinického zkoušení pak byly provedeny 3 zásadní studie, na jejichž podkladě byl leflunomid zaregistrován pro léčbu revmatoidní artritidy (RA).
V USA byla provedena randomizovaná kontrolovaná studie, ve které byl srovnáván leflunomid s methotrexatem. Publikovány byly nejprve výsledky po jednom roce [8] a dále pak výsledky po 2 letech léčby. Pacienti dostávali buď leflunomid (první 3 dny 100 mg, pak 20 mg denně), nebo methotrexat (MTX) plus folát (MTX prvních 6 týdnů 7,5 mg týdně, pak 15 mg týdně, folát 1 mg denně). Primárním kritériem byl počet respondentů dle tzv. ACR 20, který činil 52 % u leflunomidu, 46 % u MTX a 26 % u placeba (p < 0,01 oproti placebu, leflunomid vs MTX N. S.). U silnější odpovědi ACR 50 byl výsledek identický (34 % leflunomid, 23 % MTX a 8 % placebo, p < 0,01).
Statisticky významné rozdíly oproti placebu byly po léčbě leflunomidem zaznamenány u všech dílčích komponent ACR indexu (počet citlivých a oteklých kloubů, reaktanty akutní fáze). Rychlost nástupu účinku leflunomidu byla vyšší než u MTX. Leflunomid i MTX příznivě ovlivňovaly funkci a kvalitu života nemocných s RA. Leflunomid i methotrexat oproti placebu zpomalovaly rentgenovou progresi RA. Nárůst celkového Sharpova skóre byl 2,16 u placeba, 0,88 po MTX a 0,53 u leflunomidu (leflunomid vs placebo p < 0,05). Výsledky po 2 letech potvrdily dále účinnost a bezpečnost léčby leflunomidem. ACR 20 po 2 letech bylo 79 % leflunomid vs 67 % MTX, p = 0,049. Oba léky dále příznivě ovlivňovaly funkci a kvalitu života, přičemž leflunomid ve 2. roce léčby měl výraznější vliv na funkce hodnocené dotazníkem HAQ. Oba léky signifikantně zpomalovaly i po 2 letech rentgenovou progresi, přičemž mezi nimi nebyl rozdíl.
Druhou zásadní studií byla randomizovaná klinická studie, která srovnávala leflunomid oproti sulfasalazinu (SAS) a placebu [9]. Studie trvala 24 týdnů a bylo do ní zařazeno 362 pacientů. Primárního kritéria ACR 20 dosáhlo ve 24. týdnu 48 % pacientů po leflunomidu, 44 % po SAS a 29 % po placebu (SAS vs placebo p < 0,003). Nástup účinku leflunomidu byl opět rychlejší než u SAS, když ACR 20 dosáhlo po 4 týdnech 37,6 %, zatímco po SAS 23,9 % (p = 0,031). Oba léky srovnatelným způsobem zpomalovaly rentgenovou progresi onemocnění. Leflunomid měl výraznější účinek na zlepšení funkce nemocných. Příznivý klinický efekt leflunomidu přetrvával 24 měsíců [10].
Třetí velkou studií byla práce Emeryho a kol. [11]. Šlo o dvojitě slepou studii na kohortě 999 pacientů, kteří byli randomizováni do skupiny léčené MTX nebo leflunomidem. Primárním kritériem bylo ACR 20 za 1 rok, který docílilo 50,5 % po leflunomidu a 64,8 % po MTX (p = 0,01), ale po 2 letech byl již rozdíl nesignifikantní (64,3 % vs 71,2 %). V účincích na sekundární ukazatele účinnosti, funkci a kvalitu života se oba preparáty nelišily.
Pětileté sledování
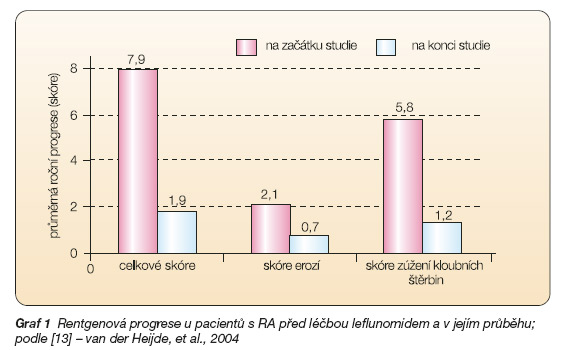
Pětileté sledování pacientů ve 2 studiích III. fáze klinického zkoušení ukázalo, že klinická účinnost dosažená po 12 měsících v ukazatelích HAQ a ACR 20 je udržována (průměrná doba léčení 4,6 roku) [12]. Dále bylo prokázáno, že rentgenová progrese subsetu pacientů dlouhodobě léčených leflunomidem je dramaticky zpomalena [13]. Roční odhadovaná progrese v celkovém Sharpově skóre před studií byla 7,9 a v průběhu léčby leflunomidem 1,9 (průměrná doba léčby 4,3 roku) (graf 1). Tento fakt je velmi důležitý, protože rentgenová progrese velmi úzce koreluje se stupněm funkčního zhoršování.
Klinická účinnost u revmatoidní artritidy v kombinaci
Kombinovaná léčba více DMARDs najednou u pacientů, kteří neodpovídají na monoterapii jedním DMARD, se stala jedním z pilířů moderní aktivní léčby revmatoidní artritidy. Leflunomid je i teoreticky výhodným lékem do kombinací, a to jednak díky unikátnímu mechanismu účinku, jednak díky výhodnému podávání jedenkrát denně [14].
Protože methotrexat je základním stavebním kamenem většiny kombinovaných režimů, bylo logické, že první bude zkoušena kombinace leflunomidu a methotrexatu. Po úvodní otevřené studii byla provedena dvojitě slepá randomizovaná studie, kdy pacientům s nedostatečným efektem léčby MTX byl přidáván leflunomid, nebo placebo [15].
Kombinovaná léčba leflunomidem plus MTX byla po 24 týdnech ve všech ukazatelích účinnější než monoterapie MTX. Počet nežádoucích účinků a přerušení léčby byl v obou skupinách stejně častý. Průjem a nauzea byly častější při kombinované léčbě. Rovněž počet pacientů s elevací jaterních testů byl méně častý ve skupině s kombinovanou léčbou, ale po redukci dávky se většinou norma JT normalizovala. Data z prospektivní dlouhodobé studie MTX + leflunomid rovněž ukazují dobrou toleranci této kombinace s retencí 72,4 % pacientů na léčbě po 6 měsících [16]. I přes tyto příznivé zprávy stále není kombinace MTX + leflunomid oficiálně doporučována EMEA.
Kombinace leflunomid a sulfasalazin byla zkoušena ve dvojslepé randomizované studii [17]. Pacientům léčeným leflunomidem byl buď přidán sulfasalazin, nebo byl pacient převeden na sulfasalazin. Kombinace byla účinnější jen v některých ukazatelích.
Nejasná je situace kolem kombinace leflunomidu a infliximabu. Zatím neexistují dvojitě slepé studie. Zatímco jedna otevřená studie prokázala větší toxicitu této kombinace, dvě ostatní ji nepotvrdily [18–20]. Mezinárodní fórum expertů doporučuje provést randomizovanou studii této kombinace. Prozatím se doporučuje zahajovat kombinovanou léčbu leflunomidem (a bez bolusové dávky) a infliximab přidat až v době, kdy je bezpečnost terapie leflunomidem etablována [14].
Účinnost leflunomidu v běžné klinické praxi
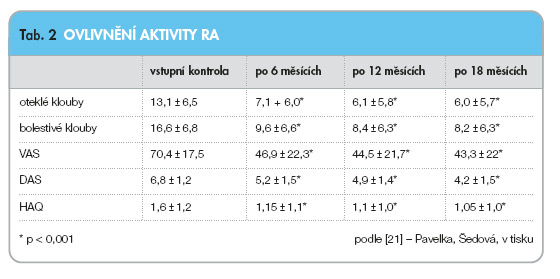
Na začátku klinického používání leflunomidu v České republice byla léčba pacientů registrována na formulářích České revmatologické společnosti a byla vyhodnocena jako kohortová studie IV. fáze. Do studie bylo zařazeno celkem 999 pacientů. Průměrná doba léčby byla 10,5 měsíce, šest měsíců léčby dokončilo 92,6 % a 12 měsíců léčby 83 % pacientů. Klinické odpovědi dle kritérií EULAR (pokles DAS > 1,2) bylo dosaženo u 68,3 % pacientů po 6 měsících a 66,1 % po 12 měsících [21]. K signifikantnímu poklesu došlo i u individuálních komponent DAS a zlepšila se signifikantně i funkce hodnocená pomocí HAQ (Health Assessment Questionnaire) (tab. 2). Závažnější nežádoucí účinky vedoucí k přerušení léčby se vyskytly v méně než 2 %, závažnější hepatopatie u 1 pacienta (0,1 %).
Klinická účinnost u psoriatické artritidy
T buňky hrají velmi důležitou roli v patogenezi psoriatické artritidy (PsA), a proto leflunomid, který inhibuje proliferaci T buněk, může být výborným kandidátem pro léčbu tohoto onemocnění. Otevřené studie také ukázaly, že leflunomid může mít příznivý účinek jak u psoriatické artritidy, tak i u psoriázy [22, 23].
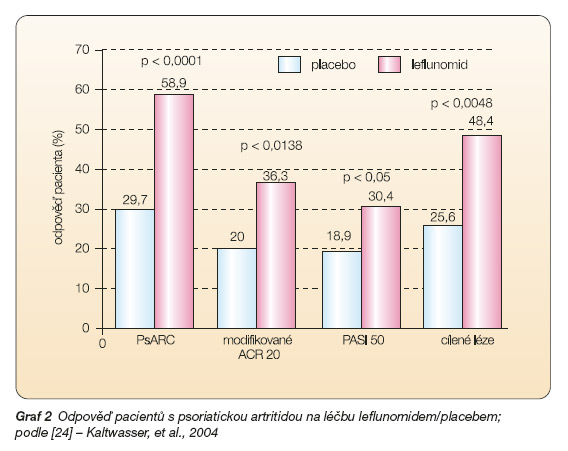
Přesvědčivý důkaz o účinnosti leflunomidu v této indikaci přinesla až dvojitě slepá randomizovaná, placebem kontrolovaná studie se 190 pacienty [24]. Jako primární kritérium účinnosti bylo zvoleno tzv. PsARC (Psoriatic Arthritis Response Criteria). Odpovědi po leflunomidu bylo dosaženo u 58,9 % vs 29,7 % po placebu (p < 0,0001) (graf 2). Vliv na kožní syndrom byl hodnocen pomocí skóre PASI (Psoriasis Area and Severity Index), přičemž kritériem byla redukce tohoto skóre o 50 %. Rozdíl mezi leflunomidem a placebem byl signifikantní (p < 0,05). PsA je indikace leflunomidu schválená FDA i EMEA.
Další indikace leflunomidu
Leflunomid byl zkoušen u juvenilní idiopatické artritidy (polyartikulární forma) v dvojslepé studii oproti methotrexatu [25]. Oba léky byly vysoce účinné a dobře tolerované, přičemž účinnost MTX byla oproti leflunomidu mírně vyšší (pokles JRA o 30 % dosažen u 84,4 % vs 68,1 %, p = 0,016). Dvojitě slepá randomizovaná studie zatím nepotvrdila účinnost u ankylozující spondylitidy [26].
Další dvojitě slepá randomizovaná, placebem kontrolovaná studie ukázala klinickou účinnost leflunomidu u systémového lupus erythematodes [27]. Celkový počet pacientů byl velmi malý a je potřeba provést další větší studie.
Dalšími potenciálními indikacemi do budoucna, u kterých je leflunomid zkoušen, jsou Wegenerova granulomatóza a Crohnova nemoc [1].
Zařazení do palety léčiv
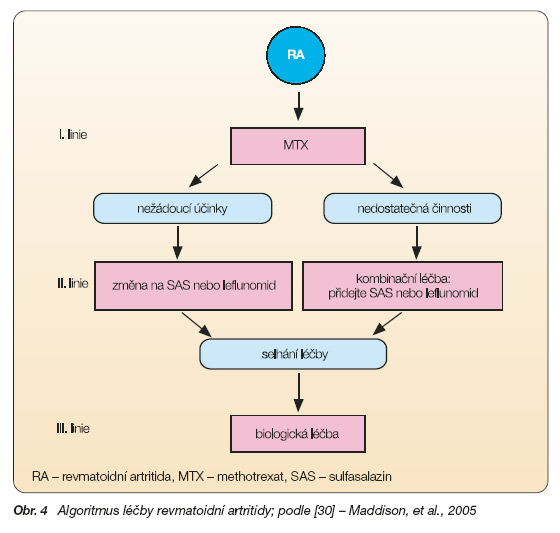
Zařazení leflunomidu do algoritmu léčby revmatoidní artritidy v rámci aplikace DMARDs se věnuje konsenzuální dokument publikovaný v roce 2005 [30]. Vychází z obecných principů léčby aktivní revmatoidní artritidy: včasné nasazení DMARDs, kontinuální podávání DMARDs, kombinování DMARDs, precizní monitorování účinnosti i toxicity DMARDs.
Leflunomid je dle dostupné literatury a 2 provedených metaanalýz srovnatelně účinný jako methotrexat a sulfasalazin. Snášenlivost leflunomidu je rovněž srovnatelná s methotrexatem a sulfasalazinem. Nicméně konsenzuální skupina autorů [30] se domnívá, že lékem první volby v léčbě RA je methotrexat, který je účinný, má nízký výskyt závažných nežádoucích účinků a je levný. Pro pacienty, kteří mají nežádoucí reakce po methotrexatu, nebo mají nedostatečný efekt MTX, mohou být použity jako léky druhé volby v monoterapii sulfasalazin nebo leflunomid. Alternativou může být kombinovaná léčba leflunomidem a methotrexatem (obr. 4). U pacientů, kteří nemají klinický efekt při výše uvedeném postupu, se jako léky třetí volby používají TNF-a blokující léky.
Indikace
Leflunomid je indikován k léčbě dospělých pacientů:
– ‑s aktivní revmatoidní artritidou jako tzv. chorobu modifikující antirevmatikum,
– ‑s aktivní psoriatickou artritidou.
Kontraindikace
Vzhledem k nedostatku důkazů by lék neměl být podáván dětem a mladistvým do 18 let, podávání těhotným a kojícím matkám je též kontraindikováno. Samozřejmou kontraindikací je přecitlivělost na leflunomid. Lék by neměl být podáván ani u těžkých stavů, jako je jaterní a ledvinová nedostatečnost, imunodeficience či poškozená funkce kostní dřeně.
Nežádoucí účinky
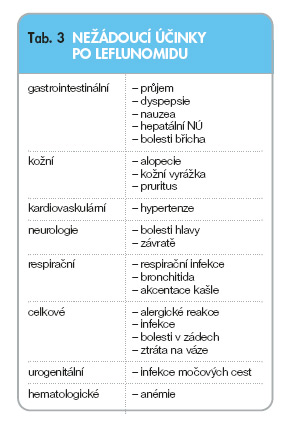
Leflunomid může vyvolávat nežádoucí účinky, které jsou sumárně uvedeny v tab. 3.
Celkový počet nežádoucích účinků, počet závažných nežádoucích účinků a nežádoucích účinků daných do kauzální souvislosti s terapií byl po leflunomidu srovnatelný s počtem nežádoucích účinků po SAS a MTX [8–12]. Nejčastějšími nežádoucími účinky byly: průjem (32 %), respirační infekce (32 %), bolesti hlavy (17 %), nauzea a dyspepsie (16 %), hypertenze (16 %), kožní rash (15 %), reverzibilní alopecie (9 %). Elevace jaterních testů se vyskytuje v 12–15 %. Incidence infekcí nebyla častější než ve skupině léčené MTX nebo placebem.
Nedávno byla publikována metaanalýza studií fáze II a III klinického zkoušení leflunomidu, která ukázala podobnou incidenci nežádoucích účinků po leflunomidu, methotrexatu a sulfasalazinu. Častější elevace jaterních testů po methotrexatu mohla být způsobena tím, že pacienti nebyli suplementováni folátem [28].
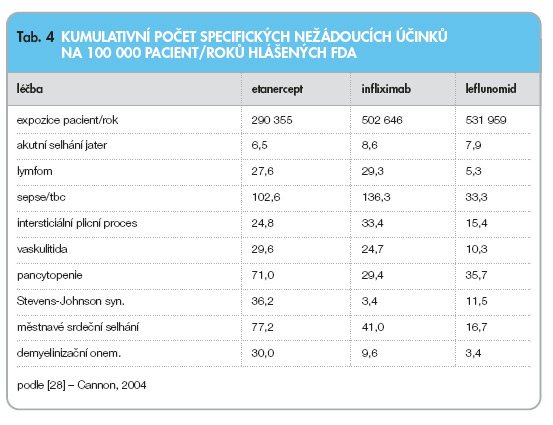
Závažné nežádoucí účinky leflunomidu a biologických léků (tab. 4) jsou srovnatelné [28].
Po ukončení fáze III klinického zkoušení byl lék zaveden do širší klinické praxe. V rámci postmarketingové farmakovigilance byly hlášeny případy závažné hepatotoxicity, které vyústily až v oficiální žádost pacientských svazů o přezkoušení hepatální bezpečnosti leflunomidu adresovanou FDA; stejná žádost byla předložena i Evropské lékové agentuře EMEA.
Při analýze dat byly hodnoceny i právě dokončované postmarketingové studie z USA a Francie [29]. Např. analýza velké americké databáze AETNA ukázala procentuálně nižší výskyt elevace jaterních testů po léčbě leflunomidem než po léčbě MTX. Rovněž Česká revmatologické společnost provedla analýzu toxicity leflunomidem z celostátní databáze. Sledovali jsme 348 pacientů, kteří byli zařazeni do studie průměrně 6 měsíců. Elevace JT se vyskytla celkem 18krát, k přerušení léčby došlo pouze 6krát. Závažné hepatopatie se nevyskytly [21].
Lékové interakce
V kombinaci s hepatotoxickými léky (např. methotrexatem) může leflunomid synergicky zvyšovat hladiny jaterních enzymů. Cholestyramin či aktivní uhlí způsobují pokles plazmatických koncentrací leflunomidu, což lze využít při předávkování leflunomidem. Studie in vitro poukázaly na možný inhibiční účinek leflunomidu na CYP 2C9, což by mohlo potenciálně ovlivnit plazmatické hladiny phenytoinu, warfarinu, tolbutamidu a dalších látek.
Monitorování bezpečnosti léčby leflunomidem
FDA doporučuje při monitorování bezpečnosti postup v podstatě identický jako při monitorování hepatotoxicity MTX. Doporučuje monitorovat jaterní testy měsíčně. Pacienti s elevací JT 3krát nad normu by měli být monitorováni v týdenních intervalech. Při elevaci ALT 2–3krát vyšší, než je norma, doporučuje FDA redukovat dávku na 10 mg denně. Při elevaci 3krát a více doporučuje leflunomid vysadit. Před zahájením léčby by měl být pacient vyšetřen na přítomnost hepatitidy B a C. Lék by neměl být podáván pacientům s perzistujícím hepatálním postižením. V případě závažné hepatotoxicity je možné podat cholestyramin. Kombinace leflunomidu s MTX zatím není příliš doporučována.
Balení
Viz tab. 5.
Seznam použité literatury
- [1] Kaltwasser JP, Behrens F. Leflunomide: long-term clinical experience and new uses. Expert Opin Pharmacother 2005; 6: 787–799.
- [2] Barlett RR, Brendel S, Zielinski T, et al. Leflunomide, an immunorestoring drug for the autoimmune disorders, esspecially rheumatoid arthritis. Transplant Proc 996; 28: 3074–3078.
- [3] Cherwinski HM, Cohn RG, Cheung P, et al. The immunosupressant leflunomide inhibits lymphocyte proliferation by inhibiting pyrimidine biosynthesis. J Pharmacol Exp Ther 1995; 275: 1043–1049.
- [4] Herrmann ML, Schlayerbach, Kirschbaum. Leflunomide: an immunomodulatory drug for the treatment of rheumatoid arthritis and other autoimmune diseases. Immunopharmacology 2000; 47: 273–289.
- [5] Fox RI, Herrman M, Costacis G, et al. How does leflunomide modulate the immune response in rheumatoid arthritis. Bio Drugs 1999; 4: 301–315.
- [6] Chong AS, Huang W, Lin W, et al. In vivo activity of leflunomide pharmacokinetics analyses and mechanism of immunosupression. Transplantation 1999; 68: 100–109.
- [7] Doležal T. Leflunomid. Remedia 2002; 12: 55–56.
- [8] Strand V, Cohen S, Schiff M, et al. Treatment of active rheumatoid arthritis with leflunomid compared with placebo and methotrexate. Arch Intern Med 1999; 159: 2542–2550.
- [9] Smolen JS, Kalden JR, Scott DL, et al. Efficacy and safety of leflunomide compared with placebo and sulfasalazine in active rheumatoid arthritis: a double blind, randomized, multicenter study. Lancet 1999; 353: 259–266.
- [10] Scott DL, Smolen JS, Kalden JR, et al. Treatment of active rheumatoid arthritis with leflunomide: two year follow up of a double blind, placebo controlled trial versus sulfasalazine. Ann Rheum Dis 2001; 60: 913–923.
- [11] Emery P, Breedveld FC, Lemmel EM, et al. A comparison of the efficacy and safety of leflunomide and methotrexate for the treatment of rheumatoid arthritis. Rheumatology (Oxford) 2000; 39: 655–665.
- [12] Kalden JR, Scott DL, Smolen JS, Schattenkirchner M, Rozman B, et al. European Leflunomide Study Group. Improved functional ability in patients with rheumatoid arthritis – longterm treatment with leflunomide versus sulfasalzine. European Leflunomide Study Group. J Rheumatol 2002; 29: 205.
- [13] van der Heijde D, Kalden J, Scott D, Smolen J, Strnad V. Long term evaluation of radiographic disease progression in a subset of patients with rheumatoid arthritis treated with leflunomide beyond 2 years. Ann Rheum Dis 2004; 63: 737–739.
- [14] Kalden JR, Smolen JS, Emery P, et al. Leflunomide in combination therapy. J Rheumatol 2004; 71 (Suppl.): 25–30.
- [15] Kremer J, Genovese M, Cannon GW, Caldwell J, Cush J, Furst DE, et al. Combination leflunomide and methotrexate (MTX) therapy for patients with active rheumatoid arthritis failing MTX monotherapy: open – label extension of a randomized, double-blind, placebo controlled trial. J Rheumatol 2004; 31: 1521–1531.
- [16] Chung C, Mallon C, Spady B, Russell AS, Maksymowych WP. Survival analysis of treatment with leflunomide, combination leflunomide/methotrexate, and infliximab for rheumatoid arthritis in routine clinical practice. Presented at The 68th Annual Meeting of the American College of Rheumatology 2003; Abstract 793.
- [17] Dougados M, Combe B, van Riel P, et al Efficacy and safety of leflunomide in combination with SSZ versus SSZ in patients with rheumatoid arthritis: results from RELIEF study. EULAR 2002; Abstrakt.
- [18] Antoni C, Nüsslein HG, Wollenhaupt J, Burmester GR, Krüger K, Kalden JR. Combination treatment with infliximab and leflunomide in patients with active rheumatoid arthritis: safety and efficacy in an open-label clinical trial. Presented at The Annual European Congress of Rheumatology EULAR 2004; Abstract FRI0093.
- [19] Struppler CI, Thies W, Schattenkirchner M, Kellner H. Safety and efficacy of leflunomide and infliximab in rheumatoid arthritis (RA) patients. Presented at The Annual European Congress of Rheumatology EULAR 2002; Abstract AB0157.
- [20] Kiely PDW, Johnson DM. Infliximab and leflunomide combination therapy in rheumatoid arthritis: an open-label study. Rheumatology 2002; 41: 631–637.
- [21] Pavelka K, Šedová L. Zkušenosti s aplikací leflunomidu (ARAVA) v léčbě aktivní RA v klinické praxi v České republice. Česká revmatologie. V tisku.
- [22] Liang GC, Barr WG. Open trial of leflunomide for refractory psoriasis and psoriatic arthritis. J Clin Rheumatol 2001; 7: 366–370.
- [23] Reich K, Hummel KM, Beckmann I, Mossner R, Neumann C. Treatment of severe psoriasis and psoriatic arthritis with leflunomide. Br J Dermatol 2002; 146: 335–336.
- [24] Kaltwasser JP, Nash P, Gladman D, et al. Efficacy and safety of leflunomide in the treatment of psoriatic arthritis and psoriasis. A multinational, double-blind, randomized, placebo-controlled clinical trial. Arthritis Rheum 2004; 50: 1939–1950.
- [25] Silverman E, Spiegel L, Jung LK, et al. Efficacy and safety of leflunomide (LEF) versus metho-trexate (MTX) in the treatment of pediatric patients with juvenile rheumatoid arthritis (JRA). Presented at The 68th Annual Meeting of the American College of Rheumatology 2003; Poster 511.
- [26] van Denderen JC, van der Paardt M, Nurmohamed MT, De Ryck YM, Dijkmans BAC, van der Horst-Bruinsma IE. Double-blind, randomized, placebo-controlled study of leflunomide in the treatment of active ankylosing spondylitis. Presented at The Annual European Congress of Rheumatology EULAR 2004; Abstract SAT0033.
- [27] Tam LS, Li EK, Wong CK, Lam CW, Szeto CC. Double-blind, randomized, placebo-controlled pilot study of leflunomide in systemic lupus erythematosus. Lupus 2004; 13: 601–604.
- [28] Cannon GW, Strand V, Oed C, Scarazzini L, Holden W L. Adverse events during clilnical trials comparing leflunomide, methotrexate, sulfasa-lazine, and placebo. Meta-analysis of data from Phase II and III controlled clinical trials. Presented at The Annual European Congress of Rheumatology EULAR 2004; Abstract and poster FRI0014.
- [29] Cannon GW, Holden WL, Juhaeri J, Dai W, Scarazzini L, Stang P. Adverse events with disease modifying antirheumatic drugs (DMARD): a cohort study of leflunomide compared with other DMARD. J Rheumatol 2004; 31: 1906–1911.
- [30] Maddison P, Kiely P, Kirkan B, et al. Leflunomide in rheumatoid arthritis: recommendations through a process of consensus. Rheumatology 2005, 44: 280-286