Natalizumab
Natalizumab je monoklonální protilátka schválená EMEA a FDA v roce 2006 k monoterapii vysoce aktivní a rychle se rozvíjející relaps-remitentní formy roztroušené sklerózy, zejména v případech nedostatečné účinnosti léčby interferony beta a glatiramer acetátem. Byl zařazen spolu s těmito imunomodulátory do skupiny léčiv ovlivňujících onemocnění (disease modifying drugs – DMDs), je však reprezentantem další generace léčiv této skupiny. V současné době je podáván pouze na specializovaných pracovištích, jimiž jsou v ČR Centra pro diagnostiku a léčbu demyelinizačních onemocnění (MS centra). Natalizumab je aplikován jednou za 4 týdny. Doba trvání infuze je 60 minut, nemocný zůstává dalších 60 minut v observaci na tomto pracovišti, zejména z důvodu možných známých bezprostředních příznaků přecitlivělosti na léčivý přípravek. Hypersenzitivní reakce na podání infuze natalizumabu představuje soubor nespecifických nežádoucích symptomů (exantém, únava, nauzea, bolesti kloubů či hlavy aj.). Přibližně u 6 % nemocných se v průběhu terapie objeví protilátky proti natalizumabu, což do jisté míry může limitovat jeho léčebný účinek. Podávání natalizumabu je spojováno se zvýšeným rizikem výskytu progresivní multifokální leukoencefalopatie v poměru 1 : 1000; jde o závažnou komplikaci léčby natalizumabem, na kterou dosud není známa účinná léčba. Před zahájením léčby je nezbytné pacienty informovat o výhodách a rizicích této léčby.
Farmakologická skupina
Natalizumab je řazen do skupiny selektivních imunosupresivních látek, ATC kód L04AA23.
Natalizumab patří do skupiny monoklonálních protilátek (mAbs), které byly poprvé identifikovány Kohlerem a Milsteinem v roce 1975 [1]. První úspěchy s mAbs byly zaznamenány v transplantologii v procesu ovlivnění orgánové rejekce. Na počátku to byla mAb muromonab-CD3 cílená na CD3 T-buněčného antigen-receptorového komplexu. Původní mAbs byly produkovány na zvířecím modelu (myš), avšak myší mAbs indukovaly u pacientů alergické reakce anebo generovaly protilátky (Human Anti-Mouse Antibody = HAMA). HAMA redukovaly účinnost mAbs jejich sekvestrací a degradací. Proto začaly být konstruovány postupně mAbs na lidské molekule, jenom vazebná místa zůstala totožná jako na myším modelu, a jsou označovány jako „humanized mAbs". Imunitní systém neidentifikuje takovouto humanizovanou mAb jako cizorodou bílkovinu, a proto je významně redukováno riziko alergických reakcí a generování HAMA. Ukázalo se, že je lze s výhodou užít k přímé aplikaci do nádorových buněk a k léčbě zhoubných nádorů. Rituximab a trastuzumab přidané ke standardní chemoterapii v rámci randomizovaných klinických studií zlepšily globální přežití pacientů s malignitou [1, 2]. Laboratorně zkoumaný účinek mAbs na experimentální autoimunitní encefalomyelitidu (EAE) vedl k nalezení nových specifických mAbs schopných inhibice EAE – natalizumabu a daklizumabu.
Natalizumab je první antagonista a4-integrinu nové třídy selektivně působící inhibici jeho vazby na adhezivní molekuly 1 vaskulárního endotelu (VCAM-1) [1, 3], která je důležitá pro leukocyto-endoteliální adhezi a migraci leukocytů přes hematoencefalickou bariéru (HEB). Tento a4-integrinový antagonismus inhibuje migraci leukocytů do mozku, a tím redukuje zánět spojený s lézí mozkové tkáně. Stejně tak ve střevě má natalizumab schopnost blokovat tuto molekulární interakci a-integrinů s VCAM-1 cév střeva a s adhezivními molekulami 1 buněk slizničního endotelu (mucosal addressin-cell adhesion molecule 1 = MAdCAM-1).
Chemické a fyzikální vlastnosti
Natalizumab je rekombinantní humanizovaná protilátka a4-integrinu produkovaná linií myších buněk na základě technologie rekombinantní DNA. Přípravek je dodáván jako sterilní, bezbarvý, čirý nebo lehce opalescentní roztok bez viditelných částic určený pro intravenózní infuzní podání. V 15 ml je obsaženo 300 mg natalizumabu (20 mg/ml) ve vodě pro injekce. Molekulová hmotnost natalizumabu je 149 kilodaltonů.
Mechanismus účinku, farmakodynamika
Natalizumab je specifická rekombinantní humanizovaná monoklonální protilátka proti a4-integrinům, která je historicky zkoumána ve dvou základních výzkumných projektech pro léčbu roztroušené sklerózy (RS) a Crohnovy choroby.
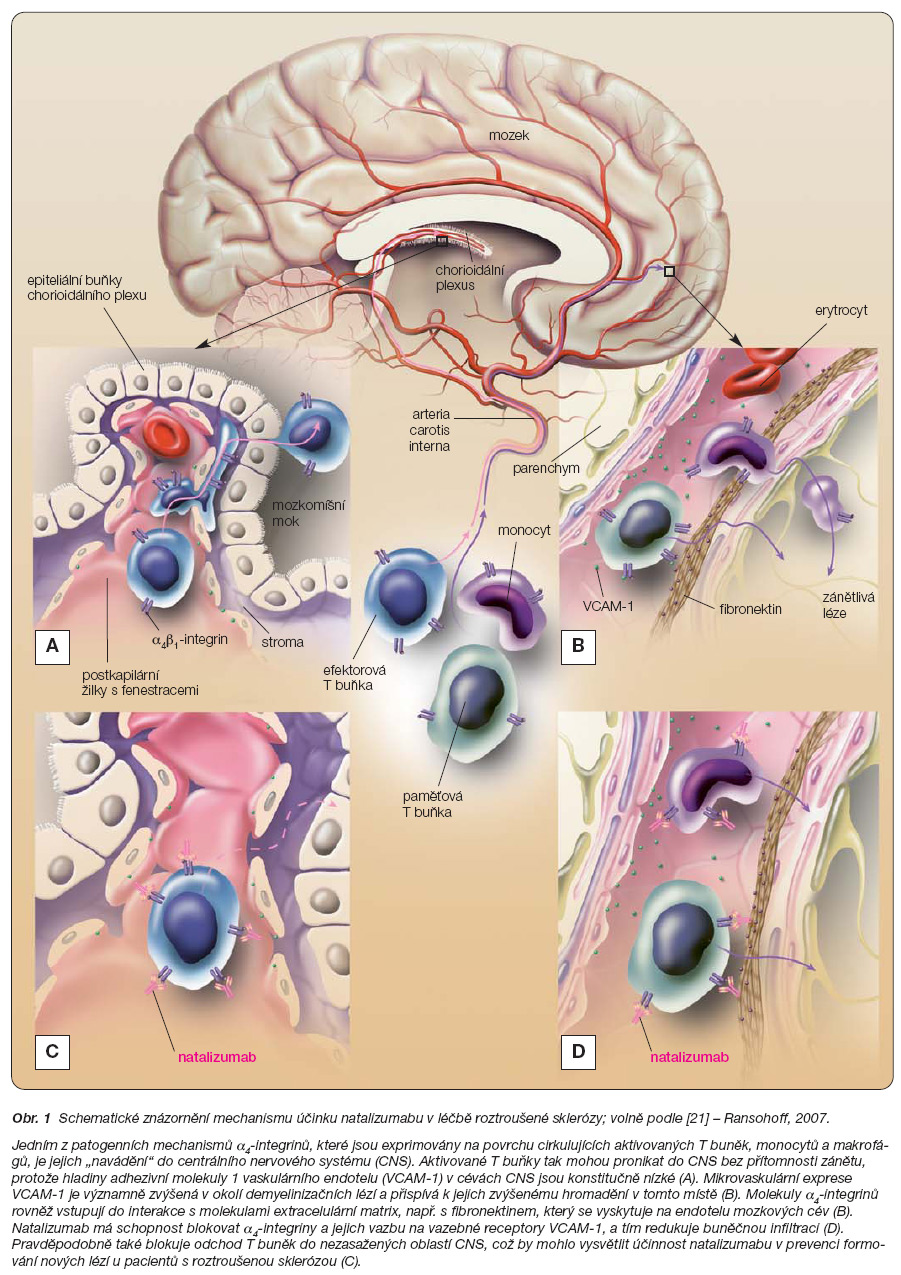
Svým základním popsaným a ověřeným mechanismem účinku natalizumab vstupuje do interakce s a4-integriny, resp. se dvěma z nich: a4b1 a a4b7 a jejich ligandy VCAM-1 a MAdCAM-1. Fyziologicky a4b1-VCAM-1 zprostředkují navádění a retenci hematopoetických progenitorových buněk a IgG produkujících plazmatických buněk v kostní dřeni. Zároveň zprostředkovávají interakci mezi buňkami kostní dřeně a vznikajícími B buňkami, což je důležité pro jejich zrání. Interakce mezi zralými B buňkami a folikulárními dendritickými buňkami je rovněž zprostředkována a4b1-VCAM-1; a4b7-MAdCAM-1 jsou důležité pro udržování střevní slizniční imunity, zejména pro navádění naivních lymfocytů do lymfoidní tkáně střeva a pro migraci paměťových naváděcích střevních buněk do střevní lamina propria. Kromě těchto fyziologických funkcí je jedním z patogenních mechanismů a4-integrinů u člověka „navádění" cirkulujících aktivovaných T buněk, monocytů a makrofágů do centrálního nervového systému (CNS). Aktivované T buňky tak mohou pronikat do CNS bez přítomnosti zánětu, protože hladiny VCAM-1 v cévách CNS jsou konstitučně nízké. Mikrovaskulární exprese VCAM-1 je významně zvýšená v okolí demyelinizačních lézí a přispívá k jejich zvýšenému hromadění v tomto místě. U Crohnovy choroby se patogenní T buňky přednostně dostávají do střeva prostřednictvím a4b7-MAdCAM-1, ale mohou se zde uplatňovat také a4b1-VCAM-1.
Natalizumab má schopnost blokovat a4b1-integriny a a4b7-integriny, resp. vazbu a4b1-integrinu a a4b7-integrinu na endoteliální vazebné receptory VCAM-1 a MAdCAM-1. Tyto molekulární interakce jsou potřebné pro vstup lymfocytů do CNS (zprostředkovaný a4b1 a VCAM-1) a do střeva (zprostředkovaný a4b7 a MAdCAM-1). Bylo prokázáno, že záchyt leukocytů z krve do tkáně je regulován následným spojením adhezivních signálních molekul na leukocytech a endoteliálních buňkách. Iniciální kontakt leukocytů s adhezivními molekulami jim dovoluje pomalý pokles a posun podél cévní stěny. Tento krok je lehce reverzibilní a může být zprostředkován selektiny, a4-integriny nebo oběma. K zástavě a vazbě „valících se" leukocytů je nutný aktivační signál např. chemokiny, který proměňuje integriny do stavu vysoké afinity a dovoluje buňce zastavit se. Leukocyty se dostávají do tkáně pouze tehdy, když je naplněn tento krok. Tyto dva a4-integriny a jejich vazebné receptory mají unikátní roli v této vícestupňové kaskádě, protože jsou to jediné molekuly, které změnou své afinity ke stěně cévní nebo sliznici střeva nabývají obou vlastností. Důkazy přinesly studie EAE, jež se na zvířecím modelu zabývaly autoimunitním onemocněním zprostředkovaným T buňkami podobným RS [4]. Normálně nízká exprese VCAM-1 je vlivem zánětlivých podnětů zvýšená a předchází perivaskulární infiltraci leukocyty. Podobně je tomu v CNS u pacientů s RS. Protilátky proti a4-integrinům redukují buněčnou infiltraci, a tak blokují vývoj EAE. Inhibitory a4-integrinů by mohly blokovat odchod T buněk do nezasažených oblastí CNS. Tento mechanismus by mohl vysvětlit účinnost natalizumabu v prevenci formování nových lézí u pacientů s RS (obr. 1).
Molekuly a4-integrinů vstupují také do interakce s molekulami extracelulární matrix, jako je fibronektin, a s VCAM-1 neendoteliálních buněk, zejména kostní dřeně a lymfatické tkáně. Touto cestou působí a4-integriny na imunitní systém. Proto se ukázalo, že u EAE je více účinná blokáda a4-integrinů než blokáda VCAM-1 nebo protilátek, které vážou a4-integriny, ale neovlivňují migraci lymfocytů. Je proto možné, že natalizumab blokuje další patologické mechanismy, které se nevztahují k migraci T buněk.
U Crohnovy choroby je účinnost natalizumabu závislá na inhibici vazby a4b7-integrinu na MAdCAM-1, která je exprimována ve střevních venulách a v lymfatické tkáni asociované se střevem. Kterýkoliv z uvedených mechanismů působení natalizumabu měl jen částečně protizánětlivé účinky, jednalo se však o relativně krátký léčebný interval. Navíc potvrzuje to, že při střevním zánětu existují další cesty hromadění leukocytů. Zánětlivý infiltrát u Crohnovy choroby je především neutrofilní, který neexprimuje normálně a4-integriny, ale spíše b2-integriny směřující do místa zánětu. Natalizumab zde tedy inhibuje jen relativně malou populaci T buněk. Tyto jsou potřebné pro indukci sekundárních signálních molekul, jako jsou cytokiny a chemokiny, které jsou potřebné pro udržení infiltrace neutrofily.
Natalizumab aplikovaný intravenózně jedenkrát za 4 týdny má několik předností. Například vazbou vytvářené protilátky se vyvinuly pouze u 11 % pacientů s RS a u 7 % pacientů s Crohnovou nemocí. Malé molekuly tak méně stimulují protilátkovou odpověď. Chronická inhibice a4-integrinů by mohla působit nevhodnými vlivy, které jsou nezávislé na imunogenicitě farmakologického inhibitoru. Příjemci natalizumabu měli zvýšenou hladinu lymfocytů, monocytů a eozinofilů, což je konzistentní s expresí a4-integrinů na leukocytech, zatímco hladina neutrofilů se neměnila. Protilátky neinterferují s neutrofily, které jsou nezávislé na a4-integrinech a jsou důležité v boji proti bakteriálním a plísňovým infektům. Pacienti léčení natalizumabem mají vyšší incidenci infektů, speciálně faryngitid.
Farmakokinetické vlastnosti
S odstupem 4 týdnů po aplikaci natalizumabu v dávkách 1–3 mg/kg pacientům s roztroušenou sklerózou dosahovaly jeho koncentrace v séru hodnoty vyšší než 1 mg/l, přičemž biologický poločas se pohybuje při podání stejných dávek v rozmezí 92,4–108 hodin a celková clearance v rozmezí 0,3–0,6 ml/h/kg. Distribuční objem dosahuje hodnoty kolem 90 ml/kg [5]. Vzhledem k frekvenci opakovaného podávání 300 mg natalizumabu intravenózně 1krát za 4 týdny u nemocných s relaps-remitentní formou RS a vzhledem k dlouhému biologickému poločasu bývá ustálených plazmatických koncentrací dosaženo přibližně po 36 týdnech – průměrná koncentrace odpovídá 23–29 mg/ml [5].
Průměrný biologický poločas po dosažení ustálené koncentrace činil 11 6 4 dny, distribuční objem 5,7 6 1,9 l/kg a clearance natalizumabu 16 ml 6 5 ml/h. Základní farmakokinetické parametry natalizumabu u pacientů s roztroušenou sklerózou jsou shrnuty v tab. 1.
V randomizované, dvojitě zaslepené klinické studii (n = 244) byla sledována farmakokinetika natalizumabu u pacientů s Crohnovou nemocí. Po rozdělení do 4 jednotlivých skupin (natalizumab jednorázově 3 mg/kg, natalizumab 2krát 3 mg/ kg s odstupem 4 týdnů či 2krát 6 mg/kg s odstupem 4 týdnů či placebo) bylo dosaženo následujících maximálních plazmatických koncentrací (cmax): 85,1 mg/ml, 83,1 mg/ml a 147 mg/ml. Průměrné hodnoty biologického poločasu se pohybovaly v rozmezí 132 až 161 hodin.
Klinické zkušenosti
Účinnost natalizumabu byla ověřena v několika randomizovaných, dvojitě slepých multicentrických klinických studiích kontrolovaných placebem [6–8]. Například ve studii fáze III v monoterapii u pacientů s relaps-remitentní formou RS (AFFIRM) [7] nebo u pacientů léčených kombinovanou terapií s interferonem beta-1a (SENTINEL) [8].
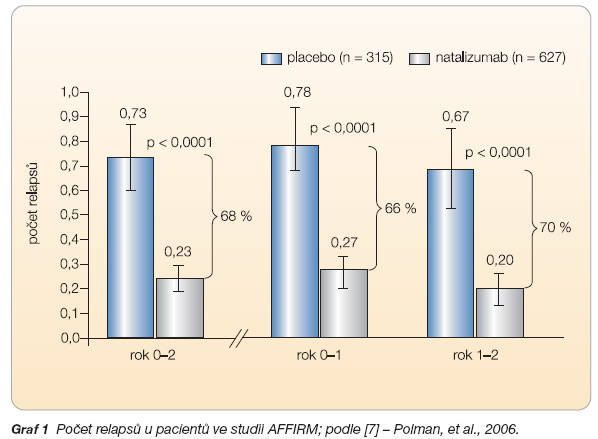
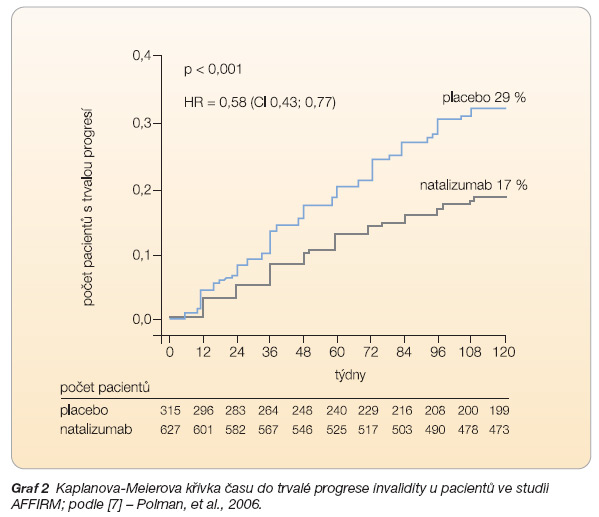
Léčba natalizumabem v monoterapii v první citované studii [7] zahrnovala 627 pacientů léčených natalizumabem a 315 ve skupině s placebem, klinicky vedla po dvou letech k signifikantnímu snížení výskytu relapsů o 68 % (p < 0,001) a ke snížení rizika trvalé progrese invalidity o 42 % (p < 0,001), viz graf 1, 2. Po roce sledování bylo bez progrese ve skupině natalizumabu 77 % pacientů a v placebové skupině 56 % pacientů, po dvou letech to bylo 67 % vs. 41 % pacientů.
Natalizumab signifikantně redukoval počet gadolinium(Gd)-vychytávajících lézí v průběhu druhého roku léčby o 92 % (p < 0,001). Ve skupině natalizumabu rovněž došlo k redukci počtu nových nebo zvětšujících se stávajících T2 hyperintenzních lézí (detekováno MR) po 2 letech léčby o 83 % (p < 0,001). Po 2 letech nebyla u 57 % pacientů, kteří byli léčeni natalizumabem, detekována žádná nová nebo zvětšující se hyperintenzní léze; ve skupině dostávající placebo to bylo u 15 % pacientů. Celkem u 18 % pacientů léčených natalizumabem se během studie objevilo 3 a více nových nebo zvětšujících se hyperintenzních lézí, v placebové skupině byly zaznamenány u 68 % pacientů.
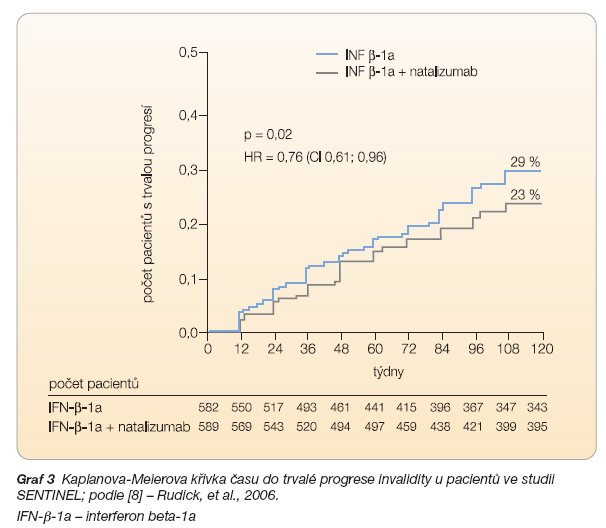
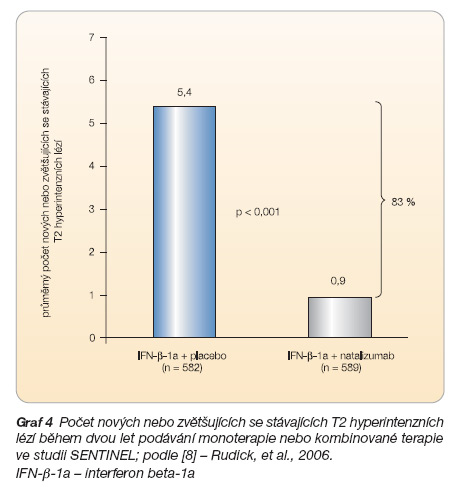
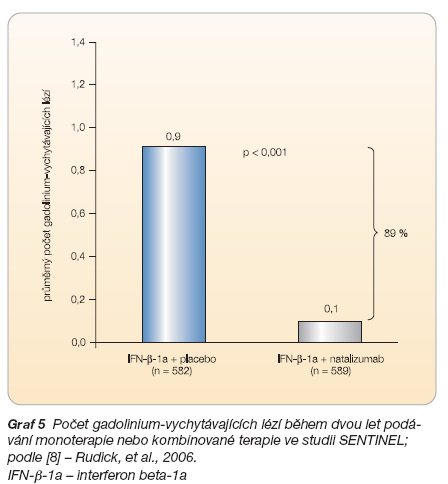
Klinická studie SENTINEL [8], která se zabývala srovnáním účinnosti monoterapie intramuskulárním interferonem beta-1a (n = 582) s účinností kombinované léčby natalizumabem a intramuskulárním inter-feronem beta-1a (n = 589), zaznamenala zvýšení účinnosti léčby po podání kombinované terapie ve srovnání s účinností monoterapie intramuskulárním interferonem beta-1a, a to jak v parametrech klinických (počet relapsů, progrese invalidity), viz graf 3, tak v zobrazení na magnetické rezonanci (MR) mozku (graf 4, 5). Riziko trvalé progrese invalidity bylo po podání kombinované terapie sníženo o 24 % (p = 0,02). Po dvou letech podávání terapie bylo bez relapsu onemocnění 54 % pacientů léčených kombinovanou terapií oproti 32 % pacientů léčených monoterapií, riziko relapsu u pacientů s kombinovanou terapií bylo o 50 % nižší než u pacientů s monoterapií (p < 0,001). Zda naopak kombinace s intramuskulárním interferonem beta-1a zvýšila účinnost natalizumabu, však není jasné.
V obou citovaných klinických studiích byla hodnocena kromě klinických parametrů relaps/rate a progrese disability také úroveň kognitivních funkcí. Z výsledků použité baterie testů vyplynulo signifikantní zlepšení kvality života (HRQoL = Health-Related Quality of Life) v porovnání s placebem [9].
Přestože byl natalizumab dobře tolerován, byly ve studii SENTINEL zaznamenány 2 případy progresivní multifokální encefalopatie (PML) u pacientů po podání 28 a 37 dávek natalizumabu v kombinaci s intramuskulárním interferonem beta-1a. Třetí případ PML byl zaznamenán v klinické studii léčby Crohnovy choroby natalizumabem, kde byl nález nejprve chybně hodnocen jako astrocytom. Tento pacient dostal celkem 8 dávek natalizumabu.
PML, jejíž etiologické agens, JC virus (JCV) ze skupiny lidských poliomavirů, byl izolován poprvé v roce 1970, byla popsána u imunosuprimovaných jedinců; v 80. letech byla PML identifikována jako příčina smrti u 4 % nemocných infikovaných virem HIV. Do roku 2005 nebyla PML uváděna jako příčina smrti v souvislosti s RS. I přesto, že se jedná v obou případech RS a PML o demyelinizaci bílé hmoty mozku, mají obě tyto choroby mnoho charakteristických odlišností. V klinickém obraze PML převažují na rozdíl od RS mozkové příznaky deteriorace intelektové, motorické, senzitivní a vizuální s rychlou progresí a úmrtím. Léze PML nebyly popsány na míše. Diagnostika MR je extrémně obtížná v časných stadiích PML u pacientů s RS. Mozkomíšní mok (MM) nemá buněčnou zánětlivou formuli, vzácně jsou přítomny oligoklonální pásy. Specifickou diagnostiku z mozkomíšního moku umožnilo až rozšíření o vyšetření JCV DNA sekvence z MM metodou polymerázové řetězové reakce (PCR), která vykazuje pozitivitu u 90 % případů [10]. Léčba PML není dostatečně prozkoumána, standardní antivirová léčba je neúčinná. U 3 případů ze 12 nemocných AIDS léčených inhibitorem topoizomerázy topotekanem bylo zaznamenáno prodloužení přežití, avšak podávání bylo provázenou signifikantní hematotoxicitou [11].
PML jako komplikace léčby natalizumabem je velmi závažná, její incidence je aktuálně 1 : 1000, avšak asociace léčby natalizumabem a výskyt PML jsou založeny pouze na poznatcích z krátkého období, kdy je natalizumab užíván v klinické praxi. Zda dlouhodobá léčba bude mít za následek zvýšenou incidenci PML při léčbě natalizumabem, však není známo [12].
Zařazení do současné palety léčiv
Současná léčba roztroušené sklerózy mozkomíšní (RS) je pouze částečně účinná. Tato skutečnost vede k neustálému hledání nové imunoterapie, která bude schopna měnit rovnováhu imunitního systému a bude použitelná k ovlivnění mechanismů autoimunity. S tímto cílem začaly být zkoumány některé monoklonální protilátky včetně natalizumabu.
Ten byl v rámci registrace v ČR zařazen do skupiny protinádorových, imunomodulačních a imunosupresivních látek. Pro klinickou indikaci léčby relaps-remitentní formy RS, zejména její vysoce aktivní a maligní varianty, je zařazen do skupiny tzv. léků dlouhodobě ovlivňujících onemocnění RS (DMDs). Nepochybně však představuje novou generaci léčiv této skupiny; jeho klinická účinnost a bezpečnost v léčbě trvající 2 roky byla ověřena celou řadou dvojitě slepých, randomizovaných multicentrických klinických studií kontrolovaných placebem. V kategorizaci léčivých přípravků určených pro léčbu relaps-remitentní RS aktuálně nepatří do skupiny léků první volby, kam řadíme interferony beta a glatiramer acetát (GA). Jeho základní indikací je eskalace léčby vysoce aktivní formy RS, navíc při současně nepotvrzené odpovědi na léčbu interferony beta a GA, je na přibližně totožné indikační úrovni s mitoxantronem, méně s cyklofosfamidem.
Účinnost léčby natalizumabem byla kvantifikována citovanými klinickými studiemi zejména v základních parametrech hodnocení (poměr relapsů, stupeň invalidity, aktivita zobrazená MR); léčba relaps-remitentní formy RS natalizumabem je mnohem efektivnější než léčba ostatními DMDs. Chybné zařazení natalizumabu na totožnou úroveň s interferonem beta a GA, nikoliv jako další generace DMDs, pak předznamenalo v současné době, při platných principech úhrady léčivých přípravků zdravotními pojišťovnami, přiznání finanční spoluúčasti pacienta na úhradě natalizumabu, která představuje řádově desítky tisíc korun za rok léčby. Odborné aktivity Neuroimunologické sekce České neurologické společnosti, aktivity veřejnosti i samotných pacientů snad přimějí příslušné odborné autority k revizi a k nápravě chybného rozhodnutí, poškozujícího nemocné v ústavou daném právu na jedinou účinnou léčbu definovaného stadia onemocnění relaps-remitentní formou RS.
Indikace
Natalizumab byl schválen EMEA (European Medicines Agency) a FDA (Food and Drugs Administration) jako jedinečná léčba ovlivňující onemocnění (single-disease-modifying therapy) u pacientů s relaps-remitentní formou RS; natalizumab je určen zejména k eskalaci léčby RS v případech vysoké aktivity onemocnění a rychle se rozvíjejícího onemocnění postihujícího CNS. Je indikován u pacientů, kteří měli inadekvátní odpověď na ostatní imunomodulační, imunosupresivní a kombinovanou léčbu, včetně léčby interferonem beta a glatiramer acetátem.
Z důvodu bezpečnosti i možnosti získání významných prospektivních dat je doporučeno pacienty léčené natalizumabem zařazovat a monitorovat v rámci mezinárodního předpisujícího programu TOUCH (Tysabri Outreach: Unified Commitment to Health Prescribing Program).
Bezpečnost a účinnost natalizumabu nebyla studována u dětských pacientů s RS do 18 let, proto není indikován k aplikaci u dětí. Na druhé straně není dostatečný počet léčených starších 65 let, aby bylo možno posoudit, zda jejich reakce není rozdílná oproti mladším pacientům.
V ČR doporučila Neuroimunologická sekce České neurologické společnosti, jaký by měl být profil pacienta s RS, u kterého je indikována léčba natalizumabem.
Profil pacienta k léčbě natalizumabem
– Jistá diagnóza RS podle revidovaných kritérií dle McDonalda z roku 2005 a zároveň potvrzení diagnózy pozitivním nálezem oligoklonálních pásů v MM.
– Předchozí léčba léky první volby trvající alespoň 9 měsíců, charakteristika jejího selhání je definována jako stav 2 a více relapsů za definované období s nedostatečnou úpravou nebo progrese o 1 stupeň Kurtzkeho EDSS, pokud bylo výchozí EDSS vyšší než 2,5, nebo o 1,5 stupně Kurtzkeho EDSS, pokud výchozí EDSS bylo nižší než 2,5. Rovnocenně jedné klinické atace lze aktivitu nemoci dokumentovat zánětlivou aktivitou RS zobrazenou na MR mozku a míchy s přítomností gadolinium-vychytávající léze či zánětlivým nálezem v MM (zvýšený počet mononukleárních buněk > 10/3).
– Pacient by měl mít před zahájením léčby provedenu v posledních 3 měsících MR.
– Pacient by měl podepsat informovaný souhlas o tom, že byl seznámen s riziky léčby, a ochotu poskytnout svá klinická data anonymně do celostátního, eventuálně mezinárodního registru.
– Pacient musí splnit následující laboratorní parametry: lymfocyty > 1000/ml), neutrofily > 1500/ml. (Pokud by pacient nesplňoval tato kritéria v souvislosti s předchozí léčbou DMDs, krevní obraz je nutné opakovaně vyšetovat každé 2–4 týdny až do návratu sledovaných parametrů k normálním hodnotám.)
– Pacient by neměl být v předchozích 3 měsících léčen vysokými dávkami cytostatik.
– Léčba natalizumabem se nesmí kombinovat s dlouhodobou léčbou kortikosteroidy, krátkodobé pulzy kortikosteroidů jsou možné.
– Diagnostikované maligní onemocnění nebo prekanceróza v anamnéze v posledních 10 letech je neslučitelná s léčbou natalizumabem.
– Dalšími kritérii vylučujícími léčbu natalizumabem jsou: a) invazivní mykotické infekce (Candida spp. a Aspergillus spp.) v posledních 6 měsících, b) herpes simplex nebo herpes zoster v posledních 4 týdnech, při perzistenci infekce v krvi či v likvoru je doporučena dlouhodobá profylaxe aciklovirem, c) jakákoliv oportunní infekce v posledních 3 měsících.
– Pacient v době zahájení léčby natalizumabem nesmí vykazovat akutní infekt (zejména močových cest, plic).
– Léčba bude poskytnuta na 6 měsíců, prodloužena může být vždy o dalších 6 měsíců při splnění kritérií účinnosti léčby.
Kontraindikace
Absolutní a relativní kontraindikace léčby natalizumabem vyplývají z výsledků klinických studií, zejména AFFIRM a SENTINEL.
Absolutní kontraindikací léčby natalizumabem je potvrzení diagnózy PML, která je také absolutní indikací k ukončení léčby natalizumabem. Diagnostikované maligní onemocnění nebo prekanceróza v anamnéze je rovněž neslučitelná s léčbou natalizumabem. K dalším absolutním kontraindikacím léčby natalizumabem patří prokázaná hypersenzitivní reakce na natalizumab, veškeré oportunní infekce, invazivní mykotické infekce, herpes simplex, herpes zoster a HIV infekce.
U imunokompromitovaných pacientů je relativní kontraindikace léčby natalizumabem v souvislosti s možným vyšším rizikem infekcí z důvodu ovlivnění migrujících leukocytů, resp. ovlivnění jejich penetrace přes stěnu cévní. Léčba natalizumabem u imunokompromitovaných pacientů znamená rovněž zvýšené riziko rozvoje PML. Proto před uvažovanou léčbou natalizumabem je nutné včasné ukončení imunosupresivní léčby (např. mitoxantron, azathioprin, cyklofosfamid, methotrexát, mykofenolát mofetil) a vyhodnocení stavu imunosuprese.
Stav imunosuprese je vyhodnocován podle následujících kritérií:
– Za nejzávažnější kritérium stavu imunosuprese je považován časový interval „washout period" mezi ukončením imunosupresivní léčby a zahájením léčby natalizumabem. Specifický „washout interval" pro jednotlivé imunosupresivní a imunomodulační látky nebyl dosud definován a je víceméně doporučován empiricky, protože chybějí vědecké důkazy délky biologického účinku imunoterapeutik na imunitní systém po ukončení léčby.
– Některé klinické parametry mohou korespondovat se stavem imunosuprese, proto je doporučeno cíleně se jimi zabývat před zahájením léčby natalizumabem:
a) invazivní mykotické infekce (Candida spp., Aspergillus spp.) v posledních 6 měsících (do této skupiny se neřadí povrchové mykotické infekce);
b) aktivní infekční proces (zejména plicní nebo močový);
c) těžký herpetický infekt nebo reaktivace (herpes simplex nebo herpes zoster) v posledních 3 měsících;
d) stav po oportunní infekci v posledních 3 měsících;
e) infekce virem HIV.
– Některé laboratorní parametry mohou rovněž signalizovat imunosupresivní stav. Celkový počet leukocytů (neutrofily >1500/ml, lymfocyty >1000/ml); poměr CD4+/CD8+ T lymfocytů; CD4+ > 500/ml; CD8+ > 250/ml.
I když budou splněny uvedené laboratorní parametry, nelze plně vyloučit riziko imunosupresivního stavu a PML, protože PML se může rozvinout i tehdy, když není průkaz stavu imunosuprese. Přesto před zahájením léčby natalizumabem musí být celkový počet leukocytů vyšší, než je určená dolní hranice normy.
Stanovení titru anti-JC virus protilátek je rovněž doporučeno před zahájením léčby natalizumabem. Nebyla však prokázána prediktivní hodnota testů na JC virus DNA z plazmy pro stanovení diagnózy PML. Ani negativní titr protilátek proti viru JC v průběhu léčby natalizumabem nevylučuje možnost infekce.
Mezi relativní kontraindikace léčby lze počítat také veškeré na infuzi vázané vedlejší reakce, které nastanou bezprostředně po aplikaci léčby natalizumabem (do 2 hod.) nebo v odložené fázi s přítomností perzistujících protilátek detekovaných již v prvních 6 měsících léčby. Do této skupiny lze zařadit období těhotenství a laktace.
Nežádoucí účinky
Vzhledem k povaze přípravku, resp. mechanismu jeho klinického účinku se nejčastěji setkáváme se sekundárním infekčním onemocněním (např. infekce močových cest, nazofaryngitida apod.).
Hypersenzitivní reakce na podání infuze natalizumabu (nejčastěji po 2. nebo 3. infuzi) je soubor nespecifických nežádoucích symptomů (exantém, únava, nauzea, bolesti kloubů či hlavy aj.), které v klinické studii AFFIRM byly popsány u 28 případů, z toho v 8 případech šlo o závažné nežádoucí reakce, z nichž 5krát se jednalo o systémovou anafylaktickou reakci (anafylaktický šok) [5, 13].
Přibližně u 6 % nemocných se v průběhu terapie objeví protilátky proti natalizumabu, což do jisté míry může limitovat jeho léčebný účinek [14, 15]. Perzistencí protilátek u 6 % nemocných a přechodnou incidencí u 3 % nemocných byla v klinických studiích vysvětlována zvýšená incidence reakcí na podání infuze natalizumabu, zejména to byly hypersenzitivní kožní reakce, bolesti hlavy, nauzea, kopřivka, mrazení nebo zčervenání.
Podávání natalizumabu je spojováno se zvýšeným rizikem výskytu (1 : 1000) progresivní multifokální leukoencefalopatie (PML); PML je závažnou komplikací léčby natalizumabem, na niž dosud není známa účinná léčba [16].
V únoru 2005 byla ukončena výroba všech lékových forem natalizumabu z důvodu výskytu dvou případů PML u pacientů, kteří dostávali natalizumab déle než dva roky v kombinaci s interferonem beta-1a. Následně další případ PML byl identifikován v klinické studii léčby Crohnovy choroby natalizumabem u pacienta, u něhož byl původně nález na mozku hodnocen jako astrocytom [10]. Byla provedena rozsáhlá bezpečnostní hodnocení u pacientů s cílem umožnit další léčbu natalizumabem, ale minimalizovat rizika nežádoucích účinků této léčby. Výsledkem bylo opakované schválení natalizumabu pouze k monoterapii relaps-remitentní formy RS v USA v červnu 2006 a následně i v Evropské unii.
Lékové interakce
Léčba natalizumabem bývá zmiňována především v souvislosti s možným vyšším rizikem výskytu infekcí z důvodu ovlivnění migrujících leukocytů, resp. ovlivnění jejich penetrace přes stěnu cévní. Toto riziko se tak logicky zvyšuje při současném užití imunosupresiv včetně kortikosteroidů, chemoterapie anebo je již přirozeně vyšší u pacientů s již přítomným imunodeficitem z jiné příčiny. V ojedinělých případech u imunokompromitovaných pacientů bylo zaznamenáno onemocnění PML [17]. Imunosupresivní léčiva představují zvýšené riziko vývoje PML, ale i dalších oportunních infekcí. Předpokladem je ukončení imunosupresivní léčby (např. mitoxantron, azathioprin, cyklofosfamid, methotrexát, mykofenolát mofetil). Před zahájením léčby natalizumabem je proto nezbytné určit, zda pacient, který dostával imunosupresivní léčiva, nevykazuje stav imunosuprese. Byly definovány parametry klinické a laboratorní, které mohou pomoci tento stav identifikovat [18], viz výše.
Za nejzávažnější je považován časový interval „washout period" (tzv. vymývací perioda) mezi ukončením imunosupresivní léčby a zahájením léčby natalizumabem. Specifický „washout interval" pro jednotlivé imunosupresivní a imunomodulační látky nebyl dosud definován a je víceméně doporučován empiricky, protože chybějí vědecké důkazy délky biologického účinku imunoterapeutik na imunitní systém po ukončení léčby. Pro interferony b je tento interval maximálně 6 týdnů, pro azathioprin 3 měsíce a pro mitoxantron 6 měsíců.
Nejsou k dispozici data, která se zabývají vlivem vakcinace u pacientů léčených natalizumabem, rovněž také chybějí data sledující sekundární transmisi infekce atenuovanou vakcínou u pacientů léčených natalizumabem.
Těhotenství a kojení
Neexistují žádné odpovědné a kontrolované studie s natalizumabem u těhotných žen. Animální reprodukční studie nejsou vždy prediktivní pro lidskou populaci. V případě, že žena léčená natalizumabem otěhotní, mělo by být zvažováno přerušení léčby a žena by měla být zaregistrována do mezinárodního registru těhotných žen léčených natalizumabem.
V reprodukčních animálních studiích na opicích a guinejských prasatech při dávkování natalizumabu 30 mg/kg (7krát vyšší než léčebná dávka u člověka) nebyl zjištěn žádný teratogenní účinek. Pouze v jedné studii byla zaznamenána mírná redukce přežití novorozence v prvních 14 dnech po narození. Počet abortů takto léčených opic byl 33 % proti kontrolní skupině se17 % abortů.
V reprodukčních animálních studiích byl studován vliv léčby natalizumabem na plod. Byla zaznamenána lehká anemizace, redukce počtu trombocytů, zvýšení hmotnosti sleziny a naopak snížení hmotnosti jater a brzlíku, pokles jaterní hematopoézy. U narozeného potomstva nebyla anémie zjištěna. Rovněž tak jedinci exponovaní intrauterinně a v době kojení nevykazovali změny na lymfatických orgánech spojené s léčbou natalizumabem a vykazovali normální imunitní odpověď na T-buněčné antigeny. Protože není známo, zda natalizumab přechází do mateřského mléka, je vždy zvažováno přerušení léčby natalizumabem v období kojení.
Dávkování
Na rozdíl od léčiv dosud používaných v léčbě relaps-remitentní formy RS ovlivňujících onemocnění (disease modifying drugs – DMDs, interferony beta a glatiramer acetát), která jsou aplikována intramuskulárně nebo subkutánně, je natalizumab v dávce 300 mg určen k infuzní intravenózní aplikaci každé 4 týdny. Infuzní roztok se podává nitrožilně, v současné době pouze na specializovaných pracovištích, jimiž jsou v ČR Centra pro diagnostiku a léčbu demyelinizačních onemocnění (MS centra). Doba trvání infuze je 60 minut, následně se provádí proplach infuzního setu 20 ml 0,9% fyziologického roztoku. Nemocný zůstává dalších 60 minut v observaci na tomto pracovišti, zejména z důvodu možných známých bezprostředních příznaků přecitlivělosti na léčivý přípravek [19, 20].
Balení
Natalizumab je do ČR dodáván jako koncentrát určený pro přípravu infuzního roztoku. Koncentrát obsahuje 20 mg natalizumabu v 1 mililitru; musí být uchováván chráněný před světlem a mrazem, nejlépe v chladničce při teplotách od 2 °C do 8 °C. Infuzní roztok vzniklý naředěním je určen neprodleně k podání, nejpozději však do 8 hodin, po tuto dobu musí být opět skladován v totožných podmínkách (tab. 2).
Závěr
Natalizumab je částečně hrazen z veřejného zdravotního pojištění, neboť byl kategorizační komisí v roce 2006 kvalifikován a formálně zařazen do skupiny léků určených k léčbě relaps-remitentní formy RS, tzv. léky ovlivňující onemocnění RS (DMDs). Představuje novou generaci DMDs, která je v ČR určena v monoterapii zejména k eskalaci léčby RS s klinicky vysokým stupněm aktivity a tam, kde není léčba DMDs (interferony beta a GA) v první léčebné linii dostatečně účinná.
Seznam použité literatury
- [1] Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256: 495–497.
- [2] Ortho Multicenter Transplant Study group. A randomized clinical trial of OKT3 monoclonal antibody for acute rejection of cadaveric renal transplants. Ortho Multicenter Transplant Study Group. N Engl J Med 1985; 313: 337–342.
- [3] Von Adrian UH, Engelhardt B. Alfa4 Integrins Therapeutic Targets in Autoimmune Disease. N Engl J Med 2003; 348: 68–72.
- [4] Strupp M. Recent news on MS: Natalizumab is beneficia, stem cell transplantation is not, and the differentiation of neuromyelitis optica and MS is complex. J Neurol 2007; 254: 820–822.
- [5] Sheremata WA, Vollmer TL, Stone LA, et al. A safety and pharmacokinetic study of intravenous natalizumab in patients with MS. Neurology 1999; 52: 1072–1074.
- [6] Miller DH, Khan OA, Sheremata WA, et al. International Natalizumab Multiple Sclerosis Trial Group. A Controlled trial of Natalizumab for relapsing Multiple Sclerosis. N Engl J Med 2003; 348: 15–23.
- [7] Polman CH, O´Connor PW, Havrdova E, et al. A Randomized, Placebo-Controlled Trial of Natalizumab for Relapsing Multiple Sclerosis. N Engl J Med 2006; 354: 899–910.
- [8] Rudick RA, Stuart WH, Calabresi PA, et al. Natalizumab plus interferon b-1a for relapsing multiple sclerosis. N Engl J Med 2006; 354: 911–923.
- [9] Rudick RA, Miller D, Hass S, et al. Health-Related Quality of Life in Multiple Sclerosis: Effects of Natalizumab. Ann Neurol 2007; 62: 335–346.
- [10] Yousry TA, Major EO, Ryschkewitsch C, et al. Evaluation of Patients Treated with Natalizumab for progressive Multifocal Leukoencephalopathy. N Engl J Med 2006; 354: 924–933.
- [11] Greenlee JE. Progressive Multifocal leucoencephalopathy in the Era of Natalizumab: A Review and Discussion of the Implications. The International MS Journal. 2006; 13: 100–107.
- [12] Kappos L, Batges D, Hartung HP, et al. Natalizumab treatment for multiple sclerosis: recommendations fo patient selection and monitoring. Lancet Neurology 2007; 6: 431–441.
- [13] Philips JT, O´Connor PW, Havrdova E, et al. Infusion-related hypersensitivity reactions during natalizumab treatment. Neurology 2006; 67: 1717–1718.
- [14] Krumbholz M, Pellkofer H, Gold R, et al. Delayed allergic reaction to natalizumab associated with early formation of neutralizing antibodies. Arch Neurol 2007; 64: 1331–1333.
- [15] Calabresi PA, Giovannoni G, Confavreux C, et al. The incidence and significance of anti-natalizumab antibodies: results from AFFIRM and SENTINEL. Neurology 2007; 69: 1391–1403.
- [16] Stuve O, Bennett JL. Pharmacological properties, toxicology and scientific rationale for the use of natalizumab (Tysabri) in inflammatory diseases. CNS Drug Rev 2007; 13: 79–95.
- [17] Sweet BV. Natalizumab update. Am J Health Syst Pharm 2007; 64: 705–716.
- [18] Gold R, Jawa A, Miller DH, et al. Expert opinion: Guidelines for the use of natalizumab in multiple sclerosis patiens previously treated with immunomodulating therapies. Neuroimmun 2007; 187: 156–158.
- [19] Rossman HS, Lawson S. Setting Up a neurology-Based Infusion Center: Rationale and Guidelines. Applied Neurology 2005; D1–D8.
- [20] O´Leary S, Beavin J, Bishop C, et al. Practical Guidelines for Administering Natalizumab: A Nursing Perspective. Int J MS Care 2007; 9: 1–8.
- [21] Ransohoff RM. Natalizumab for multiple sclerosis. N Engl J Med 2007; 356: 2622–2629.