Nintedanib
Souhrn:
Nintedanib je inhibitor tyrosinkinázových receptorů pro růstový faktor pro fibroblasty, vaskulární a endoteliální růstový faktor a od destiček odvozený růstový faktor. Léčba je indikována u dospělých pacientů s idiopatickou plicní fibrózou. Signifikantně zpomaluje pokles usilovné vitální kapacity a pravděpodobně příznivě ovlivňuje i mortalitu pacientů. Podává se perorálně ve dvou denních dávkách. Nejčastější nežádoucí účinky léčby souvisejí s gastrointestinálním traktem a zahrnují především průjmy. Pro pacienty s idiopatickou plicní fibrózou jsou tak v současné době k dispozici dva léky prokazatelně zpomalující pokles plicních funkcí – nintedanib a pirfenidon.
Key words:
idiopathic pulmonary fibrosis – lung functions – nintedanib – treatment.
Summary:
Nintedanib is a potent tyrosine kinase inhibitor targeting fibroblast growth factor receptor, vascular and endothelial growth factor receptor, and platelet derived growth factor receptor. Treatment with nintedanib is indicated in adult patients with idiopathic pulmonary fibrosis. It significantly slows decline of forced vital capacity and is very likely to reduce mortality of idiopathic pulmonary fibrosis patients. Nintedanib should be taken orally in two separate daily doses. Most frequent adverse events originate from gastrointestinal tract and are typically represented by diarrhoea. Currently, two drugs with proved effect on lung functions decline – nintedanib and pirfenidone – are available for patients with idiopathic pulmonary fibrosis.
Úvod
Nintedanib je řazen do farmakologické skupiny cytostatik a imunomodulačních léčiv. Najdeme jej v kategorii „Jiná cytostatika – inhibitory proteinkináz“, ATC skupina L01XE31.
Nintedanib patří mezi indolinové deriváty. Molekulová hmotnost nintedanib esylátu je 649,76 g/mol, jde o jasně žlutý krystalický prášek rozpustný ve vodě (> 20 mg/ml). Sumární vzorec nintedanibu je C31H33N5O4.C2H6O3S. Chemická reakce vedoucí ke vzniku nintedanibu a jeho ethansulfonové soli probíhá v pěti na sebe navazujících krocích, dalšími dvěma kroky je pak dotvořen anilinový řetězec. Za účinky nintedanibu odpovídají především substituenty na pozici 6. oxindolového jádra, které zapadají do specifické kapsy pro adenosintrifosfát (ATP) tyrosinkinázových domén. Molekula má dále tzv. ribózovou kapsu, jejíž důležitou částí je fenylová skupina. Ta zajišťuje typickou konformaci molekuly odpovídající za dobrou rozpustnost nintedanibu ve vodě [1].
Mechanismus účinku, farmakodynamika
Nintedanib blokuje účinek receptorových i nereceptorových tyrosinkináz vazbou v „kapse“ určené pro vazbu ATP (tab. 1). Ovlivňuje tím vlastnosti různých buněk, které se podle výsledků dosavadních studií podílejí na patogenezi idiopatické plicní fibrózy (IPF). Mezi ně patří především alveolární epiteliální buňky, fibroblasty a myofibroblasty [2]. Alveolární epitel je pravděpodobně u nem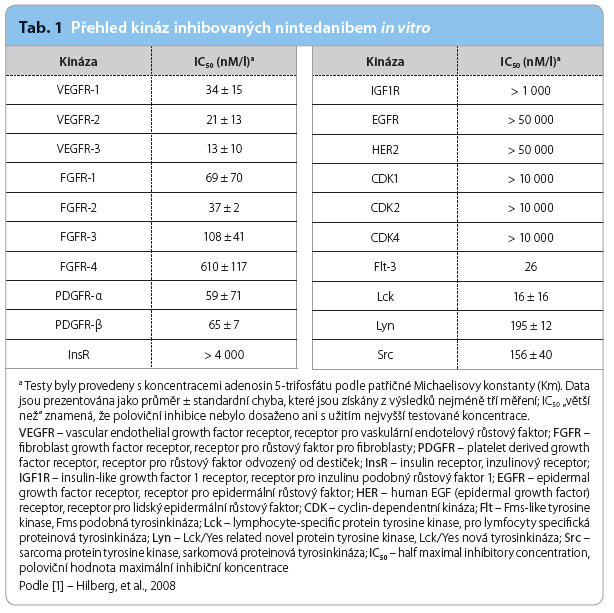 ocných s IPF poškozen jako první, buňky podléhají apoptóze a uvolnění řady mediátorů včetně růstového faktoru pro destičky (platelet derived growth factor, PDGF), fibroblasty (fibroblast growth factor, FGF) a pro cévy a endotel (vascular endothelial growth factor, VEGF) vede jednak k migraci fibroblastů a jiných buněk do místa poškození, k epitelo‑mezenchymální tranzici a k produkci kolagenu fibroblasty a myofibroblasty (obr. 1) [3]. Ovlivněn je nejen alveolární epitel a bazální membrána, ale i cévy.
ocných s IPF poškozen jako první, buňky podléhají apoptóze a uvolnění řady mediátorů včetně růstového faktoru pro destičky (platelet derived growth factor, PDGF), fibroblasty (fibroblast growth factor, FGF) a pro cévy a endotel (vascular endothelial growth factor, VEGF) vede jednak k migraci fibroblastů a jiných buněk do místa poškození, k epitelo‑mezenchymální tranzici a k produkci kolagenu fibroblasty a myofibroblasty (obr. 1) [3]. Ovlivněn je nejen alveolární epitel a bazální membrána, ale i cévy.
Odkud přesně pocházejí![Obr. 1 Mechanismus působení nintedanibu na celulární úrovni; podle [3] – Wollin, et al., 2015. Nintedanib se váže do kapsy určené pro vazbu ATP v intracelulární části FGFR, PDGFR a VEGFR. To vede k blokování autofosforylace receptorů a navazujících signalizačních kaskád. Nintedanib může blokovat i nereceptorové tyrosinkinázy, jako je Src nebo Lck. Účinek nintedanibu spočívá v omezení proliferace, migrace a přežívání fibroblastů a možná i v negativním působení na angiogenezi. FAK – fokální adhezní kináza; FGF(R) – fibroblast growth factor, růstový faktor pro fibroblasty (receptor); Grb2 – growth factor receptor bound protein 2, protein 2 vázaný na receptor pro růstový faktor; MEK½ – mitogen activated protein kinase kinase, mitogeny aktivovaná proteinkináza ½; PDGF(R) – platelet derived growth factor, od destiček odvozený růstový faktor (receptor); PI3K – phosphatidylinositol 3 kinase, fosfatidylinositol 4,5 bifosfát 3 kináza; PIP – phosphatidylinositol 4,5 phosphate, fosfatidylinositol 4,5 bifosfát; PKC – proteinkináza C; PLC γ – phospholipase C, gamma 1, fosfolipáza C γ; SOS – son of sevenless, faktor působící na Ras GTPázy; Src – sarcoma protein tyrosine kinase, sarkomová proteinová tyrosinkináza; VEGF(R) – vascular endothelial growth factor, vaskulární endotelový růstový faktor (receptor)](https://www.remedia.cz/photo-a-30500---.jpg) fibroblasty nalézané ve fibroblastických fokusech nemocných s IPF, není dosud jasné. Nicméně bylo prokázáno, že nintedanib snižuje proliferační a migrační schopnosti fibroblastů. Přestože pravděpodobně nemá vliv na epitelo‑mezenchymální tranzici, inhibuje přeměnu fibroblastů v myofibroblasty indukovanou transformujícím růstovým faktorem beta (transforming growth factor beta, TGFβ) [4]. Podávání nintedanibu také snižuje množství kolagenu ve tkáni. Není známo, zda se jedná o přímý vliv nintedanibu na produkci kolagenu, nebo o nepřímý důsledek inhibice fibroblastů a myofibroblastů. Lék zasahuje mimo jiné i do angiogeneze, což má spíše než na mechanismus jeho působení dopad na výběr kandidátů léčby nintedanibem [5]. Stejně jako u všech přípravků zasahujících do signalizace VEGF je i zde třeba brát v úvahu potenciální dopad na angiogenezi v rámci fyziologických procesů hojení.
fibroblasty nalézané ve fibroblastických fokusech nemocných s IPF, není dosud jasné. Nicméně bylo prokázáno, že nintedanib snižuje proliferační a migrační schopnosti fibroblastů. Přestože pravděpodobně nemá vliv na epitelo‑mezenchymální tranzici, inhibuje přeměnu fibroblastů v myofibroblasty indukovanou transformujícím růstovým faktorem beta (transforming growth factor beta, TGFβ) [4]. Podávání nintedanibu také snižuje množství kolagenu ve tkáni. Není známo, zda se jedná o přímý vliv nintedanibu na produkci kolagenu, nebo o nepřímý důsledek inhibice fibroblastů a myofibroblastů. Lék zasahuje mimo jiné i do angiogeneze, což má spíše než na mechanismus jeho působení dopad na výběr kandidátů léčby nintedanibem [5]. Stejně jako u všech přípravků zasahujících do signalizace VEGF je i zde třeba brát v úvahu potenciální dopad na angiogenezi v rámci fyziologických procesů hojení.
Farmakokinetické vlastnosti
Farmakokinetika nintedanibu je lineární. Rovnovážného stavu plazmatických koncentrací bývá dosaženo po jednom týdnu užívání léku. Všechny farmakokinetické fáze probíhající po podání nintedanibu se vyznačují středně vysokou až vysokou interindividuální variabilitou, zatímco intraindividuální variabilita je nízká až střední.
Biologická dostupnost nintedanibu je nízká, lék podléhá efektu prvního průchodu játry. Dispoziční kinetika nintedanibu je dvojfázová. Po intravenózním podání je zdánlivý distribuční objem nintedanibu velký (tj. lék je distribuován po intravenózním podání extravaskulárně). V plazmě je lék vázán především na albumin.
Po absorpci se nachází ve většině tkání vyjma centrálního nervového systému (CNS) [6].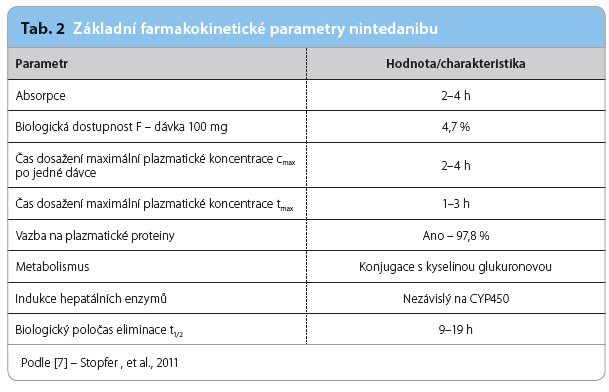
Eliminační poločas nintedanibu u pacientů s IPF se pohybuje kolem 9,5 hodiny. Za 48 hodin od perorálního užití léku je do moči vyloučeno nezměněno 0,05 % dávky; po intravenózním podání je to 1,4 %. Renální clearance mateřské látky je 20 ml/min. Lék je v rámci svého metabolismu štěpen esterázami. Výsledný produkt je glukuronidován. Na biotransformaci se podílí především cytochrom CYP3A4. Lék je vylučován žlučí do stolice, renální exkrece je minimální. Více než 90 % účinné látky se z organismu vyloučí za čtyři dny (tab. 2) [7].
Klinické zkušenosti
Výsledky klinických studií, ve kterých byla léčba nintedanibem ověřována u nemocných s IPF, jsou shrnuty v tab. 3 [8,18].
Zařazení do současné palety léčiv
Nintedanib je jedním ze dvou antifibroticky působících léků (společně s pirfenidonem) schválených americkým Úřadem pro potraviny a léky (Food and Drug Administration, FDA) a Evropskou lékovou agenturou (European Medicines Agency, EMA) pro léčbu IPF. V zemích Evropské unie, v Japonsku a ve Spojených státech amerických byl nintedanib schválen pro léčbu IPF bez omezení (bez ohledu na plicní funkce pacienta, tj. pro všechny nemocné s IPF). Není znám žádný biomarker, jenž by dokázal predikovat, který pacient bude mít z léčby nintedanibem prospěch a který nikoliv [9].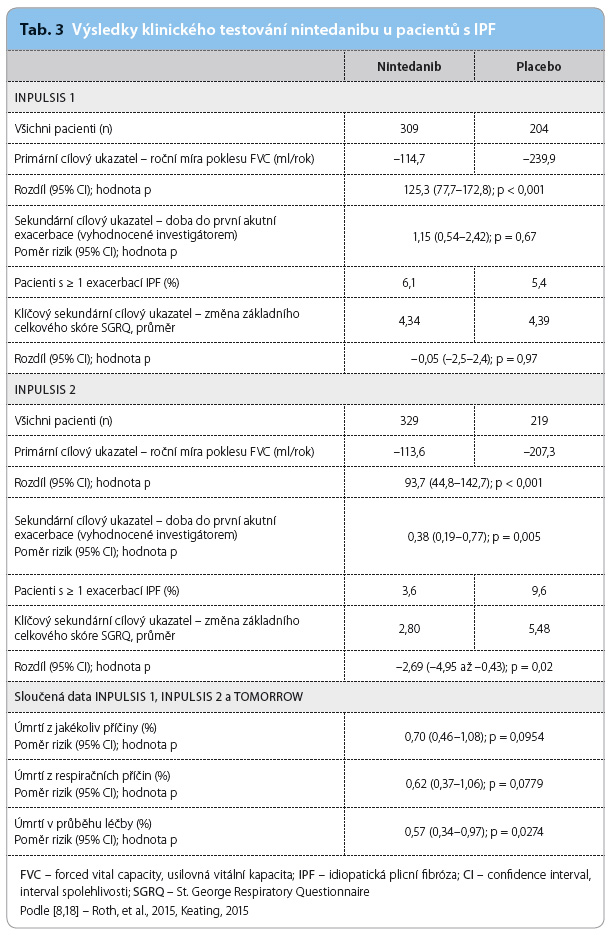
Bylo prokázáno, že nintedanib i pirfenidon zmírňují meziroční pokles usilovné vitální kapacity (forced vital capacity, FVC), pozorován byl i trend k poklesu mortality léčených [10,11]. Nintedanib byl ověřován nejprve v rámci studie TOMORROW (klinická studie fáze II, testování dávky léku) a následně klinickými studiemi fáze III INPULSIS‑1 a INPULSIS‑2. Výsledky obou studií INPULSIS se od sebe poněkud odlišovaly, a to zejména s ohledem na prevenci akutních exacerbací a kvalitu života. Zařazováni byli pacienti s FVC ≥ 50 % očekávané hodnoty a s transfer faktorem (TLco) ≥ 30 % očekávané hodnoty, dat od pacientů s výraznějším plicním postižením není mnoho [12]. Stejně tak nebyla dosud provedena studie, která by přímo porovnávala účinek nintedanibu a pirfenidonu na průběh a prognózu IPF. K dispozici jsou pouze studie nepřímé a ty naznačují, že by nintedanib mohl mít oproti pirfenidonu výraznější vliv na zpomalení poklesu vitální kapacity (poměr šancí – odds ratio, OR – 0,67; 95% CI [interval spolehlivosti, confidence interval]: 0,51–0,88) [13]. Který lék bude pacientovi doporučen, závisí v současné době spíše na preferencích nemocného, na dostupnosti léku a na toleranci k němu.
Výsledky mortalitních studií zatím k dispozici nemáme, ale ze sloučených dat získaných studiemi INPULSIS a TOMORROW víme, že léčba nintedanibem snižuje mortalitu ze všech příčin o 30 % (poměr rizik – hazard ratio, HR – 0,7, p = 0,095) [14].
V České republice je nintedanib v indikaci IPF možno pro pacienta získat prostřednictvím tzv. mimořádného dovozu. Aktuálně je indikován u nemocných s IPF, kteří nesplňují limity úhrady pro léčbu pirfenidonem, mají kontraindikaci léčby pirfenidonem, u kterých došlo k selhání léčby pirfenidonem, kteří mají výrazné nežádoucí účinky léčby a/nebo lék netolerují. V praxi léčbu zvažujeme především u pacientů s FVC > 80 % očekávaných hodnot a/nebo s TLco 35–30 % očekávaných hodnot. Dolní hranice TLco vychází z dat získaných registračními studiemi, jak bylo zmíněno výše, v zemích Evropské unie je lék registrován obecně pro všechny nemocné s IPF [15].
Indikace
Lék je indikován v léčbě dospělých pacientů s idiopatickou plicní fibrózou.
Kontraindikace
Kontraindikace léčby nintedanibem představuje přecitlivělost na účinnou látku, na arašídy nebo na další pomocné látky přípravku (lék obsahuje jako pomocnou látku sójový lecitin, existuje riziko zkřížených alergických reakcí u osob alergických na arašídy).
Nežádoucí účinky
Nejčastější nežádoucí účinky nintedanibu se manifestují v oblasti zažívacího traktu a zahrnují průjem (> 60 % léčených), nauzeu (> 22 % léčených), sníženou chuť k jídlu (> 8 % léčených), zvracení a hubnutí. Z hlediska respiračního traktu byla hlášena nazofaryngitida, kašel, progrese IPF, bronchitida, infekce horních cest dýchacích a dušnost [16]. Možným nežádoucím účinkem, který vychází z biologické podstaty přípravku a z jeho působení na signalizaci cestou VEGF, jsou krvácivé komplikace zejména u nemocných užívajících antikoagulační terapii. Pro tyto nemocné obzvlášť platí nutnost důsledného porovnání potenciálního přínosu a rizik spojených s léčbou [17]. I když rizika vzniku arteriálních tromboembolických příhod a perforace gastrointestinálního traktu jsou relativně řídká, u rizikových pacientů je nutno zvážit přínos užívání nintedanibu [18].
Lékové interakce
Potenciální lékové interakce vycházejí především z metabolismu nintedanibu – lék je substrátem P-glykoproteinu (P-gp) a CYP3A4. Ke zvýšení expozice nintedanibu může dojít při současném užívání ketoconazolu nebo erythromycinu. Naopak induktory P‑gp a CYP3A4 (rifampicin, carbamazepin, phenytoin) mohou vést k nižší expozici nintedanibu [19]. Vhodná je i monitorace antikoagulační léčby.
Těhotenství a kojení
Nintedanib má teratogenní a embryocidní účinky, proto by neměl být podáván v těhotenství. Ženy v reprodukčním věku by měly po dobu léčby nintedanibem užívat účinnou kontracepční metodu. Lék je vylučován do mléka, a protože studie zaměřené na účinky nintedanibu u kojenců chybějí, kojícím ženám se nedoporučuje užívat nintedanib a ženám užívajícím nintedanib se nedoporučuje kojit.
Ovlivnění pozornosti
Nintedanib může mírně snižovat pozornost.
Dávkování
Doporučené dávkování nintedanibu (v indikaci idiopatická plicní fibróza) je 150 mg ve dvou denních dávkách, mezi kterými by měl být časový interval přibližně 12 hodin. Lék je vhodné užívat s jídlem. Pokud nemocný netoleruje výše uvedenou dávku, je možno zvážit podání léku ve snížené dávce 100 mg dvakrát denně. Snížení dávky je doporučeno při více než trojnásobném vzestupu aktivity aspartátaminotransferázy a/nebo alaninaminotransferázy. Pokud vzestup přesáhne pětinásobek horní hranice fyziologického rozmezí, je vhodnější léčbu přerušit. Stejně tak by měla být léčba přerušena při známkách těžkého jaterního poškození. U pacientů s jaterním poškozením klasifikovaným jako Childovo–Pughovo skóre třídy A není nutno dávku nintedanibu snižovat. Data od pacientů s vážnějším jaterním poškozením chybějí [19,20].
Nejsou k dispozici studie, které by identifikovaly vyšší riziko nežádoucích účinků nebo odlišnosti v indikaci pro starší populaci. U pacientů starších 75 let je vyšší pravděpodobnost, že bude nutné s ohledem na nežádoucí účinky dávku nintedanibu snížit. Nintedanib není určen pro léčbu dětí.
Vzhledem k tomu, že močí se vylučuje jen 1 % nintedanibu, není u nemocných s clearance kreatininu > 30 ml/min nutno snižovat dávky. Data od pacientů se závažnějším selháním ledvin chybějí.
Stabilita a kompatibilita
Kompatibilita se neuplatňuje, lék není určen pro intravenózní podání.
Stabilita léku v komerčním balení byla testována po 60 měsících skladování při teplotě 25 °C a relativní vlhkosti vzduchu 60 % a šest měsíců při teplotě 40 °C a relativní vlhkosti vzduchu 75 %. Aktivní látka sama o sobě byla v rámci testování vystavována vysokým teplotám, vysoké vzdušné vlhkosti, světlu a prostředí o různém pH. Produkt v komerčním balení byl dle provedených testů stabilní, aktivní látka je citlivá k extrémně vysokým teplotám a k působení oxidačních podmínek.
Závěr
Inhibitor tyrosinkináz nintedanib ve studiích prokazatelně zpomaloval pokles usilovné vitální kapacity u pacientů s IPF. Přínos pro nemocné přináší dávkování léku – dvakrát denně jedna tableta. Nejčastější nežádoucí účinky se manifestují v oblasti gastrointestinálního traktu a jde především o průjmy, v řadě případů zvládnutelné úpravou dávkování nintedanibu a režimovými opatřeními. Navzdory tomu, že nintedanib nemá v ČR dosud stanovenu úhradu, je dostupný v rámci mimořádného dovozu i pro české pacienty a představuje další možnost, jak zlepšit prognózu nemocných s IPF.
Seznam použité literatury
- [1] Hilberg F, Roth GJ, Krssak M, et al. BIBF 1120: triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res 2008; 68: 4774–4782.
- [2] Wuyts WA, Agostini C, Antoniou KM, et al. The pathogenesis of pulmonary fibrosis: a moving target. Eur Respir J 2013; 41: 1207–1218.
- [3] Wollin L, Wex E, Pautsch A, et al. Mode of action of nintedanib in the treatment of idiopathic pulmonary fibrosis. Eur Respir J 2015; 45: 1434–1445.
- [4] Willis BC, duBois RM, Borok Z. Epithelial origin of myofibroblasts during fibrosis in the lung. Proc Am Thorac Soc 2006; 3: 377–382.
- [5] Renzoni EA. Neovascularization in idiopathic pulmonary fibrosis: too much or too little? Am J Respir Crit Care Med 2004; 169: 1179–1180.
- [6] Wollin L, Maillet I, Quesniaux V, et al. Antifibrotic and inti inflammatory activity of the tyrosine kinase inhibitor nintedanib in experimental models of lung fibrosis. J Pharmacol Exp Ther 2014; 349: 209–220.
- [7] Stopfer P, Roth W, Mross K, et al. Pharmacokinetics and metabolism of BIBF 1120 after oral dosing to healthy male volunteers. Xenobiotica 2011; 41: 297–311.
- [8] Roth GJ, Binder R, Colbatzky F, et al. Nintedanib: from discovery to the clinic. J Med Chem 2015; 58: 1053–1063.
- [9] Costabel U, Yoshikazu I, Richeldi L, et al. Efficacy of nintedanib in idiopathic pulmonary fibrosis across prespecified subgroups in INPULSIS. Am J Respir Crit Care Med 2016; 193: 178–185.
- [10] King Jr TE, Bradford WZ, Castro Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 2071–2082.
- [11] Richeldi L, du Bois RM, Raghu G, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014; 370: 2071–2082.
- [12] Hunninghake GM. A new hope for idiopathic pulmonary fibrosis. NEJM 2014; 370: 2142–2143.
- [13] Loveman E, Copley VR, Scott DA, et al. Comparing new treatments for idiopathic pulmonary fibrosis – a network meta analysis. BMC Pulm Med 2015; 15: 37.
- [14] Cottin V. Nintedanib: a new treatment for idiopathic pulmonary fibrosis. Clin Invest 2015; 5: 621–632.
- [15] Boehringer Ingelhein, OFEV (nintedanib). Summary of product characteristics. 2015. Dostupné z: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_ _Product_Information/human/003821/WC500182474.pdf
- [16] Bonella F, Stowasser S, Wollin L. Idiopathic pulmonary fibrosis: current treatment options and critical appraisal of nintedanib. Drug design, development and therapy 2015; 9: 6407–6419.
- [17] Richeldi L, Costabel U, Selman M, et al. Efficacy of tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011; 365: 1079–1087.
- [18] Keating GM. Nintedanib: a review of its use in patients with idiopathic pulmonary fibrosis. Drugs 2015; 75: 1131–1140.
- [19] European Medicines Agency. Ofev (nintedanib) soft capsules: EU summary of product characteristics. 2015. http:// www.ema.europa.eu/
- [20] Karimi Shah BA, Chowdhury BA. Forced vital capacity in idiopathic pulmonary fibrosis FDA review of pirfenidone and nintedanib. NEJM 2015; 372: 1189–1191.