Nintedanib
Souhrn:
Nintedanib je perorální trojitý inhibitor angiokináz, který blokuje aktivitu kináz receptorů vaskulárního endoteliálního růstového faktoru (VEGFR), destičkového růstového faktoru (PDGFR) a fibroblastového růstového faktoru (FGFR). Vědecký výzkum prokázal, že tyto receptory hrají důležitou roli v procesu angiogeneze, růstu nádoru a metastazování. V roce 2014 byl nintedanib (Vargatef®) v kombinaci s docetaxelem schválen v Evropské unii pro léčbu dospělých pacientů s lokálně pokročilým, metastazujícím nebo s lokálně rekurentním nemalobuněčným karcinomem plic, histologicky prokázaným adenokarcinomem po předchozí první linii léčby chemoterapií. Studie LUME Lung 1 a LUME Lung 2 prokázaly účinnost a bezpečnost léčby nintedanibem. Kromě onkologických indikací vykázal nintedanib (Ofev®) vysokou účinnost ve zmírnění progrese nevyléčitelného onemocnění – idiopatické plicní fibrózy.
Key words: angiogenesis – nintedanib – LUME-Lung 1.
Summary:
Nintedanib is an oral triple angiokinase inhibitor which simultaneously inhibits vascular endothelial growth factor receptors (VEGFR), platelet derived growth factor receptors (PDGFR), and fibroblast growth factor receptors (FGFR) signalling pathways. Growing scientific evidence shows that these three different angiokinase receptors play an important role not only in angiogenesis but also in tumour growth and metastasis. Nintedanib (Vargatef®) in combination with docetaxel was approved in the EU in 2014 for use by adult patients with locally advanced, metastatic or locally recurrent NSCLC of adenocarcinoma tumour histology after first line chemotherapy. The LUME-Lung 1 and LUME-Lung 2 studies demonstrated the efficacy and safety of the treatment by nintedanib. Nintedanib (Ofev®) is used to treat a lung disease called idiopathic pulmonary fibrosis to slow down disease progression.
Farmakologická skupina
Nintedanib je řazen do skupiny cytostatik a imunomodulačních léčiv v kategorii Jiná cytostatika – Inhibitory proteinkináz, ATC skupina L01XE31 [1].Chemické a fyzikální vlastnosti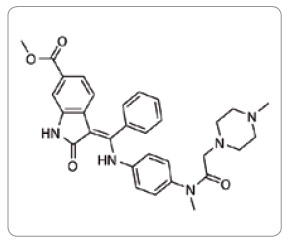
Nintedanib patří mezi indolinové deriváty. Účinnou látkou je nintedanib esylát s molekulovou hmotností 649,76 g/mol. Sumární vzorec nintedanibu je C31H33N5O4.C2H6O3S (obr. 1). Jedná se o jasně žlutý krystalický prášek rozpustný ve vodě (> 20 mg/ml) [2].
Farmakokinetické vlastnosti
Farmakokinetika nintedanibu je lineární vzhledem k času. Interindividuální variabilita farmakokinetiky nintedanibu je středně vysoká až vysoká, zatímco intraindividuální variabilita je nízká až střední. Distribuční kinetika nintedanibu je nejméně dvojfázová. Léčivo se váže na bílkoviny, predominantně na albumin, a je distribuováno zejména do plazmy (poměr krev/plazma je 0,869). Nintedanib dosahuje maximální plazmatické koncentrace zhruba za 2–4 hodiny po perorálním podání (rozpětí 0,5–8 hodin). Absorpce a biologická dostupnost jsou sníženy účinky transportérů a významným metabolismem při prvním průchodu játry, k absorpci perorálně podaného lé ku ve střevě dochází jen ve 4,7 % [2]. Rovnovážného stavu plazmatických koncentrací je dosaženo do týdne od podání první dávky. Po požití stravy je expozice nintedanibu zvýšena přibližně o 20 % v porovnání s podáním nalačno a absorpce je zpožděna (medián času do dosažení maximální plazmatické koncentrace, tmax, nalačno je 2 hod., po jídle 3,98 hod., tab. 1). Po absorpci se nintedanib nachází ve většině tkání kromě centrálního nervového systému (CNS).
ku ve střevě dochází jen ve 4,7 % [2]. Rovnovážného stavu plazmatických koncentrací je dosaženo do týdne od podání první dávky. Po požití stravy je expozice nintedanibu zvýšena přibližně o 20 % v porovnání s podáním nalačno a absorpce je zpožděna (medián času do dosažení maximální plazmatické koncentrace, tmax, nalačno je 2 hod., po jídle 3,98 hod., tab. 1). Po absorpci se nintedanib nachází ve většině tkání kromě centrálního nervového systému (CNS).
Převažující metabolickou reakcí u nintedanibu je hydrolytické štěpení esterázami, výsledný produkt, kterým je kyselina karboxylová, je následně glukuronidován. Hlavní cestou eliminace je vylučování stolicí a žlučí (93,4 % dávky), ledvinami se vyloučí jen malé množství léku (0,649 % dávky). Cytochrom P450 je součástí biotransformace nintedanibu pouze v malé míře. Biologický poločas eliminace nintedanibu je 10–15 hodin (více než 90 % léku se z organismu vyloučí za 4 dny) [1,2].
Úvod do problematiky angiogeneze
Angiogeneze je proces novotvorby cév, který se uplatňuje jak za fyziologických okolností, tak v patogenezi různých onemocnění, včetně nádorových. Jde o vícestupňový proces, který je regulován souborem humorálních působků, zejména cytokinů, integrinů, adhezních molekul, proteolytických enzymů a nízkomolekulárních látek. K aktivaci angiogeneze dochází uvolněním proangiogenních faktorů (např. VEGF a bFGF) vylučovaných ![Obr. 2 Nádorová angiogeneze – novotvorba cév; podle [3,4] – Klener, 2002; Ferrara, Kerbel, 2005. Angiogenní faktory uvolňované zejména z nádorových buněk stimulují angiogenezi. Kromě přímých angiogenních faktorů (VEGF, bFGF a HGF) se uplatňují i nepřímé angiogenní faktory, které způsobují zvýšený výdej faktorů přímých (TGFα, EGF, PDGF a jiné). VEGF jako nejvýznamnější faktor angiogeneze je růstovým faktorem pro endotelie, váže se na jejich receptory a spouští transdukční kaskádu, jejímž výsledkem je zvýšená proliferace a permeabilita cév a usnadněná migrace buněk. bFGF – basic fibroblast growth factor 2, bazický fibroblastový růstový faktor 2; BMC – bone marrow cell, krvetvorné kmenové buňky; EGF – endothelial growth factor, endoteliální růstový faktor; HGF – hepatocyte growth factor, hepatocytární růstový faktor; PDGF – platelet‑derived growth factor, destičkový růstový faktor; SDF‑1 – stromal cell‑derived factor 1, stromální buněčný růstový faktor; TGFα (β) – transforming growth factor alfa (beta), transformující růstový faktor alfa (beta); VEGF – vascular endothelial growth factor, vaskulární endoteliální růstový faktor](https://www.remedia.cz/photo-a-30647---.jpg) nádorovou buňkou zejména v prostředí hypoxie. Vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF) je růstový faktor pro endotelie a je považován za nejvýznamnější faktor angiogeneze. Bylo identifikováno šest variant tohoto faktoru (VEGF, PGF – platelet derived growth factor, homologní s VEGF, dále VEGF B, C, D a E) tvořících tzv. rodinu VEGF. Uvolňují se převážně z fibroblastů a za patologických okolností z nádorových buněk, účinkem epidermálního růstového faktoru (epidermal growth factor, EGF) a jiných nepřímých angiostimulátorů. Produkce VEGF se zvyšuje také při hypoxii působením faktoru označovaného jako HIF‑1 (hypoxia inducible factor 1). Faktor VEGF se podobně jako jiné růstové faktory váže na specifické receptory lokalizované na membráně endotelových buněk a touto vazbou aktivuje receptorové tyrosinkinázy.
nádorovou buňkou zejména v prostředí hypoxie. Vaskulární endoteliální růstový faktor (vascular endothelial growth factor, VEGF) je růstový faktor pro endotelie a je považován za nejvýznamnější faktor angiogeneze. Bylo identifikováno šest variant tohoto faktoru (VEGF, PGF – platelet derived growth factor, homologní s VEGF, dále VEGF B, C, D a E) tvořících tzv. rodinu VEGF. Uvolňují se převážně z fibroblastů a za patologických okolností z nádorových buněk, účinkem epidermálního růstového faktoru (epidermal growth factor, EGF) a jiných nepřímých angiostimulátorů. Produkce VEGF se zvyšuje také při hypoxii působením faktoru označovaného jako HIF‑1 (hypoxia inducible factor 1). Faktor VEGF se podobně jako jiné růstové faktory váže na specifické receptory lokalizované na membráně endotelových buněk a touto vazbou aktivuje receptorové tyrosinkinázy.
U nádorových onemocnění je zvýšená angiogeneze většinou považována za negativní prognostický faktor, který znamená zvýšenou agresivitu nádoru a riziko vzniku metastáz (obr. 2) [3,4].
Mechanismus účinku, farmakodynamika
Nintedanib je trojnásobný inhibitor angiokináz, který současně blokuje aktivitu kináz receptorů vaskulárního endoteliálního růstového faktoru (VEGFR 1–3), destičkového růstového faktoru (platelet derived growth factor receptor, PDGFR α a ß) a fibroblastového růstového faktoru (fibroblast growth factor receptor, FGFR 1–3) a tím následně i signální dráhy, které aktivace těchto receptorů spouštějí. Nintedanib se kompetitivně váže ![Obr. 3 Mechanismus účinku nintedanibu; podle [5] – Awasthi, Schwarz, 2015. FGFR – fibroblast growth factor receptor, receptor pro fibroblastový růstový faktor; PDGFR – platelet derived growth factor receptor, receptor pro destičkový růstový faktor; VEGFR – vascular endothelial growth factor receptor, receptor pro endoteliální růstový faktor](https://www.remedia.cz/photo-a-30648---.jpg) na vazebnou kapsu těchto receptorů pro adenosintrifosfát (ATP) a blokuje intracelulární signalizaci, která je zásadní pro proliferaci a přežití endotelových a perivaskulárních buněk (pericyty a buňky cévní hladké svaloviny) [5]. Dochází navíc k inhibici proteinové tyrosinkinázy podobné Fms – (Flt)‑3, proteinové tyrosinkinázy specifické pro lymfocyty (Lck) a protoonkogenní proteinové tyrosinkinázy Src (Src). Inhibicí receptorových i nereceptorových kináz brání nintedanib nádorové neoangiogenezi, porušuje integritu nádorové tkáně, znemožňuje růst a šíření nádorových buněk a dezintegruje mikrocirkulaci nádoru [6]. V rámci klinických studií byla/je účinnost nintedanibu zkoumána u nemalobuněčného karcinomu plic (non‑small cell lung carcinoma, NSCLC), mezoteliomu, renálního, ovariálního, hepatocelulárního a kolorektálního karcinomu (obr. 3) [5].
na vazebnou kapsu těchto receptorů pro adenosintrifosfát (ATP) a blokuje intracelulární signalizaci, která je zásadní pro proliferaci a přežití endotelových a perivaskulárních buněk (pericyty a buňky cévní hladké svaloviny) [5]. Dochází navíc k inhibici proteinové tyrosinkinázy podobné Fms – (Flt)‑3, proteinové tyrosinkinázy specifické pro lymfocyty (Lck) a protoonkogenní proteinové tyrosinkinázy Src (Src). Inhibicí receptorových i nereceptorových kináz brání nintedanib nádorové neoangiogenezi, porušuje integritu nádorové tkáně, znemožňuje růst a šíření nádorových buněk a dezintegruje mikrocirkulaci nádoru [6]. V rámci klinických studií byla/je účinnost nintedanibu zkoumána u nemalobuněčného karcinomu plic (non‑small cell lung carcinoma, NSCLC), mezoteliomu, renálního, ovariálního, hepatocelulárního a kolorektálního karcinomu (obr. 3) [5].
Klinická účinnost a bezpečnost
Nintedanib v kombinaci s chemoterapií byl srovnáván se standardní chemoterapií v kombinaci s placebem ve studiích LUME‑Lung 1 a LUME‑Lung 2 u pacientů s pokročilým NSCLC ve druhé linii léčby [6–11].
Studie LUME‑Lung 1
Účinnost a bezpečnost nintedanibu byla zjišťována v stěžejní studii fáze III LUME‑Lung 1. Jednalo se o multicentrickou, randomizovanou, dvojitě zaslepenou studii, která probíhala ve 27 zemích v Evropě, Asii a v jižní Africe [7]. Do studie bylo zařazeno celkem 1 314 nemocných s NSCLC všech histologických typů, zatím bez ověření přítomnosti známých mutací. Analýza molekulárních charakteristik je však plánována.
Z celkového počtu 1 314 pacientů jich 658 (50,1 %) trpělo adenokarcinomem, 555 (42,2 %) dlaždicobuněčným karcinomem a 101 (7,7 %) pacientů mělo nádory s jinou histologií.
Do studie byli zařazeni pacienti ve stadiu lokálně pokročilého, metastatického nebo rekurentního NSCLC po jedné předchozí linii chemoterapie. Ve studii převažovali muži (72,7 %) a většina nemocných byla neasijské rasy (81,6 %). Pacienti byli randomizováni v poměru 1 : 1 k léčbě nintedanibem v dávce 200 mg podávané perorálně dvakrát denně v kombinaci s docetaxelem aplikovaným intravenózně každých 21 dnů (n = 655) v dávce 75 mg/m2 nebo k podávání placeba perorálně dvakrát denně v kombinaci s docetaxelem ve stejném režimu a dávce. Pacienti byli stratifikováni v obou léčebných ramenech podle stavu výkonnosti hodnoceného pomocí škály ECOG (Eastern Cooperative Oncology Group) 0 oproti 1, podle předchozí léčby bevacizumabem (ano/ne), podle přítomnosti mozkových metastáz (ano/ne) a podle histologie nádoru (dlaždicobuněčná nebo jiná histologie).
Primárním cílovým ukazatelem studie byla doba do progrese onemocnění (progression‑free survival, PFS), sekundárním cílovým ukazatelem bylo celkové![Graf 1 Doba do progrese onemocnění ve studii LUME‑Lung 1; podle [7] – Reck, et al., 2014.](https://www.remedia.cz/photo-a-30649---.jpg) přežití (overall survival, OS). Dalšími sledovanými parametry byly objektivní léčebná odpověď, kontrola onemocnění, změna velikosti nádoru a kvalita života. Studie přinesla očekávané výsledky. Medián PFS byl v rameni s nintedanibem delší o 0,7 měsíce (3,4 měsíce vs. 2,7 měsíce), a to u všech nemocných bez ohledu na histologický typ nádoru (poměr rizik, HR = 0,79; 95% interval spolehlivosti [CI]: 0,68–0,92; p = 0,0019), graf 1. Medián OS byl 10,1 měsíce u pacientů léčených nintedanibem a docetaxelem a 9,1 měsíce při podávání placeba a docetaxelu. Delšího celkového přežití dosáhli nemocní s adenokarcinomy léčení nintedanibem v kombinaci s docetaxelem ve srovnání s nemocnými v rameni placeba s docetaxelem (12,6 vs. 10,3 měsíce; p = 0,0
přežití (overall survival, OS). Dalšími sledovanými parametry byly objektivní léčebná odpověď, kontrola onemocnění, změna velikosti nádoru a kvalita života. Studie přinesla očekávané výsledky. Medián PFS byl v rameni s nintedanibem delší o 0,7 měsíce (3,4 měsíce vs. 2,7 měsíce), a to u všech nemocných bez ohledu na histologický typ nádoru (poměr rizik, HR = 0,79; 95% interval spolehlivosti [CI]: 0,68–0,92; p = 0,0019), graf 1. Medián OS byl 10,1 měsíce u pacientů léčených nintedanibem a docetaxelem a 9,1 měsíce při podávání placeba a docetaxelu. Delšího celkového přežití dosáhli nemocní s adenokarcinomy léčení nintedanibem v kombinaci s docetaxelem ve srovnání s nemocnými v rameni placeba s docetaxelem (12,6 vs. 10,3 měsíce; p = 0,0![Graf 2 Celkové přežití ve studii LUME‑Lung 1 u pacientů s adenokarcinomem; podle [7] – Reck, et al., 2014.](https://www.remedia.cz/photo-a-30650---.jpg) 359, HR = 0,83). Ze studie vyplývá, že nintedanib v kombinaci s docetaxelem oproti placebu s docetaxelem ve druhé linii léčby pokročilého NSCLC signifikantně prodlužuje PFS bez závislosti na histologické diagnóze, OS významně prodlužuje u pacientů s adenokarcinomem, graf 2, 3. Nintedanib také o čtvrtinu zvýšil šanci na přežití delší než dva roky (po léčbě první linie) v porovnání se samotným docetaxelem (25,7 %, vs. 19,1 %.). Nejčastějšími nežádoucími účinky byly průjem a elevace hodnot
359, HR = 0,83). Ze studie vyplývá, že nintedanib v kombinaci s docetaxelem oproti placebu s docetaxelem ve druhé linii léčby pokročilého NSCLC signifikantně prodlužuje PFS bez závislosti na histologické diagnóze, OS významně prodlužuje u pacientů s adenokarcinomem, graf 2, 3. Nintedanib také o čtvrtinu zvýšil šanci na přežití delší než dva roky (po léčbě první linie) v porovnání se samotným docetaxelem (25,7 %, vs. 19,1 %.). Nejčastějšími nežádoucími účinky byly průjem a elevace hodnot 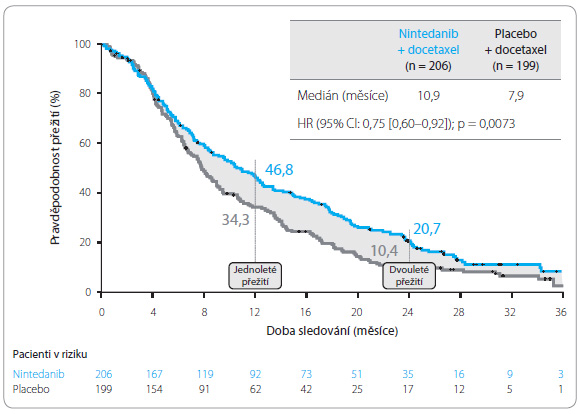 alaninaminotransferázy (ALT). Průjem se vyskytl u 42,3 % pacientů (21,8 % – placebo + docetaxel), elevace hodnot ALT u 28,5 % pacientů (8,4 % – placebo + docetaxel). Procentuálně vyjádřený počet pacientů, u nichž musela být ukončena léčba z důvodu závažnosti nežádoucích účinků, byl v obou ramenech podobný: 22,7 % oproti 21,7 % (placebo s docetaxelem). Podobné výsledky byly zaznamenány při výskytu hypertenze, krvácení či trombózy stupně 3. Nežádoucí účinky léčby se ve většině případů daly zvládnout snížením dávky léčiva a symptomatickou léčbou. Součástí studie bylo i hodnocení kvality života, která byla u pacientů užívajících nintedanib vyšší [7].
alaninaminotransferázy (ALT). Průjem se vyskytl u 42,3 % pacientů (21,8 % – placebo + docetaxel), elevace hodnot ALT u 28,5 % pacientů (8,4 % – placebo + docetaxel). Procentuálně vyjádřený počet pacientů, u nichž musela být ukončena léčba z důvodu závažnosti nežádoucích účinků, byl v obou ramenech podobný: 22,7 % oproti 21,7 % (placebo s docetaxelem). Podobné výsledky byly zaznamenány při výskytu hypertenze, krvácení či trombózy stupně 3. Nežádoucí účinky léčby se ve většině případů daly zvládnout snížením dávky léčiva a symptomatickou léčbou. Součástí studie bylo i hodnocení kvality života, která byla u pacientů užívajících nintedanib vyšší [7].
Studie LUME‑Lung 2
LUME‑Lung 2 byla multicentrická, randomizovaná, dvojitě zaslepená studie fáze III, která srovnávala účinnost a bezpečnost nintedanibu s pemetrexedem s kombinací placebo a pemetrexed ve druhé linii léčby nemocných s pokročilým NSCLC neskvamózního typu. Studie se 713 pacienty probíhala v Asii, v Severní a Jižní Americe a v Evropě. V rameni s nintedanibem bylo zařazeno 353 pacientů, placebo užívalo 360 pacientů. Pacienti v obou skupinách byli léčeni až do progrese onemocnění či do nepřijatelné toxicity, a to dávkou 200 mg nintedanibu podávanou perorálně denně, pemetrexed byl podáván v dávce 500 mg/m2 intravenózně po 21 dnech. Primárním cílovým ukazatelem studie byl PFS, sekundárními cílovými ukazateli byly OS, zmenšení nádoru, bezpečnost a snášenlivost léčby.
Přestože byla studie LUME‑Lung 2 na základě interim analýzy předčasně ukončena, primárního cíle bylo dosaženo. Medián PFS byl 4,4 měsíce (3,6 měsíce – placebo a pemetrexed), délka OS se v obou ramenech zásadně nelišila [8]. Studie nebyla ukončena z bezpečnostních důvodů, výskyt nežádoucích účinků byl předvídatelný a nebyl vysoký. Nežádoucí účinky měly stejnou četnost výskytu v obou ramenech studie a byly stejné jako ve studii LUME‑Lung 1. Studie i přesto, že byla na základě předběžné analýzy předčasně zastavena, prokázala, že nintedanib v kombinaci s pemetrexedem ve druhé linii léčby NSCLC neskvamózního typu signifikantně prodlužuje PFS [8,9].
Z výsledků uvedených studií vyplývá, že nintedanib prodlužuje dobu do progrese onemocnění jak ve srovnání s docetaxelem ve studii LUME‑Lung 1, tak při srovnání s pemetrexedem ve studii LUME‑Lung 2 [7,8].
Zařazení do současné palety léčiv
Nintedanib je trojnásobný inhibitor angiokináz. Ireverzibilně blokuje receptory pro VEGF, PDGF a FGF, které hrají zásadní roli v angiogenezi. Blokádou těchto receptorů brání novotvorbě cév, která je u nádorových onemocnění považována za negativní prognostický faktor a představuje zvýšenou agresivitu nádoru a riziko vzniku metastáz [3,4]. Tento mechanismus účinku je unikátní, ostatní inhibitory angiogeneze v současnosti registrované pro použití u NSCLC (bevacizumab, ramucirumab) blokují pouze VEGF. Bevacizumab (v trojkombinaci s cytostatikem III. generace a s platinovým derivátem) lze použít pouze v první linii léčby NSCLC (ne u dlaždicobuněčného karcinomu), ramucirumab není v České republice hrazen ani není uveden v doporučeních pro léčbu NSCLC pro Českou republiku [12]. Ve druhé linii léčby NSCLC, histologicky adenokarcinomu, lze kromě kombinace nintedanibu s docetaxelem dle doporučení Modré knihy České onkologické společnosti použít pemetrexed nebo erlotinib, pokud nebyly podány v první linii [12]. Přínos podávání nintedanibu na základě výsledků klinických studií porovnávajících účinnost kombinace nintedanib s docetaxelem/pemetrexedem s monoterapií docetaxelem/pemetrexedem je popsán výše [7,9]. Je rovněž vhodné zdůraznit, že podávání nintedanibu bylo provázeno jen nízkým výskytem nežádoucích účinků jako hypertenze, krvácení, perforace a tromboembolie, které jsou spojovány s antiangiogenními přípravky [7].
Indikace a užívání nintedanibu
Nintedanib v kombinaci s docetaxelem je indikován ve druhé linii léčby (po první linii chemoterapie) dospělých pacientů s lokálně pokročilým, metastazujícím nebo s lokálně rekurentním NSCLC, histologicky prokázaným adenokarcinomem.
Evropská komise udělila rozhodnutí o registraci přípravku Vargatef® platné v celé Evropské unii dne 21. listopadu 2014 [1].
Kontraindikace léčby nintedanibem
Kontraindikací podávání přípravku je hypersenzitivita na nintedanib, na arašídy nebo na sóju (jedna tobolka obsahuje 1,2 mg sójového lecitinu, v případě síly 150 mg obsahuje 1,8 mg sójového lecitinu). Existuje riziko vzniku zkřížených alergických reakcí u osob alergických na arašídy [1].
Nežádoucí účinky
Nežádoucí účinky léčby nintedanibem se nejčastěji manifestují v oblasti gastrointestinálního traktu. Objevuje se průjem, nauzea, zvracení, nechutenství a v souvis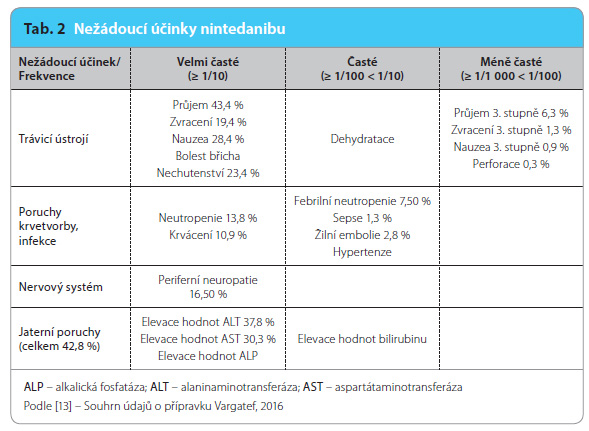 losti s těmito obtížemi následně i dehydratace, minerálová dysbalance a hubnutí (tab. 2). Nejčastější je průjem. Pokud se objeví, je třeba včas zajistit dostatečnou hydrataci a podávat protiprůjmové léky (např. loperamid). Z laboratorních odchylek jsou časté zvýšené hodnoty jaterních testů, zejména aktivity ALT.
losti s těmito obtížemi následně i dehydratace, minerálová dysbalance a hubnutí (tab. 2). Nejčastější je průjem. Pokud se objeví, je třeba včas zajistit dostatečnou hydrataci a podávat protiprůjmové léky (např. loperamid). Z laboratorních odchylek jsou časté zvýšené hodnoty jaterních testů, zejména aktivity ALT.
Z dalších nežádoucích účinků, které vyplývají z mechanismu účinku samotného léčiva (inhibice VEGF), jsou to různé krvácivé komplikace, nejčastěji epistaxe. Riziko závažných krvácivých, arteriálních tromboembolických příhod nebo perforace v oblasti gastrointestinálního traktu není veliké, přesto bychom měli u rizikových pacientů léčbu nintedanibem zvážit. U pacientů, kteří mají v anamnéze chirurgický zákrok v břišní dutině, je možné zahájit léčbu nejdříve za čtyři týdny od operace. Zvýšené riziko krvácení hrozí především u pacientů užívajících antikoagulační léčbu warfarinem, nezbytná je proto pravidelná monitorace koagulačních parametrů (INR). Pacientům léčeným kyselinou acetylsalicylovou nebo nízkomolekulárními hepariny v nízkých (profylaktických) dávkách nehrozí riziko zvýšené frekvence krvácení. U pacientů s anamnézou hemoptýzy, s centrálně uloženými tumory s invazí do velkých cév, s kavitujícími či s nekrotickými nádory se doporučuje léčbu nintedanibem nepodávat, neboť tito pacienti nebyli zařazeni do klinických studií a nejsou dostupná klinická data týkající se rizik krvácivých komplikací [1,7,8].
Lékové interakce
Možné lékové interakce vyplývají z metabolismu nintedanibu. Nintedanib je substrátem P‑glykoproteinu (P‑gp) a CYP3A4. Současné podávání nintedanibu se silnými inhibitory P‑gp (např. erythromycin, ketoconazol) může způsobit zvýšení expozice nintedanibu. Naopak induktory P‑gp (např. rifampicin, carbamazepin, phenytoin a třezalka tečkovaná) mohou expozici nintedanibu snižovat. Při terapii nintedanibem je vhodné sledování koagulačních parametrů při antikoagulační léčbě [1].
Dávkování
Nintedanib je vyráběn ve formě želatinových tobolek o síle 100 mg a 150 mg. Užívá se perorálně, nejlépe s jídlem. Doporučená dávka je 200 mg dvakrát denně, což je také maximální denní dávka. Nepodává se ve stejný den jako docetaxel ‚ který je podáván první den 21denního léčebného cyklu. Nintedanib se tedy podává 2.–21. den. Léčba nintedanibem pokračuje i po ukončení léčby docetaxelem až do progrese onemocnění či do nepřijatelné toxicity [1].
Pokud se objeví závažné nežádoucí účinky, může být léčba dočasně přerušena a po odeznění nebo zmírnění obtíží opětovně zahájena nižší dávkou. Doporučuje se dávku upravovat postupně po 100 mg denně (tedy snížení o 50 mg na jednu dávku), v závislosti na toleranci pacienta. V případě, že nežádoucí účinek přetrvává a pacient netoleruje ani dávku 100 mg dvakrát denně, léčba se trvale ukončuje.
Průjem je třeba léčit při prvních příznacích hydratací a léčivými přípravky proti průjmu (např. loperamidem). U pacientů se sníženými renálními funkcemi, ale s hodnotou clearance kreatininu > 30 ml/min není nutno dávky snižovat, protože pouze zhruba 1 % nintedanibu se vylučuje močí. Pokud dojde ke zvýšení hodnot jaterních enzymů (AST, ALT), doporučuje se snížit dávku při 3–5násobném vzestupu hodnot a léčbu ukončit, pokud jsou tyto hodnoty zvýšeny více než pětinásobně [1].
Těhotenství a kojení
Nintedanib má teratogenní a embryocidní účinky, proto není určen pro těhotné ženy. Léčivo je vylučováno do mateřského mléka. Nebyly prováděny studie s těhotnými ženami a s kojenci, proto není vhodné nintedanib podávat kojícím ženám [1].
Ovlivnění pozornosti
Nintedanib může snižovat pozornost, pacienty je třeba upozornit na nutnost zvýšené opatrnosti při řízení a obsluze strojů.
Seznam použité literatury
- [1] http://www.sukl.cz/modules/medication/detail.php?code=0210207&tab=texts VARGATEF®: A triple angiokinase inhibitor approved in combination with docetaxel for the treatment of patients with distinct types of adenocarcinoma of the lung after first line chemotherapy.1, ‚SMC website. https://www.scottishmedicines.org.uk/SMC_Advice/Advice/1027_15_nintedanib_Vargatef/nintedanib_Vargatef. Last accessed June 2015
- [2] Nintedanib, Pubchem, Open chemistry databaze, https://pubchem.ncbi.nlm.nih.gov/compound/Vargatef#section=Top (navštíveno 1. 5. 2016).
- [3] Klener P. Angiogeneze a nádorová onemocnění. Remedia 2002; 12: 2–8.
- [4] Ferrara N, Kerbel R. Angiogenesis as a therapeutic target. Nature 2005; 438: 967–974.
- [5] Awasthi N, Schwarz RE. Profile of nintedanib in the treatment of solid tumors: the evidence to date. OncoTargets Ther 2015; 8: 3691–3701.
- [6] Kaneda H. Perspectives on nintedanib treatment in non small cell lung cancer. Jpn J Lung Cancer 2015; 55: 962–972.
- [7] Reck M, Kaiser R, Mellemgaard A, et al. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non small cell lung cancer (LUME Lung 1): a phase 3, double blind, randomised controlled trial. Lancet Oncol 2014; 15: 143–155.
- [8] Lume Lung 2: BIBF 1120 Plus Pemetrexed Compared to Placebo Plus Pemetrexed in 2nd Line Nonsquamous NSCLC [online]. Zdroj: http://clinicaltrials. gov/ct2/show/NCT00806819
- [9] Hanna N. LUME Lung 2: A multicentre, randomized, double blind, Phase III study of nintedanib plus pemetrexed vs. placebo plus pemetrexed in patients with advanced non squamous non small cell lung cancer (NSCLC) after failure of first line chemotherapy. (Abstract #8034) at American Society of Clinical Oncology, Chicago, June 2, 2013.
- [10] Hanna N, Rashdan S. Nintedanib for the treatment of non small cell lung cancer. Expert Opin Pharmacother 2014; 15: 729–739.
- [11] Caglevic C, Grassi M, Raez L, et al. Nintedanib in non small cell lung cancer: from preclinical to approval. Ther Adv Respir Dis 2015; 9: 164–172.
- [12] Modrá kniha České onkologické společnosti – 22. aktualizace, platná od 1. 3. 2016.
- [13] Souhrn údajů o přípravku Vargatef, dostupné na www.sukl.cz (ze dne 28. 1. 2016).