Ofatumumab
Souhrn:
Kubala Havrdová E. Ofatumumab. Remedia 2021; 31: 264–268.
Ofatumumab je novou léčivou látkou k terapii dospělých pacientů s relabujícími formami roztroušené sklerózy (RS) s aktivním onemocněním definovaným klinicky nebo zobrazovacími metodami. Jedná se o plně humánní monoklonální protilátku anti‑CD20 s dávkováním 20 mg jednou za měsíc (po iniciačním dávkovacím režimu). Výhodou je subkutánní aplikace autoinjektorem bez nutnosti premedikace. K distribuci v organismu dochází lymfatickým systémem, což vede k vyšší koncentraci v lymfatických uzlinách představujících rezervoár autoreaktivních lymfocytů u RS, kde nastává interakce B a T lymfocytů. Ofatumumab prokázal v klinických studiích ASCLEPIOS I a II superioritu vůči teriflunomidu snížením počtu relapsů i lézí na magnetické rezonanci a oddálením potvrzené progrese disability. Zároveň se potvrdil příznivý bezpečnostní profil a systémové injekční reakce pak byly mimo první dávky srovnatelné s placebovými injekcemi.
Summary:
Kubala Havrdova E. Ofatumumab. Remedia 2021; 31: 264–268.
Ofatumumab is a new active substance indicated for the treatment of adult patients with relapsing forms of multiple sclerosis (MS) with active disease defined by clinical or imaging features. It is a fully human anti‑CD20 monoclonal antibody with a monthly dose of 20 mg (after the initial dosing regimen). The advantage is a subcutaneous application by autoinjector without the need for premedication. Distribution in the body occurs through the lymphatic system, leading to higher concentrations in the lymph nodes, where B and T lymphocytes interact and represent a reservoir of autoreactive lymphocytes in MS. Ofatumumab has been shown to be superior to teriflunomide in the reduction of relapses, MRI lesions and confirmed progression of disability in ASCLEPIOS I and II clinical trials. At the same time, a favorable safety profile was confirmed and systemic injection reactions were comparable to placebo injections, except for the 1st dose.
Key words: ofatumumab, multiple sclerosis, monoclonal antibody, CD20 receptor
Farmakologická skupina
Ofatumumab (Kesimpta) je řazen do farmakoterapeutické skupiny Selektivní imunosupresiva, ATC kód: L04AA52.
Indikace
Indikací ofatumumabu je léčba dospělých pacientů s relabujícími formami roztroušené sklerózy (RS) s aktivním onemocněním definovaným klinicky nebo zobrazovacími metodami [1].
Dávkování
Ofatumumab je podáván v doporučené
dávce 20 mg subkutánní injekcí samoaplikací pacientem
v měsíčním dávkování od týdne 4 po úvodním
schématu s počátečními dávkami v týdnech 0, 1 a 2
(obr. 1). První injekce má být aplikována pod vedením
zdravotnického pracovníka. Pokud dojde k vynechání injekce,
má být podána co nejdříve bez čekání na další
plánovanou dávku. Následující dávky mají být podávány
v doporučených intervalech. U pacientů s poruchou
funkce ledvin nebo jater se neočekává nutnost úpravy dávky [1].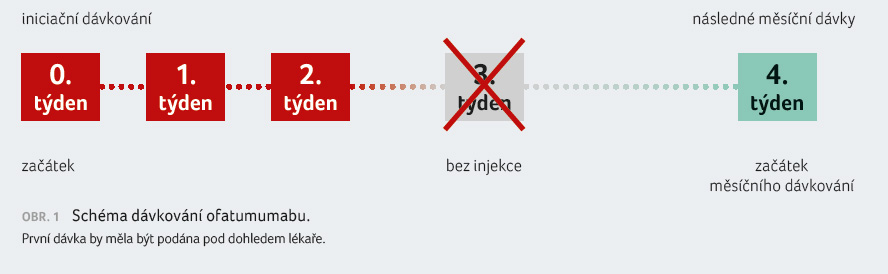
Zařazení do současné palety léčiv
Ofatumumab je určen pro léčbu aktivní relabující RS. Algoritmus léčby RS se v posledních letech s přibývajícími poznatky mění a posouvá se k účinnějším lékům podaným hned na počátku nemoci. Data z reálné praxe totiž ukázala, že včasné zahájení léčby vede k oddálení dlouhodobých následků zánětu v CNS [2−5] – k oddálení sekundární progrese, k oddálení atrofie mozkové tkáně, k oddálení nástupu kognitivního deficitu, ke snížení disability akumulující se v čase, ke zlepšené kvalitě života a k udržení práceschopnosti. V dlouhodobém horizontu vede takovýto léčebný postup ke snížení celospolečenských nákladů na tuto závažnou nemoc, začínající většinou mezi 20. a 30. rokem života. V České republice bude nutno změnit úhradová pravidla, která zatím preferují zahájení léčby méně nákladným, ale také méně efektivním terapeutickým režimem, jenž je v prvních letech choroby úspěšný stejně pouze u 30 % nemocných [6]. Pozdní eskalace, která je v ČR dána právě přísnými úhradovými pravidly, vede k tomu, že pacient se dříve dostává do vyššího stupně invalidity a často ztrácí zaměstnání. I když podíl pacientů s efektivnější léčbou v posledních letech pozvolna narůstá [7], bylo by třeba, aby se nemocní dostávali k této léčbě dříve nebo hned od začátku nemoci.
Ofatumumab patří mezi monoklonální protilátky v léčbě relabující RS, tedy mezi vysoce účinné léky. Protilátky proti molekule CD20 sdílejí podobně vysokou účinnost i podobné spektrum nežádoucích účinků. Teprve jejich úspěšné použití v léčbě RS definitivně ukázalo jednoznačnou roli B lymfocytů v patogenezi RS. V případě nedostatečné efektivity léků první volby (interferon beta, glatiramer acetát, teriflunomid, dimetylfumarát) jsou k dispozici i další léčebné možnosti – perorální modulátory sfingosin 1 fosfátových receptorů, monoklonální protilátka proti integrinům natalizumab a léky podávané pulzně se schopností dlouhodobého ovlivnění imunitního systému: perorální kladribin a monoklonální protilátka proti molekule CD52 alemtuzumab. V případě, že nemá některý z těchto léků dostatečný efekt nebo pacient léčbu netoleruje (nebo ji nelze zahájit pro kontraindikace), je vhodné neodkládat změnu léčby na lék s jiným mechanismem účinku.
Ofatumumab je zatím první monoklonální protilátkou, kterou si pacient může po zahájení léčby pod dohledem zdravotnického pracovníka dále aplikovat sám. Odpadají tím problémy s nedostatečnou kapacitou infuzních center a s přetížením zdravotnických zařízení. Další výhodou je to, že není nutná premedikace, jako je tomu u ostatních anti CD20 protilátek, protože je použita menší dávka v kratších časových intervalech. Pokud bude lékař mít možnost indikovat tento lék u vhodných pacientů (tedy pacientů s nepříznivými prognostickými markery průběhu choroby) v první linii, není sporu o tom, že celkový přínos léčiva bude mít dopad i na nákladovou efektivitu v dlouhodobém horizontu. Zachování práceschopnosti je totiž naprosto zásadním farmakoekonomickým ukazatelem úspěšnosti terapie u RS [8].
Mechanismus účinku‚ farmakodynamický efekt
Ofatumumab je plně lidská
monoklonální protilátka typu IgG1 proti
receptoru CD20. Molekula CD20 je transmembránový
fosfoprotein exprimovaný na B lymfocytech [9,10] od fáze
preB do zralého B lymfocytu, ale také na malém podílu
aktivovaných T lymfocytů. Vazba ofatumumabu na CD20 indukuje
lýzu CD20+ B lymfocytů primárně prostřednictvím
cytotoxicity závislé na komplementu (complement dependent
cytotoxicity, CDC) a v menší míře prostřednictvím
buněčné cytotoxicity závislé na protilátkách (antibody
dependent cellular cytotoxicity, ADCC). Ofatumumab též
vede k depleci T lymfocytů exprimujících CD20 [1,11], obrázek 2A, B a 3.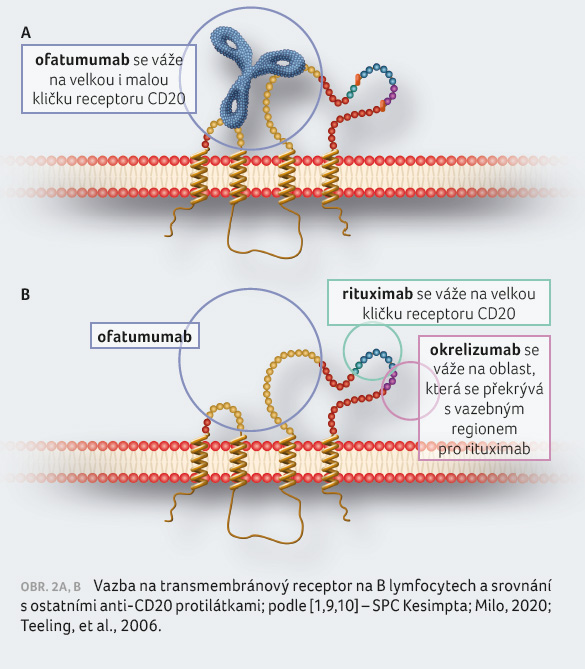
Deplece a replece B lymfocytů
V klinických studiích u relabující RS vedlo podání ofatumumabu v dávce 20 mg k rychlé a trvalé redukci počtu B lymfocytů pod dolní hranici normy (lower limit of normal, LLN; definované jako 40 buněk/µl) již dva týdny po zahájení léčby. Údaje z klinických studií fáze III naznačují medián do zotavení B lymfocytů na LLN nebo výchozí hodnotu 24,6 týdne po ukončení léčby. Modelování a simulace farmakokinetiky (PK) B lymfocytů pro repleci B lymfocytů tyto údaje potvrzují a předpovídají medián doby do zotavení B lymfocytů na LLN 23 týdnů po ukončení léčby [1].
Imunogenicita
Ve studiích fáze III
u relabujících forem RS byl celkový výskyt lékem
indukovaných protilátek (anti drug antibodies, ADA) u pacientů
léčených ofatumumabem 0,2 % (2 z 914) a nebyli
identifikováni žádní pacienti s ADA zvyšujícími nebo
neutralizujícími efekt léčby. Vliv pozitivních titrů ADA na PK,
bezpečnostní profil nebo kinetiku B lymfocytů nelze zhodnotit
vzhledem k nízké četnosti ADA spojených s ofatumumabem
[1].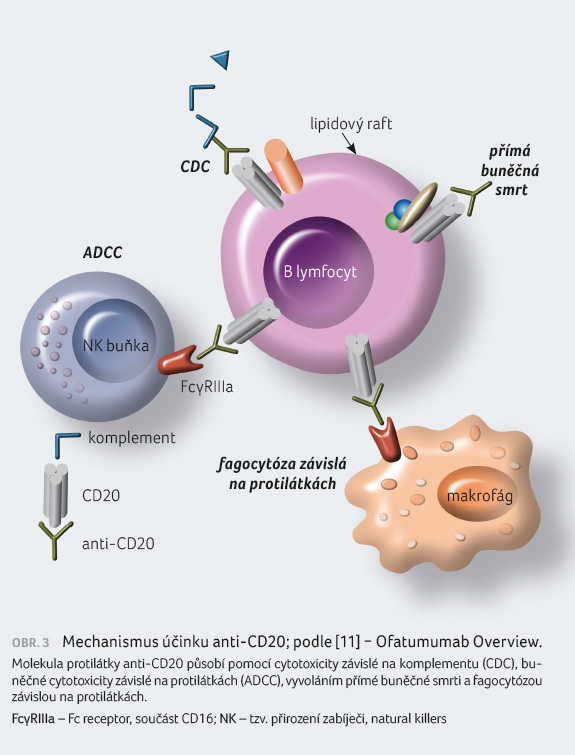
Farmakokinetické vlastnosti
Absorpce a distribuce
Měsíční subkutánní dávka 20 mg léčiva vede k průměrné ploše pod křivkou plazmatické koncentrace (AUCtau) 483 µg·h/ml a k průměrné maximální koncentraci v plazmě (cmax) 1,43 µg/ml v ustáleném stavu. Předpokládá se, že po subkutánním podání je ofatumumab převážně absorbován lymfatickým systémem podobně jako jiné terapeutické monoklonální protilátky [1].
Distribuční objem v ustáleném stavu byl po opakovaném subkutánním podání ofatumumabu v dávce 20 mg odhadnut na 5,42 litru [1].
Biotransformace a eliminace
Ofatumumab je protein, u kterého je očekávanou metabolickou cestou degradace na malé peptidy a aminokyseliny všudypřítomnými proteolytickými enzymy [1].
Léčivo je eliminováno dvěma způsoby: cíleně zprostředkovanou cestou, která souvisí s vazbou na B lymfocyty, a cílově nezávislou cestou zprostředkovanou nespecifickou endocytózou následovanou intracelulárním katabolismem, jako je tomu u jiných molekul IgG. B lymfocyty přítomné na počátku mají za následek větší složku cílově zprostředkované clearance ofatumumabu na začátku léčby. Dávkování ofatumumabu vede k silnému vyčerpání B lymfocytů a následnému snížení celkové clearance. Eliminační poločas v ustáleném stavu byl odhadován na přibližně 16 dní po opakovaném subkutánním podání ofatumumabu v dávce 20 mg [1].
Tělesná hmotnost
Na základě výsledků populační analýzy napříč studiemi byla tělesná hmotnost u pacientů s relabujícími formami RS identifikována jako kovariát expozice (cmax a AUC) ofatumumabu. Tělesná hmotnost však neovlivnila opatření týkající se bezpečnosti a účinnosti hodnocených v klinických studiích; úprava dávky proto není nutná [1].
Klinické zkušenosti
Účinnost a bezpečnost ofatumumabu byly hodnoceny ve dvou randomizovaných, dvojitě zaslepených, aktivně kontrolovaných stěžejních studiích fáze III se stejným uspořádáním (ASCLEPIOS I a ASCLEPIOS II, dle SPC studie 1 a studie 2) u pacientů s relabujícími formami RS ve věku 18−55 let. Stav postižení při screeningu byl na škále EDSS (Expanded Disability Status Scale, rozšířená škála disability) 0−5,5. Pacienti museli mít alespoň jeden zdokumentovaný relaps během předchozího roku nebo dva relapsy během předchozích dvou let nebo pozitivní gadolinium (Gd) enhancující zobrazení na magnetické rezonanci (MR) během předchozího roku. Byli zařazeni jak nově diagnostikovaní pacienti, tak pacienti přecházející ze současné léčby [1,12].
Ve dvou studiích bylo randomizováno 927 a 955 pacientů s relabující formou RS v poměru 1 : 1, kteří dostávali buď subkutánní injekce 20 mg ofatumumabu každé čtyři týdny počínaje 4. týdnem po úvodním dávkovacím režimu tří dávek 20 mg jednou týdně během prvních 14 dnů (1., 7. a 14. den), nebo teriflunomid v dávce 14 mg perorálně jednou denně. Pacienti rovněž dostávali příslušné placebo odpovídající druhému léčebnému rameni, aby bylo zajištěno zaslepení (double dummy design).
Délka léčby u jednotlivých pacientů byla různá podle toho, kdy byla splněna kritéria pro ukončení studie. V obou studiích činil medián léčby 85 týdnů, 33,0 % pacientů ve skupině s ofatumumabem oproti 23,2 % pacientů ve skupině s teriflunomidem bylo léčeno déle než 96 týdnů.
Demografické údaje a základní
charakteristiky byly dobře vyváženy mezi léčebnými rameny
a oběma studiemi. Průměrný věk byl 38 let, průměrná doba
trvání onemocnění 8,2 roku od nástupu prvního
příznaku a průměrné skóre EDSS 2,9; 40 % pacientů
nebylo dříve léčeno chorobu modifikující terapií
(disease modifying therapy, DMT) a 40 % mělo Gd
enhancující T1 léze na MR při zahájení studie.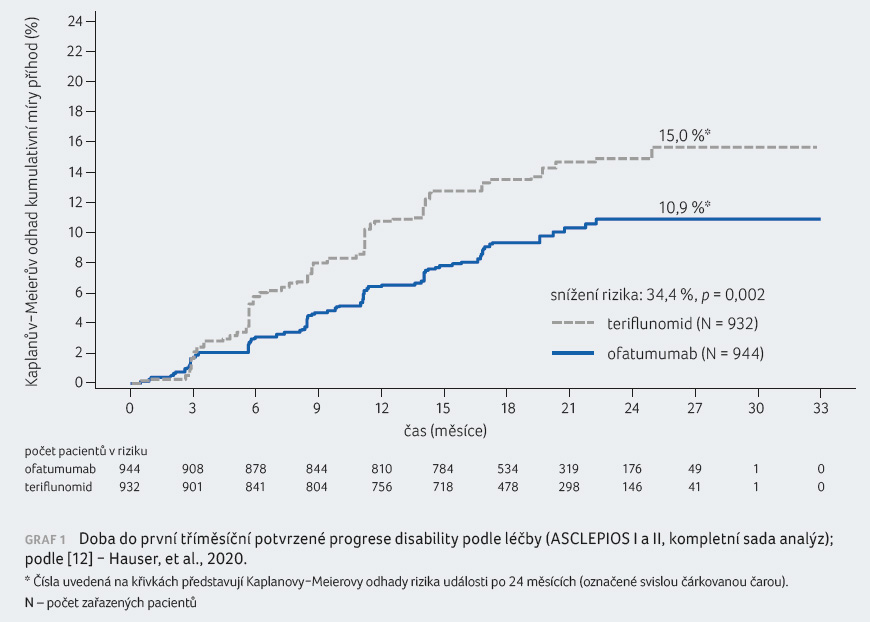
Primárním cílovým ukazatelem účinnosti obou studií byla roční míra potvrzených relapsů (annual relapse rate, ARR). Mezi klíčové sekundární cílové ukazatele účinnosti patřila doba do zhoršení disability hodnocená EDSS (potvrzená po 3 měsících a 6 měsících) a definovaná jako zvýšení EDSS o ≥ 1,5, ≥ 1 nebo ≥ 0,5 u pacientů s výchozí hodnotou EDSS 0, 1−5 nebo ≥ 5,5. Další klíčové sekundární cílové ukazatele zahrnovaly počet Gd enhancujících T1 lézí na MR zobrazení a roční míru nových nebo zvětšujících se T2 lézí. Klíčové sekundární cílové ukazatele související s disabilitou byly hodnoceny v metaanalýze kombinovaných dat ze studií ASCLEPIOS I a II, jak jsou definovány v protokolech studie.
V obou studiích fáze III
prokázal ofatumumab v porovnání s teriflunomidem
významné snížení ARR o 50,5 %, resp. 58,5 %. Předem
specifikovaná metaanalýza kombinovaných údajů ukázala, že
ofatumumab v porovnání s teriflunomidem významně
redukoval riziko tříměsíční potvrzené progrese disability
(confirmed disability progression, CDP) o 34,4 % (graf 1)
a riziko šestiměsíční CDP o 32,5 %. Ofatumumab
v porovnání s teriflunomidem významně snížil počet
Gd enhancujících T1 lézí o 95,9 % a míru nových
nebo zvětšujících se T2 lézí o 83,5 % (hodnoty
představují průměrné snížení při kombinaci studií) [1,12],
tabulka 1.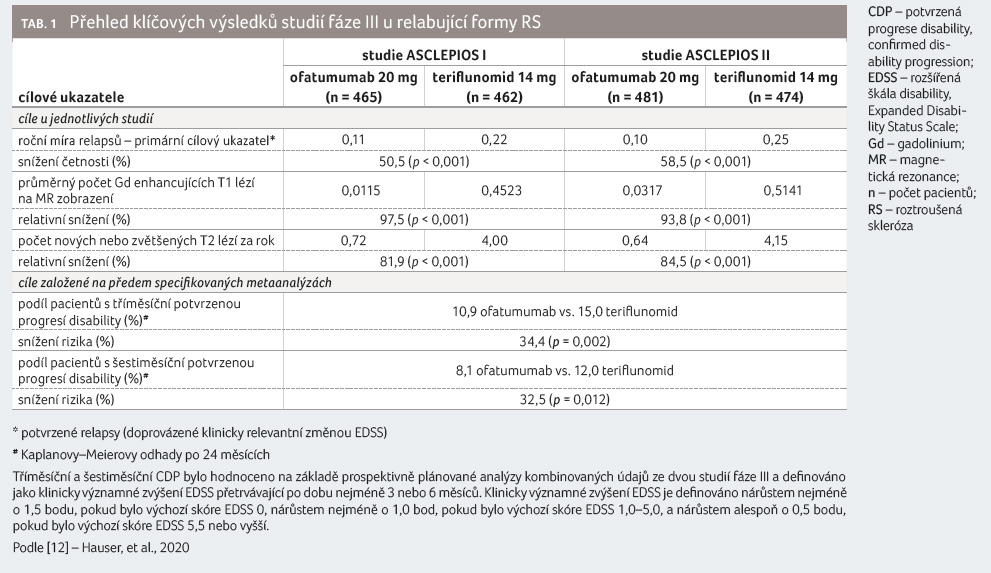
Podobný účinek ofatumumabu na klíčové parametry účinnosti ve srovnání s teriflunomidem byl pozorován v obou studiích fáze III u podskupin definovaných podle pohlaví, věku, tělesné hmotnosti, předchozí léčby RS a výchozího postižení a aktivity onemocnění.
V rámci post hoc analýzy provedené na základě poolovaných dat z obou studií ASCLEPIOS I a II byl podíl pacientů, kteří dosáhli stavu NEDA 3 (no evidence of disease activity), tedy bez aktivity onemocnění, v měsících 0–12 celých 47,0 % osob léčených ofatumumabem oproti 24,5 % nemocných léčených teriflunomidem (p < 0,001); v měsících 12–24 činil podíl pacientů dosahujících NEDA-3 s ofatumumabem 87,8 %, s teriflunomidem 48,2 % (p < 0,001). Ve druhém roce léčby ofatumumabem tak bylo přibližně devět z deseti pacientů bez aktivity nemoci (NEDA 3) [13].
Více než 90 % pacientů zařazených v klinických studiích ASCLEPIOS I a II pak v současné době pokračuje v terapii ofatumumabem v rámci extenze těchto studií pod názvem ALITHIOS [14]. Studií ASCLEPIOS I a II se v České republice účastnilo 11 center a bylo zařazeno 78 pacientů.
Kontraindikace
Ofatumumab je kontraindikován u pacientů:
- s hypersenzitivitou na léčivou látku nebo na kteroukoliv pomocnou látku,
- v těžce imunokompromitovaném stavu,
- se závažnou aktivní infekcí až do jejího odeznění,
- se známou aktivní malignitou.
Nežádoucí účinky
Ve studiích fáze III byl podíl pacientů s nežádoucími příhodami 83,6 % vs. 84,2 %. Počet pacientů s nežádoucími příhodami vedoucími k ukončení léčby byl 5,7 % vs. 5,2 %. Výskyt byl tedy podobný ve skupinách s ofatumumabem i teriflunomidem. Nejdůležitějšími a nejčastěji uváděnými nežádoucími účinky jsou infekce horních cest dýchacích (39,4 %), systémové reakce související s injekcí (20,6 %), reakce v místě vpichu (10,9 %) a infekce močových cest (11,9 %) [1].
Infekce
V klinických studiích fáze III sledujících relabující formu RS byla celková míra infekcí a závažných infekcí u pacientů léčených ofatumumabem podobná jako u pacientů léčených teriflunomidem (51,6 % vs. 52,7 %, resp. 2,5 % vs. 1,8 %). Dva pacienti (0,2 %) ukončili léčbu a 11 pacientů (1,2 %) dočasně přerušilo studijní léčbu kvůli závažné infekci. U 39,4 % pacientů léčených ofatumumabem se vyskytly infekce horních cest dýchacích ve srovnání s 37,8 % pacientů léčených teriflunomidem. Infekce byly převážně mírné až středně závažné a většinou sestávaly z nazofaryngitidy, infekce horních cest dýchacích a chřipky.
Reakce související s injekcí
V uvedených studiích fáze III byly reakce související s injekcí (systémové) hlášeny u 20,6 % pacientů léčených ofatumumabem. Výskyt reakcí souvisejících s injekcí byl nejvyšší u první injekce (14,4 %), významně se snižoval u následujících injekcí (4,4 % u druhé injekce, < 3 % od třetí injekce). Reakce spojené s injekcí byly většinou (99,8 %) mírné až středně závažné. U dvou pacientů (0,2 %) s RS léčených ofatumumabem byly hlášeny závažné reakce spojené s injekcí, ale ne život ohrožující. Mezi nejčastěji hlášené příznaky (≥ 2 %) patřily horečka, bolest hlavy, myalgie, zimnice a únava.
Reakce v místě vpichu
Lokální reakce byly ve studiích fáze III hlášeny u 10,9 % pacientů léčených ofatumumabem. Všechny reakce v místě vpichu byly mírné až středně silné intenzity a nezávažné povahy. Mezi nejčastěji hlášené příznaky (≥ 2 %) patřily erytém, bolest, svědění a otoky.
Laboratorní abnormality
V průběhu klinických studií fáze III u relabující formy RS bylo pozorováno snížení průměrné hodnoty imunoglobulinu M (IgM) − 30,9% pokles po 48 týdnech a 38,8% pokles po 96 týdnech −, ale nebyla prokázána souvislost s rizikem infekcí včetně závažných infekcí. U 14,3 % pacientů vedla léčba ofatumumabem k poklesu koncentrace IgM na méně než 0,34 g/l. Ofatumumab byl spojen i s přechodným snížením průměrných koncentrací IgG o 4,3 % po 48 týdnech léčby, ale se zvýšením o 2,2 % po 96 týdnech léčby.
Lékové interakce
Nebyly provedeny žádné studie interakcí, protože nejsou očekávány žádné interakce prostřednictvím enzymů cytochromu P450, jiných metabolizujících enzymů nebo transportérů [1].
Očkování
Bezpečnost a schopnost generovat primární nebo anamnestickou (vyvolanou) odpověď na imunizaci živými, živými oslabenými nebo inaktivovanými vakcínami během léčby ofatumumabem nebyla zkoumána. Všechna očkování mají být podána podle imunizačních pokynů nejméně čtyři týdny před zahájením léčby ofatumumabem u živých nebo živých oslabených vakcín, a pokud je to možné, nejméně dva týdny před zahájením léčby ofatumumabem u inaktivovaných vakcín. Ofatumumab může ovlivňovat účinnost inaktivovaných vakcín. Očkování živými nebo živými oslabenými vakcínami se během léčby a po ukončení léčby až do normalizace počtu B lymfocytů nedoporučuje [1].
Jiná imunosupresivní nebo imunomodulační léčba
Při zahájení léčby ofatumumabem po jiném imunosupresivním přípravku s prodlouženými imunitními účinky nebo při zahájení jiné imunosupresivní léčby s prodlouženými imunitními účinky po léčbě ofatumumabem je třeba vzít v úvahu dobu trvání a mechanismus účinku těchto léčivých přípravků z důvodu možných aditivních imunosupresivních účinků [1].
Těhotenství a kojení
Ženy ve fertilním věku mají během léčby ofatumumabem a po dobu šesti měsíců po posledním podání léčivého přípravku používat účinnou antikoncepci. Ofatumumab může podle zjištění ze studií na zvířatech procházet placentou a způsobit depleci B lymfocytů plodu. Léčba ofatumumabem nemá být zahajována během těhotenství, pokud potenciální přínos pro matku nepřeváží potenciální riziko pro plod.
Použití ofatumumabu u žen během kojení nebylo studováno. Není známo, zda se ofatumumab vylučuje do mateřského mléka. Během prvních několika dnů po narození se u člověka vylučují do mléka IgG protilátky, jejich koncentrace však brzy poté klesají na nízkou úroveň. Z tohoto důvodu nelze během tohoto krátkého období vyloučit riziko pro kojené dítě. Pokud však byla pacientka léčena ofatumumabem až do posledních několika měsíců těhotenství, kojení lze zahájit ihned po narození.
Seznam použité literatury
- [1] SPC Kesimpta. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/kesimpta‑epar‑product‑information_cs.pdf. Datum revize textu: 12. května 2021.
- [2] Brown JWL, Coles A, Horakova D, et al. Association of Initial Disease‑Modifying Therapy With Later Conversion to Secondary Progressive Multiple Sclerosis. JAMA 2019; 321: 175−187.
- [3] Andravizou A, Dardiotis E, Artemiadis A, et al. Brain atrophy in multiple sclerosis: mechanisms, clinical relevance and treatment options. Autoimmun Highlights 2019; 10: 7.
- [4] Harding K, Williams O, Willis M, et al. Clinical Outcomes of Escalation vs Early Intensive Disease‑Modifying Therapy in Patients With Multiple Sclerosis. JAMA Neurol 2019; 76: 536−541.
- [5] He A, Merkel B, Brown JWL, et al. Timing of high‑efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol 2020; 19: 307−316.
- [6] Rotstein DL, Healy BC, Malik MT, et al. Evaluation of no evidence of disease activity in a 7‑year longitudinal multiple sclerosis cohort. JAMA Neurol 2015; 72: 152−158.
- [7] Horáková D. Jaká data nabízí celostátní registr pacientů s roztroušenou sklerózou ReMuS? Neurol praxi 2020; 21: 410–413.
- [8] Havrdova E, Kobelt G, Berg J, et al. New insights into the burden and costs of multiple sclerosis in Europe: Results of the Czech Republic. Mult Scler 2017; 23(Suppl): 41−52.
- [9] Milo R. Ofatumumab – A Potential Subcutaneous B‑cell Therapy for Relapsing Multiple Sclerosis. Eur Neurol Rev 2020; 15: 27.
- [10] Teeling JL, Mackus WJM, Wiegman LJJM, et al. The Biological Activity of Human CD20 Monoclonal Antibodies Is Linked to Unique Epitopes on CD20. J Immunol 2006; 177: 362−371.
- [11] Ofatumumab Overview. Dostupné na: https://www.creativebiolabs.net/ofatumumab‑overview.htm
- [12] Hauser SL, Bar‑Or A, Cohen JA, et al. ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020; 383: 546−557.
- [13] Hauser SL, Bar‑Or A, Cohen J, et al. Ofatumumab vs Teriflunomide in Relapsing Multiple Sclerosis: Analysis of No Evidence of Disease Activity (NEDA‑3) from ASCLEPIOS I and II Trials. (Poster LB62) Presented at the 6th Congress of the European Academy of Neurology, May 23–26, 2020.
- [14] Fox E, Mayer L, Aungst A, et al. Adherence and Compliance with Subcutaneous Administration of Ofatumumab in Relapsing Multiple Sclerosis. (Poster 4521) Poster Presentation at the American Academy of Neurology (AAN) Virtual Annual Meeting, 2021.