Palonosetronum
Palonosetron je silným a vysoce selektivním antagonistou 5-HT3-receptorů užívaným v současné době k prevenci nevolnosti a zvracení po protinádorové chemoterapii. Má velmi dlouhý plazmatický eliminační poločas (přibližně 40 hod.), významně delší než jiné léky této skupiny. Jeho afinita k 5-HT3-receptorům je 100krát vyšší než u ostatních serotoninových antagonistů. V klinických studiích byl palonosetron podobně účinný nebo účinnější než srovnávané blokátory 5-HT3-receptorů v prevenci nevolnosti a zvracení vyvolaných středně nebo vysoce emetogenní terapií. Výhodou palonosetronu je jeho vyšší účinnost v zabránění oddálené nevolnosti a zvracení po středně emetogenní chemoterapii. V této indikaci se palonosetron stává preferovaným lékem.
Farmakologická skupina
Selektivní blokátor 5-HT3-receptorů s antiemetickým účinkem.
Chemické a fyzikální vlastnosti
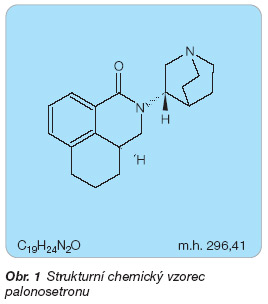
Palonosetron je chemicky (3aS)-2,3,3a, 4,5,6-hexahydro-2-[(3S)-3-chinuklidinyl]-1H-benz[de]isochinolin-1-on (obr. 1). V léčivém přípravku je obsažen ve formě hydrochloridu.
Sumární vzorec:
palonosetron: C19H24N2O
palonosetron-hydrochlorid: C19H25ClN2O
Molekulová hmotnost:
palonosetron: 296,41
palonosetron-hydrochlorid: 332,87
Přibližně 1,123 mg palonosetron-hydrochloridu odpovídá 1 mg báze palonosetronu.
Palonosetron-hydrochlorid je bílý nebo téměř bílý krystalický prášek snadno rozpustný ve vodě, dobře rozpustný v propylenglykolu a mírně rozpustný v ethanolu nebo v isopropylalkoholu.
Mechanismus účinku a farmakodynamika
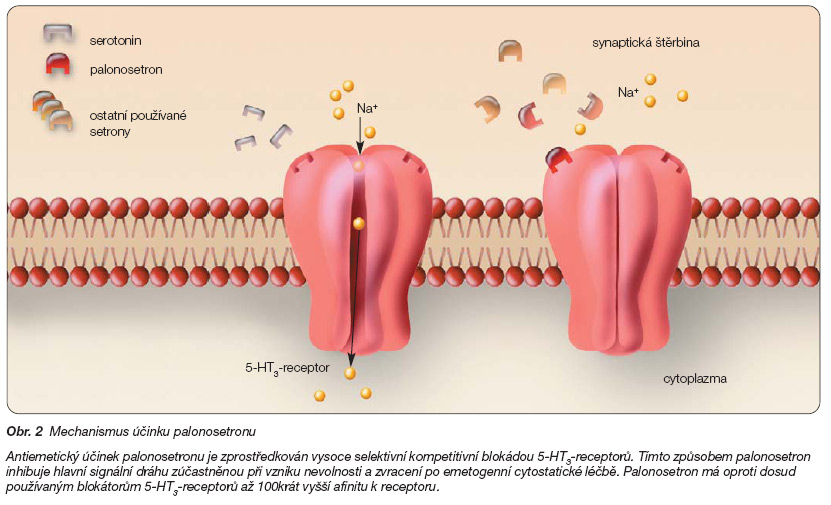
Antiemetický účinek palonosetronu je zprostředkován vysoce selektivní kompetitivní blokádou 5-HT3-receptorů. Tímto způsobem palonosetron inhibuje hlavní signální dráhu zúčastněnou při vzniku nevolnosti a zvracení po emetogenní cytostatické léčbě (obr. 2).
Palonosetron má oproti dosud používaným blokátorům 5-HT3-receptorů až 100krát vyšší afinitu k receptoru.
Antiemetický účinek palonosetronu byl prokázán v několika preklinických studiích na zvířecích modelech, na jejichž základě byl následně testován u lidí a zaveden do klinické praxe.
Závislost účinku palonosetronu na dávce byla testována u 161 nemocných léčených vysoce emetogenní chemoterapií, kteří do té doby neměli žádnou zkušenost s cytostatiky [1]. Při aplikaci jednorázové intravenózní dávky v rozmezí 0,3–90 mg/kg hmotnosti, podané 30 minut před chemoterapií, byla maximální antiemetická účinnost zaznamenána u dávky 3 mg/kg (46 % nemocných s kompletní odpovědí po samotném palonosetronu). Podávání vyšších dávek již nevedlo k dalšímu zvýšení účinnosti podobně jako u jiných léků této skupiny (plateau efect). Je zajímavé, že u třetiny nemocných s účinným dávkováním přetrvávala po jednorázové aplikaci palonosetronu kompletní odpověď po celých dalších 7 dnů, aniž by se objevilo zvracení oddáleného typu.
Na základě uvedených poznatků byly pro klinické použití doporučeny fixní dávky palonosetronu buď 0,25 mg (3 mg/kg), nebo 0,75 mg (přibližně 10 mg/kg).
Farmakokinetické vlastnosti
Terapeuticky využíván je pouze jeden stereoizomer palonosetronu, což může poskytovat výhodu lepšího farmakokinetického profilu oproti lékům, jež obsahují racemickou směs látek [1]. Vzhledem k tomu, že v současné době není k dispozici perorální forma pro klinické použití, týkají se následující údaje intravenózního podání [2].
Po jednorázové intravenózní aplikaci palonosetronu v dávce 0,25 mg šesti pacientům s onkologickým onemocněním byla zjištěna průměrná maximální koncentrace léku v krvi cmax 5,6 ng/ml a plocha pod křivkou AUC 35,8 ng . hod/ml [1]. Po jednorázové dávce 0,75 mg podané jiným pěti pacientům s onkologickým onemocněním byly hodnoty cmax 13,0 ng/ml a AUC 81,8 ng . hod/ml.
Na plazmatické bílkoviny se váže 62 % léčiva, což je oproti ostatním setronovým antiemetikům o něco menší podíl (ondansetron 70–76 %, granisetron 65 %, hydrodolasetron 73 %). Distribuční objem palonosetronu Vdss je přibližně 8,3 l/kg po jednorázové intravenózní aplikaci 0,75 mg.
Další osud léčiva má biexponenciální charakter; rychlá počáteční distribuční fáze je následována pomalou eliminační fází. Průměrná celková clearance u zdravých jedinců se pohybuje v rozmezí 1,1–3,9ml/ min/kg [3].
Asi 50 % léčiva je metabolizováno v játrech. Dva hlavní metabolity jsou biologicky inaktivní. Během šesti dnů po jednorázové aplikaci se 80 % podané dávky vyloučí močí, přičemž polovinu z tohoto množství představuje nezměněná původní látka, zatímco druhou polovinu její metabolity [4].
V klinických studiích fáze I na lidských dobrovolnících byl zjištěn terminální eliminační plazmatický poločas přibližně 40 hodin, tedy významně delší než u dosud běžně používaných setronů (ondansetron 4 hod., granisetron 9 hod., tropisetron 8 hod., hydrodolasetron 7,5 hod.). Po opakované aplikaci palonosetronu zdravým dobrovolníkům v dávce 0,25 mg tři dny po sobě klesala koncentrace léku v krvi pomalu a byla měřitelná ještě za 168 hodin (7 dnů) po podání třetí dávky [5].
Na farmakokinetiku léku nemá významný vliv věk léčeného, jaterní dysfunkce ani lehká či středně těžká ledvinová nedostatečnost. Základní farmakokinetické parametry viz tab. 1.
Metabolismus
Palonosetron je metabolizován systémem cytochromu P-450, a to jeho izoenzymem 2D6 [4, 6]. Hlavní metabolit palonosetronu má zanedbatelnou aktivitu, takže antiemetický účinek je způsoben především samotným palonosetronem.
Izoenzym 2D6 je zodpovědný za přeměnu jedné čtvrtiny všech předepisovaných léčiv. Jeho zvláštní charakteristikou (na rozdíl od řady jiných izoenzymů, včetně 3A4) je významný vliv polymorfismu genu, který kóduje výsledný funkční protein. Dnes je známo více než 90 různých alel pro CYP2D6, z nichž ta nejčastěji se vyskytující způsobuje extenzivní přeměnu léčiv, zatímco některé další naopak vedou ke zpomalení přeměny (tyto alely jsou přítomny až u 10 % příslušníků kavkazské rasy). Vyskytují se však také jedinci s velmi rychlým metabolismem, kteří mají příslušný gen zdvojený nebo amplifikovaný (asi 8 % příslušníků kavkazské rasy). Některá léčiva s afinitou k CYP2D6, jako jsou např. antidepresiva, mohou být významnými inhibitory tohoto systému, a ovlivňovat tak účinek jiných léčiv metabolizovaných tímto izoenzymem.
Genetický polymorfismus může způsobit abnormální odpověď na palonosetron. Proto u jedinců s genetickým typem vysoce aktivního CYP2D6 může být účinek palonosetronu výrazně oslaben [6].
Klinické zkušenosti
Antiemetická účinnost palonosetronu byla potvrzena třemi velkými klinickými studiemi III. fáze. Dvě z nich hodnotily nemocné se středně emetogenní a jedna s vysoce emetogenní chemoterapií.
V multicentrické studii převážně evropských autorů byl srovnán účinek palonosetronu v jednotlivé intravenózní dávce s účinkem 32 mg ondansetronu u nemocných léčených středně emetogenní chemoterapií [7]. Heterogenní skupinu 563 pa-cientů, z nichž někteří již dříve podstoupili chemoterapii, tvořily z velké části ženy (72 %) s karcinomem prsu. Z cytostatik byl nejčastěji použit cyclophosphamid (63 % všech nemocných) a doxorubicin (48 %). Palonosetron v obou testovaných jednorázových fixních dávkách (0,25 mg a 0,75 mg i.v.) nebyl v hodnocení kompletní odpovědi (žádné zvracení ani nutnost změny antiemetické medikace) horší než ondansetron (32 mg i.v.) v prevenci akutního zvracení (0–24 hod. po chemoterapii). Úplně se podařilo zabránit oddálenému zvracení (24–120 hodin po zahájení chemoterapie) po podání palonosetronu v dávce 0,25 mg v 74,1 %, což představovalo signifikantně vyšší počet nemocných než po ondansetronu (55,1 %, p = 0,001). Efekt vyšší dávky palonosetronu nebyl proti ondansetronu významný. Signifikantní byl také rozdíl v kompletní odpovědi za celých 0–120 hodin po jednorázové aplikaci palonosetronu 0,25 mg oproti ondansetronu (p = 0,001).
Právě tato přetrvávající účinnost jednotlivé dávky přisuzovaná dlouhému poločasu eliminace palonosetronu byla ve zmíněné studii považována za klinicky významný nález.
Ve studii amerických autorů bylo hodnoceno 569 nemocných randomizovaných do tří větví podle typu jednorázové intravenózní antiemetické prevence aplikované 30 minut před podáním středně emetogenní chemoterapie (palonosetron 0,25 mg, 0,75 mg a dolasetron 100 mg) [8]. Procento kompletní odpovědi s úplnou zábranou zvracení v prvních 24 hodinách se v jednotlivých skupinách významně nelišilo (63 % po palonosetronu 0,25 mg, 57 % po palonosetronu 0,75 mg a 53 % po dolasetronu). Při hodnocení oddáleného zvracení (24–120 hodin po chemoterapii) však byla kompletní odpověď signifikantně častější po obou dávkách palonosetronu proti dolasetronu (54 %, 56 % a 39 %, p < 0,005). Při hodnocení celého období (0–120 hodin) po chemoterapii byl palonosetron 0,25 mg účinnější než dolasetron (46 % kompletní odpovědi vs 34 %, p = 0,02). Palonosetron byl také signifikantně účinnější v sekundárních ukazatelích, a to v celkovém počtu emetických epizod a v čase do selhání léčby.
Aapro a kol. provedli retrospektivní analýzu obou uvedených studií se zhodnocením účinnosti palonosetronu v podskupině 171 nemocných starších 64 roků [9]. Kompletní antiemetické odpovědi po celou dobu pěti dnů po podání středně emetogenní chemoterapie bylo dosaženo signifikantně častěji po palonosetronu než po ondansetronu či dolasetronu. Také další ukazatele, jako čas do selhání léčby nebo oddálená nevolnost 2. a 3. den po cytostatické léčbě, byly příznivější ve skupině léčené palonosetronem.
V další studii byla u 667 nemocných srovnána antiemetická účinnost palonosetronu v jednorázové intravenózní dávce 0,25 a 0,75 mg s účinností ondansetronu 32 mg intravenózně před vysoce emetogenní chemoterapií (cisplatina > 60 mg/m2, cyclophosphamid > 1500 mg/m2 nebo dacarbazin) (převzato z [4]). Procento kompletní odpovědi se mezi použitými léky významně nelišilo ani při hodnocení akutního či oddáleného zvracení. Palonosetron byl signifikantně účinnější než ondansetron pouze v sekundárních ukazatelích, a to v čase do selhání léčby a v počtu emetických epizod.
Dosud nebyla publikována velká kontrolovaná studie, která by srovnávala efekt palonosetronu s účinností granisetronu.
Zařazení do současné palety léčiv
Palonosetron patří spolu s dalšími blokátory 5-HT3-receptorů mezi nejúčinnější léčiva v předcházení nevolnosti a zvracení po protinádorové chemoterapii [2]. Předností palonosetronu proti dosud používaným setronovým antiemetikům je vysoká afinita k 5-HT3- receptorům a dlouhý poločas plazmatické eliminace. Těmito vlastnostmi se palonosetron liší od dosud používaných blokátorů 5-HT3-receptorů, takže je v této skupině řazen k lékům II. generace [10].
Palonosetron sdílí spolu s ostatními blokátory 5-HT3-receptorů vysokou účinnost v prevenci akutního zvracení po středně a vysoce emetogenní chemoterapii, ale navíc má po středně emetogenní chemoterapii prokazatelnou účinnost i v zabránění oddálenému zvracení.
U středně emetogenní chemoterapie zabraňuje intravenózně podaný palonosetron akutnímu zvracení se stejnou účinností jako dosud používaná setronová antiemetika. Kompletní odpovědi dosahuje nejméně 75 % léčených. Velkou předností jednorázové aplikace je však vyšší účinnost v prevenci oddáleného zvracení, které jinak představuje závažný klinický problém [11]. Vzhledem k jednoduchému dávkování a dobré toleranci je nyní palonosetron doporučen k prevenci nevolnosti a zvracení po středně emetogenní chemoterapii [4, 9].
U vysoce emetogenní chemoterapie zabraňuje palonosetron akutnímu i oddálenému zvracení se stejnou účinností jako ondansetron nebo dolasetron. Kompletní odpověď po samotné jednorázové aplikaci lze v intervalu prvních 24 hodin očekávat u 40–50 % léčených. Palonosetron však prokázal určitou přednost v některých dalších ukazatelích, jako byl nižší průměrný počet emetických epizod a delší čas do selhání léčby po jednorázovém podání léku.
Vzhledem k tomu, že účinnost samotného palonosetronu v zabránění akutnímu zvracení není u části nemocných úplná, je stejně jako u ostatních setronových antiemetik na místě kombinace s dalšími antiemetiky, především s kortikosteroidy.
V klinické praxi může být palonosetron užitečným léčivem při několikadenních cytostatických režimech, u nichž je požadována prodloužená blokáda 5-HT3-receptorů [12].
Důvody pro potřebu nových antiemetik
Antiemetika ze skupiny blokátorů 5-HT3-receptorů představují významný pokrok v prevenci a léčbě nevolnosti a zvracení po cytotoxické chemoterapii. Přes jejich rozšířené používání však velká část nemocných nadále trpí po chemoterapii těmito obtížemi [13].
V nedávné studii byl hodnocen vliv moderní antiemetické profylaxe (97 % nemocných dostávalo blokátory 5-HT3-receptorů a 78 % současně kortikosteroidy, obojí ve většině případů po dobu 3 dnů) u 298 pacientů léčených chemoterapií (67 nemocných podstoupilo vysoce emetogenní a 231 nemocných středně emetogenní chemoterapii) [14, 15]. Akutní zvracení (vzniklé v den podání chemoterapie) se objevilo u 13 % léčených, akutní nevolnost u 35 % případů. Oddálené zvracení (den 2–5) bylo zjištěno u 50 % nemocných po vysoce emetogenní a u 28 % po středně emetogenní chemoterapii, zatímco v případě nevolnosti oddáleného typu představoval tento podíl 60 % a 52 % léčených. Přestože byl předpovědní odhad odborníků v případě akutního zvracení správný, došlo v případě oddálené nevolnosti a zvracení k významnému podhodnocení pozdějšího skutečného výskytu těchto obtíží.
Také v další studii se u ambulantních pacientů i přes profylaktické podání ondansetronu a dexamethasonu vyskytla do pěti dnů po středně emetogenní chemoterapii nauzea u 73 % a zvracení u 30 % pacientů, přičemž třetina nemocných trpěla nevolností nejméně 4 dny [16].
Uvedené práce dokladují přetrvávající výskyt nevolnosti a zvracení u významné části nemocných léčených chemoterapií, navzdory moderní kombinované antiemetické profylaxi.
Proto je stále třeba hledat nové možnosti prevence a léčby nevolnosti a zvracení – nejvíce obávaných důsledků protinádorové chemoterapie, které mohou vést i k odmítání další onkologické léčby [17, 18].
Potenciální přínos palonosetronu
Palonosetron dosud nebyl testován u vysoce emetogenních několikadenních přípravných cytostatických režimů před transplantací krvetvorných buněk, u nichž se na častém výskytu obtíží podílí jak opakované akutní, tak oddálené zvracení [19].
Dlouhý eliminační poločas palonosetronu by mohl být přínosem také při snaze o ovlivnění pooperační nevolnosti a zvracení, kde setronová antiemetika vykazují částečný efekt [6]. Podobně by palonosetron mohl přinést úlevu nemocným s chronickou nevolností a občasným zvracením u pokročilého nádorového onemocnění, kde také byly v paliativní léčbě podle několika studií blokátory 5-HT3-receptorů účinnější než dříve používaná antiemetika [20].
Indikace
Palonosetron je indikován k prevenci akutního zvracení po vysoce emetogenní a středně emetogenní protinádorové chemoterapii. Kromě toho se stal prvním lékem ze skupiny blokátorů 5-HT3-receptorů indikovaných k prevenci oddáleného zvracení po středně emetogenní chemoterapii. Ve standardních doporučeních NCCN (National Comprehensive Cancer Network) je nyní preferovaným lékem u nemocných léčených středně emetogenní chemoterapií.
Kontraindikace
Palonosetron v doporučené dávce nemá žádné absolutní kontraindikace, s výjimkou prokázané přecitlivělosti na tento lék. V dosud provedených klinických studiích se nevyskytly žádné závažné nežádoucí účinky, které by byly přičítány palonosetronu a vedly k nutnosti lék vysadit [4].
Nežádoucí účinky
Palonosetron je dobře tolerovaným léčivem. Nežádoucí účinky jsou většinou jen mírné a jsou stejného charakteru jako po podávání ostatních blokátorů 5-HT3-receptorů. Mají obdobnou intenzitu a frekvenci výskytu. Nežádoucí účinky jsou mezi léčenými rovnoměrně distribuovány, bez zjevné závislosti na výši dávky léku [1, 3]. Nejčastějšími nežádoucími účinky jsou bolest hlavy (9 %) a zácpa (5 %) [4, 10]. Méně často jsou popisovány závratě nebo bolest břicha. V laboratorním obraze se v provedených studiích nevyskytovaly žádné závažnější změny a nedocházelo ani k významnému prodloužení intervalu QT na EKG [4, 9].
Lékové interakce
Potenciál palonosetronu pro vznik lékových interakcí je nízký, protože léčivo je metabolizováno pouze jedním z izoenzymů cytochromu P-450 (CYP2D6). U zdravých dobrovolníků nebyly pozorovány žádné interakce mezi palonosetronem a metoclopramidem [4]. Farmakokinetika palonosetronu se významně nemění ani při kombinaci s aprepitantem, novým antiemetikem ze skupiny blokátorů NK1-receptorů [21]. Při použití obvyklé perorální dávky aprepitantu podávané po 3 dny nedošlo k významné změně eliminačního poločasu palonosetronu ani ke změně celotělové clearance či distribučního objemu.
Dávkování
V současné době lze za doporučenou považovat jednorázovou fixní dávku 0,25 mg aplikovanou intravenózně přibližně po dobu 30 vteřin, nejlépe 30 minut před zahájením chemoterapie.
Stabilita a kompatibilita
Palonosetron je fyzikálně i chemicky stabilní v běžných infuzních roztocích, jako je fyziologický roztok nebo 5% glukóza, a to po dobu 48 hodin při pokojové teplotě 23 °C a až 14 dnů při teplotě kolem 4 °C v lednici [22].
Balení
Viz tab. 2.
Seznam použité literatury
- [1] Eisenberg P, MacKintosh FR, Ritch P, et al. Efficacy, safety and pharmacokinetics of palonosetron in patiens receiving highly emetogenic cisplatin-based chemotherapy: a doseranging clinical study. Annals of Oncology 2004; 15: 330–37.
- [2] Kris MG, Hesketh PJ, Herrstedt J et al. Consensus proposals for the prevention of acute and delayed vomiting and nausea following high-emetic-risk chemotherapy. Supportive Care in Cancer 2005; 13: 85–96.
- [3] Stoltz R, Cyong JC, Shah A, Parisi S. Pharmacokinetic and safety evaluation of palonosetron, a 5-hydroxytryptamine-3 receptor antagonist, in U.S. and Japanese healthy subjects. J Clin Pharmacol 2004; 44: 520–31.
- [4] Siddiqui MAA and Scott LJ. Palonosetron. Drugs 2004; 64: 1125–32.
- [5] Hunt TL, Gallagher SC, Cullen MT, Shah AK. Evaluation of safety and pharmacokinetics of consecutive multiple-day dosing of palonosetron in healthy subjects. J Clin Pharmacol 2005; 45: 589–96.
- [6] Janicki PK. Cytochrome P450 2D6 metabolism and 5-hydroxytryptamine type 3 receptor antagonists for postoperative nausea and vomiting. Med Sci Monit 2005; 11(10): RA322-RA328.
- [7] Gralla R, Lichinitser M, Van der Vegt S et al. Palonosetron improves prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic cemotherapy: results of a double-blind randomized phase III trial comparing single doses of palonosetron with ondansetron. Annals of Oncology 2003; 14: 1570–7.
- [8] Eisenberg P, Figueroa-Vadillo J, Zamora R et al. Improved prevention of moderately emetogenic chemotherapy-induces nausea and vomiting with palonosetron, a pharmacologically novel 5-HT3 receptor antagonists: results of a phase III, single-dose trial versus dolasetron. Cancer 2003; 98; 2473–82.
- [9] Aapro MS, Macciocchi A, Gridelli C. Palonosetron improves prevention of chemotherapy-in-duced nausea and vomiting in elderly patients. J Support Oncol 2005; 3: 369–74.
- [10] Hesketh PJ. New treatment options for chemo-therapy-induced nausea and vomiting. Support Care Cancer 2004; 12: 550–4.
- [11] Gridelli C. 5-HT3 receptor antagonists in the control of delayed-onset emesis. Anticancer Research 2003; 23: 2773–82.
- [12] Grunberg SM, Koeller JM. Palonosetron: a unique 5-HT3 receptor antagonist for the prevention of chemotherapy-induced emesis. Expert Opin Pharmacother 2003; 4: 2297–303.
- [13] Glaus A, Knipping C, Morant R et al. Chemotherapy-induced nausea and vomiting in routine practice: a European perspective. Support Care Cancer 2004; 12: 708–15.
- [14] Grunberg SM, Deuson RR, Mavros P et al. Incidence of chemotherapy-induced nausea and emesis after modern antiemetics. Cancer 2004; 10: 2261–68.
- [15] Grunberg SM, Osoba D, Hesketh PJ et al. Evaluation of new antiemetic agents and definition of antineoplastic agent emetogenicity-an update. Supp Care Cancer 2005; 13: 80–4.
- [16] Hickok JT, Roscoe JA, Morrow GR et al. Nausea and emesis remain significant problems of chemotherapy despite prophylaxis with 5-hydroxytryptamine-3 antiemetics. Cancer 2003; 97: 2880–6.
- [17] Martin AR, Pearson JD, Cai B et al. Assessing the impact of chemotherapy-induced nausea and vomiting on patients´ daily lives: a modified version of the Functional Living Index-Emesis (FLIE) with 5-day recall. Supp Care Cancer 2003; 11: 522–7.
- [18] Neymark N, Crott R. Impact of emesis on clinical and economic outcomes of cancer therapy with highly emetogenic chemotherapy regimen: a retrospective analysis of three clinical trials. Supportive Care in Cancer 2005; 13: 812–18.
- [19] Einhorn LH, Rapoport B, Koeller J et al. Antiemetic therapy for multiple-day chemotherapy and high-dose chemotherapy with stem cell transplant: review and consensus statement. Support Care Cancer 2005; 13: 112–16.
- [20] Glare P, Pereira G, Kristjanson LJ et al. Systematic review of the efficacy of antiemetics in the treatment of nausea in patients with far-advanced cancer. Support Care Cancer 2004; 12: 432–40.
- [21] Shah AK, Hunt TL, Gallagher SC, Cullen MT Jr. Pharmacokinetics of palonosetron in combination with apprepitant in healthy volunteers. Curr Med Res Opin 2005; 21: 595–601.
- [22] Trissel LA, Xu QA. Physical and chemical stability of palonosetron HCl in 4 infusion solutions. Ann Pharmacoter 2004; 38: 1608–11.