Pegylovaný interferon β 1a
Souhrn:
Interferon β je dnes standardním léčivem první volby u pacientů s relabující remitující roztroušenou sklerózou. Klinické studie prokázaly statisticky významné snížení ročního počtu relapsů a známek aktivity nemoci, snížení počtu a objemu lézí vychytávajících gadolinium při zobrazení pomocí magnetické rezonan-ce. Interferon β 1a kromě toho působí i na zpomalení klinické progrese. Přestože tolerance léčby intramuskulárně podávaným interferonem β 1a je velmi dobrá, pegylací této molekuly bylo dosaženo stejného klinického efektu při snížení výskytu nežádoucích účinků tím, že je aplikován subkutánně jen jednou za dva týdny. Pegylací lze dosáhnout zlepšení chemické stability a tím zvýšení účinnosti v nižší koncentraci. Zvětšením velikosti molekuly se redukuje moleku-lární filtrace a prodlužuje se eliminační poločas. Dochází k ochraně molekuly proti makrofágům, protilátkám a proteolytickým enzymům.
Key words: multiple sclerosis – pegylated interferon β1 a – adherence.
Summary:
Nowadays, interferon β 1a is a standard first choice therapy in patients with relapsing remitting multiple sclerosis. Clinical studies have shown statistically significant reduction in relapse rate and disease activity plus reduction in the number and load of gadolinium enhancing lesions on magnetic resonance images with this treatment. Interferon β 1a also slows the clinical progression. Although the tolerance of treatment with intramuscular interferon β 1a is very good, pegylation of this molecule made it possible to use subcutaneous applications just once in two weeks while preserving the clinical effect. Pegylation improves the chemical stability of the molecule, thus increasing its effectiveness in lower concentrations. By increasing the size of the molecule, molecular filtration diminishes and elimination halftime is prolonged. The molecule is also shielded from macrophages, antibodies, and proteolytic enzymes.
Úvod
V roce 1993 se interferon β‑1b (IFNβ‑1b), podávaný podkožně v dávce 250 µg ob den, stal prvním oficiálně schváleným lékem, u kterého bylo prokázáno snížení ročního počtu relapsů (annualised relapse rate, ARR) a potlačení aktivity nemoci na magnetické rezonanci ve srovnání s placebem u pacientů s relabující‑remitující roztroušenou sklerózou (RR‑RS) [1,2].
O tři roky později byl uveden na trh interferon β‑1a (IFNβ‑1a), podávaný intramuskulárně jednou týdně. Do klinického sledování bylo zařazeno 301 pacientů s mírou postižení hodnocenou pomocí stupnice EDSS (Expanded Disability Status Scale) v rozmezí 1,0–3,5, kteří prodělali alespoň dva relapsy během posledních tří let. Pacienti byli randomizováni do skupiny s placebem nebo s léčbou IFNβ‑1a (30 mg intramuskulárně jednou týdně) po dobu dvou let. U nemocných, jimž byl podáván IFNβ‑1a, došlo oproti placebu k signifikantnímu poklesu aktivity onemocnění hodnocené klinicky i na magnetické rezonanci [3,4]. Další studie prokázala velmi významnou skutečnost, a sice jednoznačné zpomalení klinické progrese, která je zodpovědná za ireverzibilní neurologický deficit [5].
 Studie CHAMPS se zaměřila na možnost léčebného ovlivnění časných forem roztroušené sklerózy. Prokázala statisticky významné oddálení rozvoje klinicky definitivní roztroušené sklerózy v případě první demyelinizační příhody označované jako klinicky izolovaný syndrom (clinically isolated syndrome, CIS). V průběhu tří let sledování byla kumulovaná pravděpodobnost vývoje klinicky definitivní roztroušené sklerózy u pacientů léčených IFNβ‑1a podstatně nižší než v placebové skupině. Ve srovnání s pacienty ve skupině s placebem bylo u pacientů, kterým byl podáván IFNβ‑1a, zjištěno relativní snížení objemu mozkových lézí, méně nových nebo zvětšených lézí a méně lézí vychytávajících gadolinium po dobu 18 měsíců [6].
Studie CHAMPS se zaměřila na možnost léčebného ovlivnění časných forem roztroušené sklerózy. Prokázala statisticky významné oddálení rozvoje klinicky definitivní roztroušené sklerózy v případě první demyelinizační příhody označované jako klinicky izolovaný syndrom (clinically isolated syndrome, CIS). V průběhu tří let sledování byla kumulovaná pravděpodobnost vývoje klinicky definitivní roztroušené sklerózy u pacientů léčených IFNβ‑1a podstatně nižší než v placebové skupině. Ve srovnání s pacienty ve skupině s placebem bylo u pacientů, kterým byl podáván IFNβ‑1a, zjištěno relativní snížení objemu mozkových lézí, méně nových nebo zvětšených lézí a méně lézí vychytávajících gadolinium po dobu 18 měsíců [6].
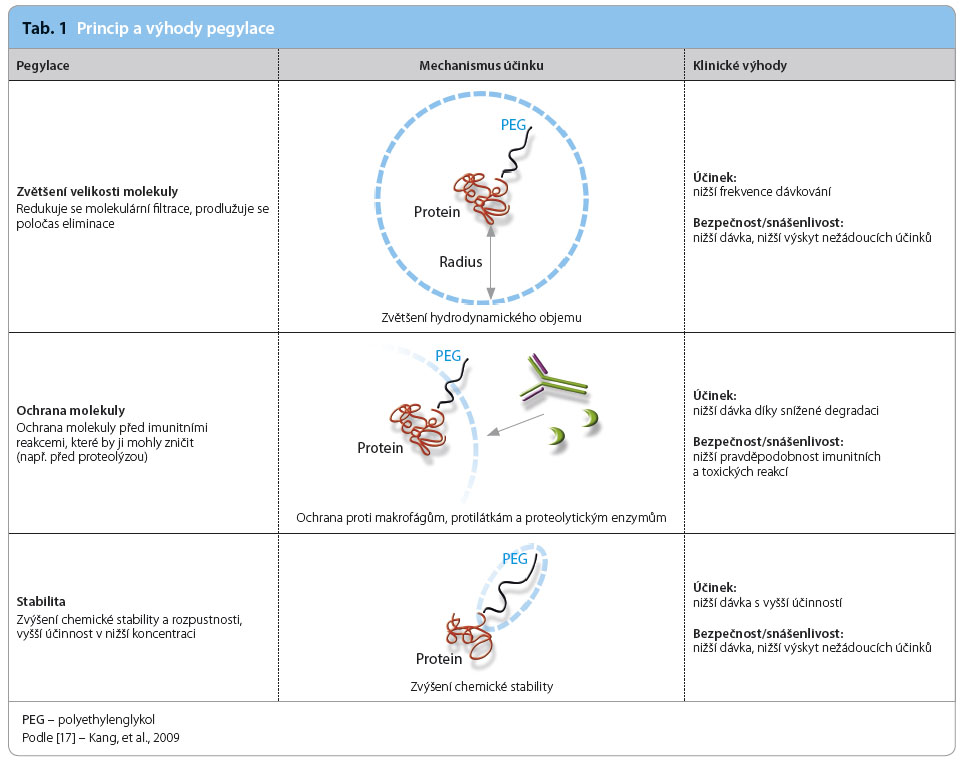
Přestože intramuskulární aplikace jednou týdně nepředstavovala pro pacienty výrazné omezení z hlediska pohodlnosti léčby, hledala se možnost, jak docílit stejného efektu léčby se sníženou frekvencí podávání. Jako velmi nadějná se ukázala metoda pegylace, která spočívá v konjugaci IFNβ‑1a s polyethylenglykolem. Pegylace byla již v minulosti použita u jiných léčiv ke zvýšení biologické dostupnosti, účinnosti a stability přípravku [7]. Principy tohoto procesu jsou znázorněny v tab. 1.
Pegylovaný IFNβ‑1a (Peg‑IFNβ‑1a) byl na sklonku roku 2014 schválen americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) i Evropskou lékovou agenturou (European Medicines Agency, EMA) k léčbě pacientů s RR‑RS, v České republice je registrován a jeho uvedení na tuzemský trh se předpokládá v roce 2016.
Farmakologická skupina
Peg‑IFNβ‑1a se řadí dle Anatomicko‑terapeuticko‑chemické klasifikace léčiv do skupiny Cytostatika a imunomodulační léčiva, respektive byl zařazen mezi Imunostimulancia, interferony; ATC kód je L03AB13.
Fyzikální a chemické vlastnosti
Peg‑IFNβ‑1a je interferon β‑1a konjugovaný s jednou lineární molekulou methoxypoly(ethylenglykol)‑O‑2‑methylpropionaldehydu o molekulové hmotnosti 20 kDa, na stupni substituce 1 mol polymeru/mol bílkoviny. Průměrná molekulová hmotnost je kolem 44 kDa, ze kterých proteinová část činí přibližně 23 kDa.
Mechanismus účinku
Úplný mechanismus účinku IFNβ‑1a u roztroušené sklerózy není znám. Peg‑IFNβ‑1a se váže k interferonovému receptoru typu I na povrchu buněk a vyvolává kaskádu intracelulárních reakcí vedoucích k regulaci exprese genů odpovídajících na IFNβ. Biologický účinek, který může být pomocí IFNβ‑1a zprostředkován, zahrnuje zvýšenou produkci protizánětlivých ![Obr. 1 Imunomodulační aktivity interferonu β; podle [10] – Kasper, et al., 2014. Polarizace T-buněk u neléčených pacientů s roztroušenou sklerózou (A) a účinky IFNβ (B). Polarizace a diferenciace efektorových a regulačních T-buněk je pod vlivem cytokinů. Pacienti s roztroušenou sklerózou mají narůstající počet buněk Th17 vlivem IL-6 a TGFβ, což vede k narůstající sekreci prozánětlivého cytokinu IL-17; IFNβ inhibuje diferenciaci Th17, což vede k poklesu sekrece IL-17. Kromě tohoto efektorového buněčného fenotypu mají pacienti s roztroušenou sklerózou známky dysregulace odpovědi Treg na buňky Foxp3+, které nejsou schopny potlačit aktivitu Th17. Léčba IFNβ vede ke zvýšení počtu buněk Foxp3+ s vyšší produkcí IL-4, IL-5 a IL-13 a přispívá tak k normalizaci sekrece IL-17 buňkami Th17 jako u zdravých jedinců. IFNβ – interferon beta; IL – interleukin; TGFβ – transforming growth factor, transformující růstový faktor beta; Th - T-helper lymphocyte, pomocný T lymfocyt](https://www.remedia.cz/photo-a-30339---.jpg) cytokinů (např. interleukinů IL‑4, IL‑10, IL‑27), tlumení aktivity prozánětlivých cytokinů (např. IL‑2, IL‑12, IFN‑γ, TNF‑α) [8], inhibici aktivovaných monocytů, inhibici migrace aktivovaných T‑buněk přes hematoencefalickou bariéru snížením sekrece proteolytické matrix metaloproteinázy, ovlivněním solubilních adhezních molekul apod. [9]. Dochází k polarizaci a k patologické diferenciaci efektorových a regulačních buněk stimulací IL‑4, IL‑5 a IL‑13 a k upravení normální produkce IL‑17 (obr. 1) [10]. Bylo prokázáno, že IFNβ ovlivňuje mitochondriální aktivity v buňkách CD+ [11].
cytokinů (např. interleukinů IL‑4, IL‑10, IL‑27), tlumení aktivity prozánětlivých cytokinů (např. IL‑2, IL‑12, IFN‑γ, TNF‑α) [8], inhibici aktivovaných monocytů, inhibici migrace aktivovaných T‑buněk přes hematoencefalickou bariéru snížením sekrece proteolytické matrix metaloproteinázy, ovlivněním solubilních adhezních molekul apod. [9]. Dochází k polarizaci a k patologické diferenciaci efektorových a regulačních buněk stimulací IL‑4, IL‑5 a IL‑13 a k upravení normální produkce IL‑17 (obr. 1) [10]. Bylo prokázáno, že IFNβ ovlivňuje mitochondriální aktivity v buňkách CD+ [11].
Vzhledem k tomu, že patofyziologie roztroušené sklerózy není plně objasněna, není známo, zda mechanismus účinku Peg‑IFNβ‑1a u roztroušené sklerózy je zprostředkován stejnou cestou jako popsané biologické účinky u IFNβ‑1a.
Farmakodynamické účinky
Interferony tvoří skupinu přirozeně se vyskytujících proteinů, jejichž tvorba je indukována buňkami jako odpověď na biologické a chemické podněty. Interferony zprostředkovávají množství buněčných odpovědí, jde o antivirové, antiproliferativní a imunomodulační účinky. Farmakologické vlastnosti Peg‑IFNβ‑1a jsou obdobné jako u IFNβ‑1a. Předpokládá se, že jsou zprostředkovány proteinovou částí molekuly.
Farmakodynamické odpovědi byly hodnoceny měřením indukce tzv. interferon‑responzivních genů, včetně těch, které kódují 2‘,5‘‑oligoadenylát syntetázu, protein A myxovirové rezistence (MxA) a několik chemokinů a cytokinů, stejně jako neopterin, produkt reakce katalyzované GTP‑cyklohydrolázou I, enzymem indukovatelným interferonem. Genová indukce u zdravých osob byla při podání Peg‑IFNβ‑1a rozsáhlejší ve smyslu nejvyšší hladiny a expozice (plocha pod křivkou účinku) než při podání nepegylovaného IFNβ‑1a intramuskulárně, přičemž v obou případech byla podána stejná dávka dle aktivity (6 MIU). Odpověď na podání Peg‑IFNβ‑1a byla stabilní a dlouhodobá, s elevacemi detekovanými až po dobu 15 dnů, v porovnání s krátkodobostí odpovědi (4 dny) při podání nepegylovaného IFNβ‑1a. Zvýšené koncentrace neopterinu byly pozorovány jak u zdravých lidí, tak u pacientů s roztroušenou sklerózou léčených přípravkem Peg‑IFNβ‑1a; stabilní a prolongovaná elevace hodnot se při léčbě Peg‑IFNβ‑1a udržovala po dobu 10 dnů, zatímco po podání nepegylovaného IFNβ‑1a přetrvávaly tyto hodnoty pouze po dobu pěti dnů. Po dvoutýdenním dávkovacím intervalu se koncentrace neopterinu vrací k výchozí hodnotě [12].
Farmakokinetické vlastnosti
Pegylovaný IFNβ‑1a má ve srovnání s nepegylovaným IFNβ‑1a delší poločas eliminace v séru. Obdobně jako při klinickém hodnocení při podávání jedné dávky a opakovaných dávek u zdravých lidí byla sérová koncentrace IFNβ‑1a úměrná dávce v rozmezí 63–188 µg. Farmakokinetika zjištěná u pacientů s roztroušenou sklerózou byla konzistentní s farmakokinetikou u zdravých lidí [12].
Absorpce
Po subkutánním podání Peg‑IFNβ‑1a pacientům s roztroušenou sklerózou bylo maximální plazmatické koncentrace (cmax) dosaženo za 1–1,5 dne po aplikaci. Po opakovaném podávání 125 µg každé dva týdny byla cmax (průměr ± SE) 280 ± 79 pg/ml. Podání jednotlivých dávek 63 µg, 125 µg a 188 µg podkožního Peg‑IFNβ‑1a vedlo k přibližně 4‑, 9‑ a 13násobně vyšším expozičním hodnotám (AUC 168 h) a přibližně k 2‑, 3‑, 5násobně vyšší cmax ve srovnání s intramuskulární aplikací 30 µg (6 MIU) nepegylovaného IFNβ‑1a.
Distribuce
Po opakovaném subkutánním podávání 125 mikrogramových dávek každé dva týdny představoval distribuční objem neupravený dle biologické dostupnosti (průměr ± SE) 481 ± 105 litrů.
Biotransformace a eliminace
Za hlavní cestu vylučování Peg‑IFNβ‑1a je považována eliminace močí (ledvinami). Proces kovalentní konjugace Peg části k proteinu může změnit in vivo vlastnosti nemodifikované bílkoviny, včetně snížené ledvinové clearance a snížené proteolýzy, čímž se prodlužuje poločas v oběhu. Proto je biologický poločas (t1/2) Peg‑IFNβ‑1a u zdravých dobrovolníků přibližně dvojnásobně delší než biologický čas nepegylovaného IFNβ‑1a. U pacientů s roztroušenou sklerózou byl t1/2 (průměr ± SE) Peg‑IFNβ‑1a v rovnovážném stavu 78 ± 15 hodin. Průměrná clearance Peg‑IFNβ‑1a v rovnovážném stavu byla 4,1 ± 0,4 l/h.
Klinické zkušenosti
Klinická účinnost a bezpečnost Peg‑IFNβ‑1a byla posuzována na základě dat dvouleté randomizované, dvojitě zaslepené multicentrické klinické studie kontrolované placebem u pacientů s RR‑RS (studie ADVANCE). Celkem 1 512 pacientů bylo randomizováno k podávání dávky 125 µg subkutánně každé dva týdny (n = 512) nebo každé čtyři týdny (n = 500) proti placebu (n = 500). Základním vstupním kritériem pro zařazení do studie bylo onemocnění RR‑RS s nejméně dvěma ![Graf 1 Roční počet relapsů ve studii ADVANCE; podle [13] – Calabresi, et al., 2014. a Po vyloučení základních hodnot EDSS (< 4, ≥ 4), při základním ročním počtu relapsů a věku (< 40 let, ≥ 40 let), na základě negativní binomiální regrese. EDSS – Expanded Disability Status Scale; Peg-IFNβ-1a – pegylovaný interferon beta 1a](https://www.remedia.cz/photo-a-30340---.jpg) relapsy v předchozích třech letech a s jedním relapsem v předcházejícím roce, se skóre EDSS ≤ 5,0.
relapsy v předchozích třech letech a s jedním relapsem v předcházejícím roce, se skóre EDSS ≤ 5,0.
Primárním cílovým ukazatelem byl parametr ARR. Sekundární cílové ukazatele představoval podíl relabujících pacientů, progrese disability měřená pomocí EDSS po dobu 12 týdnů a počet nových T2 hyperintenzních lézí na magnetické rezonanci.
Peg IFNβ‑1a podávaný každé dva týdny významně snížil roční míru relapsů – o 36 % ve srovnání s placebem (p = 0,0007) během jednoho roku, graf 1, s konzistentním snížením ARR v podskupinách definovaných demografickými charakteristikami a základními vlastnostmi onemocnění. Peg IFNβ‑1a rovněž významně snížil riziko relapsu o 39 % (p = 0,0003), riziko trvalé progrese postižení potvrzené ve 12 týdnech sledování o 38 % (p = 0,0383) a ve 24 týdnech (post hoc analýza) o 54 % (p = 0,0069), graf 2, počet nových nebo nově se zvětšujících T2 lézí o 67 % (p < 0,0001), počet lézí vychytávajících gadolinium o 86 % (p < 0,0001) a počet T1 hypointenzních lézí ve srovnání s placebem o 53 % (p < 0,0001).
![Graf 2 Podíl pacientů s 24týdenní potvrzenou progresí disability; podle [13] – Calabresi, et al., 2014. a Progrese postižení je defi nována jako zvýšení nejméně o 1,0 bodu EDSS od základní hodnoty skóre EDSS ≥ 1,0 udržující se po dobu 24 týdnů, nebo alespoň jako zvýšení o 1,5 bodu EDSS od základní hodnoty skóre EDSS 0,0 setrvávající po dobu 24 týdnů. b Hodnoty p a poměr rizika (HR) jsou založeny na Coxově modelu proporcionálních rizik a upraveny pro základní skóre EDSS (< 4,0 vs. ≥ 4,0) a věk (< 40 let vs. ≥ 40 let). EDSS – Expanded Disability Status Scale; Peg-IFNβ-1a – pegylovaný interferon beta 1a](https://www.remedia.cz/photo-a-30341---.jpg) Léčebný účinek byl pozorován již po šesti měsících, přičemž u Peg‑IFNβ‑1a v dávce 125 µg podávané každé dva týdny bylo zjištěno 61% snížení (p < 0,0001) počtu nových nebo nově se zvětšujících T2 lézí ve srovnání s placebem. Jak u výsledků týkajících se relapsů, tak v případě progrese na magnetické rezonanci prokázal Peg‑IFNβ‑1a podávaný každé dva týdny v prvním roce léčby větší léčebný účinek než přípravek podávaný ve čtyřtýdenním dávkovacím režimu [13].
Léčebný účinek byl pozorován již po šesti měsících, přičemž u Peg‑IFNβ‑1a v dávce 125 µg podávané každé dva týdny bylo zjištěno 61% snížení (p < 0,0001) počtu nových nebo nově se zvětšujících T2 lézí ve srovnání s placebem. Jak u výsledků týkajících se relapsů, tak v případě progrese na magnetické rezonanci prokázal Peg‑IFNβ‑1a podávaný každé dva týdny v prvním roce léčby větší léčebný účinek než přípravek podávaný ve čtyřtýdenním dávkovacím režimu [13].
Výsledky po dvou letech, kdy došlo k odslepení studie a pacientům byla místo placeba podávána účinná látka, potvrdily, že účinnost přetrvávala i po prvním, placebem kontrolovaném roce studie. V post hoc analýze dvouletých dat vykazovali pacienti, kterým byl Peg‑IFNβ‑1a podáván jedenkrát za 2 týdny, statisticky významné snížení hodnocených parametrů ve srovnání s placebem, pro ARR 37 % (p < 0,0001). Ve srovnání s prvním rokem léčby (R1) byl ARR i ve druhém roce léčby (R2) nadále snížen při podávání Peg‑IFNβ‑1a jedenkrát za 2 týdny (R1: 0,230 [95% CI: 0,183–0,291], R2: 0,178 [95% CI: 0,136–0,233]) a stejná hodnota ARR se udržovala i při dávkování jedenkrát za 4 týdny (R1: 0,286 [95% CI: 0,231–0,355], R2: 0,291 [95% CI: ![Graf 3 Snížení ročního počtu relapsů po dvou letech sledování; podle [14] – Kieseier, et al., 2015. a Placebo - Aktivní léčba: pacienti dostávali placebo do 48. týdne, pak byli náhodně rozděleni do skupin léčených Peg-IFNβ-1a podávaným 1× za 2 týdny nebo 1× za 4 týdny. b Po vyloučení základních hodnot EDSS (< 4, ≥ 4), při základním ročním počtu relapsů a věku (< 40 let, ≥ 40 let), na základě negativní binomiální regrese. EDSS – Expanded Disability Status Scale; Peg-IFNβ-1a – pegylovaný interferon beta 1a](https://www.remedia.cz/photo-a-30342---.jpg) 0,231–0,368]).
0,231–0,368]).
Pacienti původně léčení Peg‑IFNβ‑1a měli proti placebu snížený ARR: při podávání jedenkrát za 2 týdny o 37 % (p < 0,0001); při podávání jedenkrát za 4 týdny o 17 % (p = 0,0906) se snížením rizika relapsu (při podávání každé 2 týdny: o 39 %, p < 0,0001; každé 4 týdny: o 19 %, p = 0,0465). Snížení rizika progrese postižení dosahovalo při hodnocení 12 týdnů léčby s frekvencí podávání jedenkrát za dva týdny 33 % (p = 0,0257), při podávání jedenkrát za 4 týdny 25 % (p = 0,0960) a snížení rizika progrese postižení během ![Graf 4 Snížení celkového počtu nových a zvětšujících se T2 lézí během dvou let sledování; podle [14] – Kieseier, et al., 2015. a Placebo - Aktivní léčba: pacienti dostávali placebo do 48. týdne, pak byli náhodně rozděleni do skupin léčených Peg-IFNβ-1a 1× za 2 týdny nebo 1× za 4 týdny. b Po vyloučení základních hodnot objemu T2 lézí. Peg-IFNβ-1a – pegylovaný interferon beta 1a](https://www.remedia.cz/photo-a-30343---.jpg) 24 týdnů léčby při podávání jedenkrát za 2 týdny představovalo 41 %, (p = 0,0137), zatímco při frekvenci podávání jedenkrát za 4 týdny pouze 9 % (p = 0,6243) [14].
24 týdnů léčby při podávání jedenkrát za 2 týdny představovalo 41 %, (p = 0,0137), zatímco při frekvenci podávání jedenkrát za 4 týdny pouze 9 % (p = 0,6243) [14].
Průměrný počet nových nebo nově se zvětšujících lézí na magnetické rezonanci se v případě Peg‑IFNβ‑1a podávaného každé dva týdny ve srovnání s placebem![Graf 5 Snížení počtu lézí vychytávajících gadolinium během dvou let sledování; podle [14] – Kieseier, et al., 2015. a Placebo Aktivní léčba: pacienti dostávali placebo do 48. týdne, pak byli náhodně rozděleni do skupin léčených Peg-IFNβ-1a 1× za 2 týdny nebo 1× za 4 týdny. b Po vyloučení základních hodnot objemu lézí vychytávajících gadolinium. c Počítáno jako průměr placeba – průměr aktivně léčených/průměr placeba × 100. d Hodnota p pro srovnání mezi aktivní léčbou a placebem, která je založena na logistické regresi očištěné o základní počet lézí vychytávajících gadolinium. Peg-IFNβ-1a – pegylovaný interferon beta 1a](https://www.remedia.cz/photo-a-30344---.jpg) snížil o 67 % (p < 0,0001), průměrný počet lézí vychytávajících gadolinium se snížil o 60 % (p = 0,0002) a průměrný počet T1 lézí poklesl o 59 % (p < 0,0001), grafy 3, 4, 5, 6. Signifikantně více pacientů dosáhlo při dávkování Peg‑IFNβ‑1a jedenkrát za 2 týdny stavu NEDA (no evidence of disease activity) – tedy beze známek aktivity nemoci, a to jak v týdnu 24, tak v týdnu 48 a také v periodě mezi 24. a 48. týdnem hodnocení. Obdobné výsledky byly pozorovány také při hodnocení
snížil o 67 % (p < 0,0001), průměrný počet lézí vychytávajících gadolinium se snížil o 60 % (p = 0,0002) a průměrný počet T1 lézí poklesl o 59 % (p < 0,0001), grafy 3, 4, 5, 6. Signifikantně více pacientů dosáhlo při dávkování Peg‑IFNβ‑1a jedenkrát za 2 týdny stavu NEDA (no evidence of disease activity) – tedy beze známek aktivity nemoci, a to jak v týdnu 24, tak v týdnu 48 a také v periodě mezi 24. a 48. týdnem hodnocení. Obdobné výsledky byly pozorovány také při hodnocení ![Graf 6 Snížení celkového počtu T1 hypointenzních lézí během dvou let sledování; podle [14] – Kieseier, et al., 2015. a Placebo - Aktivní léčba: pacienti dostávali placebo do 48. týdne, pak byli náhodně rozděleni do skupin léčených Peg-IFNβ-1a 1× za 2 týdny nebo 1× za 4 týdny. b Po vyloučení základních hodnot objemu T1 lézí. Peg-IFNβ-1a – pegylovaný interferon beta 1a](https://www.remedia.cz/photo-a-30345---.jpg) minimální aktivity onemocnění při zobrazení na magnetické rezonanci. V této studii se ukázalo, že v prvním roce studie ADVANCE dosáhlo signifikantně více pacientů s relabující‑remitující roztroušenou sklerózou při léčbě Peg‑IFNβ‑1a podávané jedenkrát za 2 týdny stavu NEDA a také časného a setrvalého zlepšení hodnocení nálezů na magnetické rezonanci, a to ve srovnání s placebem či s méně intenzivním dávkováním (jedenkrát za 4 týdny) [15].
minimální aktivity onemocnění při zobrazení na magnetické rezonanci. V této studii se ukázalo, že v prvním roce studie ADVANCE dosáhlo signifikantně více pacientů s relabující‑remitující roztroušenou sklerózou při léčbě Peg‑IFNβ‑1a podávané jedenkrát za 2 týdny stavu NEDA a také časného a setrvalého zlepšení hodnocení nálezů na magnetické rezonanci, a to ve srovnání s placebem či s méně intenzivním dávkováním (jedenkrát za 4 týdny) [15].
Zařazení do současné palety léčiv
Peg‑IFNβ‑1a je lékem první volby ovlivňujícím průběh onemocnění u pacientů s RR‑RS. Jeho výhodou je nejmenší frekvence aplikací v porovnání s léky téže skupiny podávanými parenterálně (IFNβ‑1b a glatiramer acetát).
Indikace
Peg‑IFNβ‑1a je indikován u dospělých pacientů pro léčbu RR‑RS.
Kontraindikace
Léčba Peg‑IFNβ‑1a je kontraindikována při přecitlivělosti na přirozený nebo rekombinantní interferon beta nebo na pegylovaný interferon nebo na kteroukoli pomocnou látku. Kontraindikováno je zahájení léčby během těhotenství a u pacientů se stávající těžkou depresí a/nebo se sebevražednými myšlenkami.
Nežádoucí účinky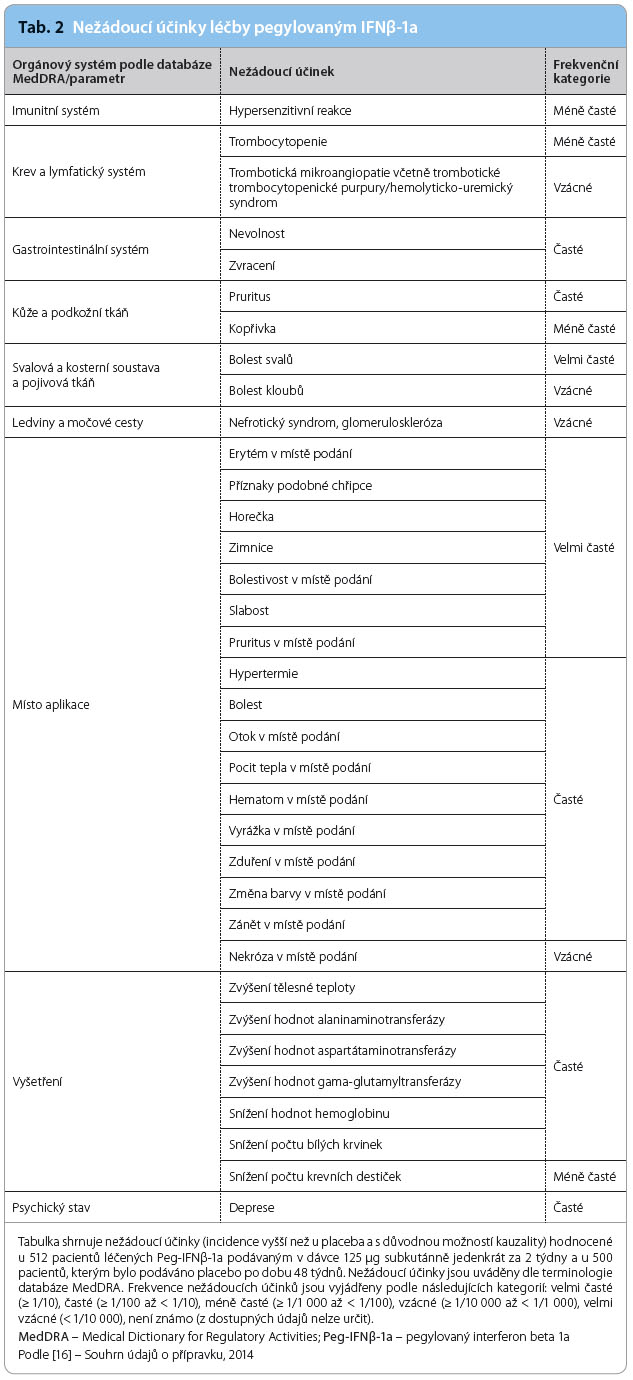
V porovnání s jinými léčivy indikovanými u RR‑RS je výskyt nežádoucích účinků velmi příznivý. V klinických studiích s 1 468 pacienty, jimž byl podáván Peg‑IFNβ‑1a po dobu 177 týdnů (celková expozice ekvivalentní 1 932 „osobo‑rokům“), užívalo 1 093 pacientů Peg‑IFNβ‑1a nejméně jeden rok a 415 pacientů užívalo Peg‑IFNβ‑1a nejméně dva roky. Poznatky z randomizované, nekontrolované fáze (rok 2) studie ADVANCE a z dvouleté pokračovací studie hodnocení bezpečnosti ATTAIN byly shodné s těmi, které přinesla jednoroční fáze studie ADVANCE kontrolovaná placebem. Výčet nežádoucích účinků je shrnut v tab. 2 [16].
Lékové interakce
Nebyly provedeny žádné studie zkoumající lékové interakce. Klinické studie naznačují, že pacienti s roztroušenou sklerózou mohou během relapsů užívat kortikosteroidy bez většího rizika. Bylo zjištěno, že interferony snižují aktivitu enzymů jaterního cytochromu P450 u lidí i zvířat. Se zvýšenou opatrností je třeba postupovat při podávání Peg‑IFNβ‑1a v kombinaci s léčivými přípravky, které mají úzký terapeutický index a jejichž clearance je ve větší míře závislá na jaterním cytochromu P450, jako jsou např. antiepileptika a některá antidepresiva.
Zvláštní populace
Bezpečnost a účinnost Peg‑IFNβ‑1a u dětí a dospívajících s roztroušenou sklerózou od narození až do věku 18 let nebyly stanoveny. U pacientů starších než 65 let nebyla bezpečnost a účinnost dostatečně prozkoumána z důvodu omezeného počtu těchto pacientů zařazovaných do klinických studií.
Z dat ze studií provedených u pacientů s mírnou, střední a závažnou poruchou funkce ledvin a u pacientů v konečném stadiu ledvinového onemocnění vyplývá, že u pacientů s poruchou funkce ledvin není nutná žádná úprava dávkování. U pacientů s poruchou funkce jater nebylo podávání Peg‑IFNβ‑1a hodnoceno.
Těhotenství a kojení
Údaje o podávání Peg‑IFNβ‑1a těhotným ženám jsou omezené. Dostupné údaje naznačují, že může existovat zvýšené riziko samovolného potratu. Zahájení léčby je během těhotenství kontraindikováno. Ženy v plodném věku musejí používat vhodnou antikoncepci. Pokud pacientka otěhotní nebo plánuje otěhotnět během užívání Peg‑IFNβ‑1a, měla by být informována o potenciálním riziku a je zapotřebí zvážit přerušení léčby. U pacientek s vysokou mírou relapsů před zahájením léčby je třeba posoudit riziko závažného relapsu po ukončení léčby Peg‑IFNβ‑1a a v případě těhotenství možné zvýšené riziko samovolného potratu. Přípravek je dle klasifikace Food and Drug Administration řazen do kategorie C.
Není známo, zda se Peg‑IFNβ‑1a vylučuje do lidského mateřského mléka. Vzhledem k možnosti závažných nežádoucích reakcí u kojených dětí je nutno rozhodnout, zda přerušit kojení, nebo léčbu.
Nejsou k dispozici žádné údaje o účincích Peg‑IFNβ‑1a na fertilitu lidí. Při velmi vysokých dávkách byl u zvířat pozorován anovulační účinek [16].
Ovlivnění pozornosti
Nežádoucí příhody související s centrálním nervovým systémem spojené s užíváním interferonu beta (např. nevolnost) mohou ovlivnit schopnost pacientů řídit a obsluhovat stroje.
Dávkování
Doporučená dávka přípravku je 125 µg podaných subkutánně každé dva týdny. Je doporučováno, aby pacienti zahájili léčbu první dávkou 63 µg, druhou dávku zvýšili na 94 µg a třetí dávkou dosáhli plné dávky 125 µg; potom by měli v léčbě pokračovat podáváním plné dávky (125 µg) každé dva týdny. Balení určené k zahájení léčby obsahuje první dvě dávky (63 µg a 94 µg).
Titrace dávky při zahájení léčby může pomoci zmírnit příznaky podobné chřipce, které se mohou při zahájení léčby interferony objevit. Profylaktické a souběžné podávání protizánětlivých, analgetických a/nebo antipyretických léčiv může zabránit rozvoji chřipkových příznaků nebo je zmírnit.
Pokud dojde k vynechání dávky, měla by být podána co nejdříve. Zbývá‑li do užití další plánované dávky 7 dnů a více, pacienti mají okamžitě dostat vynechanou dávku. Zbývá‑li do podání další plánované dávky méně než 7 dnů, pacienti musejí začít užívat léčbu podle nového dvoutýdenního dávkovacího schématu, které začíná od okamžiku podání vynechané dávky. Pacienti nesmějí dostat dvě dávky přípravku v rozmezí kratším než 7 dnů.
Stabilita a kompatibilita
Přípravek může být uchováván při pokojové teplotě (2 °C až 25° C) po dobu až 30 dnů, avšak musí být chráněn před světlem. Jestliže je přípravek uchováván při pokojové teplotě po dobu celkem 30 dnů, měl by být buď použit, nebo zlikvidován.
Závěr
Peg‑IFNβ‑1a může i při současné nabídce léčiv ovlivňujících průběh onemocnění směle konkurovat všem ostatním přípravkům, včetně perorálních, zejména pokud lze docílit zvýšení adherence. Bezpečnostní profil je ve srovnání s perorálními léky a monoklonálními protilátkami výrazně lepší. Pegylace je ve skupině interferonů unikátní a přináší pacientům s roztroušenou sklerózou větší pohodlí a snížení míry nežádoucích účinků při zachování účinnosti léčby.
Seznam použité literatury
- [1] Interferon beta 1b is effective in relapsing remitting multiple sclerosis. I. Clinical results of a multicenter, randomized, double blind, placebo controlled trial. The IFNB Multiple Sclerosis Study Group. [No authors listed]. Neurology 1993; 43:655–661.
- [2] Paty DW, Li DK. Interferon beta 1b is effective in relapsing remitting multiple sclerosis. II. MRI analysis results of a multicenter, randomized, double blind, place-bo controlled trial. UBC MS/MRI Study Group and the IFNB Multiple Sclerosis Study Group. Neurology 1993; 43: 662–667.
- [3] Rudick RA, Goodkin DE, Jacobs LD, et al. Impact of interferon beta 1a on neurologic disability in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG). Neurology 1997; 49: 358–363.
- [4] Simon JH, Jacobs LD, Campion M, et al. Magnetic resonance studies of intramuscular interferon beta 1a for relapsing multiple sclerosis. The Multiple Sclerosis Collabora-tive Research Group. Ann Neurol 1998; 43: 79–87.
- [5] Jacobs LD, Cookfair DL, Rudick RA, et al. Intramuscular interferon beta 1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG). Ann Neurol 1996; 39: 285–294.
- [6] Jacobs LD, Beck RW, Simon JH, et al. Intramuscular interferon beta 1a therapy initiated during a first demyelinating event in multiple sclerosis. CHAMPS Study Group. N Engl J Med 2000; 343: 898–904.
- [7] Bailon P, Won CY. PEG modified biopharmaceuticals. Expert Opin Drug Deliv 2009; 6: 1–16.
- [8] Kieseier BC. The mechanism of action of interferon β in relapsing multiple sclerosis. CNS Drugs 2011; 25: 491–502.
- [9] Graber J, Zhan M, Ford D, et al. Interferon beta 1a induces increases in vascular cell adhesion molecule: implications for its mode of action in multiple sclerosis. J Neuroimmunol 2005; 161: 169–176.
- [10] Kasper LH, Reder AT. Immunomodulatory activity of interferon beta. Ann Clin Transl Neurol 2014; 1: 622–631.
- [11] Haghikia A, Faissner S, Pappas D, et al. Interferon beta affects mitochondrial activity in CD4+ lymphocytes: Implications for mechanism of action in multiple sclerosis. Mult Scler 2015; 21: 1262–1270.
- [12] Hu X, Cui Y, White J, et al. Pharmacokinetics and pharmacodynamics of peginterferon beta 1a in patients with relapsing remitting multiple sclerosis in the randomized ADVANCE study. Br J Clin Pharmacol 2015; 79: 514–522.
- [13] Calabresi PA, Kieseier BC, Arnold DL, et al. Pegylated interferon β 1a for relapsing remitting multiple sclerosis (ADVANCE): a randomised, phase 3, double blind study. Lancet Neurol 2014; 13: 657–665.
- [14] Kieseier BC, Arnold DL, Balcer LJ, et al. Peginterferon beta 1a in multiple sclerosis: 2 year results from ADVANCE. Mult Scler 2015; 21: 1025–1035.
- [15] Arnold DL, Calabresi PA, Kieseier BC, et al. Effect of peginterferon beta 1a on MRI measures and achieving no evidence of disease activity: results from a randomized controlled trial in relapsing remitting multiple sclerosis. BMC Neurol 2014; 14: 240.
- [16] Souhrn údajů o přípravku Plegridy, dostupné na http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_ _Product_IFNormation/human/002827/WC500170302.pdf.
- [17] Kang JS, Deluca PP, Lee KC. Emerging PEGylated drugs. Expert Opin Emerg Drugs 2009; 14: 363–380.